2. 山西中医药大学中药学院, 山西 太原 030619;
3. 湖南中医药大学药学院, 湖南 长沙 410208
2. College of Chinese Materia Medica, Shanxi University of Chinese Medicine, Taiyuan 030619, China;
3. College of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China
肌萎缩侧索硬化症(amyotrophic lateral sclerosis, ALS)也称Lou Gehrig病, 是选择性累及上、下运动神经元的严重致死性运动神经元病(motor neuron disease, MND), 患者生存期短, 大多在起病3~5年后死于呼吸衰竭[1]。目前仍无有效的治疗药物, 理解其致病机制及寻找有效治疗药物刻不容缓。
氧化应激主要由活性氧(reactive oxygen species, ROS)经有氧代谢产生。过量的ROS均为高活性的氧化剂, 能够损伤蛋白、脂及DNA等生物大分子, 如改变蛋白构象、通过氧化不饱和脂肪酸改变细胞膜动力学等。ALS患者脑脊液及尸检脊髓等组织切片发现, ALS患者与正常人样本相比氧化应激明显增加, 脊髓[2]及运动皮层[3]中蛋白质羰基水平升高, 约20%家族性ALS中存在着超氧化物歧化酶(superoxide dismutase 1, SOD1)基因突变[4]。SOD1 G93A小鼠中过表达人突变的SOD1基因(hSOD1), 表现出明显的ALS样症状, 是被公认的ALS小鼠模型, 对阐述此疾病的病理机制及研发临床治疗药物具有重要意义[5, 6]。SOD1 G93A小鼠模型中发现的脑及脊髓中蛋白、脂及核酸等生物大分子的氧化应激损伤明显增加[7]。上述研究结果均表明氧化应激损伤在ALS病理进程中起重要作用[8]。
NF-E2-相关因子2 (NF-E2-related factor 2, Nrf2)能够调控抗氧化酶的产生, 包括血红素氧合酶-1 (heme oxygenase-1, HO-1)、NAD(P)H脱氢酶醌1 [NAD(P)H dehydrogenase quinone1 (NQO1)]、谷氨酰半胱氨酸连接酶修饰亚单位[(catalytic or modified subunit of glutamate-cysteine ligase (GCLC/GCLM)]等[9, 10], 因此调控Nrf2信号对ALS病程的缓解有重要意义。
人参皂苷Rg1具有抗炎、抗氧化和缓解疲劳等功效。研究表明, Rg1对3-硝基邻苯二甲酸(3-nitro phthalic acid)诱导的纹状体氧化应激损伤具有保护作用[11], 且可通过影响Nrf2缓解四氯化碳[7]及酒精[12]造成的肝损伤; Rg1在帕金森氏病[13, 14]等神经退行性疾病中表现出良好的神经保护作用, 然而其在ALS中的作用未见报道。因此, 本研究旨在检测Rg1是否对ALS具有神经保护功能, 并对其机制进行深入探讨, 为将Rg1开发为有效的ALS治疗药物提供理论依据。
材料与方法药品与主要试剂 Rg1 (由云南极粹生物科技有限公司提供, 纯度> 98%); 细胞培养基DMEM、胎牛血清、青链霉素混合液、Lipofectamine 2000、Alexa Fluor® 546标记驴抗兔抗体、Alexa Fluor® 488标记驴抗羊抗体(Life Technology公司); 噻唑蓝(MTT)、多聚赖氨酸、DMSO (Sigma公司); 微孔滤膜(默克密理博公司); miR-153及对照(上海吉玛制药技术有限公司); RIPA裂解液、ECL超敏发光液(北京普利莱基因技术有限公司), 其他试剂购自北京化工厂。
实验动物及处理 B6SJL-Tg (SOD1 G93A) 1Gur/JNju小鼠(J002726), SPF级, 许可证号: SCXK (苏) 2015-0001, 购自南京大学南京生物医药研究所, 饲养繁殖于斯贝福(北京)生物技术有限公司, Tg (SOD1 G93A)雄性与野生型B6SJL雌性繁殖得半合子。实验动物分两批:第一批分为4组, 每组10只, 雌雄各半。小鼠经过3天适应期后, 进行灌胃给药, 一天一次。对照组给水, 实验组给予Rg1 (10、20和40 mg·kg-1)。小鼠出生后70天至死亡每周记录体重。从小鼠体重降低开始每天观察记录各组死亡率。死亡终点判定方法:从伦理学角度考虑, 按文献[15]报道小鼠侧卧平板上25 s不能自主翻身至正常体式则判定小鼠死亡并给予安乐死。从小鼠体重降低开始每周进行转棒行为学实验; 第二批4组给药同前, 每组6只, 雄性, 测量体重, 至对照组死亡终点统一取材检测病理改变, 每组3只灌流石蜡切片检测病理; 3只取材进行蛋白核酸等含量检测。
转棒实验 用于评价小鼠运动协调能力。小鼠首先进行转棒适应, 转棒5 min内从5 r·min-1均匀加速到10 r·min-1。小鼠完成转棒适应后, 调节转棒5 min内从5 r·min-1均匀加速到30 r·min-1。记录小鼠停留在转棒上的潜伏时间, 测量3次取平均值, 每次至少间隔30 min。
脊髓病理切片 动物麻醉后固定, 用0.1 mol·L-1 PBS经心脏灌流至肝脏白色, 换4%多聚甲醛灌流10 min, 取小鼠脊髓腰段置于4%多聚甲醛固定48 h送石蜡切片(武汉谷歌生物科技有限公司), 每片厚4 μm, 1%甲苯胺蓝染色30 min, 镜检观察。
免疫荧光 脊髓腰段切片用0.1 mol·L-1 PBS洗涤, 0.5% Triton X-100室温孵育30 min, 5% BSA室温封闭1 h, 一抗(ChAT兔多抗1:200, Iba1羊多抗1:200) 4 ℃孵育过夜, PBS漂洗3次, 荧光二抗(Alexa Fluor® 546标记驴抗兔荧光二抗1:500, Alexa Fluor® 488标记驴抗羊荧光二抗1:500, Hochest 33342 1:1 000)室温孵育1 h, PBS漂洗后封片, 荧光显微镜下观察。
Western blot 小鼠断头处死, 冰上分离脊髓组织腰段, 液氮速冻后加入RIPA裂解液超声破碎, BCA蛋白定量, 加入loading buffer后95 ℃处理5 min, -20 ℃保存。蛋白上样量为30 μg, 将蛋白转印至PVDF膜, 以3% BSA封闭1 h, 一抗(Nrf2、HO-1、β-actin) 4 ℃孵育过夜, 二抗室温孵育2 h, PBST漂洗后加入ECL发光液显影。使用Gelpro凝胶分析软件对蛋白条带进行灰度分析。
RNA提取及定量 脊髓新鲜腰段组织用miRNA提取试剂盒(ER601-01)提取, 经miRNA两步qRT-PCR (AQ202-01)检测miR-153丰度。
细胞培养 NSC-34鼠神经元细胞(广州吉妮欧生物科技有限公司)用DMEM高糖培养基(10% FBS和1%青链霉素)培养[16]。Lipofectamin 2000转染pcDNA-SOD1 G93A。
细胞存活/死亡率检测 细胞存活率用MTT法检测。细胞接种于96孔板(5×103个细胞/孔), 24 h后转染pcDNA-SOD1 G93A/Nrf2 siRNA/miR-153, 6 h后换完全培养基含或不含Rg1。48 h后加入0.5 mg·mL-1 MTT 10 μL, 37 ℃处理4 h后加入三联液100 μL作用8 h溶解结晶。检测570 nm吸光度。
统计分析 数据用x± s表示, 采用GraphPad Prism 6软件进行统计分析。数据组间比较采用单因素方差分析(one-way ANOVA)结合post hoc Newman-Keuls test检验。以P < 0.05为具有统计学差异。
结果 1 Rg1可推迟ALS小鼠发病时间并延迟其生存期前期研究[13]表明, 10~40 mg·kg-1 Rg1表现出明显的神经保护作用, 故本实验Rg1的给药剂量为10、20和40 mg·kg-1。文献报道SOD1 G93A小鼠体重最高点可被认为是其发病的起点[15, 17], 对其体重监测发现13周左右SOD1 G93A小鼠体重达到最大值, Rg1 10 mg·kg-1剂量组在14~15周体重持平, 15周后开始下降。20及40 mg·kg-1 Rg1明显推迟起病时间, 40 mg·kg-1与20 mg·kg-1相比未表现出显著性差异(图 1A)。对其生存率进行统计发现, 20及40 mg·kg-1 Rg1明显延长了其生存期(图 1B)。
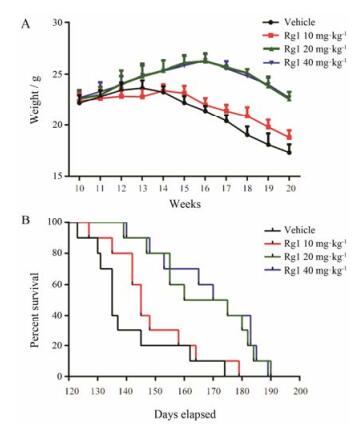
|
Figure 1 Rg1 treatment postponed the onset age of amyotrophic lateral sclerosis (ALS) (A) and improved the survival interval (B). n = 10, x± s |
后肢肌肉的逐步萎缩是ALS小鼠发病的典型特征。转棒实验可被用于快速检测小鼠运动协调能力。结果显示, 17周以后SOD1 G93A小鼠及Rg1 10 mg·kg-1剂量组的运动能力开始出现降低。20与40 mg·kg-1剂量组运动能力下降趋势明显, 较ALS小鼠缓慢(图 2A)。对腓肠肌进行病理检测发现, SOD1 G93A小鼠纤维束明显变得不规则, 纤维间肌内膜空间明显增大, 纤维增生引起的核高度聚集化表明肌肉萎缩明显。Rg1 10 mg·kg-1剂量组中上述现象出现缓解, 而Rg1 20及40 mg·kg-1剂量组可见纤维排列较为正常, 同期肌肉萎缩现象不明显(图 2B)。
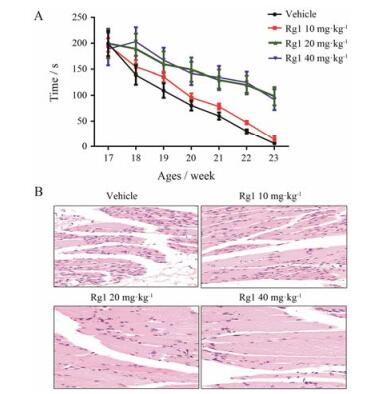
|
Figure 2 Rg1 treatment alleviated the motor dysfunction of ALS mice (A, n = 3-10, x± s) and muscle atrophy (B, Scale bar = 50 μm) |
对小鼠进行病理检测发现, ALS小鼠对照组在病程晚期脊髓前角细胞丢失明显, 而同时取材的Rg1 20及40 mg·kg-1剂量组小鼠与ALS对照组相比, 脊髓前角运动神经元的丢失明显降低, 表明Rg1具有运动神经元保护功能(图 3A)。胶质细胞的激活在ALS疾病进程中发挥重要作用[18], 为了检测小胶质细胞的活化, 本研究用Iba1抗体对脊髓切片进行染色, 为了进一步验证小胶质活化情况对脊髓运动神经元的影响, 同时用胆碱乙酰转移酶抗体(ChAT)特异性标记脊髓运动神经元进行免疫荧光染色, 发现Rg1在降低Iba1激活的同时能够明显增加ChAT阳性细胞数(图 3B)。

|
Figure 3 Attenuation of motor neuron loss and microglia activation in the spinal cord by Rg1. (A) Toluidine blue staining of lumbar segments of spinal cord. Scale bar = 100 μm. (B)Immunohistochemical staining of motor neuron (ChAT, red) and microglia (Iba1, green). Scale bar = 100 μm |
上述结果表明, 给予Rg1能够缓解运动功能损伤, 降低神经元丢失, 抑制小胶质细胞激活, 为进一步检测其作用机制, 采用Western blot检测脊髓中Nrf2和HO-1的表达情况。Nrf2作为转录因子能够结合抗氧化应激反应元件(antioxidant response element, ARE), 进而调控胞内抗氧化及抗炎相关因子的表达, 其中HO-1等发挥了重要作用。结果显示, Rg1组Nrf2和HO-1的表达升高(图 4A)。为进一步验证Nrf2在Rg1抗ALS中的作用, 采用NSC-34细胞过表达hSOD1 G93A制备细胞模型, 对其同时转染Nrf2 siRNA或对照siRNA后给予Rg1, 观察Rg1的作用。结果显示Nrf2 siRNA处理明显抑制了Rg1引起的Nrf2的升高(图 4B)。采用MTT检测细胞活力发现, Rg1对细胞的保护作用受到抑制(图 4C), 以上结果表明Rg1通过Nrf2在ALS病程中发挥保护功能。
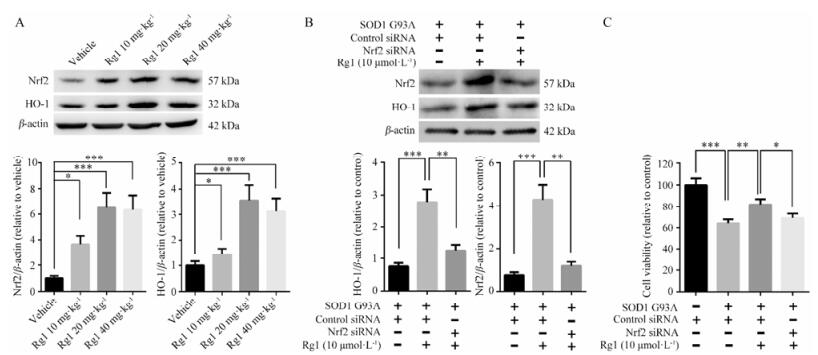
|
Figure 4 Rg1 functions through Nrf2 in ALS treatment. (A) Effects of Rg1 treatment on the expression of Nrf2 and HO-1. (B) The expression of Nrf2 and HO-1 after transfection of Nrf2 siRNA in Rg1 treated NSC-34 cells. (C) Cell viability was tested by MTT. n = 4, x± s. *P < 0.05, **P< 0.01, ***P < 0.001 |
为研究Rg1对Nrf2的调控机制, 本研究检测了靶向Nrf2的miR-153表达。对实验动物脊髓miR-153表达进行检测发现, Rg1给药组与ALS小鼠对照组相比, 脊髓中miR-153的表达明显降低(图 5A)。为验证miR-153的作用, 在转染SOD1 G93A的细胞中加入miR-153后检测Rg1对Nrf2和HO-1及细胞生存率的影响。结果显示加入miR-153后降低了Rg1对Nrf2的上调作用, 削弱其对细胞生存率的改善, 表明Rg1通过miR-153上调Nrf2表达发挥保护作用(图 5B, C)。
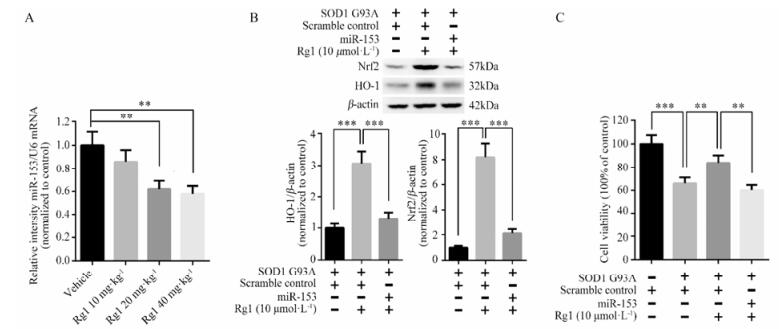
|
Figure 5 miR-153 participates in the regulation of Rg1 on Nrf2. (A) The expression of miR-153 in the lumbar segments of spinal cord. (B) The expression of Nrf2 and HO-1 after transfection of miR-153 or scramble control in Rg1 treated NSC-34 cells. (C) Cell viability was tested by MTT. n = 5, x± s. **P < 0.01, ***P < 0.001 |
中枢神经系统因含有高浓度易被超氧化的多不饱和脂肪酸而对氧化应激损伤特别敏感, 同时中枢神经系统几乎不具有再生修复功能, 抵抗外界损害的能力更为降低。鉴于上述因素, 针对氧化应激介导的病理损伤的抑制已成为改善中枢神经退行性疾病的研究焦点。Nrf2-ARE信号通路是重要的内源性抗氧化应激信号通路。正常稳态下Nrf2半衰期很短, 在绝大多数细胞系中几乎检测不到, 其在胞质中结合一个同型二聚体蛋白Keap1, 可将Nrf2递呈至泛素蛋白酶体系统降解Nrf2。氧化剂及亲电子试剂如泛醌等与Keap1中的半胱氨酸反应, 使其不能与Nrf2结合, 导致Nrf2入核与bZip形成二聚体, 结合Ⅱ相酶基因启动子区的ARE, 使其转录活性增加, 抗氧化能力增强。但外界损伤加剧, 仅依靠自身抗氧化反应无法达到稳态平衡, 且许多外界因素本身对Nrf2/ARE系统有破坏, 如Wang等[19]报道NSC-34细胞中转染SOD1 G93A可损伤Nrf2-ARE信号通路活性。
人参具有抗炎、抗氧化和抗细胞凋亡的作用, 并能刺激免疫应答, 增加机体抵抗力。有报道人参根对SOD1 G93A小鼠具有保护作用, 小鼠30天后将人参混于饮用水中服用, 其运动功能减退出现的时间及存活率与对照组相比明显延长[20]。研究发现, 人参可以增加培养的皮质神经元存活率, 并促进神经突起生长[21, 22], 为人参用于ALS的治疗提供了理论依据。在对人参成分的研究中发现, 人参皂苷Rb1及Rg1能够保护脊髓神经元免受谷氨酸及卡因酸诱导的兴奋毒性损伤及过氧化氢引起的氧化应激损伤, 可能是治疗脊髓损伤的有效因子[23]。此外, Rg1对3-硝基邻苯二甲酸诱导的纹状体氧化应激损伤具有保护作用[11], 可通过对Nrf2的调控缓解四氯化碳[7]及酒精[12]造成的肝损伤; Rg1在PD等神经退行性疾病中也表现出良好的神经保护作用, 因此推测Rg1可能通过抗氧化应激损伤对ALS发挥神经保护作用。研究中Rg1无论对ALS小鼠模型抑或NSC-34细胞模型都能增加Nrf2的表达, 具有神经保护作用。对其机制进一步研究发现miR-153可调节Nrf2的表达, 增加的miR-153降低GCLC及GSR的表达, 导致依赖Nrf2的氧化还原失衡[24]。百草枯及H2O2等能明显增加脑内miR-153的表达, 并降低Nrf2及GCLC和NQO1的表达[25], 上述研究均表明miR-153对Nrf2的抑制具有病理意义。本研究中发现Rg1可降低SOD1 G93A导致的脊髓组抑制, 发挥抗氧化功能, 表明Rg1对miR-153/Nrf2/HO-1的调控介导其在ALS中的保护作用, 而Rg1如何调控miR-153有待进一步研究。另外, Rg1在10 mg·kg-1对miR-153的影响虽然没有显著性差异, 但其趋势相当明显, 而其下游Nrf2表现出显著变化也是非常客观的结果, 推测可能是对其效应的放大, 也可能潜在其他microRNA共同调控, 甚至是对Nrf2的其他层面的调节, 需要研究者后继的进一步论证。同时值得注意的是任何疾病都是多种致病因素协作的结果, ALS也不例外。研究报道, 人参皂苷Rg1具有抗炎、抗氧化和缓解疲劳等功效, 且具有多靶点效应, 将其应用于ALS的治疗中可能较单一靶点药物具有更明显的治疗优势。此外, ALS发病率本身存在性别差异, 本实验采用雌雄各半的小鼠, 发现Rg1对其都有保护作用, 然而其对ALS的治疗效果是否存在性别差异仍有待进一步检测。
| [1] | Mitchell JD, Callagher P, Gardham J, et al. Timelines in the diagnostic evaluation of people with suspected amyotrophic lateral sclerosis (ALS)/motor neuron disease (MND)——a 20-year review:can we do better?[J]. Amyotroph Lateral Scler, 2010, 11: 537–541. DOI:10.3109/17482968.2010.495158 |
| [2] | Shaw PJ, Ince PG, Falkous G, et al. Oxidative damage to protein in sporadic motor neuron disease spinal cord[J]. Ann Neurol, 1995, 38: 691–695. DOI:10.1002/(ISSN)1531-8249 |
| [3] | Ferrante RJ, Browne SE, Shinobu LA, et al. Evidence of increased oxidative damage in both sporadic and familial amyotrophic lateral sclerosis[J]. J Neurochem, 1997, 69: 2064–2074. |
| [4] | Valdmanis PN, Daoud H, Dion PA, et al. Recent advances in the genetics of amyotrophic lateral sclerosis[J]. Curr Neurol Neurosci Rep, 2009, 9: 198–205. DOI:10.1007/s11910-009-0030-9 |
| [5] | Shibata N. Transgenic mouse model for familial amyotrophic lateral sclerosis with superoxide dismutase-1 mutation[J]. Neuropathology, 2001, 21: 82–92. DOI:10.1046/j.1440-1789.2001.00361.x |
| [6] | Gurney ME, Pu H, Chiu AY, et al. Motor neuron degenera-tion in mice that express a human Cu, Zn superoxide dismutase mutation[J]. Science, 1994, 264: 1772–1775. DOI:10.1126/science.8209258 |
| [7] | Shibata N, Nagai R, Uchida K, et al. Morphological evidence for lipid peroxidation and protein glycoxidation in spinal cords from sporadic amyotrophic lateral sclerosis patients[J]. Brain Res, 2001, 917: 97–104. DOI:10.1016/S0006-8993(01)02926-2 |
| [8] | Barber SC, Shaw PJ. Oxidative stress in ALS:key role in motor neuron injury and therapeutic target[J]. Free Radic Biol Med, 2010, 48: 629–641. DOI:10.1016/j.freeradbiomed.2009.11.018 |
| [9] | Zhang Q, Pi J, Woods CG, et al. A systems biology perspec-tive on Nrf2-mediated antioxidant response[J]. Toxicol Appl Pharmacol, 2010, 244: 84–97. DOI:10.1016/j.taap.2009.08.018 |
| [10] | Kaspar JW, Niture SK, Jaiswal AK. Nrf2:INrf2(Keap1) signaling in oxidative stress[J]. Free Radic Biol Med, 2009, 47: 1304–1309. DOI:10.1016/j.freeradbiomed.2009.07.035 |
| [11] | Gao Y, Chu SF, Li JP, et al. Protopanaxtriol protects against 3-nitropropionic acid-induced oxidative stress in a rat model of Huntington's disease[J]. Acta Pharmacol Sin, 2015, 36: 311–322. DOI:10.1038/aps.2014.107 |
| [12] | Gao Y, Chu S, Li J, et al. Anti-inflammatory function of ginsenoside Rg1 on alcoholic hepatitis through glucocorticoid receptor related nuclear factor-kappa B pathway[J]. J Ethnopharmacol, 2015, 173: 231–240. DOI:10.1016/j.jep.2015.07.020 |
| [13] | Heng Y, Zhang QS, Mu Z, et al. Ginsenoside Rg1 attenuates motor impairment and neuroinflammation in the MPTP-probenecid-induced parkinsonism mouse model by targeting alpha-synuclein abnormalities in the substantia nigra[J]. Toxicol Lett, 2016, 243: 7–21. DOI:10.1016/j.toxlet.2015.12.005 |
| [14] | Zhang JT. Nootropic mechanisms of ginsenoside Rg1——influence on neuronal plasticity and neurogenesis[J]. Acta Pharm Sin (药学学报), 2005, 40: 385–388. |
| [15] | Thomsen GM, Gowing G, Latter J, et al. Delayed disease onset and extended survival in the SOD1G93A rat model of amyotrophic lateral sclerosis after suppression of mutant SOD1 in the motor cortex[J]. J Neurosci, 2014, 34: 15587–15600. DOI:10.1523/JNEUROSCI.2037-14.2014 |
| [16] | Vaz AR, Cunha C, Gomes C, et al. Glycoursodeoxycholic acid reduces matrix metalloproteinase-9 and caspase-9 activation in a cellular model of superoxide dismutase-1 neurodegeneration[J]. Mol Neurobiol, 2015, 51: 864–877. DOI:10.1007/s12035-014-8731-8 |
| [17] | Riancho J, Ruiz-Soto M, Berciano MT, et al. Neuroprotective effect of bexarotene in the SOD1(G93A) mouse model of amyo-trophic lateral sclerosis[J]. Front Cell Neurosci, 2015, 9: 250. |
| [18] | Boillee S, Yamanaka K, Lobsiger CS, et al. Onset and progression in inherited ALS determined by motor neurons and microglia[J]. Science, 2006, 312: 1389–1392. DOI:10.1126/science.1123511 |
| [19] | Wang F, Lu Y, Qi F, et al. Effect of the human SOD1-G93A gene on the Nrf2/ARE signaling pathway in NSC-34 cells[J]. Mol Med Rep, 2014, 9: 2453–2458. DOI:10.3892/mmr.2014.2087 |
| [20] | Jiang F, DeSilva S, Turnbull J. Beneficial effect of ginseng root in SOD-1(G93A) transgenic mice[J]. J Neurol Sci, 2000, 180: 52–54. DOI:10.1016/S0022-510X(00)00421-4 |
| [21] | Sugaya A, Yuzurihara M, Tsuda T, et al. Proliferative effect of ginseng saponin on neurite extension of primary cultured neurons of the rat cerebral cortex[J]. J Ethnopharmacol, 1988, 22: 173–181. DOI:10.1016/0378-8741(88)90125-0 |
| [22] | Mizumaki Y, Kurimoto M, Hirashima Y, et al. Lipophilic fraction of Panax ginseng induces neuronal differentiation of PC12 cells and promotes neuronal survival of rat cortical neurons by protein kinase C dependent manner[J]. Brain Res, 2002, 950: 254–260. DOI:10.1016/S0006-8993(02)03049-4 |
| [23] | Liao B, Newmark H, Zhou R. Neuroprotective effects of ginseng total saponin and ginsenosides Rb1 and Rg1 on spinal cord neurons in vitro[J]. Exp Neurol, 2002, 173: 224–234. DOI:10.1006/exnr.2001.7841 |
| [24] | Narasimhan M, Patel D, Vedpathak D, et al. Identification of novel microRNAs in post-transcriptional control of Nrf2 expression and redox homeostasis in neuronal, SH-SY5Y cells[J]. PLoS One, 2012, 7: e51111. DOI:10.1371/journal.pone.0051111 |
| [25] | Narasimhan M, Riar AK, Rathinam ML, et al. Hydrogen peroxide responsive miR153 targets Nrf2/ARE cytoprotection in paraquat induced dopaminergic neurotoxicity[J]. Toxicol Lett, 2014, 228: 179–191. DOI:10.1016/j.toxlet.2014.05.020 |
 2018, Vol. 53
2018, Vol. 53


