2. 哈尔滨医科大学黑龙江省医学科学院, 黑龙江 哈尔滨 150081
2. Heilongjiang Medical Academy, Harbin Medical University, Harbin 150081, China
白内障是指由于各种原因如老化、局部营养障碍、免疫与代谢异常、外伤、中毒、辐射等引起晶状体代谢紊乱, 使晶状体蛋白变性而发生浑浊, 最终导致视力下降甚至丧失的疾病, 严重影响患者的日常生活及生存质量。随着我国人口老龄化的加剧, 白内障已成为最主要的致盲眼病之一。目前, 治疗白内障的最主要方式是进行晶状体置换术, 即取出浑浊的晶状体, 植入人工晶体。但我国人口众多, 许多经济相对落后地区的患者无法承担昂贵的手术及治疗费用, 因此研究与开发一种具有预防与治疗白内障作用的药物刻不容缓[1]。
晶状体上皮细胞(lens epithelial cells, LECs)是位于晶状体前表面的功能性细胞, 可表达多种结构性及功能性蛋白, 参与维持晶状体的透明性及屈光性, 对晶状体的生长、分化、损伤和修复均具有重要作用[2]。研究表明, 年龄相关性白内障(age-related cataract, ARC)的发生发展与晶状体长期处于氧化应激状态密切相关。氧化应激可激活LECs中相关信号通路, 使细胞内DNA损伤、蛋白结构改变, 影响细胞生理功能, 诱导LECs发生凋亡而无法供给晶状体代谢所需的营养物质, 最终导致晶状体浑浊[3]。此外, 在对浑浊的晶状体进行摘除、并植入人工晶体的过程中, 极易引起晶状体后囊膜浑浊(posterior capsular opacification, PCO), 也称为后发性白内障。目前研究认为, LECs发生增殖、迁移、上皮间充质转化(epithelial-mesenchymal transition, EMT)、胶原沉积及纤维组织形成是后发性白内障形成的主要原因。因此, 有效地减轻LECs氧化应激损伤及EMT等病理过程, 可成为延缓白内障发生及发展的重要途径[4, 5]。
花青素(anthocyanin)属于黄酮类化合物, 广泛分布于有色植物中。目前已发现的花青素约有27种, 其特征结构为2-苯基色原烯母核, 其中以矢车菊素-3-O-葡萄糖苷最为常见[6]。花青素具有抗氧化、抗炎、抑菌和抗肿瘤等多种药理活性, 对心脏及肝脏等器官的功能具有明显的保护作用[7, 8]。研究表明, 花青素对视力也具有一定的保护作用, 但其对于白内障的作用及机制尚不明确。因此, 本研究分别采用过氧化氢(hydrogen peroxide, H2O2)及转化生长因子β2 (transforming growth factor β2, TGF-β2)处理人晶状体上皮细胞(human lens epithelial cells, HLECs), 以诱导HLECs发生氧化应激损伤及EMT, 建立ARC及PCO细胞模型, 并初步探讨anthocyanin对于白内障是否具有治疗作用及其初步机制。
材料与方法细胞培养 HLECs由哈尔滨医科大学附属第二医院惠赠, 培养于哈尔滨医科大学科技园院士工作站细胞培养室。HLECs接种于含有15%胎牛血清、1%青链霉素的DMEM低糖培养基中, 于37 ℃、5% CO2环境中培养。待细胞融合至80%后, 用胰蛋白酶进行消化、传代, 分瓶培养后用于后续实验。
药物配制 花青素(含矢车菊素-3-O-葡萄糖苷高于25%)由大兴安岭林格贝有机食品有限公司提供, 溶于无菌PBS中, 配置成母液(50 mg·mL-1), 4 ℃保存; TGF-β2溶于无菌的PBS中, 配置母液(10 μg·mL-1), -20 ℃保存; H2O2溶于无菌PBS中, 配置成母液(50 mmol·L-1), 4 ℃保存; 取3.974 g NaCl、0.201 g KCl、1.191 5 g HEPES、0.101 65 g MgCl2·6H2O溶于50 mL ddH2O中, 配制成台式母液, 4 ℃保存。
细胞分组 将培养的HLECs细胞分为2大组, 即H2O2组及TGF-β2组。H2O2组中, 将细胞分为空白对照组(control)、模型组(model)、阳性药吡诺克辛(pirenoxine)滴眼液组、花青素低、中、高剂量组(1、10、100 μg·mL-1)。其中, 阳性药组细胞预孵育0.5 μg·mL-1吡诺克辛滴眼液12 h, 花青素低、中、高剂量组分别预孵育1、10、100 μg·mL-1花青素溶液24 h。TGF-β2组中, 将细胞分为空白对照组(control)、模型组(model)、花青素低、中、高剂量组(1、10、100 μg·mL-1)。其中, 花青素低、中、高剂量组分别预孵育1、10、100 μg·mL-1花青素12 h。
细胞活力及细胞内氧化应激水平检测 HLECs细胞以500 μmol·L-1 H2O2处理3 h或10 μmol·L-1 TGF-β2处理12 h后, 使用MTT法检测各组细胞活力, 采用相关试剂盒(碧云天生物技术研究所)检测细胞内活性氧(reactive oxygen species, ROS)、脂质过氧化物丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathion peroxidase, GSH-px)、氧化型谷胱甘肽(oxidized glutathione, GSSG)水平。
Fluo-3/AM荧光探针检测细胞内Ca2+水平 在避光条件下将处理好的HLECs细胞装载Fluo-3/AM荧光探针, 并给予55 μmol·L-1 KCl诱导细胞内钙超载, 荧光显微镜检测各组细胞内Ca2+水平。
Western blot检测α-晶状体蛋白的表达 HLECs细胞以500 μmol·L-1 H2O2处理3 h后, 提取细胞总蛋白并测定蛋白浓度后, 将蛋白行SDS-PAGE电泳。孵育一抗α-晶状体蛋白(α-crystallin, 1:1 000)抗体过夜及二抗(anti-rabbit, 1:10 000)后, oddsey软件检测并分析各组细胞α-crystallin表达水平。
划痕实验检测细胞迁移率 HLECs细胞以10 μL枪头在六孔板中央制作划痕, 并给予10 μmol·L-1 TGF-β2处理(control组除外), Image Pro Plus软件分别检测加入TGF-β2处理0、12、24 h后的细胞迁移距离。
RT-PCR检测EMT标志物的表达 HLECs细胞以10 μmol·L-1 TGF-β2处理12 h后, 使用Trizol试剂盒提取RNA, RewerTra Ace qPCR RT kit试剂盒对RNA逆转录。利用SYBR Green PCR Master试剂盒进行Real-Time PCR反应。检测各组样品中EMT标志物I型胶原(collagen Ⅰ alpha 1 chain, COL1A1; collagen Ⅰ alpha 2 chain, COL1A2)、Ⅲ型胶原(collagen Ⅲ, COL3)、Ⅳ型胶原(collagen Ⅳ, COL4)、纤连蛋白(fibronectin, Fn)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达水平。引物序列见表 1, 结果以GADPH为内参, 统计以2-ΔΔCt值比较mRNA表达水平。
| Table 1 The primer sequence of real time-PCR. COL1A1: Collagen Ⅰ alpha 1 chain; COL1A2: Collagen Ⅰ alpha 2 chain; COL3: Collagen Ⅲ; COL4: Collagen Ⅳ; Fn: Fibronectin; α-SMA: α-Smooth muscle actin |
统计学处理 各组数据采用方差分析及t检验进行统计, 各给药组数据与同期对照组数据分别进行显著性检验。P < 0.05、P < 0.01、P < 0.001分别表示差异显著性级别。
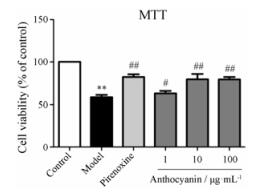
结果 1 花青素对HLEC氧化应激损伤的保护作用 1.1 花青素对氧化应激损伤后HLECs细胞活力的影响H2O2处理后, model组细胞活力降低至control组的58.5% ± 7.5% (P < 0.01);而1、10和100 μg·mL-1花青素预处理组细胞活力分别升高至control组的63.0% ± 8.0%、79.6% ± 17.7%、79.5% ± 8.0%, 与model组相比有统计学差异(P < 0.05, P < 0.01)。该结果说明, 花青素对氧化应激损伤后的HLEC细胞活力具有一定的保护作用(图 1)。
|
Figure 1 Anthocyanin protected HLECs from damaging by H2O2. n = 8, x± s. **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
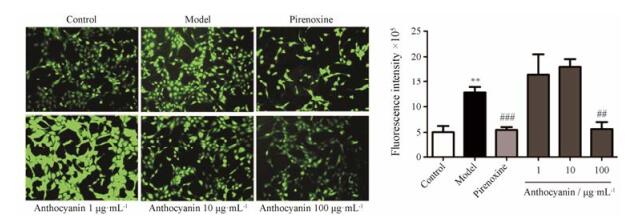
H2O2处理后, model组ROS含量升高至(12.8 ± 2.4) ×105, 显著高于control组(5.1 ± 2.7) ×105 (P < 0.01);而100 μg·mL-1花青素组细胞中ROS荧光强度降低至(5.6 ± 3.1) × 105, 显著低于model组(P < 0.01, 图 2)。
|
Figure 2 Anthocyanin reversed the increase of reactive oxygen species (ROS) in HLECs induced by H2O2 reagent. The photographs were taken under a fluorescence microscope (20×). n = 5, x± s. **P < 0.01 vs control; ##P < 0.01, ###P < 0.001 vs model |
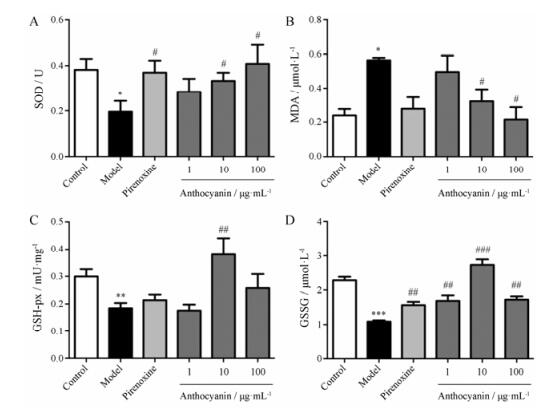
H2O2处理后, model组细胞中SOD活力降低至0.20 ± 0.12 U, 显著低于control组(P < 0.05);花青素预处理后, 10及100 μg·mL-1组SOD活力升高至0.33 ± 0.09、0.41 ± 0.20 U, 显著高于model组(P < 0.05, 图 3A)。Model组细胞中MDA含量升高至0.57 ± 0.03 μmol·L-1, 显著高于control组(P < 0.05);花青素预处理后, 10及100 μg·mL-1组MDA含量降低至0.25 ± 0.16、0.22 ± 0.16 μmol·L-1, 显著低于model组(P < 0.05, 图 3B)。H2O2组细胞中GSH-px活性降低至0.18 ± 0.05 mU·mg-1, 显著低于control组(P < 0.01);花青素预处理后, 10 μg·mL-1组GSH-px活性升高至0.38 ± 0.15 mU·mg-1, 显著高于model组(P < 0.01, 图 3C)。Model组GSSG含量降低至1.09 ± 0.09 μmol·L-1, 显著低于control组(P < 0.001); 1、10和100 μg·mL-1花青素预处理后, 细胞中GSSG含量升高至1.69 ± 0.44、2.73 ± 0.43、1.73 ± 0.25 μmol·L-1, 显著高于model组(P < 0.01, P < 0.001, 图 3D); 以上结果说明, 花青素能明显降低H2O2处理后HLECs细胞内氧化应激水平, 对HLECs氧化应激损伤具有一定的保护作用。
|
Figure 3 Anthocyanin increased anti-oxidative capacity of HLECs. Anthocyanin reversed the decease of SOD activity (A), the increase of MDA content (B), the decease of GSH-px activity (C), the decease of GSSG content (D) in HLECs induced by H2O2. n = 6-8, x± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control; #P < 0.05, ##P < 0.01, ###P < 0.001 vs model. MDA: Malondialdehyde; SOD: Superoxide dismutase; GSH-px: Glutathion peroxidase; GSSG: Oxidized glutathione |
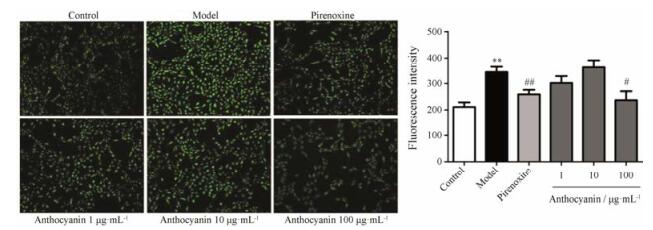
结果显示, model组细胞中Ca2+荧光强度显著升高(P < 0.01); 100 μg·mL-1花青素组细胞中降低Ca2+荧光强度, 显著低于H2O2组(P < 0.05, 图 4)。该结果说明, 花青素对细胞内Ca2+超载具有一定的抑制作用。
|
Figure 4 Anthocyanin inhibited Ca2+ overload. Ca2+ content measured by fluorescence microscope (20×). n = 5, x± s. **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
H2O2处理后, 细胞中α-crystallin的表达量显著降低至control组的68% ± 26% (P < 0.05);花青素预处理后, 细胞中α-crystallin的表达量升高至control组的1.10 ± 0.20倍, 显著高于model组(P < 0.05, 图 5)。该结果说明, 花青素可显著增加α-crystallin含量, 改善晶状体功能。

|
Figure 5 Anthocyanin reversed the decreased expression of α-crystallin induced by H2O2 in HLECs. n = 4, x± s. *P < 0.05 vs control; #P < 0.05 vs model |
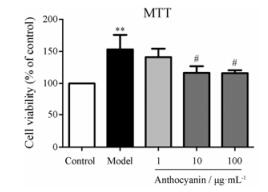
TGF-β2处理后, 细胞活力显著升高至control组的139.0% ± 54.2% (P < 0.01), 10及100 μg·mL-1花青素预处理组细胞活力降低至control组的116.5% ± 31.5%、115.7% ± 13.7%, 显著低于model组(P < 0.05, 图 6)。该结果说明, 花青素对TGF-β2诱导的HLECs细胞增殖有显著的抑制作用。
|
Figure 6 Anthocyanin reversed the proliferation of HLECs induced by TGF-β2. n = 8, x± s. **P < 0.01 vs control; #P < 0.05 vs model |
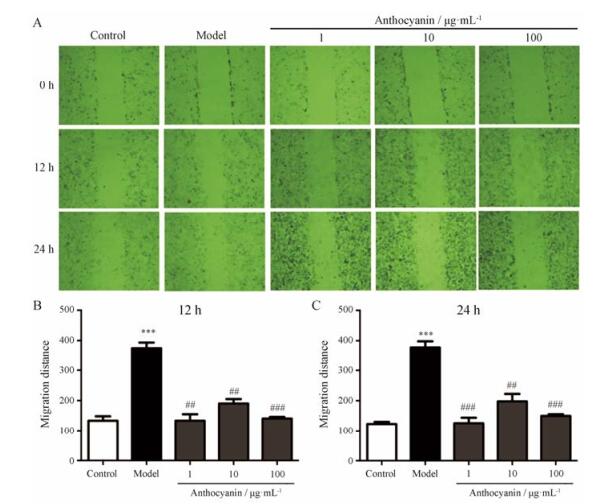
TGF-β2处理后0、12、24 h时的迁移情况如图 7所示。给予TGF-β2 12 h后, model组细胞迁移距离为375.0 ± 31.9 pixels, 显著大于control组133.4 ± 25.3 pixels (P < 0.001), 花青素预处理后细胞迁移的距离分别为133.7 ± 36.7、190.3 ± 25.4、140.7 ± 9.4 pixels, 显著小于model组(P < 0.01, P < 0.001);给予TGF-β2 24 h后, model组细胞迁移距离为308.1 ± 156.4 pixels, 显著大于control组105.5 ± 45.9 pixels (P < 0.001, n = 3), 花青素预处理后细胞迁移的距离分别为109.4 ± 46.6、161.7 ± 82.0、120.0 ± 62.3 pixels, 显著小于model组(P < 0.01, P < 0.001)。该结果说明, 花青素对TGF-β2诱导的HLECs迁移具有显著的抑制作用。
|
Figure 7 Anthocyanin prevents HLECs from migrating induced by TGF-β2. A: Representative images showed that anthocyanin reversed the migration of HLECs induced by TGF-β2. The photographs were taken under a (10×) microscope. B, C: Statistic graphs of migration distance of cells. n = 3, x± s. ***P < 0.001 vs control; ##P < 0.01, ###P < 0.001 vs model |
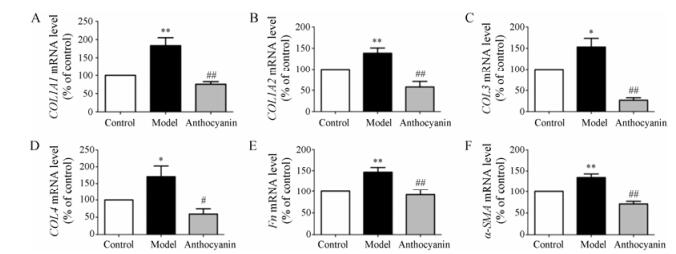
TGF-β2处理后, EMT标志物COL1A1、COL1A2、COL3、COL4、α-SMA、Fn的mRNA表达水平分别显著升高至control组的183% ± 49%、138% ± 30%、153% ± 41%、171% ± 71%、135% ± 17%、147% ± 25% (P < 0.05, P < 0.01);花青素预处理后, 细胞中COL1A1、COL1A2、COL3、COL4、α-SMA、Fn含量分别降低至control组的76% ±16%、58% ±32%、27% ±12%、59% ± 34%、71% ± 12%、92% ± 26%, 显著低于model组(P < 0.05, P < 0.01, 图 8)。该结果说明花青素对TGF-β2诱导HLECs细胞EMT具有显著的抑制作用。
|
Figure 8 Anthocyanin reversed the increase of epithelial-mesenchymal transition (EMT) markers induced by TGF-β2 in HLECs. n = 4-6, x± s. *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model. COL1A1, Collagen Ⅰ alpha 1 chain; COL1A2, Collagen Ⅰ alpha 2 chain; COL3, Collagen Ⅲ; COL4, Collagen Ⅳ; Fn, Fibronectin; α-SMA, α-Smooth muscle actin |
LECs是位于晶状体前囊膜下的单层立方上皮细胞, 代谢较活跃, 具有生长、分化及应激刺激反应的能力[9]。LECs对晶状体具有营养、代谢及损伤修复作用, 是维持晶状体透明性的最重要的防线, 任何原因(如衰老、营养代谢异常、中毒变性、外伤等)破坏LECs的正常结构和功能, 都可能导致不同类型的晶状体混浊。研究证实, ARC的发生发展即与LECs长期处于氧化应激状态密切相关[10]。由于晶状体内无血管供给, 易遭受自由基攻击, 使氧化应激水平升高。虽然正常人的晶状体及房水中存在一定数量的自由基, 如正常人房水中H2O2浓度约为20~30 μmol·L-1, 然而, 白内障患者的房水中H2O2浓度可高达660 μmol·L-1, 为正常人的30倍[11]。晶状体长期处于氧化应激状态时, 可引起LECs膜通透性改变, 细胞内的蛋白质漏出, 房水成分发生改变, 导致细胞内环境改变, 稳定性下降; 引起细胞内蛋白质变性, 不溶性蛋白质增多, 导致透明的晶状体发生浑浊, 影响视力[12, 13]。因此, 氧化应激诱导并促进了白内障发生、发展过程的恶性循环。可见, H2O2诱导的LECs氧化应激损伤是ARC发生发展的起始途径, 减少LECs氧化应激损伤是抑制ARC发生发展的重要途径[14]。而PCO是白内障囊外摘除联合人工晶状体植入术后最常见的并发症, 严重影响白内障术后的视力恢复, 导致视力严重下降甚至失明[15, 16]。研究表明, 术后残留的LECs在晶状体后囊发生增殖、移行、EMT, 形成新的晶体物质或纤维化而引起后囊皱缩是导致晶状体浑浊的主要原因[17]。目前, PCO的药物防治研究尚未取得突破性进展, 而防治的重点应集中于如何抑制残留的LECs发生增殖、迁移、EMT及纤维化[18]。
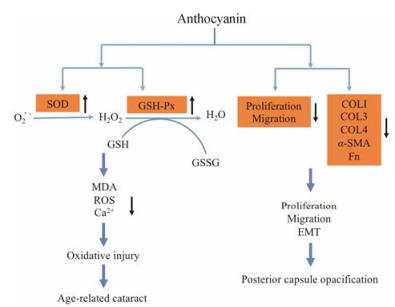
目前, 治疗白内障的最有效方法是手术, 但是早期应用药物进行预防与初步治疗也十分必要。有效的抗白内障药物能推迟手术时间, 延缓白内障的发展。目前, 临床上常用的抗白内障药物包括:非甾体类抗炎药、牛磺酸、醛糖还原酶抑制剂、谷胱甘肽及一些中药制剂等。本研究所采用的阳性对照药吡诺克辛即为醛糖还原酶抑制剂, 研究表明吡诺克辛能保护HLECs预防氧化应激损伤。花青素属于黄酮类化合物, 被誉为继水、蛋白质、脂肪、碳水化合物、维生素、矿物质之后的第七大人体必需营养素, 极具开发和利用前景。蓝莓花青素以其提取率高、结构较稳定等特点, 在食品、药品和保健品领域均有广泛应用[19]。而矢车菊素-3-O-葡萄糖苷作为蓝莓花青素的主要成分之一, 其生物活性的研究备受关注。目前已有研究表明, 矢车菊素-3-O-葡萄糖苷在多种慢性疾病如动脉粥样硬化、糖尿病、癌症等的防治中发挥重要作用, 其保护眼睛健康、预防视力受损的活性也有报道, 包括对视疲劳、屈光不正、眼表疾病、青光眼及视网膜损伤中的治疗作用[20, 21]。也有研究报道, 花青素可通过降低机体血糖、血脂水平延缓糖尿病性白内障的发生、发展, 但其对于ARC和PCO是否具有治疗作用及作用机制尚不明确[22, 23]。本研究分别以H2O2及TGF-β2处理HLECs, 诱导细胞氧化应激损伤及EMT, 建立ARC及PCO细胞模型, 探讨花青素对白内障的治疗作用及其作用机制。本研究结果显示, 花青素能有效减轻氧化应激损伤, 保护HLECs活力。进一步研究发现, 花青素能显著降低HLEC内ROS、MDA水平, 且该作用可能是由于花青素显著升高HLECs内SOD和GSH-Px活性, 增加细胞内超氧阴离子等氧自由基向H2O的转化而降低细胞内ROS及MDA水平; 花青素有效抑制细胞内Ca2+超载, 进一步抑制由氧化应激诱导的HELC凋亡; 同时, 花青素能够显著增加氧化应激损伤后细胞内α-crystallin的表达水平, α-crystallin是存在于LECs中的最重要的功能性蛋白, 具有分子伴侣功能。当细胞处于应激和病理状态时, α-crystallin能有效组织细胞的程序性死亡和蛋白质变性聚集, 从而有效增强应激状态下晶状体中各种功能蛋白的稳定性, 在增强细胞的抗氧化能力、减少细胞凋亡、维持晶状体透明性方面发挥重要作用[24]。此外, 花青素能显著降低由TGF-β2处理后的HLECs细胞活力、细胞迁移距离及EMT标志物COL1A1、COL1A2、COL3、COL4、Fn、α-SMA的mRNA表达水平, 有效抑制TGF-β2诱导的HLECs增殖、迁移、EMT及纤维化生, 进而延缓PCO发生、发展的病理进程(图 9)。
|
Figure 9 Pharmacological effect and mechanisms of anthocyanin |
综上所述, 花青素可明显提高氧化应激状态下LEC抗氧化能力及晶状体蛋白表达水平, 有效保护LECs及晶状体功能; 同时, 花青素能明显抑制由TGF-β2诱导的LECs异常增殖、迁移、EMT及纤维化生, 延缓后囊膜浑浊的病理进程。因此, 花青素对于晶状体功能的保护作用, 有望应用于ARC及PCO的预防和治疗中。
| [1] | Resnikoff S, Pascolini D, Mariotti SP, et al. Global magnitude of visual impairment caused by uncorrected refractive errors in 2004[J]. Bull World Health Organ, 2008, 86: 63–70. DOI:10.2471/BLT.00.000000 |
| [2] | Michael R, Bron A. The ageing lens and cataract:a model of normal and pathological ageing[J]. Philos Trans R Soc Lond B Biol Sci, 2011, 366: 1278–1292. DOI:10.1098/rstb.2010.0300 |
| [3] | Hawse JR, Padgaonkar VA, Leverenz VR, et al. The role of metallothionein Ⅱa in defending lens epithelial cells against cadmium and TBHP induced oxidative stress[J]. Mol Vis, 2011, 12: 342–349. |
| [4] | Gilmour DT, Lyon GJ, Carlton MB, et al. Mice deficient for the secreted glycoprotein SPARC/osteonectin/BM40 develop normally but show severe age-onset cataract formation and disruption of the lens[J]. EMBO J, 1998, 17: 1860–1870. DOI:10.1093/emboj/17.7.1860 |
| [5] | Hawse JR, Hejtmancik JF, Horwitz J, et al. Identification and functional clustering of global gene expression differences between age-related cataract and clear human lenses and aged human lenses[J]. Exp Eye Res, 2004, 79: 935–940. DOI:10.1016/j.exer.2004.04.007 |
| [6] | Lee YK, Lee WS, Kim GS, et al. Anthocyanins are novel AMPKalpha1 stimulators that suppress tumor growth by inhibiting mTOR phosphorylation[J]. Oncol Rep, 2010, 24: 1471–1477. |
| [7] | Han KH, Sekikawa M, Shimada K, et al. Anthocyanin-rich purple potato flake extract has antioxidant capacity and improves antioxidant potential in rats[J]. Br J Nutr, 2006, 96: 1125–1133. DOI:10.1017/BJN20061928 |
| [8] | Matsumoto H, Nakamura Y, Iida H, et al. Comparative assessment of distribution of blackcurrant anthocyanins in rabbit and rat ocular tissues[J]. Exp Eye Res, 2006, 83: 348–356. DOI:10.1016/j.exer.2005.12.019 |
| [9] | Zhang W, Hawse J, Huang Q, et al. Decreased expression of ribosomal proteins in human age-related cataract[J]. Invest Ophthalmol Vis Sci, 2002, 43: 198–204. |
| [10] | Martens E, Stevens I, Janssens V, et al. Genomic organization chromosomal localization tissue distribution and developmental regulation of the PR61/B0 regulatory subunits of protein phosphatase 2A in mice[J]. J Mol Biol, 2004, 336: 971–986. DOI:10.1016/j.jmb.2003.12.047 |
| [11] | Hejtmancik JF, Kantorow M. Molecular genetics of age-related cataract[J]. Exp Eye Res, 2004, 79: 3–9. DOI:10.1016/j.exer.2004.03.014 |
| [12] | Du YX, Guo DD, Wu QX, et al. Zinc chloride inhibits human lens epithelial cell migration and proliferation involved in TGF-β1 and TNF-α signaling pathways in HLEB-3 cells[J]. Biol Trace Elem Res, 2014, 159: 425–433. DOI:10.1007/s12011-014-9979-6 |
| [13] | Ou Y, Yuan ZJ, Li KP, et al. Phycocyanin may suppress D-galactose-induced human lens epithelial cell apoptosis through mitochondrial and unfolded protein response pathways[J]. Toxicol Lett, 2012, 215: 25–30. DOI:10.1016/j.toxlet.2012.09.017 |
| [14] | Xie L, Santhoshkumar P, Reneker LW, et al. Histone deace-tylase inhibitors trichostatin A and vorinostat inhibit TGF-β2-induced lens epithelial-to-mesenchymal cell transition[J]. Invest Ophthalmol Vis Sci, 2014, 55: 4731–4740. DOI:10.1167/iovs.14-14109 |
| [15] | Wertheimer C, Siedlecki J, Kook D, et al. EGFR inhibitor gefitinib attenuates posterior capsule opacification in vitro and in the ex vivo human capsular bag model[J]. Graefes Arch Clin Exp Ophthalmol, 2015, 253: 409–417. DOI:10.1007/s00417-014-2875-0 |
| [16] | Wertheimer C, Liegl R, Kernt M, et al. EGF receptor inhibitor erlotinib as a potential pharmacological prophylaxis for posterior capsule opacification[J]. Graefes Arch Clin Exp Ophthalmol, 2013, 251: 1529–1540. DOI:10.1007/s00417-013-2257-z |
| [17] | Wang Z, Wang D, Li Y, et al. Protective effects of verapamil against H2O2-induced apoptosis in human lens epithelial cells[J]. Biomol Ther (Seoul), 2014, 22: 553–557. DOI:10.4062/biomolther.2014.033 |
| [18] | Sharma P, Panwar M. Trypan blue injection into the capsular bag during phacoemulsification:initial postoperative posterior capsule opacification results[J]. J Cataract Refract Surg, 2013, 39: 699–704. DOI:10.1016/j.jcrs.2012.11.025 |
| [19] | Jing Y, Yumin X, Khaoustov V, et al. Identification of components of grape powder with anti-apoptotic effects[J]. Toxicol Ind Health, 2011, 27: 19–28. DOI:10.1177/0748233710380220 |
| [20] | Yao JY, Li ZJ. Research progress in blueberry anthocyanin in eye disease[J]. Guoji Yanke Zazhi (Int Eye Sci), 2016, 16: 2234–2236. |
| [21] | Jin GR, Hong H, Jin GY, et al. Anthocyanidin inhibits immunoglobulin E-mediated allergic response in mast cells[J]. Acta Pharm Sin (药学学报), 2012, 47: 34–38. |
| [22] | Miyake S, Takahashi N, Sasaki M, et al. Vision preservation during retinal inflammation by anthocyanin-rich bilberry extract:cellular and molecular mechanism[J]. Lab Invest, 2012, 92: 102–109. DOI:10.1038/labinvest.2011.132 |
| [23] | Chung MY, Park HJ, Manautou JE, et al. Green tea extract protects against nonalcoholic steatohepatit is in ob/ob mice by decreasing oxidative and nitrative stress responses induced by proinflammatory enzymes[J]. J Nutr Biochem, 2012, 23: 361–367. DOI:10.1016/j.jnutbio.2011.01.001 |
| [24] | Andley UP, Song Z, Wawrousek EF, et al. Differential protective effect of αA-and αB-crystallin in lens epithelial cells[J]. J Biol Chem, 2000, 275: 36823–36831. DOI:10.1074/jbc.M004233200 |
 2018, Vol. 53
2018, Vol. 53


