纳米技术与药学相结合, 从而衍生出纳米药物。根据纳米药物存在形式的不同可分为纳米载体药物(借助于载体材料使药物分散在载体中纳米化, 如纳米粒、纳米脂质载体、纳米乳)与纳米晶体药物(药物本身纳米化)。纳米载体药物属载体型纳米系统[1], 药物包裹于载体材料, 制备工艺复杂、载药量较低、稳定性差; 而药物纳米晶体技术是纯药物纳米胶态分散体系, 不需要载体材料, 制备工艺简单, 载药量高。纳米晶体技术最早由爱尔兰Elan公司开发, 于1991年首次提出了纳米晶体(nanocrystals)的概念, 而事实上药剂学家普遍认为纳米晶体技术本质上是由1988年研发的Hydrosols技术发展而来。纳米晶体技术为改善难溶性药物的溶解度与生物利用度提供了一种有效的技术方法, 极具产业化应用与发展潜力[2]。本文将对纳米晶体技术的发展历程进行回顾, 以纳米晶体制备技术方法的发展过程为主线进行综述, 并对其存在的问题进行分析与展望, 期望为药物纳米晶体制剂的开发与应用提供借鉴。
1 药物纳米晶体技术发展历程药物纳米晶体通常是在高强度机械力作用下将药物粉碎至纳米级别, 并在少量稳定剂作用下形成的纳米胶态颗粒, 可显著提高药物的可润湿性、饱和溶解度及溶出速度, 凭借巨大的表面积, 可增强与生物膜的黏附性, 延长黏附时间和滞留时间, 提高药物的生物利用度[3]。其作为一种中间制剂技术, 被广泛应用于口服、吸入、鼻腔、经皮和注射等给药途径制剂的制备[4-7]。表 1概述了纳米晶体制备技术授权专利的相关信息[8-18]。纳米晶体的制备方法按照原理通常可分为3类: Top-down技术和Bottom-up技术及二者联用技术, 联用技术又分为NanoEdge和SmartCrystal技术, 其中SmartCrystal技术包含了不同的专利, 由数种技术组合而得(H69:即沉淀-高压均质组合技术; H42:即喷干技术与高压均质技术联用; H96:即冻干技术与高压均质技术联用; CT:介质研磨法-高压均质组合法), 可以最大限度地减小药物纳米晶体的粒径。可见纳米晶体从1988年诞生, 截止目前历经30年的创新发展, 形成了10多项制备关键技术, 并逐步走向成熟, 已有17个药物制剂品种先后获得FDA批准上市。
| Table 1 Patent technologies on production of nanocrystals |
Bottom-up技术系指将含有药物的良溶剂加入到另一种不良溶剂中, 使药物浓度过饱和而析出结晶的方法, 根据技术原理可分为微量沉淀法、超临界流体法等[19]。
2.1.1 微量沉淀法微量沉淀法是将溶有难溶性药物的良溶剂溶液加入到可混溶的不良溶剂中, 通过控制析晶条件来制备纳米晶体。该方法的优点是对仪器的要求不高, 成本低, 操作简单, 可一步完成, 制得的粒子粒径小, 分布窄。晶核形成和成长是析晶过程中两个关键步骤, 不稳定的粒子易发生重结晶, 导致晶体的聚集、沉降, 从而影响药物的稳定性。其缺点是由于制备过程中使用了有机溶剂, 存在有机溶剂残留问题, 所以在制备后需要将有机溶剂除去, 导致较高的生产成本, 且不适用于既不溶于水又不溶于非水溶剂的药物[20]。Hydrosols与Nanomorph技术均是微量沉淀技术, 区别在于药物纳米晶体存在形式不同。Hydrosols技术即是最早利用微量沉淀原理制备纳米晶体的技术方法, 于1988年由Sucker等研发[8], 现被Novartis公司拥有[21]。而Nanomorph技术是利用微量沉淀法制备无定型纳米晶体的技术方法, 最早由Auweter等研发[22, 23], 然而, 至今为止市场上采用微量沉淀法制备的纳米晶体产品很少。
2.1.2 超临界流体法超临界流体法系指将药物溶解在超临界液体(如CO2)中, 当该液体通过微小孔径的喷嘴减压雾化时, 随着超临界液体的迅速气化从而析出纳米晶体粒子。其优点在于技术简单, 成本较低, 使用了对环境无害的溶剂, 可制备出高纯度的无任何有机溶剂残留的纳米晶体, 而其缺点在于超临界流体消耗大, 且不适用于在超临界流体中不溶解的药物。Zhang等[24]采用超临界流体快速膨胀法制备了152~863 nm的阿托伐他汀钙纳米晶体。
2.1.3 酸碱汽化泡腾辅助沉淀法酸碱汽化泡腾辅助沉淀法系指利用酸碱溶液中和反应产生二氧化碳, 利用汽化泡腾作用控制溶液药物微小晶体的形成而制备药物纳米晶体的方法。通常将药物溶于含有弱酸(柠檬酸、枸橼酸等)的溶液中作为酸相, 弱碱(碳酸氢钠)等溶于含有稳定剂的溶液中作为碱相, 然后酸相缓慢加入到碱相中反应产生二氧化碳, 同时汽化泡腾辅助作用下析出药物纳米晶体[25]。该法制备工艺简单, 成本较低, 但要求药物不能被酸碱破坏, 且可能会使用有机溶剂。Wang等[26]利用酸碱汽化泡腾辅助沉淀法制备了他克莫司纳米晶体混悬液, 药物、稳定剂、柠檬酸与碳酸氢钠的质量比例为1:1:1:1.2, 制备的他克莫司纳米晶体的粒径为(348.2 ± 16.7) nm, 其原理为沉淀过程中酸碱中和反应产生的二氧化碳泡腾作用控制纳米晶体的形成与长大。
2.2 Top-down技术Top-down技术指利用机械力如研磨或均质等使药物粒径减小的方法, 包括介质碾磨法、高压均质法等, Top-down工艺重现性好以及易于产业化, 是纳米晶体应用最广的制备技术。表 2详细列出了目前研发上市的药物纳米晶体制剂的生产企业、制备技术等相关信息, 可见目前研发上市产品中主要应用的是Top-down技术[27]。
| Table 2 Nanocrystals products in development and on the market. WMM: Wet media milling; HPH: High press homogenization; CP: Cavi-precipitation |
如图 1所示, 介质研磨技术系依靠研磨介质(玻璃珠或陶瓷球等)制备药物纳米晶体的方法, 该技术由Meriskoliversidge等[28, 29]发明, 是FDA批准上市药物如Rapamune、Emend、Tricor和Megace ES等的常用制备方法。该法制备过程简单, 可操作性强, 制备的纳米晶体粒径分布均一, 易于产业化, 且因制备过程可控制温度而适用于热不稳定性药物。该法制备的药物纳米晶体的粒径大小主要与研磨介质的大小及用量、研磨时间和速度、药物浓度等因素密切相关[30]。
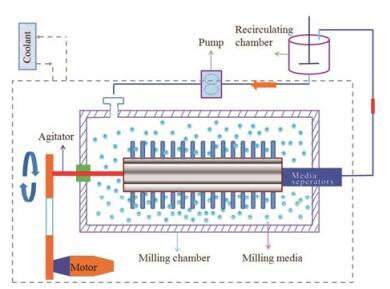
|
Figure 1 The schematic image of media milling |
高压均质技术依据均质原理不同可分为两种, 即微射流技术(IDD-P)和活塞-裂隙均质技术(Dissocubes、Nanopure)。高压微射流技术是将大颗粒药物分散于水溶液或其他溶剂中形成粗混悬液, 高压作用下使粗混悬液高速通过一个特别设计(“Z”形或“Y”形)的均化室(图 2), 利用撞击力、剪切力和空穴作用来减小药物的粒径, 在“Z”形均化室中, 混悬液在短时间内改变液流方向, 因碰撞而产生剪切力, 而在“Y”形均化室, 则是由于两个管道中的混悬液在交叉处正面高速碰撞而产生剪切力[31]。IDD-P已被加拿大Skypharma公司成功应用于Triglide (非诺贝特)产品的生产[11]。该技术影响药物粒径大小和粒度分布的因素主要有处理压力、循环次数及药物本身性质等, 但是该技术生产效率不高, 循环次数较多, 且不适合硬度较大的药物, 一般得到微米级粒子, 不利于生产扩大化[32]。
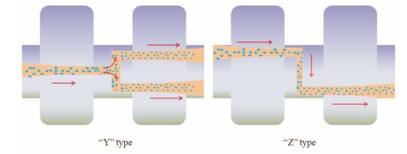
|
Figure 2 The schematic image on chambers types of Jet-stream homogenization |
活塞-裂隙均质技术是将微粉化的原料药置于含有稳定剂的溶剂中高速搅拌分散制得初混悬液, 然后利用高压均质使初混悬液通过均质阀座的狭缝, 依赖空化作用、剪切力或冲撞力制备纳米晶体, 直到符合粒度要求(图 3)。该技术的影响因素主要为均质化过程中的压力、循环次数、温度及药物的硬度[33]。Dissocubes、Nanopure技术最初由Muller团队发明[12, 13], 均属于活塞-裂隙均质技术, Dissocubes技术现为加拿大Skyepharma公司拥有, Nanopure技术隶属于Abbott GmbH公司, 这两项技术采用的高压均质压力可达到150 MPa, 然而采用的分散介质不同, Dissocubes技术以水作为分散介质, 而Nanopure技术以非水溶剂(如油或液体聚乙二醇等)为分散介质, 用于纳米晶体生产。
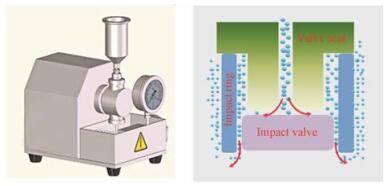
|
Figure 3 The schematic image of homogenization |
介质研磨技术、高压均质技术是制备纳米晶体的常规技术, 然而这两种技术通常要求药物初始物料必须微粉化, 而且研磨或均质时间比较长, 限制了这两种技术的广泛应用。因此, 现在常将“bottom-up”和“top-down”技术联合使用, 以提高药物粒径减小效率, 组合技术与常规的纳米晶体制备技术的对比见图 4, 相关的研究实例见表 3[18, 34-46]。
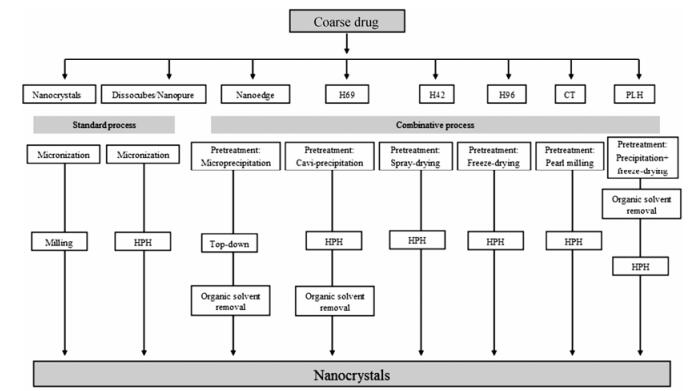
|
Figure 4 Schematic description of standard and combinative particle size reduction technologies |
| Table 3 The study cases of drugs processed with the combinative particle size reduction technologies |
该技术最初为Baxer公司发明[34], 此法联合微量沉淀法与高压均质法, 一方面利用沉淀法获得粒径小于25 μm的初始晶体粒子, 从而减少高压均质机狭缝堵塞的风险, 提高高压均质过程中药物粒径减小的效率; 另一方面运用高压均质法的均化作用使药物晶型趋于完美, 并克服沉淀法所得的晶体粒子粒径分布不均匀、易产生奥斯瓦尔德熟化的问题, 增加纳米晶体粒子的物理稳定性。Wang等[35]利用微量沉淀法-联合高压均质法制备光甘草定纳米晶体混悬液, 制得的纳米晶体粒径为149.2 nm, 多分散系数为0.254。Shen等[36]利用基于酸碱中和的微量沉淀法联合高压均质法制备波棱瓜子总木脂素纳米晶体混悬液, 制得的纳米晶体粒径为243 nm, 多分散系数为0.187。
2.3.2 H69技术(高压空化沉淀-均质组合技术)该方法类似于NanoEdge技术, 最初由Möschwitzer等[38]发明, 该技术联合微量沉淀法与高压均质法, 与NanoEdge技术不同之处在于纳米晶体的形成发生在高压均质空化区域, 即微量沉淀的过程同时伴随着高压均质, 纳米晶体粒子一经形成便受到高压空化作用、破碎力及冲撞力等作用, 从而控制晶体的长大, 提高纳米晶体粒径的均一性。Li等[39]运用高压空化沉淀-均质组合法制备熊去氧胆酸纳米晶体混悬液, 沉淀压力为50 MPa, 均质压力为60 MPa, 制备的纳米晶体粒径为372 nm, 显著小于普通高压均质技术制备的纳米晶体粒径大小。
2.3.3 H42技术(喷干分散-高压均质组合技术)与H96技术(冻干分散-高压均质组合技术)该系列技术由Möschwitzer教授发明, 系指将难溶性药物与稳定剂的溶液分别经喷雾干燥或冷冻干燥, 使药物均匀分散于稳定剂骨架分子中而形成药物分散物, 然后将其重新分散到水中经高压均质而制备药物纳米晶体的方法。该法既可以使药物表面充分被稳定剂吸附修饰而减少高压均质过程中粒子的聚集, 又可以使粒子达到微米级而提高高压均质过程中药物粒径减小效率。Möschwitzer等[41]采用H42技术制备氢化可的松纳米晶体混悬液, 结果表明喷雾干燥处理后的格列本脲在150 MPa下均质循环1次制得的纳米晶体与未处理的格列本脲于150 MPa下均质循环20次制得的纳米晶体粒径相当, 可见经喷雾干燥处理后的药物粒径减小效率显著提高。Salazar等[42]采用H96技术制备了格列本脲纳米晶体混悬液, 经冻干处理后的格列本脲在150 MPa的压力下均质循环5次, 粒径即可减小到355 nm, 而直接高压均质法需150 MPa均质循环20次, 表明该方法明显提高了药物粒径减小的效率。
2.3.4 PLH技术(沉淀-冻干-高压均质组合技术)PLH是将沉淀法、冻干法、均质法结合在一起的方法, 首先将药物溶解在有机溶剂中, 再加入到水相中从而沉淀形成较小晶体, 随后利用冷冻干燥对原料进行改性, 除去在沉淀步骤中所使用的有机溶剂, 最后经过高压均质使其粒径达到纳米范围。Morakul等[43]利用PLH技术制备了粒径为(444 ± 10) nm的克拉霉素纳米晶体, 均质条件为150 MPa, 均质5次, 而直接高压均质法制备同等粒径大小的克拉霉素纳米晶体, 则需要150 MPa均质30次。
2.3.5 CT技术该技术系联合介质研磨技术与高压均质技术制备纳米晶体, 药物首先经介质研磨技术预处理得到600~1 500 nm的纳米晶体粗混悬液, 然后再经高压均质制备稳定均一的纳米晶体混悬液, 该技术可减少高压均质的压力, 提高均质效率, 同时可显著提高纳米晶体的稳定性[44]。Martena等[45]运用CT技术(介质研磨3 h联合高压均质150 MPa 10次)制备麦角溴烟酯纳米晶体混悬液, 制得的纳米晶体粒径为(353 ± 17) nm, 然而直接高压均质(150 MPa均质30次)制备的纳米晶体粒径为(670 ± 55) nm, 这显著提高了麦角溴烟酯纳米晶体粒径减小的效率。
2.3.6 MRT技术(微射流反应技术)如图 5所示, 微射流反应技术方法是将良溶剂与反溶剂物料流经单向阀后, 在高压腔内混合并被加压, 然后通过喷嘴的微孔被挤压出来, 形成高速喷射流喷入反应腔, 喷射流在反应腔内对流剪切、形成湍流并相互对撞, 通过剪切、对撞和空化效应能够达到控制晶体粒径减小的技术方法, 而良溶剂与反溶剂的混合比例、射流强度、稳定剂用量、温度等是影响微射流反应技术制备纳米晶体的关键因素。Panagiotou等[46]运用微射流反应技术制备了诺氟沙星纳米晶体混悬液, 选用的良溶剂二甲亚砜与反溶剂水的比例为1:4, 射流压力138 MPa, 稳定剂比例为10% (w/w), 制备的纳米晶体粒径为170~350 nm。
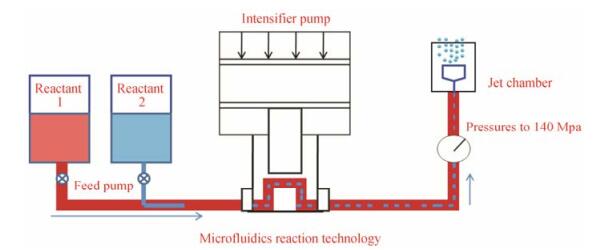
|
Figure 5 The schematic image of microfluidics reaction technology |
ART技术是联合转子-定子高速剪切技术与高压均质技术进行纳米晶体制备的方法, 首先药物混悬液经转子-定子高速剪切机(ART MICCRA, 图 6)剪切预处理, 然后再经高压均质制备稳定均一的纳米晶体混悬液, 该技术可减少高压均质的压力, 提高均质效率, 同时可显著提高纳米晶体的稳定性[47]。Scholz等[18]利用ARTcrystals技术制备芦丁纳米晶体混悬液, 剪切转速24 000 r·min-1, 剪切温度为30 ℃, 剪切时间3 min, 流速600 L·h-1, 然后经高压均质机50 MPa均质5次, 制备的芦丁纳米晶体的粒径为431 nm, 多分散系数0.27, 粒径大小与均一性较好。

|
Figure 6 The schematic image of ART MICCRA |
进一步缩短制备时间, 降低生产成本, 提高稳定性仍然是纳米晶体技术研究的难点。药物纳米晶体的制备难易与制备工艺方法密切有关, 此外, 还与稳定剂性质、药物的理化属性等因素有关[48, 49]。药物纳米晶体混悬液容易发生聚结、晶体长大等奥斯瓦尔德熟化现象, 通常使用适量的表面活性剂或高分子聚合物稳定剂来抑制纳米晶体粒子的成长速率, 而稳定剂的表面张力、黏度、分子量、亲水与疏水基团、zeta电位及浓度等可能是影响药物纳米晶体纳米化的关键属性[50]。此外, 药物的理化属性也是影响药物纳米晶体制备难易的重要因素, 如药物的固体形态、初始粒径、内聚能和多晶型等性质直接影响纳米晶体制备的粒径大小及其稳定性。
3.2 深入开展药物纳米晶体的体内外相关性及纳米毒理安全性评价研究纳米晶体为改善难溶性药物的溶解度与溶出度提供了新的方法, 其作为中间制剂技术, 已被广泛应用于口服[51]、吸入[52]、鼻腔[53]、经皮[54]和靶向[55]等给药途径制剂的制备。截至目前全球批准上市了17个产品, 其中帕利哌酮和阿立哌唑缓释注射液的上市, 为纳米晶体技术在注射液领域的应用奠定了坚实的基础。纳米晶体制剂由于药物本身为纳米状态, 具有特殊的纳米效应及性质, 能够显著改善药物的体内行为, 存在潜在的安全风险。目前, 关于药物纳米晶体制剂的体内外相关性及安全性评价的研究较少, 尤其纳米晶体注射给药与靶向给药的安全性研究更少。如何建立适合药物纳米晶体制剂特点的体内外相关性分析模型, 以及建立药物纳米晶体制剂的毒理安全性评价方法, 增强纳米晶体体内的可控性与安全性, 对药物纳米晶体制剂的发展具有重要的意义。
3.3 加强纳米晶体的基础研究, 研发纳米晶体制备相关设备, 推动我国药物纳米晶体制剂的工业化生产纳米晶体技术发展至今已有30年, 然而我国纳米晶体技术的研究仍然处于基础研究阶段, 截止目前没有批准上市的原研产品。纳米晶体技术的应用受到设备能耗高、易磨损等因素的制约, 药物本身的性质如脆碎性和热敏感性也限制了纳米晶体技术的应用。因此, 进一步加强药物纳米晶体制备过程的放大研究及其配套设备的开发, 提高产品稳定性将是今后我国推进药物纳米晶体制备技术工业化的重要方向。
4 结语纳米晶体技术为改善难溶性药物的给药提供了一种可行性技术方法。过去30年纳米晶体技术在药剂学领域取得了巨大的发展, 制备技术方法不断升级更新, 纳米化效率有不同程度提升, 并实现了17个产品的批准上市, 涵盖口服、注射等给药途径, 这充分印证了纳米晶体制剂技术产业化的成熟可行与广阔前景。然而, 也必须意识到纳米晶体技术还存在一些问题, 需要进一步加强影响纳米晶体制备的关键因素研究, 提高纳米晶体技术的粒径减小效率与稳定性, 深入开展药物纳米晶体的体内外相关性及安全性评价研究等。相信伴随基础研究的不断深入, 纳米晶体技术将不断趋于完善, 并广泛应用于更多制剂领域。
| [1] | Krishnaiah YSR. Pharmaceutical technologies for en-hancing oral bioavailability of poorly soluble drugs[J]. J Bioequival Bioavailabil, 2010, 2: 28–36. |
| [2] | Zheng A, Shi J. Research progress in nanocrystal drugs[J]. J Int Pharm Res (国际药学研究杂志), 2012, 39: 177–183. |
| [3] | Gao L, Liu G, Ma J, et al. Application of drug nanocrystal technologies on oral drug delivery of poorly soluble drugs[J]. Pharm Res, 2013, 30: 307–324. DOI:10.1007/s11095-012-0889-z |
| [4] | Lu Y, Li Y, Wu W. Injected nanocrystals for targeted drug delivery[J]. Acta Pharm Sin B, 2016, 6: 106–113. DOI:10.1016/j.apsb.2015.11.005 |
| [5] | Sinha B, Müller RH, Möschwitzer JP. Bottom-up approaches for preparing drug nanocrystals:formulations and factors affecting particle size[J]. Int J Pharm, 2013, 453: 126–141. DOI:10.1016/j.ijpharm.2013.01.019 |
| [6] | Liu T, Müller RH, Möschwitzer JP. Effect of drug phys-ico-chemical properties on the efficiency of top-down process and characterization of nanosuspensions[J]. Expert Opin Drug Del, 2015, 12: 1741–1754. DOI:10.1517/17425247.2015.1057566 |
| [7] | Müller RH, Gohla S, Keck CM. State of the art of nanocrystals-special features, production, nanotoxicology aspects and intracellular delivery[J]. Eur J Pharm Biopharm, 2011, 78: 1–9. DOI:10.1016/j.ejpb.2011.01.007 |
| [8] | List M, Sucker H. Pharmaceutical colloidal hydrosols for injection: GB, 2200048[P]. 1988-07-27. |
| [9] | Auweter H, Bohn H, Heger R, et al. Precipitated water insoluble colorants in colloid disperse form: US, 6494924[P]. 2002-12-17. |
| [10] | Keck CM, Müller RH. Drug nanocrystals of poorly soluble drugs produced by high pressure homogenization[J]. Eur J Pharm Biopharm, 2006, 62: 3–16. DOI:10.1016/j.ejpb.2005.05.009 |
| [11] | Majuru S, Oyewumi MO. Nanotechnology in Drug, Devel-opment and Life Cycle Management[M]//De Villiers MM, Aramwit P, Kwon GS. Nanotechnology in Drug Delivery. New York: Springer, 2009: 597-619. |
| [12] | Muller RH, Becker R, Kruss B, et al. Pharmaceutical nanosuspensions for medicament administration as systems with increased saturation solubility and rate of solution: US, 5858410 A[P]. 1999-01-12. |
| [13] | Helmut MR, Karsten K, Karsten M. Verfahren zur schonenden Herstellung von hochfeinen mikropartikeln und nanopartikeln: Germany, DE19932157A[P]. 2001-01-18. |
| [14] | Kipp JE, Wong JCT, Doty MJ, et al. Microprecipitation method for preparing submicron suspensions: US, 6607784[P]. 2003-08-19. |
| [15] | Sharma OP, Patel V, Mehta T. Nanocrystal for ocular drug delivery:hope or hype[J]. Drug Deliv Transl Res, 2016, 6: 399–413. |
| [16] | Möschwitzer J, Lemke A. Method for carefully producing ultrafine particle suspensions and ultrafine particles and use: EP, 2006/003377[P]. 2006-10-19. |
| [17] | Petersen R. Nanocrystals for use in topical cosmetic formulations and method of production thereof: US, 9114077[P]. 2015-08-25. |
| [18] | Scholz P, Arntjen A, Müller RH, et al. ARTcrystal® process for industrial nanocrystals production optimization of the ART MICCRA pre-milling step[J]. Int J Pharm, 2014, 465: 388–395. DOI:10.1016/j.ijpharm.2014.02.026 |
| [19] | Du J, Li X, Zhao H, et al. Nanosuspensions of poorly water-soluble drugs prepared by bottom-up technologies[J]. Int J Pharm, 2015, 495: 738–749. DOI:10.1016/j.ijpharm.2015.09.021 |
| [20] | Yue P, Wang Y, Wan J, et al. The research progress of preparation methods of solid nanocrystal delivery system[J]. Acta Pharm Sin (药学学报), 2012, 47: 1120–1127. |
| [21] | Gassmann P, Sucker H. Improvements in pharmaceutical compositions: European, 0580690[P]. 1992. |
| [22] | Auweter H, André V, Horn D, et al. The function of gelatin in controlled precipitation processes of nanosize particles[J]. J Dispers Sci Technol, 1998, 19: 163–184. DOI:10.1080/01932699808913170 |
| [23] | Kleimann J, Gehin-Delval C, Auweter H, et al. Super-stoichiometric charge neutralization in particle-polyelectrolyte systems[J]. Langmuir, 2005, 21: 3688–3698. DOI:10.1021/la046911u |
| [24] | Zhang J, Huang Y, Liu D, et al. Preparation of apigenin nanocrystals using supercritical antisolvent process for dissolution and bioavailability enhancement[J]. Eur J Pharm Sci, 2013, 48: 740–747. DOI:10.1016/j.ejps.2012.12.026 |
| [25] | Han X, Wang M, Ma Z, et al. A new approach to produce drug nanosuspensions CO2-assisted effervescence to produce drug nanosuspensions[J]. Colloids Surf B Biointerfaces, 2016, 143: 107–110. DOI:10.1016/j.colsurfb.2016.03.017 |
| [26] | Wang Y, Han X, Wang J, et al. Preparation, characterization and in vivo evaluation of amorphous tacrolimus nanosuspensions produced using CO2-assisted in situ nanoamorphization method[J]. Int J Pharm, 2016, 505: 35–41. DOI:10.1016/j.ijpharm.2016.03.056 |
| [27] | Lu Y, Chen Y, Gemeinhart RA, et al. Developing nanocrystals for cancer treatment[J]. Nanomedicine (Lond), 2015, 10: 2537–2552. DOI:10.2217/nnm.15.73 |
| [28] | Meriskoliversidge EM, Liversidge GG. Drug nanoparticles:formulating poorly water-soluble compounds[J]. Toxicol Pathol, 2008, 36: 43–48. DOI:10.1177/0192623307310946 |
| [29] | Zeng LB, Lian YF, Zhang JD, et al. Progress in the industrializetion of nanocrystal technology[J]. J Chin Pharm Univ (中国药科大学学报), 2013, 44: 504–510. |
| [30] | Bitterlich A, Laabs C, Krautstrunk I, et al. Process parameter dependent growth phenomena of naproxen nanosuspension manufactured by wet media milling[J]. Eur J Pharm Biopharm, 2015, 92: 171–179. DOI:10.1016/j.ejpb.2015.02.031 |
| [31] | Möschwitzer JP. Drug nanocrystals in the commercial pharmaceutical development process[J]. Int J Pharm, 2013, 453: 142–156. DOI:10.1016/j.ijpharm.2012.09.034 |
| [32] | Raghava Srivalli KM, Mishra B. Drug nanocrystals:a way toward scale-up[J]. Saudi Pharm J, 2016, 24: 386–404. DOI:10.1016/j.jsps.2014.04.007 |
| [33] | Leone F, Cavalli R. Drug nanosuspensions:a ZIP tool between traditional and innovative pharmaceutical formula-tions[J]. Expert Opin Drug Del, 2015, 12: 1607–1625. DOI:10.1517/17425247.2015.1043886 |
| [34] | Kipp JE, Doty MJ, Rebbeck CL, et al. Compositions of and method for preparing stable particles in a frozen aqueous matrix: US, 20030077329A1[P]. 2003-04-24. |
| [35] | Wang WP, Hu J, Sui H, et al. Glabridin nanosuspension for enhanced skin penetration:formulation optimization, in vitro and in vivo evaluation[J]. Pharmazie, 2016, 71: 252–257. |
| [36] | Shen G, Cheng L, Wang LQ, et al. Formulation of dried lignans nanosuspension with high redispersibility to enhance stability, dissolution, and oral bioavailability[J]. Chin J Nat Med, 2016, 14: 757–768. |
| [37] | Yang L, Jiang J, Hong J, et al. High drug payload 10-hydroxycamptothecin nanosuspensions stabilized by cholesterol-PEG:in vitro and in vivo investigation[J]. J Biomed Nanotechnol, 2015, 11: 711–721. DOI:10.1166/jbn.2015.2050 |
| [38] | Möschwitzer J, Muller RH. Method and device for producing very fine particles and coating such particles: Canada, CA20062628562[P]. 2006-10-13. |
| [39] | Li Y, Wang Y, Yue PF, et al. A novel high-pressure precipitation tandem homogenization technology for drug nanocrystals production-a case study with ursodeoxycholic acid[J]. Pharm Dev Technol, 2014, 19: 662–670. DOI:10.3109/10837450.2013.819015 |
| [40] | Kalvakuntla S, Deshpande M, Attari Z, et al. Preparation and characterization of nanosuspension of aprepitant by H96 process[J]. Adv Pharm Bull, 2016, 6: 83–90. |
| [41] | Möschwitzer J, Müller RH. New method for the effective production of ultrafine drug nanocrystals[J]. J Nanosci Nanotechnol, 2006, 6: 3145–3153. DOI:10.1166/jnn.2006.480 |
| [42] | Salazar J, Ghanem A, Müller RH, et al. Nanocrystals:comparison of the size reduction effectiveness of a novel combinative method with conventional top-down approaches[J]. Eur J Pharm Biopharm, 2012, 81: 82–90. DOI:10.1016/j.ejpb.2011.12.015 |
| [43] | Morakul B, Suksiriworapong J, Chomnawang MT, et al. Dissolution enhancement and in vitro performance of clari-thromycin nanocrystals produced by precipita-tion-lyophilization-homogenization method[J]. Eur J Pharm Biopharm, 2014, 88: 886–896. DOI:10.1016/j.ejpb.2014.08.013 |
| [44] | Salazar J, Müller RH, Möschwitzer JP. Performance comparison of two novel combinative particle-size-reduction technologies[J]. J Pharm Sci, 2013, 102: 1636–1649. DOI:10.1002/jps.23475 |
| [45] | Martena V, Shegokar R, Di Martino P, et al. Effect of four different size reduction methods on the particle size, solubility enhancement and physical stability of nicergoline nanocrystals[J]. Drug Dev Ind Pharm, 2014, 40: 1199–1205. DOI:10.3109/03639045.2013.810635 |
| [46] | Panagiotou T, Mesite SV, Fisher RJ. Production of norfloxacin nanosuspensions using microfluidics reaction technology through solvent/antisolvent crystallization[J]. Ind Eng Chem Res, 2009, 48: 1761–1771. DOI:10.1021/ie800955t |
| [47] | Keck CM. Nanocrystals and amorphous nanoparticles and method for production of the same by a low energy process: US, 11185527[P]. 2011-10-17. |
| [48] | Yue PF, Li Y, Wan J, et al. Study on formability of solid nanosuspensions during nanodispersion and solidification:I. novel role of stabilizer/drug property[J]. Int J Pharm, 2013, 454: 269–277. DOI:10.1016/j.ijpharm.2013.06.050 |
| [49] | Rachmawati H, Shaal LA, Müller RH, et al. Development of curcumin nanocrystal:physical aspects[J]. J Pharm Sci, 2013, 102: 204–214. DOI:10.1002/jps.23335 |
| [50] | George M, Ghosh I. Identifying the correlation between drug/stabilizer properties and critical quality attributes (CQAs) of nanosuspension formulation prepared by wet media milling technology[J]. Eur J Pharm Sci, 2013, 48: 142–152. DOI:10.1016/j.ejps.2012.10.004 |
| [51] | Fan F, Tang X, Li X, et al. Preparation and evaluation of pharmacodynamic of the pectin-doxorubicin conjugate nanosuspensions[J]. Acta Pharm Sin (药学学报), 2016, 51: 1476–1482. |
| [52] | Yazdi AK, Smyth HD. Carrier-free high-dose dry powder inhaler formulation of ibuprofen:physicochemical characterization and in vitro aerodynamic performance[J]. Int J Pharm, 2016, 511: 403–414. DOI:10.1016/j.ijpharm.2016.06.061 |
| [53] | Hao J, Zhao J, Zhang S, et al. Fabrication of an ionic-sensitive in situ gel loaded with resveratrol nanosuspensions intended for direct nose-to-brain delivery[J]. Colloids Surf B Biointerfaces, 2016, 147: 376–386. DOI:10.1016/j.colsurfb.2016.08.011 |
| [54] | Ali HSM, Hanafy AF. Glibenclamide nanocrystals in a biodegradable chitosan patch for transdermal delivery:engineering, formulation, and evaluation[J]. J Pharm Sci, 2017, 106: 402–410. DOI:10.1016/j.xphs.2016.10.010 |
| [55] | Talekar M, Ganta S, Amiji M, et al. Development of PIK-75 nanosuspension formulation with enhanced delivery efficiency and cytotoxicity for targeted anti-cancer therapy[J]. Int J Pharm, 2013, 450: 278–289. DOI:10.1016/j.ijpharm.2013.04.057 |
 2018, Vol. 53
2018, Vol. 53


