细胞凋亡是多细胞有机体重要的自稳机制, 它能主动清除不需要或异常的细胞, 对胚胎发育、维持内环境稳态以及抵抗病原体等正常生理进程发挥重要的作用。该机制的紊乱会诱发各种疾病, 如癌症、自身免疫性疾病、心血管疾病及神经退行性疾病等[1]。自从1972年Kerr等[2]首次提出了细胞凋亡的概念以来, 大量的科学研究已经证实细胞凋亡调控的相关途径, 为后续药物的研究奠定了坚实的理论基础。特别是1984年, 科学家们发现了细胞凋亡与肿瘤之间的重要诱导因子——Bcl-2基因[3], 后续的研究发现Bcl-2基因的过度表达可引起细胞凋亡异常, 并与肿瘤的发生、发展密切相关。因此深入研究细胞凋亡机制对于理解癌症的发病机制、探明癌症耐药性成因以及开发新型的抗肿瘤药物具有重要意义。
1 细胞凋亡及其信号通路现代医学研究证实, 细胞死亡主要分为两种形式, 一种是细胞坏死(necrosis), 另一种是程序性细胞死亡即细胞凋亡(apoptosis)。细胞坏死是细胞受到强烈理化或生物因素作用时引起细胞无序死亡的过程, 主要表现为细胞胀大、胞膜破裂、内容物溢出和局部严重的炎症反应; 细胞凋亡是细胞接受环境的生理或病理信号刺激, 由细胞环境条件的变化或缓和性损伤后产生的有序死亡过程, 其细胞及组织的变化与坏死有明显的不同。
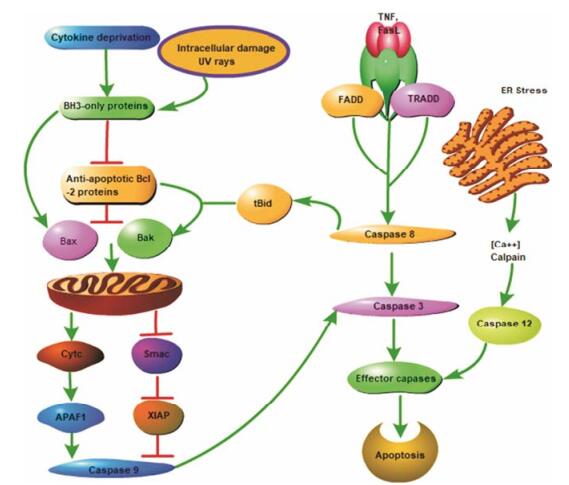
目前已知的凋亡通路主要有3条:线粒体凋亡通路、死亡受体通路和内质网通路(图 1)[4], 其中线粒体凋亡通路又称为内源性凋亡通路, 是最经典的通路。当细胞受到多种内源性凋亡信号(如细胞因子缺失、药物诱导等)刺激时, Bcl-2蛋白家族成员调控线粒体通透性转变孔(mitochondrial permeability transition pore, MPTP)不可逆地过度开放, 导致膜间隙的细胞色素C (Cytc)进入胞浆与凋亡蛋白活化因子-1 (apoptosis protease-activating fator-1, Apaf-1)结合, 募集Caspase-9前体, 使其通过自我剪切活化。活化的Caspase-9激活下游Caspase-3介导的级联反应, 引起细胞凋亡[5]。
|
Figure 1 Cellular apoptosis pathway |
Bcl-2家族蛋白有20多种, 根据功能可分为抗凋亡蛋白和促凋亡蛋白两大类。这些蛋白都拥有1~4个Bcl-2同源结构域(Bcl-2 homology domains, 包括BH1、BH2、BH3和BH4)。抗凋亡蛋白Bcl-2、Bcl-xL、Bcl-W、Mcl-1、A1/Bfl-1可与促凋亡蛋白结合, 使肿瘤细胞逃避凋亡, 其结构一般包含BH1~4四个结构域。促凋亡蛋白又分为BH3-only蛋白和多结构域蛋白两类, 其中Bim、Bad、Bid、Puma和Noxa等属于BH3-only蛋白, 而Bax和Bak属于多结构域促凋亡蛋白(也称促凋亡效应器)。抗凋亡蛋白通过其疏水口袋(BH3结合口袋)与促凋亡蛋白的BH3结构域的α螺旋结合。
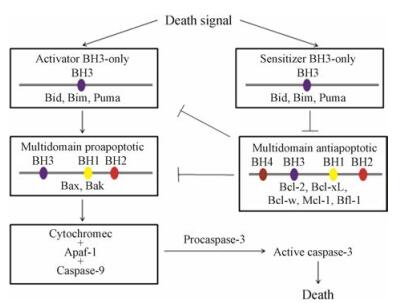
Bcl-2蛋白家族成员之间通过蛋白-蛋白相互作用(protein-protein interaction, PPI), 共同调控线粒体凋亡通路。如图 2所示[6], BH3-only蛋白接受死亡信号刺激后, 激活凋亡通路。Bid、Bim和Puma (激活子, activator)直接激活Bax和Bak; 而Bad、Bik、Bmf、Noxa、Hrk和Puma (敏感子, sensitizer)与抗凋亡蛋白竞争性结合, 促使其释放出Bax和Bak。Bax和Bak形成的寡聚体作用于线粒体外膜, 使其通透性发生改变, 导致Cytc释放, 激活下游级联反应, 放大死亡信号, 最终引发细胞凋亡[7]。
|
Figure 2 Mitochondrial apoptotic pathway |
研究表明, 放化疗药物多是通过诱导细胞凋亡作用实现肿瘤的治疗。恶性肿瘤细胞通常表现为细胞凋亡失调, 其原因与抗凋亡蛋白过度表达密切相关。应用抗凋亡蛋白抑制剂, 可以调控促凋亡蛋白与抗凋亡蛋白之间的平衡, 恢复肿瘤细胞内的正常凋亡功能。因此抗凋亡蛋白Bcl-2已成为肿瘤治疗领域新兴的药物靶标, 近20年来已发展了许多抑制剂, 有些药物已进入临床研究。现简要介绍如下。
3 早期Bcl-2抑制剂的发现目前主要有3种Bcl-2抑制剂, 包括反义寡核苷酸、BH3模拟肽和小分子抑制剂。
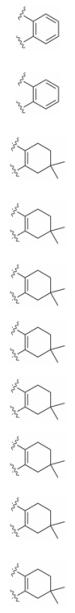
3.1 反义寡核苷酸类Bcl-2抑制剂此类药物通过碱基互补配对原则与靶标蛋白的mRNA结合, 通过阻止mRNA转录、mRNA剪接等机制来抑制mRNA加工或翻译成蛋白质[8]。目前已有4个此类药物被报道(图 3)。其中oblimersen (G3139, genasense)含有18个核苷酸序列, 主要与Bcl-2开放阅读框的前6个密码子序列进行碱基互补配对。Oblimersen能有效的降低Bcl-2蛋白的表达, 抑制淋巴瘤细胞株的增殖。慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)是一种以淋巴细胞聚集在外周血、骨髓、脾脏和淋巴结为特征的成熟B淋巴细胞克隆增殖性肿瘤。该病是西方国家最常见的成人白血病, 约占成人白血病的25%, 占非霍奇金淋巴瘤的25%[9]。目前, 较为有效的治疗CLL手段是FCR方案(氟达拉滨+环磷酰胺+利妥昔单抗)[10]。FCR方案对年轻、并发症少的低风险CLL患者具有良好的治疗效果, 但对高龄、并发症多的患者使用效果不佳。研究发现在Ⅰ/Ⅱ期临床试验中, oblimersen在治疗复发/难治性CLL时出现了细胞因子释放综合征, 这限制了其在临床中应用[11]。临床Ⅲ期试验中随机将患者分为氟达拉滨/环磷酰胺或氟达拉滨/环磷酰胺/oblimersen组, 给药后结果显示两组的5年生存率无明显差异[12]。随后, 停止了该药物用于治疗CLL的临床试验。
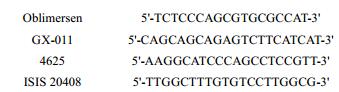
|
Figure 3 Four antisense oligonucelotides |
BH3模拟肽类药物主要是由BH3-only蛋白的结构设计而来。在非细胞实验中BH3模拟肽类药物可以与抗凋亡蛋白结合, 进而阻断抗凋亡蛋白与促凋亡蛋白之间的相互作用。Wang等[13]通过化学修饰方法获得了细胞渗透性Bcl-2结合肽CPM-1258。该化合物与Bcl-2蛋白有较好的亲和力, 体外能够诱导HL-60肿瘤细胞凋亡。
3.3 小分子Bcl-2抑制剂 3.3.1 苯并吡喃(色烯)类衍生物20世纪末以来, 科学家们已成功发现了多个小分子Bcl-2抑制剂。Wang等[14]通过以优化所得的Bcl-2蛋白结合模型, 筛选MDL/ACD 3D数据库中的193 833个化合物成功得到了苯并吡喃类化合物HA14-1 (图 4)。HA14-1是首个报道的小分子Bcl-2抑制剂。HA14-1能够干扰Bcl-2与Bim和Bax的结合, 并且可以选择性的诱导恶性造血细胞系肿瘤的凋亡。但由于其稳定性差、易分解、产生活性氧簇等缺点, Tian等[15]对HA14-1进行了结构改造, 在6位引入苯基并将氰基去除得到其类似物sHA14-1 (图 4)。sHA14-1能稳定存在于细胞培养基中, 与HA14-1相比, 该化合物具有更强的干扰Bak与Bcl-2/Bcl-xL结合的能力。
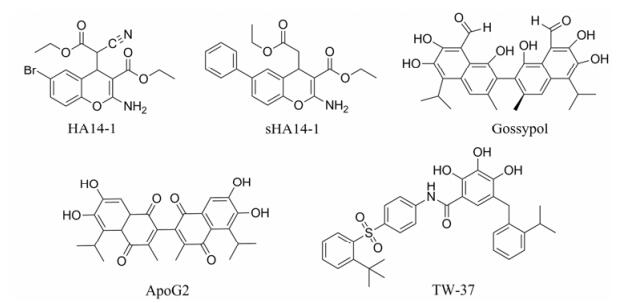
|
Figure 4 Small molecular inhibitors of Bcl-2 |
棉酚(gossypol, 图 4)最初是从棉花籽中分离得到的, 具有较好的抗肿瘤活性。科学家们通过筛选发现棉酚属于Bcl-2小分子抑制剂, 棉酚直接与Bcl-xL结合(IC50 = 0.5 μmol·L-1)[16], 棉酚通过诱导对半胱天冬酶非依赖性的细胞凋亡, 治疗原发性慢性淋巴细胞白血病。随后, 科学家研究发现左旋体R-(-)-棉酚(AT-101)抑制肿瘤生长的活性更强。AT-101与Bcl-2、Bcl-xL和Mcl-1三种蛋白都具有较好的亲和力。临床Ⅰ期试验结果显示, 当AT-101单独给药用于治疗复发/难治性CLL时, 转氨酶的变化限制了它的应用[17]。临床Ⅱ期试验结果显示, 当AT-101与利妥昔单抗联合用药用于治疗复发/难治性CLL时, 总缓解率为44%, 无完全缓解的患者[18]。
由于棉酚的两个醛基在体内容易与体内活性物质发生反应, 科学家通过结构修饰得到ApoG2 (图 4)[19]。ApoG2能够有效的抑制Bcl-2蛋白和Mcl-1蛋白, 促进肿瘤细胞的凋亡。2006年, 王少萌教授团队[20]以AT-101为先导化合物, 在保留多酚环结构的基础上, 引入新的苯磺酰基片段, 得到活性目标化合物TW-37 (图 4)。体外实验证实, 该化合物与Bcl-2、Bcl-xL和Mcl-1蛋白结合的Ki值分别为0.29、1.11和0.26 μmol·L-1[21], 可通过拮抗上述抗凋亡蛋白的作用实现抗肿瘤活性[22]。
除了HA14-1和棉酚外, 科学家们还发展了一些其他结构类型的Bcl-2抑制剂, 如obatoclax[23]和WL-276[24]等, 详细内容可参见文献[25]。但这些药物普遍存在亲和力较低、选择性较差等问题。也曾有许多课题组通过计算机辅助药物设计策略进行该靶标研究, 但未取得很好的结果, 可能原因是现有的计算化学方法在处理蛋白-蛋白相互作用时精度不够。因此科学家们需要发展新的药物设计方法解决上述问题。
4 基于片段药物设计的Bcl-2抑制剂发现 4.1 Navitoclax (ABT-263)的发现20世纪末, 随着结构生物学的发展, 科学家们提出了“SAR by NMR”的方法进行创新药物研究[26]。Abbott公司的科研人员应用该方法从化合物库中获得两个亲和力较弱的小分子化合物Ⅰ(Kd = 0.30 ± 0.03 mmol·L-1)和Ⅱ (Kd = 4.3 ± 1.6 mmol·L-1) (图 5), 它们与Bcl-xL蛋白结合位点虽然都位于BH3结合区, 但结合口袋不同。在此基础上, 研究人员应用基于片段的药物设计策略(fragment-based drug design, FBDD), 参照这两个化合物所处结合口袋的位置和空间取向, 设计连接基团并构建了新的母体结构。进一步构效关系研究发现[27], 片段Ⅰ的苯甲酸基团引入酰基苯磺酰基后更易进入P2口袋; 而片段Ⅱ替换为3-硝基-4-(2-苯硫基乙基)氨基苯基基团后, 可通过疏水作用和π-π堆积作用进入P4口袋, 由此得到先导化合物1。
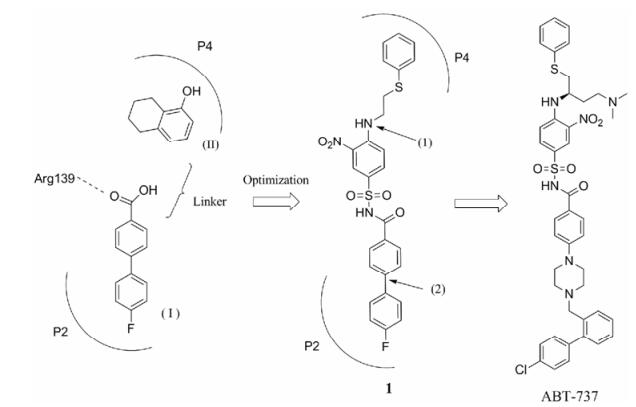
|
Figure 5 The discovery of ABT-737 |
化合物1与Bcl-xL的亲和力很高(Ki = 36 ± 1.6 nmol·L-1), 但与人血清白蛋白(HSA)有很强的结合。在后续的结构优化中, 研究人员通过在特定位置进行极性基团取代, 减少化合物对HSA的结合。研究发现, 化合物1在位置(1)引入2-二甲基氨基乙基取代基, 在位置(2)引入取代哌嗪基可提高化合物与Bcl-2蛋白的结合。最终, 在哌嗪上引入联苯基团后得到化合物ABT-737 (图 5)[28]。
ABT-737与Bcl-2和Bcl-xL的亲和力都非常高, 在Bcl-2蛋白这一靶标抑制剂的研究中具有里程碑式意义, 也成为FBDD策略在创新药物研究领域的成功案例。ABT-737不仅广泛应用于细胞凋亡的生物学基础研究, 也在淋巴瘤、小细胞肺癌(SCLC)和慢性淋巴细胞白血病等领域开展了临床前研究。
然而, ABT-737的口服吸收很差, 科学家们又研发了口服生物利用度好的第二代药物navitoclax (ABT-263)。Navitoclax与Bcl-2和Bcl-xL的亲和力很高, 但与Bcl-W的结合较弱, 与Mcl-1的亲和力非常低。临床前研究发现, navitoclax单独给药时, 对抑制小细胞肺癌异种移植肿瘤生长具有非常好的疗效; 该药与其他抗肿瘤药物联用时, 对实体瘤和血液瘤的细胞系都表现出较好的生长抑制作用[29]。在临床Ⅰ期研究和临床Ⅱ期研究中, navitoclax与利妥昔单抗联用均对慢性淋巴细胞白血病有良好的治疗效果。然而在动物实验中发现Navitoclax会引起暂时性的血小板数大幅度下降[30], 原因可能与该药抑制Bcl-xL有关。在临床试验中也发现, 血小板减少症是navitoclax单独给药时最主要的剂量限制性毒性。尽管血小板减少症限制了navitoclax在患者中的使用, 但是这一发现证实基于Bcl-2蛋白这一靶标开展first-in-class药物研究的有效性。随后研究又报道了多个navitoclax结构类似物的小分子Bcl-2抑制剂(图 6)。其中BM-1197与navitoclax的结构近似, 均以N-酰基苯磺酰胺为基本骨架。该药与Bcl-2、Bcl-xL的亲和力达到在纳摩尔级别, 在小细胞肺癌细胞系中可诱导Bax和Bak介导的细胞凋亡。BM-1197在小细胞肺癌小鼠异种移植模型中每天或每周静脉内给药都能够有效消除肿瘤。其他类似结构的临床候选药物也具有良好的肿瘤抑制活性(表 1)。
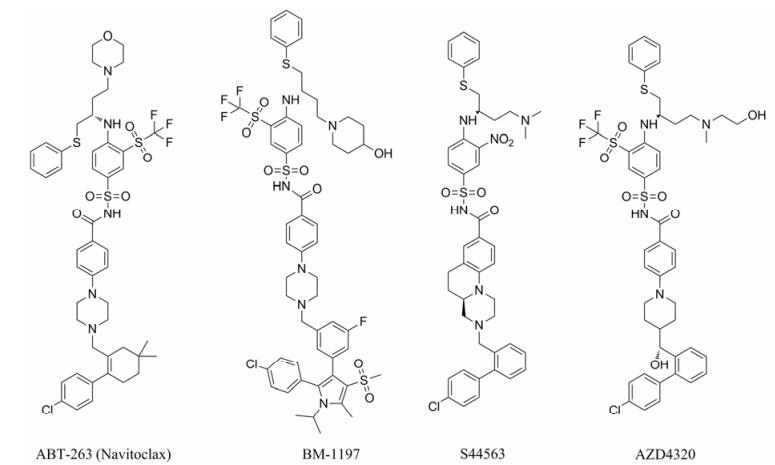
|
Figure 6 N-acylbenzenesulfonamides Bcl-2 inhibitors |
| Table 1 Small molecules that target B cell lymphoma 2 family proteins |
然而, 根据navitoclax的临床经验可知, 上述Bcl-2抑制剂虽然与靶蛋白Bcl-2结合能力强, 但仍保留与Bcl-xL蛋白的高亲和力。因此研究对Bcl-2蛋白亲和力高、对Bcl-xL作用弱的新型小分子抑制剂成为该靶标药物的研发方向。
4.2 Venetoclax (ABT-199)的发现通过解析Bcl-2蛋白与小分子酰基磺酰胺化合物的共晶复合物结构发现, 引入吲哚基团有利于通过疏水作用力增强药物与P4口袋的结合[31], 同时能够与Bcl-2蛋白特有的天冬氨酸残基形成静电相互作用。在此基础上, 艾伯维(AbbVie)公司将吲哚基团和氮杂吲哚基团引入ABT-263骨架结构并进行了深入的构效关系研究(表 2)。在生物活性评价过程中, 除应用荧光能量共振转移法(FRET)测试目标物对Bcl-2的亲和力外, 还应用急性淋巴细胞白血病(ALL)细胞系(RS4;11)进行体外细胞活性测试, 以评价化合物引发的细胞凋亡与抑制Bcl-2蛋白有关。
| Table 2 Structure and activity of analogs of ABT-263. *The inhibition constant (Ki) is the dissociation constant of an enzyme-inhibitor complex or protein/small molecule complex in which small molecules inhibit the binding of one protein to another protein or peptide. The larger the Ki value, the weaker the affinity, and the smaller the Ki value, the stronger the affinity |
由表 2可知, 含有氮杂吲哚的化合物(如2、4、6、8、10)比含有吲哚的化合物(如3、5、7、9、11)具有较高的亲和力, 且具有较高的诱导细胞凋亡水平; 当环为3, 3-二甲基环己烯时, 其活性明显增强, 且亲和力有大幅提升(如5、6); 芳环取代基X为硝基取代时, 具有较高的亲和力, 且诱导凋亡水平较好(如6、8); R基团引入4-甲基吡喃基时诱导细胞凋亡效果最好。最终确定的优选结构为venetoclax (ABT-199)。
Venetoclax对Bcl-2具有亚纳摩尔的亲和力(Ki < 0.010 nmol·L-1), 对Bcl-xL (Ki = 48 nmol·L-1)和Bcl-W (Ki = 245 nmol·L-1)的亲和力较弱, 与Mcl-1的亲和力很差(Ki > 444 nmol·L-1)。相比第二代药物navitoclax, venetoclax在体内外均可大大减少对血小板的损伤[31]。Venetoclax可选择性的抑制Bcl-2蛋白的活性, 诱导Bax/Bak依赖性细胞凋亡, 实现其抗肿瘤活性。
深入的生物活性评价发现, venetoclax对于弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)等非霍奇金氏淋巴瘤(NHL)细胞具有良好的抗增殖活性, 同时对急性淋巴瘤细胞也具有较好的抗增殖活性[31](表 3)。
| Table 3 Cell killing activity of ABT-199 against cell lines. *ABC: Activated B cell subtype; GCB: Germinal B cell subtype; PMBL: Primary mediastinal B cell lymphoma |
前文曾提到, CLL作为西方国家最常见的成人白血病, 传统的FCR方案对高龄、并发症多、存在预后不良指征(如IGHV、17p缺失)的患者使用效果不佳。B细胞受体(B-cell receptor, BCR)信号通路和Bcl-2信号通路是细胞逃避凋亡的重要信号通路。近年来, 作用于BCR信号通路的药物依鲁替尼和idelalisib的问世, 极大的促进了CLL的治疗, 但仍难满足全部临床的需求。临床研究发现, 17p缺失(17号染色体部分缺失)与CLL的关系密切, 约占CLL病例的10%, 在难治愈性的慢性淋巴细胞白血病病例中约占30%~50%[32]。研究表明调控Bcl-2细胞凋亡信号通路的小分子药物可成为治疗17p缺失CLL有效手段。
在Ⅰ期临床研究(NCT01328626)中, venetoclax被单独用于治疗难治性或复发性慢性淋巴瘤[33]。临床Ⅱ期试验(NCT01889186)对ABT-199治疗难治性或复发性17p缺失的慢性淋巴瘤进行了更加深入的研究[34]。107位患者在12个月的观察周期内ORR达79.4%, 部分响应值(PR)为69%。
另一项临床Ⅱ期试验(NCT02141282)研究了venetoclax在已应用依鲁替尼(A组, n = 41)或idelalisib (B组, n = 13)治疗后复发或难治的CLL患者的疗效[35]。Venetoclax单独给药24周后, 对患者的治疗情况进行评估, A组的ORR为61%, B组的ORR为50%, 病情稳定率(SD) A组为26%, B组为40% (表 4)。
| Table 4 Clinical study of venetoclax on chronic lymphocytic leukemia (CLL) |
2015年4月venetoclax获得美国FDA突破性疗法认定, 用于单药治疗有17p缺失基因突变患者的慢性淋巴细胞白血病, 2016年4月被FDA批准上市。该药不仅成为Bcl-2蛋白抑制剂的同类首创药物(first-in-class), 也是蛋白-蛋白相互作用领域首个获批的小分子药物, 具有里程碑意义。从20世纪末细胞凋亡学说认为Bcl-2蛋白可能是潜在的药物靶标, 至venetoclax上市已接近20年时间。Bcl-2蛋白作为药物靶标的概念验证在此期间也历经多次波折, 最终以小分子药物venetoclax上市而最终获得成功。
在该靶标的药物研发中, 最初困扰科研人员的关键问题是难以找到亲和力足够高的小分子先导化合物。此时基于片段的药物设计策略大大加速了这一发现进程, 并找到了高活性先导化合物ABT-737, 从而为后续结构优化和药物研发奠定了坚实的基础。尽管第一代药物ABT-737和第二代药物ABT-263分别由于成药性问题和靶标选择性问题而中止临床试验, 但已充分证实Bcl-2蛋白在靶标概念验证方面获得了成功。正是由于基础医学、药物化学、结构生物学和临床医学等学科的科研人员协同攻关, 在转化医学的道路上不断克服一个又一个问题, 最终才将Bcl-2蛋白从生物医学的基础研究成果变为临床治疗CLL的有效药物靶标。
| [1] | Ouyang L, Shi Z, Zhao S, et al. Programmed cell death pathways in cancer:a review of apoptosis, autophagy and programmed necrosis[J]. Cell Prolif, 2012, 45: 487–498. DOI:10.1111/cpr.2012.45.issue-6 |
| [2] | Kerr JF, Wyllie AH, Currie AR. Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J]. Br J Cancer, 1972, 26: 239–257. DOI:10.1038/bjc.1972.33 |
| [3] | Tsujimoto Y, Finger LR, Yunis J, et al. Cloning of the chromosome breakpoint of neoplastic B cells with the t(14;18) chromosome translocation[J]. Science, 1984, 226: 1097–1099. DOI:10.1126/science.6093263 |
| [4] | Zhang X, Chen Y, Jenkins LW, et al. Bench-to-bedside review:apoptosis/programmed cell death triggered by traumatic brain injury[J]. Crit Care, 2005, 9: 66–75. |
| [5] | Cory S, Huang DCS, Adams JM. The Bcl-2 family:roles in cell survival and oncogenesis[J]. Oncogene, 2003, 22: 8590–8607. DOI:10.1038/sj.onc.1207102 |
| [6] | Letai A. Pharmacological manipulation of Bcl-2 family members to control cell death[J]. J Clin Investig, 2005, 115: 2648–2655. DOI:10.1172/JCI26250 |
| [7] | Adams JM, Cory S. Bcl-2-regulated apoptosis:mechanism and therapeutic potential[J]. Curr Opin Immunol, 2007, 19: 488–496. DOI:10.1016/j.coi.2007.05.004 |
| [8] | Agrawal S, Zhao Q. Antisense therapeutics[J]. Curr Opin Chem Biol, 1998, 2: 519–528. DOI:10.1016/S1367-5931(98)80129-4 |
| [9] | Rai KR, Jain P. Chronic lymphocytic leukemia (CLL)-then and now[J]. Am J Hematol, 2016, 91: 330–340. DOI:10.1002/ajh.24282 |
| [10] | Vitale C, Burger JA. Chronic lymphocytic leukemia therapy:new targeted therapies on the way[J]. Expert Opin Pharmacother, 2016, 17: 1077–1089. DOI:10.1517/14656566.2016.1168401 |
| [11] | O'Brien SM, Cunningham CC, Golenkov AK, et al. Phase Ⅰ to Ⅱ multicenter study of oblimersen sodium, a Bcl-2 antisense oligonucleotide, in patients with advanced chronic lymphocytic leukemia[J]. J Clin Oncol, 2005, 23: 7697–7702. DOI:10.1200/JCO.2005.02.4364 |
| [12] | O'Brien S, Moore JO, Boyd TE, et al. 5-year survival in patients with relapsed or refractory chronic lymphocytic leukemia in a randomized, phase Ⅲ trial of fludarabine plus cyclophosphamide with or without oblimersen[J]. J Clin Oncol, 2009, 27: 5208–5212. DOI:10.1200/JCO.2009.22.5748 |
| [13] | Wang JL, Zhang ZJ, Choksi S, et al. Cell permeable Bcl-2 binding peptides:a chemical approach to apoptosis induction in tumor cells[J]. Cancer Res, 2000, 60: 1498–1502. |
| [14] | Wang JL, Liu D, Zhang ZJ, et al. Structure-based discovery of an organic compound that binds Bcl-2 protein and induces apoptosis of tumor cells[J]. Proc Natl Acad Sci USA, 2000, 97: 7124–7129. DOI:10.1073/pnas.97.13.7124 |
| [15] | Tian D, Das SG, Doshi JM, et al. sHA14-1, a stable and ROS-free antagonist against anti-apoptotic Bcl-2 proteins, bypasses drug resistances and synergizes cancer therapies in human leukemia cell[J]. Cancer Lett, 2008, 259: 198–208. DOI:10.1016/j.canlet.2007.10.012 |
| [16] | Kitada S, Leone M, Sareth S, et al. Discovery, characterization, and structure-activity relationships studies of proapoptotic polyphenols targeting B-cell lymphocyte/leukemia-2 proteins[J]. J Med Chem, 2003, 46: 4259–4264. DOI:10.1021/jm030190z |
| [17] | James DF, Castro JE, Loria O, et al. AT-101, a small mole-cule Bcl-2 antagonist, in treatment naïve CLL patients (pts) with high risk features; preliminary results from an ongoing phase Ⅰ trial[J]. J Clin Oncol, 2006, 24: 6605. |
| [18] | Castro JE, Loria OJ, Aguillon RA. A phase Ⅱ, open label study of AT-101 in combination with rituximab in patients with relapsed or refractory chronic lymphocytic leukemia. Evaluation of two dose regimens[J]. Blood, 2007, 110: 3119. |
| [19] | Becattini B, Kitada S, Leone M, et al. Rational design and real time, in-cell detection of the proapoptotic activity of a novel compound targeting Bcl-xL[J]. Chem Biol, 2004, 11: 389–395. DOI:10.1016/j.chembiol.2004.02.020 |
| [20] | Wang G, Nikolovska-coleska Z, Yang CY, et al. Structure-based design of potent small-molecule inhibitors of anti-apoptotic Bcl-2 proteins[J]. J Med Chem, 2006, 49: 6139–6142. DOI:10.1021/jm060460o |
| [21] | Wolter KG, Wang SJ, Henson BS, et al. (-)-Gossypol inhibits growth and promotes apoptosis of human head and neck squamous cell carcinoma in vivo[J]. Neoplasia, 2006, 8: 163–172. DOI:10.1593/neo.05691 |
| [22] | Mohammad RM, Goustin AS, Aboukameel A, et al. Pre-clinical studies of TW-37, a new nonpeptidic small-molecule inhibitor of Bcl-2, in diffuse large cell lymphoma xenograft model reveal drug action on both Bcl-2 and Mcl-1[J]. Clin Cancer Res, 2007, 13: 2226–2235. DOI:10.1158/1078-0432.CCR-06-1574 |
| [23] | Joudeh J, Claxton D. Obatoclax mesylate:pharmacology and potential for therapy of hematological neoplasms[J]. Expert Opin Investig Drugs, 2012, 21: 363–373. DOI:10.1517/13543784.2012.652302 |
| [24] | Wang L, Sloper DT, Addo SN, et al. WL-276, an antagonist against Bcl-2 proteins, overcomes drug resistance and suppresses prostate tumor growth[J]. Cancer Res, 2008, 68: 4377–4383. DOI:10.1158/0008-5472.CAN-07-6590 |
| [25] | Yap JL, Chen L, Lanning ME, et al. Expanding the cancer arsenal with targeted therapies:disarmament of the anti-apoptotic Bcl-2 proteins by small-molecules[J]. J Med Chem, 2017, 60: 821–838. DOI:10.1021/acs.jmedchem.5b01888 |
| [26] | Shuker SB, Hajduk PJ, Meadows RP, et al. Discovering high-affinity ligands for proteins:SAR by NMR[J]. Science, 1996, 274: 1531–1534. DOI:10.1126/science.274.5292.1531 |
| [27] | Guo ZR. Venetoclaxt——the first inhibitors of protein-protein interaction[J]. Acta Pharm Sin (药学学报), 2018, 53: 476–486. |
| [28] | Oltersdorf T, Elmore SW, Shoemaker AR, et al. An inhibitor of Bcl-2 family proteins induces regression of solid tumours[J]. Nature, 2005, 435: 677–681. DOI:10.1038/nature03579 |
| [29] | Tse C, Shoemaker AR, Adickes J, et al. ABT-263:a potent and orally bioavailable Bcl-2 family inhibitor[J]. Cancer Res, 2008, 68: 3421–3428. DOI:10.1158/0008-5472.CAN-07-5836 |
| [30] | Zhang H, Nimmer PM, Tahir SK, et al. Bcl-2 family proteins are essential for platelet survival[J]. Cell Death Differ, 2007, 14: 943–951. |
| [31] | Souers AJ, Leverson JD, Boghaert ER, et al. ABT-199, a potent and selective BCL-2 inhibitor, achieves antitumor activity while sparing platelets[J]. Nat Med, 2013, 19: 202–208. DOI:10.1038/nm.3048 |
| [32] | Green DR. A BH3 mimetic for killing cancer cells[J]. Cell, 2016, 165: 1560. DOI:10.1016/j.cell.2016.05.080 |
| [33] | Roberts AW, Davids MS, Pagel JM, et al. Targeting bcl-2 with venetoclax in relapsed chronic lymphocytic leukemia[J]. N Engl J Med, 2016, 374: 311–322. DOI:10.1056/NEJMoa1513257 |
| [34] | Stilgenbauer S, Eichhorst B, Schetelig J, et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion:a multicentre, open-label, phase 2 study[J]. Lancet Oncol, 2016, 17: 768. DOI:10.1016/S1470-2045(16)30019-5 |
| [35] | Jones JA, Wierda WG, Choi MY, et al. Venetoclax activity in CLL patients who have relapsed after or are refractory to ibrutinib or idelalisib[abstract no. 7519] [C]. Chicago: ASCO Annual Meeting, 2016. |
 2018, Vol. 53
2018, Vol. 53