上世纪末, Matsushita等[1]发现并鉴定了可与Bruton酪氨酸激酶(Bruton’s tyrosine kinase, Btk) SH3 (Src homology 3)结构域相结合的一种蛋白, 命名为Sab (SH3 domain-binding protein that preferentially associates with Btk)蛋白。由于该蛋白是由基因SH3BP5编码, 故又称为SH3BP5 (SH3 domain-binding protein 5)蛋白。2002年Wiltshire等[2]发现Sab蛋白可作为底物与JNK (c-Jun N-terminal kinase)结合并激活。随后Court等[3]发现Sab蛋白可被p38γ (也称为SAPK3, stress-activated protein kinase 3)磷酸化而激活。与Sab蛋白结合的Btk、JNK和p38γ是体内的关键激酶, 分别参与B细胞的生长发育和调控线粒体信号转录等重要生理过程。因此, Sab蛋白在多种信号通路中起关键作用, 有望成为一个药物开发的潜在靶点。本文主要对Sab蛋白的结构、功能及与弥漫大B细胞淋巴瘤、神经系统疾病、肝损伤等的关系进行综述, 为与Sab靶点相关新药的研发提供参考。
1 Sab蛋白的结构特征人编码Sab蛋白的基因(SH3BP5)位于1号染色体1q43上, 其开放阅读框架有1 275个核苷酸, 由425个氨基酸残基组成, 相对分子质量为70 kDa[1, 4]。该基因可在多种组织中表达, 如脑、淋巴结、胸腺、骨髓、肝脏、脾、结肠、小肠和前列腺等, 尤其在生殖器官如睾丸和卵巢中高表达[1]。
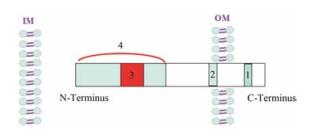
Sab蛋白分布于线粒体外膜, 如图 1所示。N端在线粒体外膜内侧, 是一个延伸的肌球蛋白样卷曲螺旋, 其中包含一个能与SH3结合的结构域; 线粒体外膜外侧的C端约占整体长度的1/5, 具有2个丝裂原激活蛋白激酶相互作用配基(kinase interaction motifs, KIMs)和4个存在于C端1/2处的丝氨酸-脯氨酸JNK磷酸化位点[2, 5]。Sab蛋白的结构与SH3结合蛋白有所不同, 即Sab蛋白的SH3结合区域无脯氨酸富含序列, Matsushita等[1]猜测Sab的SH3结合区域尽管无脯氨酸富含序列, 但也能形成左旋多聚脯氨酸Ⅱ型螺旋结构。
|
Figure 1 Structural features of the Sab protein. 1: KIM2; 2: KIM1; 3: SH3 binding domain; 4: Myosin-like coiled coil; OM: Mitochondrial outer membrane; IM: Mitochondrial inner membrane |
Btk作为胞质酪氨酸激酶中Btk/Tec家族成员, 是B细胞抗原受体(B-cell antigen receptor, BCR)信号通路的关键激酶, 该蛋白结构从N端到C端分别为PH (plecks trin homology)、TH (tec homology)、SH3、SH2和激酶结构域[6]。Sab可优先结合Btk, 而不是其他胞质酪氨酸激酶, 提示Sab对Btk信号通路的影响具有一定的专一性[1]。Sab蛋白与Btk的SH3结构域结合, 而且不依赖Btk的激活或磷酸化[7]。Sab高表达的B细胞在BCR诱导下, Btk的自我磷酸化及转磷酸化显著降低, 进而降低Btk的活性, 而且Btk相关的钙动员、肌糖1, 4, 5-三磷酸的产生及细胞凋亡等都显著减少。因而, Sab蛋白可以作为Btk的反式调节蛋白, 在B细胞抗原受体信号通路中起负调节作用[7]。
2.2 调节线粒体MAPK信号通路 2.2.1 调节线粒体JNK信号通路Wiltshire等[2, 5]应用酵母双杂交系统研究发现, Sab体外能与JNK发生相互作用。Sab的KIMs与JNK下游靶标分子c-Jun的JNK对接域的KIMs具有相似性, Sab与JNK结合是通过KIM1进行相互作用。而Takeshita等[8]认为, Sab可通过SH3结合结构域(SH3-binding domain, SH3BD)、KIM1和KIM2与JNK结合, 且KIM1、KIM2与JNK的结合互不影响。共聚焦免疫细胞化学和细胞分离研究发现, Sab能够使JNK靶向到线粒体, 与JNK的一部分结合并共同定位于线粒体, 进而启动下游程序[2]。
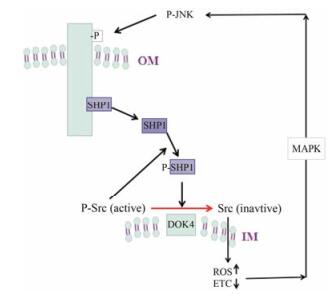
Win等[9]在研究急性肝损伤模型时发现JNK与Sab结合后, 导致线粒体外膜内侧Sab的非受体型6蛋白酪氨酸磷酸酶(protein tyrosine phosphatase, nonreceptor type 6, SHP1 or PTPN6)释放, SHP1被p-Src磷酸化生成p-SHP1, 并转移到线粒体内膜, 在内膜平台蛋白[对接蛋白4 (docking protein 4, DOK4)]的作用下, 使p-Src (活化形式)去磷酸化而失活。p-Src能够维持电子传递, 而Src可破坏电子传递, 而且在线粒体呼吸链复合物酶I的作用下产生大量的活性氧(reactive oxygen species, ROS)[10], 进而激活上游MAPK导致JNK的持续激活(图 2)。
|
Figure 2 Mitochondrial JNK signaling pathway |
Win等[11]研究发现, 由衣霉素和brefeldin A诱导的内质网应激可引起JNK的磷酸化及内质网钙离子的释放, JNK可与Sab结合进而降低呼吸功能引发ROS增加; 同时钙离子进入线粒体, 使ROS产生增强, 进而诱发JNK的持续激活, 引起细胞凋亡。
已知JNK的持续激活可激活凋亡信号通路。抗凋亡蛋白(Bcl-2和Bcl-XL)及凋亡蛋白(Bim和Bmf)都可作为JNK的底物, 引起Bcl家族凋亡蛋白活性的增加和Bcl家族抗凋亡蛋白活性的降低, 导致线粒体外膜的渗透性增加, 促进细胞色素c和其他蛋白的释放, 激活caspase而引发凋亡[5]。同时, JNK和Sab结合产生的ROS也能激活线粒体凋亡信号通路, 诱导损伤线粒体的渗透性转位(mitochondrial permeability transition, MPT), 从而增加线粒体内膜的渗透性, 引起线粒体肿胀, 导致组织坏死[12]。
Chambers等[13]发现, 小干扰RNA (small interfering RNAs, siRNAs)和能够与Sab蛋白KIM1结构域结合的细胞渗透肽Tat-SabKIM1都能选择性地阻止Bcl-2的磷酸化、线粒体膜电位的下降、超氧化物的产生及细胞死亡, 但不影响c-Jun的磷酸化和AP-1的转录。然而, JNK抑制剂TI-JIP1在阻止细胞凋亡的情况下也能影响c-Jun的磷酸化和AP-1的转录, 不具有选择性。因此, Sab抑制剂的研究可能成为线粒体JNK信号通路相关疾病的新思路, 而不影响JNK的核转录功能, 也可能降低JNK抑制剂的相关不良反应。
2.2.2 调节线粒体p38信号通路p38γ是存在于线粒体的p38 MAPK亚家族成员。Court等[3]通过对KIM1和KIM2进行选择性突变确定了p38γ也是依赖KIM1而使Sab磷酸化。p38γ对Sab蛋白的磷酸位点主要发生在321位的丝氨酸, 而JNK主要使321位的丝氨酸磷酸化, 这与JNK使Sab磷酸化的位点一致(主要磷酸化位点), 提示p38γ和JNK可能拥有共同的线粒体靶点Sab。然而, p38γ也能使Ser391少量磷酸化, 而JNK却不能使Ser391磷酸化, 这也为p38γ的底物识别提供一些新思路。
总之, Sab蛋白既能与Btk, 也能与JNK、p38γ结合, 对Btk、JNK和p38γ的信号转导通路的相互交联具有一定的作用。鉴于Btk、JNK和p38γ是机体生命过程(如调控B细胞生长发育、调控线粒体信号转录等)中发挥重要作用的分子, 且Btk、JNK异常与多种疾病(如神经系统疾病、肝损伤等)相关, 因而Sab有望作为一些疾病治疗的潜在靶点。
3 Sab蛋白与弥漫大B细胞淋巴瘤Kobayashi等[14]在研究187例非特殊型弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)患者时发现, 60%患者的瘤细胞中Sab抗原表达为阳性, 而且在CD5+ DLBCL和活化B细胞样(activated B-cell-Like, ABC) DLBCL中阳性率更高。与Sab阴性组相比, Sab阳性组与老年(>60岁)和肿瘤晚期(Ⅲ/Ⅳ期)相关, 存活率也更低。上述结果提示, Sab蛋白的表达与DLBCL的临床特征具有一定相关性, 因此有必要深入研究DLBCL细胞中Sab的功能, 如Sab与Btk和JNK的关系, 可能将有助于阐明DLBCL发生的分子机制。
4 Sab蛋白与神经系统疾病Sodero等[15]最新研究发现, Sab在成年小鼠脑内广泛表达, 尤其在海马、中脑腹侧和小脑具有高表达。在纯化的突触体、海马神经元、星形胶质细胞中也可发现Sab, 而且Sab的分布与其结合分子JNK的分布具有相似性。使用Sab抑制剂细胞渗透肽Tat-SabKIM1能够显著降低海马神经元的放电频率和振幅, 表明Sab蛋白介导的信号通路能够影响神经元的活性。神经元中Sab介导信号通路的具体作用仍不清楚, 推测轴突线粒体上的Sab对于高能量需求的树突和轴突末端区的线粒体快速转运和去极化线粒体的再生是必需的; 而且线粒体向突触的转运是依赖Sab蛋白和JNK共同完成。因此, 基于Sab在脑内的表达和分布, 可见脑内特殊的Sab介导的信号通路通过激酶的相互作用调控线粒体生理功能, 进而对神经元活性发挥重要功能。
6-羟基多巴胺诱导的神经毒性是由JNK定位于线粒体引起的, 而Sab抑制剂细胞渗透肽Tat-SabKIM1能够显著降低6-羟基多巴胺诱导的SHSY5Y细胞毒性。Tat-SabKIM1能够降低活性氧的产生、蛋白羰基化及脂质过氧化反应, 增加线粒体膜电位和氧消耗速率, 阻止大鼠JNK转位, 增加TH+神经元数量, 提示Tat-SabKIM1可通过阻止JNK转位到线粒体而降低6-羟基多巴胺诱导的神经毒性, 进而发挥抗帕金森疾病的作用[16]。Takeshita等[8]研究发现, Sab是分泌生物活性肽humanin发挥神经保护作用的下游关键效应分子, humanin可促进Sab蛋白和基因的表达, 而Sab能够直接抑制JNK, 降低p-JNK, 进而发挥对阿尔茨海默症相关神经元的保护作用。因此推测, Sab/JNK复合物中Sab与JNK的摩尔比低于某一阈值时, Sab仅作为一个载体使JNK靶向线粒体; 而当Sab与JNK的摩尔比高于某一阈值时, Sab产生JNK抑制作用。Nijboer等[17]通过对出生7天的幼年大鼠进行单侧颈动脉结扎和组织缺氧诱导的低氧缺血(hypoxic-ischemic, HI)脑损伤模型研究发现, HI诱导的脑损伤仅引起线粒体p-JNK的增多, 对胞质或细胞核中p-JNK无明显影响。因此, 支持线粒体JNK激活对HI脑损伤至关重要的假说。此外, 他们还发现腹腔注射小肽D-JNKi (JNK的AMP激酶抑制剂)和Sab抑制剂细胞渗透肽SabKIM1都能保护HI脑损伤, 其保护机制均为抑制线粒体JNK的激活, 进而保护线粒体的完整性, 达到神经保护作用。因此, SabKIM1能够特异性地靶向抑制线粒体JNK的激活, 有效减轻HI脑损伤, 避免或降低JNK抑制剂可能引起的不良反应, 有望用于治疗因脑缺血导致的新生儿脑病。
在多种神经系统疾病中, 由于JNK定位于线粒体, 可引起氧化应激、线粒体功能紊乱及细胞死亡。Sab作为线粒体JNK的结合靶标, 抑制或促进Sab蛋白的表达能够改善神经系统疾病如帕金森症、阿尔茨海默症、新生儿低氧缺血脑病等, 因此Sab蛋白有望作为神经保护作用的新靶点。
5 Sab蛋白与肝损伤Win等[9, 12]研究发现, 在对乙酰氨基酚和肿瘤坏死因子/半乳糖胺分别引起的急性肝损伤模型中, 应用腺病毒shRNA沉默肝脏Sab蛋白的表达后可抑制JNK的持续激活、JNK线粒体的靶向性及MKK4的活性, 对小鼠肝损伤及体外肝细胞损伤具有保护作用。因此, 可确定对乙酰氨基酚和GalN/TNF-α引起的肝损伤与线粒体Sab蛋白表达相关, 即Sab能够增加JNK的靶向性及MKK4的活性, 进而引起线粒体内p-JNK的增多, 最终导致JNK的持续激活。因此, 应激激活的JNK与Sab的相互作用对于JNK的持续激活及急性肝损伤至关重要。
Win等[18]研究发现, 高浓度软脂酸可诱导原代小鼠肝细胞死亡, 敲除Sab或使用Sab抑制剂能够抑制JNK与线粒体的结合, 抑制线粒体损伤, 改善呼吸链功能, 降低活性氧水平, 阻止肝细胞死亡, 表明软脂酸诱导的肝细胞脂毒性是由依赖Sab蛋白的JNK激活而引发的。
6 小结与展望Sab蛋白作为线粒体外膜支架蛋白, 可与胞质酪氨酸激酶Btk、丝氨酸-苏氨酸激酶(JNK、p38γ)结合, 进而调控B细胞的生长发育和线粒体的信号转导, 尤其是与JNK结合而调控线粒体的生理功能, 已成为研发热点。线粒体JNK的磷酸化和JNK的持续激活可引发阿尔茨海默症、帕金森症、新生儿脑缺血性损伤的神经炎症和凋亡及肝损伤等疾病, Sab蛋白作为线粒体JNK直接作用的下游靶标分子, 通过Sab蛋白抑制JNK的激活对相关疾病具有保护作用[8, 9, 16, 17]。因此, Sab蛋白有望成为神经系统疾病及肝损伤的新治疗靶点。同时针对Sab蛋白开发的特异性JNK抑制剂可能会避免依赖JNK的核转录抑制而引起的毒性反应。因此, 有必要对Sab蛋白的功能及其介导的信号通路进行深入研究, 阐明Sab蛋白在疾病中的作用, 开发疗效好且毒副作用小的Sab蛋白抑制剂或诱导剂以治疗相关疾病。
| [1] | Matsushita M, Yamadori T, Kato S, et al. Identification and characterization of a novel SH3-domain binding protein, Sab, which preferentially associates with Bruton's tyrosine kinase (BtK)[J]. Biochem Biophys Res Commun, 1998, 245: 337–343. DOI:10.1006/bbrc.1998.8420 |
| [2] | Wiltshire C, Matsushita M, Tsukada S, et al. A new c-Jun N-terminal kinase (JNK)-interacting protein, Sab (SH3BP5), associates with mitochondria[J]. Biochem J, 2002, 367: 577–585. DOI:10.1042/bj20020553 |
| [3] | Court NW, Kuo I, Quigley O, et al. Phosphorylation of the mitochondrial protein Sab by stress-activated protein kinase 3[J]. Biochem Biophys Res Commun, 2004, 319: 130–137. DOI:10.1016/j.bbrc.2004.04.148 |
| [4] | Baba Y, Matsushita M, Matsuda Y, et al. Assignment of SH3BP5/Sh3bp5 encoding Sab, an SH3 domain-binding protein which preferentially associates with Bruton's tyrosine kinase, to human chromosome 1q43 and mouse chromosome 14B by in situ hybridization[J]. Cytogenet Cell Genet, 1999, 87: 221–222. DOI:10.1159/000015430 |
| [5] | Wiltshire C, Gillespie DAF, May GHW. Sab (SH3BP5), a novel mitochondria-localized JNK-interacting protein[J]. Biochem Soc Trans, 2004, 32: 1075–1077. DOI:10.1042/BST0321075 |
| [6] | Akinleye A, Chen Y, Mukhi N, et al. Ibrutinib and novel BTK inhibitors in clinical development[J]. J Hematol Oncol, 2013, 6: 59. DOI:10.1186/1756-8722-6-59 |
| [7] | Yamadori T, Baba Y, Matsushita M, et al. Bruton's tyro-sine kinase activity is negatively regulated by Sab, the Btk-SH3 domain-binding protein[J]. Proc Natl Acad Sci U S A, 1999, 96: 6341–6346. DOI:10.1073/pnas.96.11.6341 |
| [8] | Takeshita Y, Hashimoto Y, Nawa M, et al. SH3-binding protein 5 mediates the neuroprotective effect of the secreted bioactive peptide humanin by inhibiting c-Jun NH2-terminal kinase[J]. J Biol Chem, 2013, 288: 24691–24704. DOI:10.1074/jbc.M113.469692 |
| [9] | Win S, Than TA, Min RWM, et al. JNK mediates mouse liver injury through a novel Sab (SH3BP5) dependent pathway leading to inactivation of intramitochondrial Src[J]. Hepatology, 2016, 63: 1987–2003. DOI:10.1002/hep.28486 |
| [10] | Chambers JW, LoGrasso PV. Mitochondrial c-Jun N-terminal kinase (JNK) signaling initiates physiological changes resulting in amplification of reactive oxygen species generation[J]. J Biol Chem, 2011, 286: 16052–16062. DOI:10.1074/jbc.M111.223602 |
| [11] | Win S, Than TA, Fernandezcheca JC, et al. JNK interaction with Sab mediates ER stress induced inhibition of mitochondrial respiration and cell death[J]. Cell Death Dis, 2014, 5: e989. DOI:10.1038/cddis.2013.522 |
| [12] | Win S, Than TA, Han D, et al. c-Jun N-terminal kinase (JNK)-dependent acute liver injury from acetaminophen or tumor necrosis factor (TNF) requires mitochondrial Sab protein expression in mice[J]. J Biol Chem, 2011, 286: 35071–35078. DOI:10.1074/jbc.M111.276089 |
| [13] | Chambers JW, Cherry L, Laughlin JD, et al. Selective inhibition of mitochondrial JNK signaling achieved using peptide mimicry of the Sab kinase interacting motif-1(KIM1)[J]. ACS Chem Biol, 2011, 6: 808–818. DOI:10.1021/cb200062a |
| [14] | Kobayashi K, Yamaguchi M, Miyazaki K, et al. Expres-sions of SH3BP5, LMO3, and SNAP25 in diffuse large B-cell lymphoma cells and their association with clinical features[J]. Cancer Med, 2016, 5: 1802–1809. DOI:10.1002/cam4.2016.5.issue-8 |
| [15] | Sodero AO, Rodriguezsilva M, Salio C, et al. Sab is differentially expressed in the brain and affects neuronal activity[J]. Brain Res, 2017, 1670: 76–85. DOI:10.1016/j.brainres.2017.06.005 |
| [16] | Chambers JW, Howard S, LoGrasso PV. Blocking c-Jun N-terminal kinase (JNK) translocation to the mitochondria prevents 6-hydroxydopamine-induced toxicity in vitro and in vivo[J]. J Biol Chem, 2013, 288: 1079–1087. DOI:10.1074/jbc.M112.421354 |
| [17] | Nijboer CH, Bonestroo HJC, Zijlstra J, et al. Mitochondrial JNK phosphorylation as a novel therapeutic target to inhibit neuroinflammation and apoptosis after neonatal ischemic brain damage[J]. Neurobiol Dis, 2013, 54: 432–444. DOI:10.1016/j.nbd.2013.01.017 |
| [18] | Win S, Than TA, Le BHA, et al. Sab (Sh3bp5) dependence of JNK mediated inhibition of mitochondrial respiration in palmitic acid induced hepatocyte lipotoxicity[J]. J Hepatol, 2015, 62: 1367–1374. DOI:10.1016/j.jhep.2015.01.032 |
 2018, Vol. 53
2018, Vol. 53


