2. 北京军事医学研究院毒物药物研究所, 北京 100850;
3. 佳木斯大学, 黑龙江 佳木斯 154007
2. Beijing Institute of Pharmacology and Toxicology, Beijing 100850, China;
3. Jiamusi University, Jiamusi 154007, China
脑胶质瘤作为恶性肿瘤之一, 严重危及人类生命。因胶质瘤强浸润性的特点使得患者预后极差[1, 2], 且中位生存期低于16个月[3]。发生浸润性生长的脑胶质瘤细胞可以存在于远离肿瘤原发部位的脑组织中, 甚至可以存在于对侧大脑半球, 并由正常脑组织包被, 拥有正常的血液供应及血脑屏障的保护作用[4], 血脑屏障的存在使得大部分化学药物无法透过BBB进入脑内[5]。因此, 手术治疗无法将肿瘤切除干净, 容易导致复发[6], 而放射治疗也不能全部杀死癌细胞, 并且不良反应大, 容易导致放射性痴呆。因而, 构建一个可以有效杀伤原发及浸润区脑胶质瘤细胞的主动靶向药物递送系统, 是胶质瘤细胞综合治疗策略中至关重要的一步[3]。
低密度脂蛋白(low density lipoprotein, LDL)受体相关蛋白是一个广泛存在于细胞表面的跨膜内吞受体蛋白, 在脑内皮细胞、神经细胞、平滑肌细胞、星形细胞和肝细胞等均呈现高表达。研究表明, LDL受体家族在BBB上存在高表达[7]。LDL是内源性、大小约为22 nm的球形纳米微粒, 其壳表面的载脂蛋白基本只有一种, 即ApoB-100。它使LDL能够特异性地识别细胞表面的LDL受体, 从而介导LDL的内吞, 并且可以通过共价偶联的方式将其他靶向分子修饰在ApoB-100上, 起到多靶点靶向作用。脑毛细血管内皮细胞和许多恶性肿瘤细胞上还过度表达转铁蛋白(transferrin, Tf)受体, T7和Tf与转铁蛋白受体的特异性配体的结合能力相当, 并且T7肽具有极大优势:内源性Tf反而会促进T7修饰的纳米载体与转铁蛋白受体发生特异性结合[8]。因此, 将T7共价修饰于LDL载体表面, 期待两者协同作用达到双级靶向的效果, 穿透BBB后进一步靶向于脑胶质瘤细胞。本实验从人血浆中提取LDL, 通过双功能基团将T7插入至LDL表面的载脂蛋白上, 并通过荧光探针标记结合超滤离心法, 对插入的效率进行评价, 间接证明T7-LDL复合物的生成。
长春新碱(vincristine, VCR)为广谱抗肿瘤药, 通过与微管蛋白结合, 阻止微管装配并阻碍纺锤体形成, 使细胞分裂停止于M期[9]。长春新碱为脂溶性药物, 有较强抗肿瘤效果, 毒性也较大, 将它包载于LDL疏水内核中可以提高其靶向性, 提高其对脑胶质瘤的治疗作用。因此, 构建T7-LDL-VCR纳米给药系统穿透BBB靶向于脑胶质瘤具有良好的理论基础。
材料与方法主要仪器 纳米粒径仪(美国Symptec公司); 激光共聚焦(德国Zeiss公司); 低温超速离心机、透射电子显微镜(日本Hitachi公司); 活体成像仪(美国Caliper公司); 细胞超声破碎仪(宁波新芝生物科技有限公司)。
药品与试剂 T7肽(北京塞伯坦医药科技有限公司); 硫酸长春新碱(广州白云山现代汉方药业有限公司); 75%乙醇消毒液(山东利尔康医疗科技股份有限公司); 三氯甲烷、二甲基亚砜、磷酸二氢钾、氯化钠、氯化钾、二乙胺(国药集团化学试剂有限公司); 甲醇、乙腈(Fisher公司); 氢氧化钠(西陇科学股份有限公司); 胎牛血清(浙江天杭生物科技股份有限公司); DMEM培养基、1640培养基(美国Thermo Fisher Scientific公司)。
动物 昆明小鼠, 体重22~24 g, 雌雄各半。军事医学科学院动物实验中心, 动物合格证号: SCXK (京) 2007-004。
LDL纳米粒的制备[10] 本研究采用密度梯度离心法从人血浆中提取LDL。先将血浆在室温下溶解, 高速离心(8 000 r·min-1, 10 min, 4 ℃), 吸弃最上层白色的乳糜微粒; 按Radding-Steining公式计算需加入的干燥KBr重量: X = V0 (d1-d0) / (1-0.312d1)。式中, V0代表原血浆毫升数, d0代表初始血浆密度, d1代表需调定的血浆密度, 0.312为KBr的比容(mL·g-1), X代表需加KBr克数。然后用干燥KBr调血浆密度至1.300 g·mL-1, 离心时在其上层铺加约等体积的密度为1.006 g·mL-1的NaCl溶液, 仔细配平后, 设置各项参数:温度4 ℃, 15 000 xg离心120 min。提取成功后加入2%蔗糖溶解于LDL纳米粒的悬液中, 冻干, 置于-20 ℃冰箱储存。
LDL纳米粒的鉴定[11] 红外吸收光谱法可用于分子结构的基础研究, 根据光谱的峰位、强度及峰形来判断化合物的类别。因此, 用红外光谱法测定样品的结构, 可以判断LDL是否从血浆中提取成功。
T7-LDL-VCR纳米粒的制备 采用干膜法制备载长春新碱低密度脂蛋白(vincristine loaded low density lipoprotein, LDL-VCR)纳米粒[12], 首先精密称取LDL冻干样品120 mg, 加磷酸盐缓冲液(phosphate buffer saline, PBS) 2 mL溶解; 然后精密称取VCR 15 mg溶于3 mL氯仿, 与上述LDL溶液混合于茄形瓶中减压旋蒸(40 ℃, 100 r·min-1)得干燥膜后, 加入5 mL PBS (pH 8.0)水化30 min后, 用细胞超声破碎仪超声(3号探头, 60%, 共30 min:超声5 s, 停1 s)后, 置于EP管中备用。再取5 mg马来酰亚胺-聚乙二醇(polyethylene glycol, PEG)3500-N-羟基琥珀酰亚胺双功能基团(MAL-PEG3500-NHS)和T7肽10 mg溶于PBS溶液中, 于室温下反应2 h, 使MAL-PEG3500-NHS中MAL基团与T7肽半胱氨酸残基上巯基发生特异性的反应生成T7-PEG3500-NHS, 然后再将T7-PEG3500-NHS与上述备用的LDL-VCR纳米粒混合, 室温搅拌反应24 h, 使LDL表面上的伯氨基与双官能PEG衍生物的末端NHS基团特异性反应。最后用截留分子质量(molecular mass cutoff, MWCO)为300 kDa透析袋去除未反应的T7-PEG3500-NHS, 制得T7-LDL-VCR纳米粒混悬液。
包封率的测定 采用超滤离心法对纳米粒的包封率进行测定, 所得样品借助高效液相色谱(high performance liquid chromatography, HPLC)进行定量分析。
色谱条件 色谱柱为ZORBA×SB-C8柱(250 mm × 4.6 mm, 5 μm); 流动相为1.5%二乙胺溶液:甲醇(30:70, w/w); 流速: 1.0 mL·min-1; 检测波长: 297 nm; 柱温: 30 ℃; 进样量: 20 μL。
测定方法 取T7-LDL-VCR纳米粒混悬液两份:一份用超滤离心管离心(13 000 r·min-1, 10 min)后取滤过液得到游离VCR质量(W游离VCR); 另一份加入Triton-X100 (200 μL·mL-1)振荡后超声30 min, 超滤离心得总VCR质量(W总VCR)。用HPLC仪对样品进行分析, 计算包封率(encapsulation efficiency, EE)。
EE = (W总VCR-W游离VCR)/W总VCRx100%
T7肽插入LDL-VCR纳米粒效率的评价 对于多肽、蛋白等生物大分子为靶向识别的载体, 靶头插入的定性和定量评价存在困难, 尤其是对于多肽性靶头, 目前尚未有高效简便的方法来判断靶头与载体连接复合物的是否生成。本研究通过荧光探针标记结合超滤离心法, 对T7肽插入LDL的效率进行评价, 也间接证明了反应产物——连接复合物的生成。
荧光探针标记与表征 先用MAL-PEG-NHS中的马来酰亚胺基团与巯基化的T7发生Michael加成反应, 然后再利用NHS-PEG-T7中T7含有的伯胺与5(6)-羧基二乙酸荧光素[5-(6)-carboxtfluores cein diacetate, CFDA]的羧基反应连接, 实现双功能基团的探针标记。精密称取CFDA 5.0 mg, 溶于1 mL二甲基亚砜, 依次加入N, N '-二环己基碳酰亚胺2.4 mg和NHS 1.3 mg。该体系室温避光搅拌24 h, 离心(4 000 r·min-1, 15 min)除去不溶物, 上清液转移后加入2 mg NHS-PEG3500-T7和1 μL三乙胺, 室温避光反应24 h, 所得体系以双蒸水避光透析(MWCO 3 500 Da) 24 h, 冷冻干燥, 得膨松状固体产物。取少量NHS-PEG3500-T7和NHS-PEG3500-T7 (CFDA)样品进基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF MS)分析确证。
紫外光谱扫描 采用紫外-可见分光光度检测荧光标记的功能基团插入至LDL载体的效率。取适量VCR溶液、NHS-PEG-T7 (CFDA)和LDL混悬液分别制备了PBS (pH 7.4)分散体系, 利用紫外可见分光光度计, 在600~200 nm内进行光谱扫描, 确定其最大吸收波长。
CFDA线性和范围 精密称取CFDA样品10 mg于100 mL量瓶中, 作为储备液; 将上述100 μg·mL-1储备液分别用PBS (pH 7.4)稀释成一系列浓度, 实际配制的CFDA质量浓度分别为1.50、2.00、2.50、3.00和3.50 μg·mL-1, 采用紫外-可见分光光度仪测定样品在493 nm的吸光度(A), 以紫外吸收强度对浓度作图, 并进行线性回归分析。
插入效率评价 将制备好的样品稀释10倍, 先用紫外-可见分光光度计测定总吸光度(A总), 再将上述样品放入超滤离心管中(MWCO 300 kDa)离心(8 000 r·min-1, 15 min)后, 收集下层液体, 稀释4倍后测定游离吸光度(A游离), 根据公式:靶头连接率= (10A总-4A游离)/10A总×100%, 计算靶头的连接效率。
粒径的测定及透射电镜观察 将样品用PBS (pH 7.4)稀释, 配成合适浓度后于纳米粒径仪中检测。取T7-LDL-VCR纳米粒1滴置于300目碳支持膜, 待其干燥后, 用醋酸铀负染10 min, 用滤纸小心吸干支持膜, 置于透射电镜下观察。
活体成像实验脑胶质瘤原位模型的建立[13] 用1%戊巴比妥钠麻醉小鼠, 剂量0.2 mL/只, 头部备皮, 用刀片刮开颅骨骨膜约5 mm, 暴露颅骨; 将小鼠头部固定于脑立体定位仪上。以囟门为坐标原点, 在右侧1.8 mm处钻孔, 以1 μL·min-1的速度注射5 μL活细胞悬液(1×106个细胞), 针头深度为3 mm (进4 mm, 退1 mm), 最后对小鼠进行消毒和缝合。
活体成像观察 将DiR的甲醇溶液加至T7-LDL-VCR混悬液中孵育24 h后, 于PBS (pH 7.4)溶液中透析24 h, 制备得到载荧光探针DiR的T7-LDL-VCR纳米粒。将造模成功的小鼠, 随机分为3组: ①尾静脉注射200 μL生理盐水为对照组; ②注射载荧光探针DiR的LDL-VCR纳米粒组; ③尾静脉注射T7-LDL (DiR)纳米粒组。
荷C6脑胶质瘤小鼠治疗作用的考察给药方案 选择荷C6脑胶质瘤小鼠40只, 随机分成4组: ①空白对照生理盐水组; ②游离VCR组; ③ LDL-VCR组; ④ T7-LDL-VCR组。每组10只, 采用尾静脉注射, 参考相关文献[14]报道给药量为1 mg·kg-1, 于肿瘤接种后第8天开始给药, 每两天给药1次, 共给药4次。
核磁共振成像与肿瘤体积抑制率测定 肿瘤接种后第16天(给药结束后第2天), 每组取小鼠4只, 用1%异氟烷快速麻醉后进行MRI检查并计算相对肿瘤体积(RTV), RTV = V给药组 / V对照组×100%, 其中V为肿瘤体积, 最后数据用SPSS进行t检验。
生存曲线测定 给药后, 每组取小鼠6只, 每天对其行为状态进行考察, 记录小鼠活动情况、症状和死亡日期, 考察生存曲线。用SPSS绘制卡普兰-迈耶生存曲线(Kaplan-Meier survival curves), 并计算生存时间中位数及生存时间平均数。
结果 1 LDL纳米粒的制备用密度梯度离心法提取分离LDL, 可见血浆脂蛋白自动分层; 超速离心结束后可见离心管中液体分为7层, 结果见图 1A。顶部乳白色为极低密度脂蛋白(very low density lipoprotein, VLDL), 第3层浅黄色为LDL, 第5层淡黄色边界不很清楚的为高密度脂蛋白(high density lipoprotein, HDL), 最下层为无脂血清(lipoprotein deficient serum, LPDS), 其余层为NaCl溶液。用注射长针小心收集LDL。在此过程中, LDL与上下层的界面会出现逐渐明显的折光面, 针头旋转收集, 可以提高收集效率[15]。
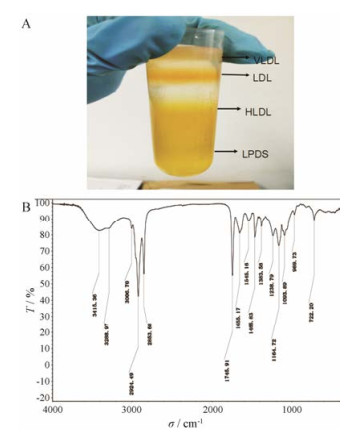
|
Figure 1 Low density lipoprotein (LDL) extracted and separated from lipoprotein, layer distribution from top to bottom as following: frist layer is very low density lipoprotein (VLDL), third layer is LDL, fifth layer is high density lipoprotein (HDL) and seventh layer is lipoprotein deficient serum (LPDS) (A); Infrared spectrum of LDL (B) |
红外结果(图 1B)可见, 在3 282. 8 cm-1的弱吸收峰为水分子的羟基O-H伸缩振动, 2 925和2 852 cm-1是脂肪链的对称与非对称伸缩振动; LDL中存在大量的酯链, 于磷脂、甘油三酯和胆固醇酯中。由图中可见, 1 736 cm-1为磷脂酯链C=O的伸缩振动; 1 653 cm-1处强吸收峰归属于蛋白质肽键中C=O的伸缩振动; 1 241 cm-1为P=O键伸缩振动; 1 088 cm-1处为PO2-的均衡拉伸振动, 969 cm-1处的峰为磷脂中胆碱聚集体N+ (CH3)3的不对称振动峰, 这些特征峰与文献[11]报道基本一致, 证明实验所采用方法适合从人血中提取LDL纳米粒。
3 T7-LDL-VCR纳米粒包封率的测定实验结果得到, T7-LDL-VCR纳米粒的EE为30.1%。由参考文献[12]可知, 此结果相对纳米制剂而言相对偏低, 但是, 对于LDL包载亲酯性药物属于正常值。
4 T7肽插入LDL-VCR纳米粒效率的评价借助MALDI-TOF MS对产物进行分析。NHS-PEG3500-T7 (图 2A)的理论相对分子质量为4 495, NHS-PEG3500-T7 (CFDA) (图 2B)的理论相对分子质量为4 935, 并且观察到响应的离子峰之间相差44个单位, 代表构成PEG结构中的重复单元-CH2CH2O-[16]。
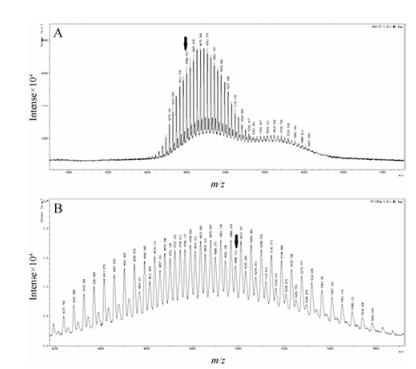
|
Figure 2 MALDI-TOF MS spectrum of NHS-PEG-T7 (A) and MALDI-TOF MS spectrum of NHS-PEG-T7 (CFDA) (B). CFDA: 5-(6)-carboxtfluores cein diacetate |
LDL和VCR在波长为493 nm处对NHS-PEG3500-T7 (CFDA)荧光检测无干扰, 结果见图 3A。
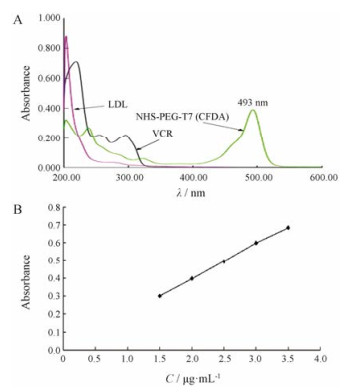
|
Figure 3 Ultraviolet visible spectrum scan of LDL, NHS-PEG-T7 (CFDA) and free vincristine (VCR) solution (A). Linear graph of CFDA solution in the range 200-600 nm (B) |
CFDA的线性回归方程为A = 0.195 0 C + 0.007 1 (R2 = 0.999 3, n = 5), 在1.5~3.5 μg·mL-1内紫外吸收强度与浓度的线性关系良好, 结果见图 3B。计算得到靶头连接率为63.88%。
5 T7-LDL-VCR纳米粒的构建与表征粒径分布测试结果表明, T7-LDL-VCR纳米粒的平均粒径为30 nm (图 4A); 由透射电镜结果可知, 纳米粒呈近圆形, 粒径约20~45 nm (图 4B)。

|
Figure 4 Particle size distribution of T7 peptide modified vincristine loaded low density lipoprotein (T7-LDL-VCR) (A); Transmission electron microscopy of T7-LDL-VCR (B) |
参考文献[12]于2 h后采用活体成像Spectrum-CT仪器进行荧光强度的检测。结果见图 5所示, 两种LDL纳米粒载体均对小鼠脑胶质瘤有靶向作用, 但是DiR-T7-LDL相对DiR-LDL脑部富集作用更好, 说明将T7肽共价修饰于LDL表面, 使载体达到了协同靶向于脑胶质瘤的目的。
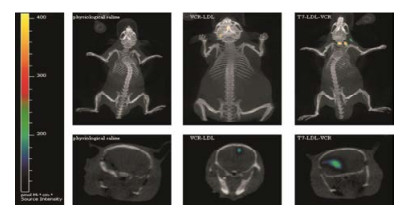
|
Figure 5 Biodistribution of DiR contained in LDL-VCR and T7-LDL-VCR in mice bearing intracranial C6 glioma determined by an IVISV R Spectrum-CT |
荷瘤小鼠经4次给药治疗后, MRI结果显示, 与对照组小鼠脑部肿瘤相比, VCR溶液或含VCR载体均对脑瘤有治疗作用, 且T7-LDL-VCR效果最为显著(图 6A); 采用核磁技术对荷瘤小鼠脑组织进行扫描, 可以获得肿瘤体积, 进而计算得到相对肿瘤体积, 结果显示, 游离VCR为(79.25 ± 8.14) %, LDL-VCR为(51.50 ± 4.73) %, T7-LDL-VCR为(30.00 ± 4.32) % (图 6B)。T7-LDL-VCR比LDL-VCR的瘤抑制作用更强。给药后, 观察记录小鼠活动情况、症状和死亡日期, 根据观察结果绘制Kaplan-Meier survival曲线可知, 生存时间平均值和中位值分别为30.57和36天(图 6C), 分别是VCR-LDL的1.69和1.38倍、游离VCR的1.81和1.85倍。说明T7修饰的LDL可增强LDL对脑瘤的靶向作用。

|
Figure 6 MRI of normal and pathological brains at 16 days after inoculation (A). Relative tumor volume of the brain glioma (B). Kaplan-Meier survival curves of C6 glioma-bearing rats treated with free VCR, LDL-VCR and T7-LDL-VCR (C) |
低密度脂蛋白靶向机制:一方面是纳米粒具有被动靶向作用, 能通过渗透滞留效应聚集于肿瘤部位; 另一方面是经T7修饰或未修饰的载脂蛋白B-100所产生的主动靶向作用, 基于上述作用原理, 本研究构建了T7-LDL-VCR药物递送系统, 并借助MALDI-TOF MS定性分析T7与LDL载体连接后的产物和效率, 但在某些情况下, 由于机器飘移或其他原因的影响, 导致实际响应离子峰与理论上不完全一致。
通过包含不同的探针对载体在实验动物体内进行追踪, 提高了成像方法的安全性、特异性和灵敏度[17]。本文用DiR标记LDL及T7-LDL纳米粒, 观察纳米粒对脑胶质瘤的体内靶向性。结果显示, 载VCR的LDL纳米粒相比游离药物均有较强的脑瘤靶向性及治疗作用, 且T7-LDL-VCR体内效果优于LDL-VCR纳米粒, 这说明LDL作为纳米载体的可行性, 用T7修饰LDL可达到BBB和脑肿瘤细胞双级靶向效果。
| [1] | Wrensch M, Minn Y, Bondy M, et al. Epidemiology of primary brain tumors:current concepts and review of the literature[J]. J Neuro-Oncol, 2002, 4: 99–108. |
| [2] | Behin A, Hoang-Xuan K, Carpentier AF, et al. Primary brain tumours in adults[J]. Lancet, 2003, 361: 323–331. DOI:10.1016/S0140-6736(03)12328-8 |
| [3] | Weil RJ, Palmieri DC, Bronder JL, et al. Breast cancer metastasis to the central nervous system[J]. Am J Pathol, 2005, 167: 913–920. DOI:10.1016/S0002-9440(10)61180-7 |
| [4] | Agarwal S, Sane R, Oberoi R, et al. Delivery of molecularly targeted therapy to malignant glioma, a disease of the whole brain[J]. Expert Rev Mol Med, 2011, 13: e17. DOI:10.1017/S1462399411001888 |
| [5] | Pardridge WM. BBB-Genomics:creating new opening for brain-drug targeting[J]. Drug Discov Today, 2001, 6: 381–383. DOI:10.1016/S1359-6446(01)01721-4 |
| [6] | Yan H, Wang J, Yi P, et al. Imaging brain tumor by dendrimer-based optical/paramagnetic nanoprobe across the blood-brain barrier[J]. Chem Commun (Camb), 2011, 47: 8130–8132. DOI:10.1039/c1cc12007g |
| [7] | Bell RD, Sagare AP, Friedman AE, et al. Transport pathways for clearance of human Alzheimers amyloid beta-peptide and apolipoproteins E and J in the mouse central nervous system[J]. J Cere Blood Flow Metab, 2007, 27: 909–918. DOI:10.1038/sj.jcbfm.9600419 |
| [8] | Oh S, Kim BJ, Singh NP, et al. Synthesis and anti-cancer activity of covalent conjugates of utemisinin and a transferrin-receptor targeting peptide[J]. Cancer Lett, 2009, 274: 33–39. DOI:10.1016/j.canlet.2008.08.031 |
| [9] | Kaplan LD, Deitcher SR, Silverman JA, et al. Phase Ⅱ study of vincristine sulfate liposome injection and rituximab for patients with relapsed and refractory diffuse large B-cell lymphoma or Mantle cell lymphoma in need of palliative therapy[J]. Clinic Lymph Myelom Leuk, 2014, 14: 37–42. DOI:10.1016/j.clml.2013.09.009 |
| [10] | Zhu QL, Zhou Y, Guan M, et al. Low-density lipoprotein-coupled N-succinyl chitosan nanoparticles co-delivering siRNA and doxorubicin for hepatocyte-targeted therapy[J]. Biomaterials, 2014, 35: 5965–5976. DOI:10.1016/j.biomaterials.2014.03.088 |
| [11] | Iwanik MJ, Shaw KV, Ledwith BJ, et al. Preparation and interaction of a low density lipoprotein:daunomycin complex with P388 leukemic cells[J]. Cancer Res, 1984, 44: 1206–1215. |
| [12] | Geng WQ, Lu Y, Gao J, et al. Preparation and in vitro evaluation of salinomycin-loaded low-density lipoprotein particles[J]. Chin J New Drugs (中国新药杂志), 2016, 25: 447–450. |
| [13] | Mei DY. A Study of Doxorubicin Hydrochloride Liposome Targeting to Glioma (盐酸多柔比星脂质体靶向神经胶质瘤的研究)[D]. Shanghai: Fudan University, 2010. |
| [14] | Li MY, Li ZP, Gong W, et al. Thermo-sensitive liposome co-loaded of vincristine and doxorubicin based on their similar physicochemical properties had synergism on tumor treatment[J]. Pharm Res, 2016, 33: 1881–1898. DOI:10.1007/s11095-016-1924-2 |
| [15] | Lai YH. Study on Low Density Lipoprotein-based Targeting Nano-carrier (基于低密度脂蛋白的靶向性纳米载体研究)[D]. Wuhan: Huazhong University of Science and Technology, 2008. |
| [16] | Suh W, Han SO, Yu L, et al. An angiogenic, endothelial-cell-targeted polymeric gene carrier[J]. Mol Ther, 2002, 6: 664–672. DOI:10.1016/S1525-0016(02)90721-5 |
| [17] | Li M, Yang YT, He Q, et al. Recent advances of nanocarriers in tumor immunotherapy[J]. Acta Pharm Sin (药学学报), 2017, 52: 1839–1848. |
 2018, Vol. 53
2018, Vol. 53


