2. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
藤黄为藤黄科植物藤黄树(Garcinahanbaryi Hook.f.)的树干切割后分泌的胶状树脂[1], 功效为消肿攻毒、祛腐敛疮[2]。从藤黄中已分离得到了藤黄酸(gambogic acid, GA, C38H44O8, 图 1)、异藤黄酸和新藤黄酸等成分, 其中藤黄酸为活性最强的有效成分[3-5]。藤黄酸具有抗肿瘤作用, 对人肺癌小细胞NCI-H1993[6]、人白血病细胞K562[7]、胃癌细胞[8]、人胰腺癌SW1990[9]和人结肠癌细胞HT-29[10]等具有明显的抑制作用, 其机制涉及诱导细胞凋亡[11]、阻滞细胞周期于S期[12]、抑制相关肿瘤血管生成和逆转机体多药耐药性[13, 14]等。但藤黄酸水溶性差(室温溶解度仅为0.324 5 µg·mL-1), 口服生物利用度低, 限制了其体内研究和临床应用[15]。而静脉注射给药常需加入L-精氨酸、葡甲胺、赖氨酸等助溶剂或聚氧乙烯蓖麻油、聚山梨酯等增溶剂[16], 但助溶剂和增溶剂的加入会引起一系列不良反应, 如过敏、心血管毒性[17]和肾毒性[18]等。
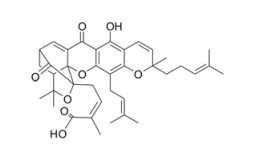
|
图 1 The structure of gambogic acid (GA) |
纳米制剂是解决藤黄酸溶解性问题的一个可行的方案。纳米级药物粒径小、表观溶解度高, 更重要的是可通过EPR效应[19, 20]富集在肿瘤组织中。国内外学者已尝试将藤黄酸制备成脂质体[21]、胶束[22]、囊泡[23]和磁性纳米粒[24]等, 但载药量均偏低(< 20%), 同时制备方法略显复杂, 有机溶剂的使用也给其产业化带来了一定难度。
考虑到藤黄酸结构上有1个羧基, 可在碱性溶液中形成羧酸盐, 加酸酸化能恢复原来的羧基而从溶液中析出, 本研究尝试通过这一特性使用微沉淀法将藤黄酸制备成纳米混悬剂, 并对其处方工艺、理化性质和体外药效进行考察, 以便为藤黄酸提供一种可静脉注射的剂型, 为藤黄酸的抗肿瘤研究和临床应用奠定基础。
材料与方法主要仪器 Zetasizer Nano ZS型粒度仪(英国Malvern Instruments公司); Waters Symmetry反相C18色谱柱(5 μm, 250 mm × 4.6 mm, 美国Waters公司); U3000高效液相色谱仪(戴安有限公司); MCA-15AC细胞培养箱(日本SANYO公司); Biotek酶联免疫检测仪(美国伯腾仪器公司); JEM-1400透射电子显微镜(日本电子珠式会社)。
药物和试剂 藤黄酸(南京春秋生物有限公司, 含量 > 98.0%, 批号20160805);牛血清蛋白(bull serum albumin, BSA, 北京冬歌生物科技有限公司, 批号20110310);泊洛沙姆(Poloxamer 188, P188, Sigma公司, 批号018K0029);聚乙二醇-聚乙内酯(mPEG2000-PCL2000, 济南岱罡有限公司, 批号20150521);十二烷基硫酸钠(sodium dodecyl sulfate, sodium salt, SDS, 西安海斯夫生物科技有限公司, 批号20151203);聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVP, 无锡科技实验二厂, 批号0712109);紫杉醇注射液(paclitaxel, PTX, 北京协和药厂, 批号161108); H22、HepG2细胞(中国医学科学院基础医学研究所细胞资源中心); RPMI 1640、DMEM培养基和胎牛血清(美国Gibco公司); 磷酸盐缓冲液、青链霉素(规格100 u·mL-1) (北京索莱宝科技有限公司)。实验用水为去离子水, 甲醇、乙腈为色谱纯, 其余试剂或药品均为分析纯, 购自国药集团化学试剂有限公司。
动物 健康昆明小鼠, 雌性, 体重18~20 g, 北京维通利华实验动物技术有限公司, SPF级, 合格证号: 11400700225312, 许可证编号: SCXK (京) 2016-0011。
HPLC测定条件的建立 HPLC色谱柱选择反相C18柱, 检测波长360 nm, 流动相为甲醇-醋酸水溶液(93:7, v/v), 流速1.0 mL·mL-1, 柱温25 ℃, 进样量20 µL。精密称取藤黄酸1 mg, 置于10 mL量瓶中, 加入适量甲醇充分溶解, 用甲醇定容至刻度, 摇匀, 得质量浓度为100 µg·mL-1的母液。以此为基础, 配制质量浓度分别为0.1、1、5、10和50 µg·mL-1溶液, 测定检测波长处的峰面积(A)值, 并以A为纵坐标, 质量浓度(C, μg·mL-1)为横坐标绘制标准曲线图, 计算其回归方程。
藤黄酸纳米混悬剂制备条件筛选 通过单因素实验, 考察不同稳定剂、超声功率、药载比、加酸量对藤黄酸纳米混悬剂(GA-NSps)制备的影响。称取一定质量的藤黄酸溶于0.1 mol·L-1 NaOH (1.0 mL)中; 分别称取一定质量不同的稳定剂溶解于0.1 mol·L-1 HCl (1.0 mL)中, 于25 ℃、一定超声条件下缓慢滴加到上述NaOH中。测试的稳定剂为SDS、P188、mPEG2000-PCL2000和BSA; 选择GA:P188质量比例分别为1:3、1:1、3:1、5:1、7:1和9:1;超声功率分别设定为50、100、250和500 W, 其中酸的加入量分别为完全中和时的60%、70%、80%、90%和100%。
藤黄酸纳米混悬剂的体外评价粒径、电位、多分散指数考察 用Zetasizer Nano ZS型电位仪测定纳米混悬剂的粒径、粒度分布和表面电位。
透射电镜形态考察 将GA-NSps稀释到藤黄酸理论质量浓度为100 μg·mL-1, 取6.0 μL滴到300目铜网上, 静置5 min, 滤纸吸干, 室温放置10 min, 滴加6.0 μL醋酸铀于铜网上染色5 min, 再用滤纸吸干, 室温放置过夜, 透射电镜下加速电压为120 kV时观察纳米混悬剂的形态、大小和分布情况。
载药量的考察 取GA-NSps 100 μL, 用乙腈900 µL破坏, HPLC测定药物浓度, 计算药物总质量; 取纳米混悬剂3 mL冻干称重, 即为纳米混悬剂的总质量(m总)。平行实验3份, 按照公式计算载药量(DL):DL = mGA / m总 × 100%。其中, mGA为纳米混悬剂中GA的质量。
不同介质中的粒径稳定性考察 精密吸取GA-NSps 1 mL, 分别滴加到等体积的2×PBS (磷酸盐缓冲液, pH 7.4)、1.8% NaCl、10%葡萄糖溶液中, 或4倍体积的人工胃液、人工肠液中, 37 ℃孵育, 不同时间点取样测定粒径变化。
体外释放考察 取药物质量浓度为1 mg·mL-1的GA-NSps 1 mL, 置于透析袋中, 在37 ℃, 于50 mL含0.2% Tween 80和5%乙醇的PBS释放介质中进行透析。分别在不同时间点各取1 mL释放外液, 计算累积释放度。另取GA物理混悬液(将GA粉末直接分散在纯水中超声而得)及GA甲醇溶液, 以同样的方法考察体外释放。
体外细胞毒性实验 体外培养HepG2细胞至对数期, 用含10%胎牛血清的DMEM培养液将细胞配成细胞数1×105/mL的单细胞悬液, 接种到96孔板。5% CO2、37 ℃细胞培养24 h后, 吸去培养液, 将GA-NSps、GA的DMSO溶液及稳定剂P188分别用不加胎牛血清的培养基稀释至不同浓度, 同时以无药物、不含胎牛血清的培养基作为空白对照。孵育24 h后, 吸去样品溶液, 每孔加MTT溶液(5 mg·mL-1, PBS配制) 20 μL; 继续孵育4 h后, 吸去孔内培养上清液, 每孔加DMSO 200 μL, 振荡20 min, 测量在570 nm波长下的吸光度值(A), 按照公式计算细胞抑制率(CI), CI = (A空白对照组 – A实验组)/A空白对照组×100%。
通过GraphPad Prism 5.0软件计算CI为50%时药物浓度(IC50)。
体内药效学实验 于每只小鼠右侧腋窝皮下接种H22肝癌瘤细胞悬液0.2 mL。肿瘤生长至第7天, 筛选出肿瘤大小相对一致的小鼠, 随机分成6组:阴性对照组, 生理盐水(ig); 阳性对照组, 紫杉醇注射液8 mg·kg-1 (iv); 纳米混悬剂对照组, 5 mg·kg-1 GA-NSps (ip); 纳米混悬剂低、中、高剂量组, 剂量分别为7.5、15、30 mg·kg-1 GA-NSps (ig)。每隔两天给药1次。每日观察其行为状态变化; 隔日称量小鼠体重, 并用电子游标卡尺测量肿瘤的长和宽, 计算瘤体积(V)。给药第8天后停药, 脱颈椎处死小鼠, 完整剥离腋窝皮下转移瘤体, 按公式计算抑瘤率(IR)。IR = (V对照组 – V给药组)/V对照组×100%。
统计学方法 所有的数据均使用SPSS18.0软件进行统计学分析, 以P < 0.05表示差异有统计学意义。
结果 1 藤黄酸HPLC分析方法的建立藤黄酸保留时间为10.05 min, 色谱峰峰型良好, 且无杂质峰干扰, 检测专属性较好。计算其回归方程为y = 0.491 5 x + 0.450 4 (R2 = 0.999 7), 线性范围为0.1~100 µg·mL-1。
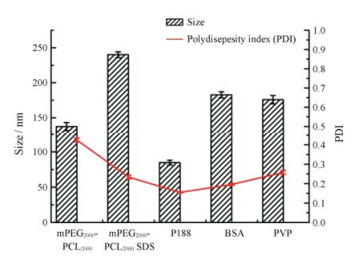
2 稳定剂由图 2可见, 以稳定剂P188制备的纳米混悬剂粒径最小, 且PDI值最小, 室温放置过程中也较稳定, 故选择P188作为GA-NSps的稳定剂。推测可能与其具有较强的表面活性作用有关: P188是聚氧乙烯-聚氧丙烯共聚物, 其中聚氧乙烯占80%。聚氧乙烯链段比例越大, 亲水亲油平衡值(HLB)越高。P188的HLB值为29, 属于高表面活性稳定剂。
|
Figure 2 The influence of different stabilizer systems on the particle size and polydispersity index (PDI) of gambogic acid nanosuspensions (GA-NSps). n = 3, x± s. mPEG2000-PCL2000: Polyethylene glycol-polycaprolactone2000; SDS: Dodecyl sulfate, sodium salt; P188: Poloxamer 188; BSA: Bovine serum albumin; PVP: Polyvinylpyrrolidone |
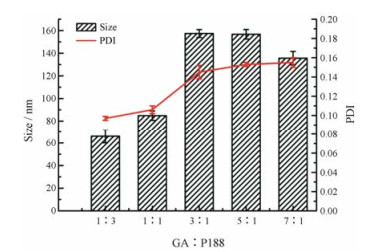
由图 3可知, 药载比3:1和5:1时粒径最大, 1:3和1:1时粒径均较小, 而7:1时粒径也不大。平均粒径均在160 nm以下。从载药量来看, 药载比7:1时载药量最高, 提高药载比到9:1时会产生沉淀而导致纳米混悬剂的制备无法成功。综合考虑, 选择药载比7:1进行后续研究。
|
Figure 3 Effect of different drug loading ratio on particle size of resultant GA-NSps. n = 3, x± s |
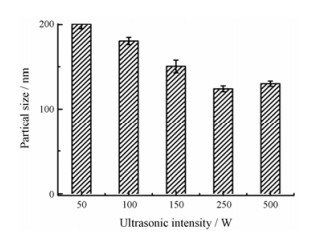
如图 4所示, 在一定范围内, 随着超声强度的增大, GA-NSps的粒径减小。在250 W时粒径达到最小, 继续增加到500 W, 粒径反而略有增大, 故最终确定250 W为最佳超声功率。
|
Figure 4 The impact of ultrasonic intensity on GA-NSps. n = 3, x± s |
胶体粒子的表面电位越大, 斥力势能大, 粒子越稳定。由表 1可知, 酸用量在中和用量的80%~90%时, 制备的GA-NSps粒径较小, 且电位较高。一般电位大于20 mV纳米混悬剂相对稳定, 对应的酸用量为85%。
| Table 1 The influence to zeta of different proportion of acid/alkali of GA-NSps |
GA-NSps 1 mL冻干后直接加入去离子水1 mL, 样品即便在超声作用下也无法复溶。只有以0.5% PVP为冻干保护剂的样品能够在复溶后粒径变化相对较小, 见表 2。故初步选择0.5% PVP作为GA-NSps冻干保护剂。
| Table 2 Various freeze-drying protective screening of GA-NSps |
根据以上处方筛选最终确定GA-NSps的制备处方:精密称取GA 7 mg快速溶解于1.0 mL NaOH (0.1 mol·L-1)中, 精密称取P188 1 mg快速溶解于1.0 mL HCl (0.1 mol·L-1)中, 超声条件(25 ℃、250 W)下向GA的碱溶液中缓慢滴加含P188的酸溶液, 酸用量为理论值(中和用量)的85%。
7 GA-NSps制备、粒径与电位按照以上处方制备GA-NSps, 测定GA-NSps平均粒径为139.0 ± 5.1 nm, PDI为0.26 ± 0.01, zeta为-35.1 ± 1.36 mV, 粒径分布见图 5。

|
Figure 5 Particle size and distribution of GA-NSps |
由图 6可见, GA-NSps近乎为球形, 分布比较均匀, 目测粒径约50 nm, 比动态光散射法测得的结果小。这主要是动态光散射法测的是纳米颗粒在分散介质中的等效半径, 是在湿态和具有水化层时的粒径。HPLC测得GA-NSps载药量为(83.73 ± 1.03) %, 低于理论载药量(87.50%), 原因可能是由于药物转移过程中出现了一定的损失。

|
Figure 6 Transmission electron microscope images of GA-NSps |
由图 7可见, GA-NSps在生理盐水、PBS、5%葡萄糖溶液、人工胃液和肠液中5 h内可稳定存在, 粒径没有明显增大, PDI比较稳定, 说明GA-NSps可调成等渗溶液, 用于静脉给药, 为进一步的体内研究奠定基础。

|
Figure 7 The stability of GA-NSps in different dispersed medium. n = 3, x± s. PBS: Phosphate buffered saline; Glu: 5% Glucose |
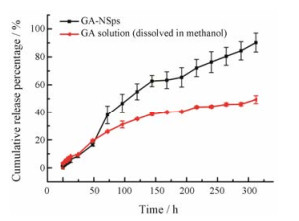
由图 8可见, GA-NSps能相对较均匀地释放, 整体无突释, 在312 h时累积释放率达到90.27%, 具有良好的缓释效果。由于溶解性低, 藤黄酸直接分散于水中检测不到药物释放(未在图中显示)。藤黄酸甲醇溶液前50 h释放较快, 之后释放减慢, 312 h时累计释放45.0%, 推测透析作用使甲醇溶液进入透析袋, 藤黄酸析出沉淀导致释放减慢。
|
Figure 8 Cumulative GA release from GA-NSps at 37 ℃ with in 350 h. n = 3, x± s |
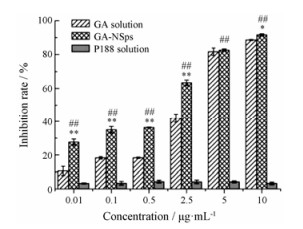
藤黄酸在DMSO中溶解性好且放置稳定, 而藤黄酸甲醇溶液放置过程容易出现沉淀, 所以选择将藤黄酸溶解在DMSO溶液中作为对照组。如图 9所示, 与GA的DMSO溶液相比, GA-NSps对HepG2细胞的杀伤作用更强; 随着浓度的增加, 肿瘤抑制率更高, 表现出明显的剂量依赖性。而稳定剂P188对HepG2细胞几乎没有任何抑制作用。GA-NSps和GA的DMSO溶液对HepG2细胞的IC50值分别为0.851 8和2.104 μg·mL-1, 两组之间具有显著性差异(P < 0.05), 说明GA-NSps抑瘤效果强于溶液组, 可能是纳米混悬剂能够通过非特异性内吞作用或吞噬作用内化入胞, 使其抑瘤作用增强。
|
Figure 9 Proliferation inhibition of GA-NSps against HepG2 cells after 24 h of incubation. n = 3, x± s. *P < 0.05, **P < 0.01 vs GA solution; ##P < 0.01 vs P188 solution |
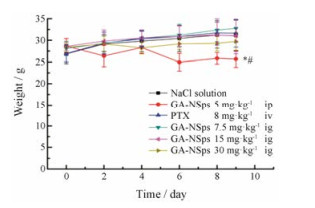
给药期间小鼠体重随时间变化曲线见图 10。由图可知, 腹腔注射GA-NSps组小鼠体重下降明显, 口服高剂量GA-NSps组小鼠体重略有下降, 其他各实验组和紫杉醇注射液组小鼠的体重均平稳增长。与生理盐水组相比, 腹腔注射组小鼠体重显著下降(P < 0.05), 表现出一定的毒副作用。其他各组体重与生理盐水组相比, 没有统计学差异。
|
Figure 10 The change of relative body weight of H22 tumor-bearing mice with time. n = 10, x± s. *P < 0.05 vs NaCl solution group; #P < 0.05 vs PTX group. PTX: Paclitaxel |
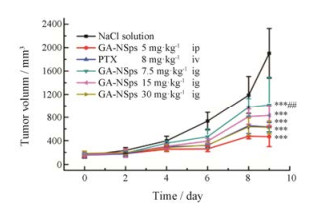
给药期间小鼠肿瘤体积随时间变化曲线见图 11, 其中生理盐水组小鼠肿瘤体积增加最快, 口服高剂量GA-NSps组与紫杉醇注射液组相似, 腹腔注射GA-NSps组增长最慢。实验结束时, 各实验组肿瘤体积与生理盐水组均有显著性差异(P < 0.001), 显示藤黄酸具有良好的肿瘤抑制作用。高剂量组和腹腔注射组的抑制率分别达75.41%和72.35%, 均显著高于阳性药紫杉醇注射液组(66.80%, P < 0.05), 提示藤黄
|
Figure 11 The change of tumor volume of H22 tumor-bearing mice with time. n = 10, x± s. ***P < 0.001 vs NaCl solution group; ##P < 0.01 vs PTX group |
酸作为抗肿瘤药物具有较好的开发前景。口服GA-NSps高、中、低剂量抑瘤率分别为72.35%、56.34%和46.48%, 具有较好的剂量依赖性。而5 mg·kg-1 GA-NSps腹腔注射时抑瘤率为75.41%, 与高剂量(30 mg·kg-1)口服给药的抑制率相当, 提示GA-NSps口服给药的生物利用度不高, 推测其大约相当于静脉给药的1/6, 即17%左右。
讨论藤黄酸作为一种新型抗肿瘤药物具有很好的应用前景, 然而水溶性差, 限制了其进一步应用。本实验利用泊洛沙姆为稳定剂, 碱溶酸沉法制备GA-NSps, 初步解决了难于给药的问题。所制备的GA-NSps近似规则球形、分布均匀, 粒径为135.9 ± 5.1 nm, 稳定性良好, 载药量高达(83.73 ± 1.03) %。在以往的实验研究中, 所制备的纳米混悬剂操作复杂, 制备时间过长, 同时载药量很低(8.51 ± 0.95) %[25], 而本碱溶酸沉法避免了有机溶剂的使用, 简化了实验步骤, 显著提高了载药量。该方法对于含羧基或内酯环的小分子药物, 如7-乙基-10-羟基喜树碱、雷公藤甲素等, 具有一定的适宜性[26]。
由于紫杉醇注射液的高效低毒作用[27], 故本实验采用紫杉醇注射液作为阳性药。药效学实验结果表明, 腹腔注射GA-NSps组的抑瘤率虽然高于紫杉醇注射液, 但该组小鼠体重降低明显, 提示可能具有较大的毒副作用, 故不建议采取此给药方式。而口服高剂量(30 mg·mL-1) GA-NSps具有较好抑瘤效果的同时, 安全性相对较高, 不失为GA-NSps一种合理给药方案。本研究为藤黄酸进一步的体内研究和临床应用奠定了基础。
| [1] | Hou WJ, Xiao W. Advances in studies on gambogic acid[J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 617–620. |
| [2] | Ou SP, Wang S, Yang QY, et al. Advances in studies on dried resin of Garcinia hanburyi processing in toxicity reducing and efficacy enhancing effects[J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 2560–2563. |
| [3] | Li Ping. Study on Phytochemistry and Metabonomics of Garcinia (藤黄属植物的化学成分及其代谢组学研究)[D]. Beijing: Minzu University of China, 2016. |
| [4] | Lv GB, Yang XX, Huang QS. Isolation and structure of neo-gambogic acid from gamboge (Garcinia hanburyi)[J]. Acta Pharm Sin (药学学报), 1984, 19: 636–639. |
| [5] | Kashyap D, Mondal R, Tuli HS, et al. Molecular targets of gambogic acid in cancer:recent trends and advancements[J]. Tumour Biol, 2016, 37: 12915–12925. DOI:10.1007/s13277-016-5194-8 |
| [6] | Li D, Yang H, Li RP, et al. Antitumor activity of gambogic acid on NCI-H1993 xenografts via MET signaling pathway downregulation[J]. Oncol Lett, 2015, 10: 2802–2806. DOI:10.3892/ol.2015.3719 |
| [7] | Chen J, Zhou M, Zhang Q, et al. Anticancer effect and apoptosis induction of gambogic acid in human leukemia cell line K562 in vitro[J]. Med Sci Monit, 2015, 21: 1604–1610. DOI:10.12659/MSM.893004 |
| [8] | Zhang Z, Qian H, Yang M, et al. Gambogic acid-loaded biomimetic nanoparticles in colorectal cancer treatment[J]. Int J Nanomed, 2017, 12: 1593–1605. DOI:10.2147/IJN |
| [9] | Xia G, Wang H, Song Z, et al. Gambogic acid sensitizes gemcitabine efficacy in pancreatic cancer by reducing the expression of ribonucleotide reductase subunit-M2(RRM2)[J]. J Exp Clin Cancer Res, 2017, 36: 107. DOI:10.1186/s13046-017-0579-0 |
| [10] | Ye JL, Yu YJ, Wu AL, et al. Sensitization of human colon cancer HT-29 cells to TRAIL-induced apoptosis by gambognic acid[J]. Acta Pharm Sin (药学学报), 2015, 50: 1252–1257. |
| [11] | Gu H, Rao S, Zhao J, et al. Gambogic acid reduced bcl-2 expression via p53 in human breast MCF-7 cancer cells[J]. J Cancer Res Clin Oncol, 2009, 135: 1778–1782. |
| [12] | Jang JH, Kim JY, Sung EG, et al. Gambogic acid induces apoptosis and sensitizes TRAIL-mediated apoptosis through downregulation of cFLIPl in renal carcinoma Caki cells[J]. Int J Oncol, 2016, 48: 376–384. DOI:10.3892/ijo.2015.3249 |
| [13] | Zhu X, Zhang H, Lin Y, et al. Mechanisms of gambogic acid-induced apoptosis in non-small cell lung cancer cells in relation to transferrin receptors[J]. J Chemother, 2009, 21: 666–672. DOI:10.1179/joc.2009.21.6.666 |
| [14] | Zhang W, Zhou H, Yu Y, et al. Combination of gambogic acid with cisplatin enhances the antitumor effects on cisplatin-resistant lung cancer cells by downregulating MRP2 and LRP expression[J]. OncoTargets Ther, 2016, 9: 3359–3368. |
| [15] | Hou WJ, Chen BL, Zhao YW, et al. Stability of gambogic acid[J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 1755–1758. |
| [16] | Zhou ZT. Phase Ⅰ Trial of Human Tolerability and Pharmacokinetics to Gambogic Acid (注射用藤黄酸Ⅰ期临床耐受性及药代动力学试验)[D]. Beijing: Peking Union Medical College, 2006. |
| [17] | Zhu J, Wang M, Zhu Y. Quantitative cardiotoxicity assessment of gambogic acid using multiple cellular phenotype analysis[J]. Chin J Pharmacol Toxicol (中国药理与毒理学杂志), 2017, 31: 73–79. |
| [18] | Wang BN. Research on Extraction and Separation and Pharmaco-toxicology of Gambogic Acid and Neogambogic Acid in Garcinia hanburyi (藤黄中藤黄酸和新藤黄酸的提取分离及药理毒理研究)[D]. Changchun: Jilin Agricultural University, 2015. |
| [19] | Au JL, Yeung BZ, Wientjes MG, et al. Delivery of cancer therapeutics to extracellular and intracellular targets:determinants, barriers, challenges and opportunities[J]. Adv Drug Deliv Rev, 2016, 97: 280–301. DOI:10.1016/j.addr.2015.12.002 |
| [20] | Maeda H. Toward a full understanding of the EPR effect in primary and metastatic tumors as well as issues related to its heterogeneity[J]. Adv Drug Deliv Rev, 2015, 91: 3–6. DOI:10.1016/j.addr.2015.01.002 |
| [21] | Wang LY, Liu YM, Wu LY, et al. Preparation and pharmacokinetics of gambogic acid long-circulating liposomes[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1309–1314. |
| [22] | Yan X, Yang Y, He L, et al. Gambogic acid grafted low molecular weight heparin micelles for targeted treatment in a hepatocellular carcinoma model with an enhanced anti-angiogenesis effect[J]. Int J Pharm, 2017, 522: 110–118. DOI:10.1016/j.ijpharm.2017.02.051 |
| [23] | Zhang D, Zou Z, Ren W, et al. Gambogic acid-loaded PEG-PCL nanoparticles act as an effective antitumor agent against gastric cancer[J]. Pharm Dev Technol, 2018, 23: 33–40. DOI:10.1080/10837450.2017.1295068 |
| [24] | Dai YJ, Wang F, Huang P, et al. Preparation and characterization of magnetic nano Fe3O4 load neogambogic acid[J]. Guangzhou Chem Ind (广州化工), 2016, 44: 71–73, 84. |
| [25] | Liu CY, Wang W, Zhou JP, et al. Preparation and evaluation of gambogic acid-loaded reconstituted high density lipoprotein nanoparticles[J]. China Pharm Univ (中国药科大学学报), 2013, 44: 311–315. |
| [26] | Yang XF, Guo RQ, Su WJ, et al. Prescription screening and preparation process of 10-hydroxycamptothecin nanocrystals and industrialization research[J]. Her Med (医药导报), 2016, 35: 1333–1340. |
| [27] | Zhang CY, Li J, Gao JM, et al. The impurity profiling of paclitaxel and its injection by UPLC-MS/MS[J]. Acta Pharm Sin (药学学报), 2016, 51: 965–971. |
 2018, Vol. 53
2018, Vol. 53


