2. 山西大学化学化工学院, 山西 太原 030006;
3. 山西大学大型仪器中心, 山西 太原 030006
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Scientific Instrument Center, Shanxi University, Taiyuan 030006, China
款冬花为菊科植物款冬Tussilago farfara L.的干燥花蕾, 主产于我国的山西、河南、陕西和甘肃等地, 具有润肺下气、止咳化痰的功效, 用于新久咳嗽、喘咳痰多、劳嗽咳血。款冬花始载于《神农本草经》, 列为中品, 谓其“主咳逆上气, 善喘, 喉痹, 诸惊痫、寒热邪气”[1]。款冬花是中医临床常用药材, 也是复方麻杏石甘汤[2]、紫菀散[3]等多种复方的重要组成原料。
款冬在欧洲同样是一种具有悠久历史的药用植物, 但其用药部位为叶, 同样用于止咳化痰[4]。目前市场上由于款冬花价格较高, 经常出现非药用部位花梗、根茎等掺杂现象, 而叶子的产量较高可以有效避免掺假现象; 此外, 由于款冬花蕾的发育在地下进行, 采收相对困难。从药用资源的角度来看, 叶比花蕾具有明显的优势。因此, 系统比较款冬花、叶的成分对促进款冬资源有效利用有重要意义。
本课题组前期曾采用气质联用[5]和核磁共振[6]对款冬花、叶的化学成分进行了比较。近年来, 液质联用技术广泛地应用于多种药用植物及复方的化学分析, 如酸枣仁[7]、黄芪建中汤[8]、远志[9]、藤黄[10]等。本文拟采用高分辨液质联用技术结合Xcalibur 3.2、Compound Discover 2.0、Mass Frontier 7.0等软件对款冬花、叶的化学成分进行进一步深入比较, 为款冬叶资源利用奠定基础。
材料与方法仪器与试剂 Thermo fisher U3000超高效液相色谱仪, 配置在线脱气机、四元梯度泵、柱温箱、自动进样器(Thermo Fisher Scientific), Thermo Scientific Q Extractive质谱仪(Thermo Scientific, Germany); Xcalibur 3.2软件; Compound Discover 2.0软件; Mass Frontier 7.0软件; 十万分之一天平(德国赛得利斯集团)。乙腈、甲醇、甲酸为色谱纯(Thermo Fisher Scientific)、水为娃哈哈纯净水
药品 对照品咖啡酸(批号: 14100803)购自MUST公司; 芦丁(批号: 140912)购自上海盛中医药化工有限公司; 异绿原酸A (批号: 14062009)、异绿原酸B (批号: 14122417)、异绿原酸C (批号: 14062011)购自成都普瑞法科技开发有限公司; 山柰酚(批号: YJ-141119)、绿原酸(批号: YJ-141004)、金丝桃苷(批号: YJ-150109)购自江苏永健医药有限公司; 槲皮素(批号: 100081-200907)中国药品生物制品检定所; 没食子酸(批号: 20130729)上海源叶生物科技有限公司, 款冬酮、色原酮、款冬花素酯为本实验室自制, 纯度为98%以上。连续3个年度的款冬花、叶药材均采自山西沁县(表 1), 经山西大学中医药现代研究中心秦雪梅教授鉴定, 并保存于山西大学中医药现代研究中心。
| Table 1 Flower buds and leaves of T. farfara L. from different stages |
对照品溶液的制备 取对照品适量, 精密称定, 加甲醇分别制备成浓度为1.650 mg·mL-1芦丁; 1.170 mg·mL-1山柰酚; 1.559 mg·mL-1没食子酸; 1.341 mg·mL-1槲皮素; 1.414 mg·mL-1异绿原酸A; 1.696 mg·mL-1异绿原酸B; 1.171 mg·mL-1异绿原酸C; 1.062 mg·mL-1金丝桃苷; 1.276 mg·mL-1咖啡酸; 1.251 mg·mL-1款冬酮; 1.032 mg·mL-1色原酮; 0.978 mg·mL-1款冬花素酯的对照品溶液。
供试品溶液的制备 分别取3批不同年限的款冬花、款冬叶粉碎, 每一批平行备样3份, 分别取样品粉末(过4号筛)约0.5 g, 精密称定, 精密加入甲醇10 mL, 称定重量, 超声提取20 min, 取出, 放冷, 再称定重量, 用甲醇补足减失的重量, 过滤。过0.22 μm微孔滤膜, 取续滤液作为供试品溶液。
色谱条件 色谱柱: Wasters BEH C18 (2.1 mm × 100 mm, 1.7 μm); 流动相: 0.1%甲酸乙腈(A), 0.1%甲酸水(B)。梯度洗脱: 0~2 min, 10%~20% A; 2~6 min, 20% A; 6~7 min, 20%~67% A; 7~14 min, 67%~73% A; 14~18 min, 73%~80% A; 18~19 min, 80%~95% A; 流速: 0.3 mL·min-1; 柱温: 25 ℃; DAD检测器扫描范围为190~400 nm; 进样量3 µL。
质谱条件 离子源:电喷雾离子源(ESI); 扫描方式:正负离子同时扫描; 喷雾电压: 3.5 kV; 鞘气流速: 45 psi (1 psi ≈ 6.9 kPa); 辅助气流速: 15 psi; 毛细管温度: 320 ℃; 探头加温器温度: 300 ℃; 最大喷雾电流: 100 A; S-Lens分辨率: 55;扫描范围: m/z 80~ 1 500;质量分辨率: 70 000。
数据处理和分析 将采集到的原始质谱数据利用Xcailibar 13.0软件进行峰提取、峰匹配, 用Compound Discover 2.0软件进行峰对齐及归一化等预处理, 导出样品名称、保留时间、质荷比以及对应的离子强度组成的数据集。其主要参数设置如下:保留时间范围0~22 min; 质荷比范围为80~1 200 Da; 偏差为5 ppm; 噪音消除水平6;响应强度阈值为50; Mass Frontier 7.0软件进行化合物结构和峰匹配, 阈值一般为5%, 可根据峰相对强度做调整。将上述处理的积分数据导入SIMCA-P 13.0 (Umetrics, Sweden)软件中进行PCA分析(principal component analysis), 用单变量分析寻找差异代谢物, 对比款冬花、叶化学成分差异, 在SPSS软件中对差异成分进行ANOVA分析。
本研究拟采用靶标与非靶标结合的方法进行成分鉴定, 并依据结构指认的可靠性从高到低分为4个层次(Ⅰ、Ⅱ、Ⅲ、Ⅳ), 具体策略如下: ①采用SciFinder、Elsevier SD、Web of Science数据库, 将文献中有关款冬花的化合物数据进行全面收集整理, 共收录91个次级代谢产物信息, 包括苯丙素类、黄酮类、三萜类、甾体类、生物碱类、倍半萜类、色原酮等, 建立化合物库, 包括化合物的名称、分子式、精确分子量、结构式(ChemBioDraw Ultra 12.0, Cambridge Soft, USA, 保存为MOL file格式)信息; ②将质谱原始数据(Xcalibur 3.2 Raw file)导入Mass Frontier 7.0 Chromatogram Manager中, 筛选准分子离子峰的二级谱图, 当关注相对强度较低的峰时, 通过同位素峰、正负离子模式的准分子离子峰、报道物质特征结构碎片等信息筛选二级谱图; ③将所建数据库①中的结构式和②确定的二级图谱导入Database Manger中, 设置阈值为3%, 按照公式1计算二级碎片匹配率, 红色离子峰代表匹配成功, 同时得到匹配的碎片结构和裂解机制。可通过对照品进一步确认的定为Ⅰ类化合物, 部分结构和二级碎片离子在Mass Frontier 7.0可以匹配, 但未通过对照品确认的为Ⅱ类化合物; 在谱图中只能找到化合物的准分子离子峰, 无二级碎片或仅有少量碎片信息, 推测化合物在样本中含量较低, 定为Ⅳ类化合物。以上3类化合物定为靶标指认; ④第Ⅲ类化合物的指认是非靶标指认, 分别将9个H组、Y组和一个空白溶剂(blank)的谱图导入Compound Discover 2.0中, 谱峰归一化, 设置预测化合物的分子组成为C、H、O、N, 并将化合物碎片匹配值设置在70%以上, 通过CD数据库(http://www.mzcloud.org)进行结构指认, 计算结果显示分子离子峰、分子式、分子量、不同样本的谱峰强度、匹配度等信息, 根据匹配度的高低及碎片峰推断化合物。
结果 1 款冬花、叶指认策略及结果目前未见文献报道采用液质联用技术分析款冬植物化学成分。采用靶标和非靶标指认方法, 从款冬花、叶中共指认了43种化合物, 结果见表 2。
| Table 2 Chemical constituents identified in the extracts of T. farfara. *Represents confirmed by the standards; a, b, c, d represent the Ⅰ, Ⅱ, Ⅲ, Ⅳ; H, Y represent the flower buds and leaves. The matching ratio of Ⅰ or Ⅱ = The number of matched fragments / the MS2 fragments with threshold greater than 3% |
芦丁在正离子模式下可以观察到m/z 611.161 0 [M+H]+和633.143 0 [M+Na]+的准分子离子峰, 负离子模式下观察到m/z 609.146 5 [M-H]-, 筛选准分子离子峰的二级碎片后导入化学结构, 正离子模式下匹配度较好, 得到m/z 465 [M+H-fuc]+、303 [M+H-fuc-glu]+、285 [M+H-fuc-glu-H2O]+和257 [M+H-fuc-glu-H2O-CO]+的碎片离子, 通过与芦丁对照品的质谱行为进行对比, 确认22号为芦丁(图 1)。采用对照品比对的方法鉴定的化合物还包括金丝桃苷(23)、槲皮素(32)、山柰酚(33)。
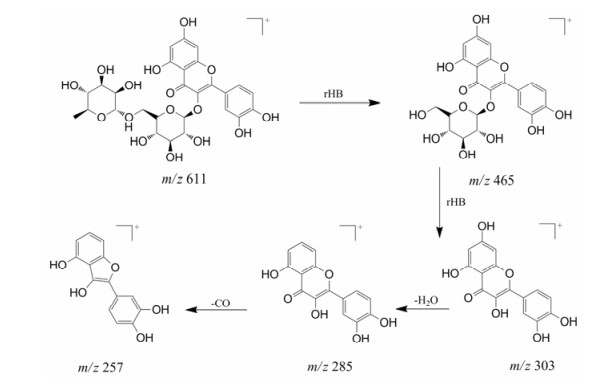
|
Figure 1 Fragmentation process of rutin |
绿原酸在正离子模式下观察到m/z 355.102 3 [M+H]+和377.084 5 [M+Na]+的准分子离子峰, 在Mass Frontier 7.0匹配的碎片m/z 163为[M+H]+和[M+Na]+脱去奎尼酸部分产生的咖啡酰基正离子; 此外, [M+H]+峰产生的碎片离子还包括: m/z 337 [M+H-H2O]+、m/z 193 [M+H-caffeoyl]+、m/z 181 [M+H-quinate]+、163 [M+H-quinate-H2O]+, 通过与绿原酸对照品的质谱行为进行对比, 确认为16号为绿原酸。异绿原酸A、B和C的结构较绿原酸多一分子的咖啡酰基, 因此具有相似的结构碎片, 裂解规律见图 2。异绿原酸A、B和C最终通过与对照品比对完成鉴定。
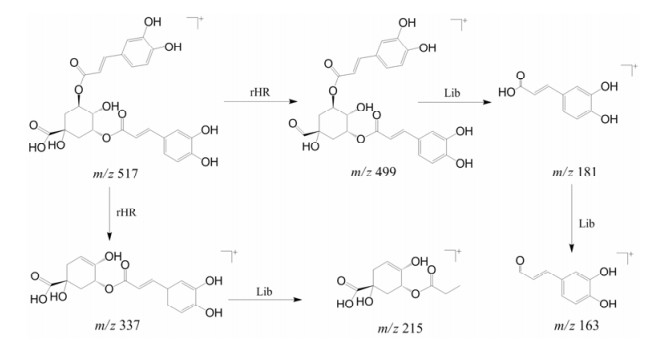
|
Figure 2 Fragmentation process of isochlorogenic acids |
款冬花素酯在正离子模式下观察到m/z 431.279 2 [M+H]+和453.261 3 [M+Na]+的准分子离子峰, 在Mass Frontier 7.0中导入二级碎片和化学结构, 匹配的碎片包括m/z 329 [M+H-MebuO]+、m/z 317 [M+H-MesenO]+、m/z 233 [M+H-MesenO-C5H8O]+、m/z 215 [M+H-MesenO-MebuO]+、m/z 173 [M+H-MesenO-MebuO-C3H6]+、m/z 115 [MesenO+H]+、m/z 103 [MebuO+H]+, 通过与款冬花素酯对照品的质谱行为进行对比确认42号为款冬花素酯(图 3)。款冬酮也通过类似的方法得到鉴定。
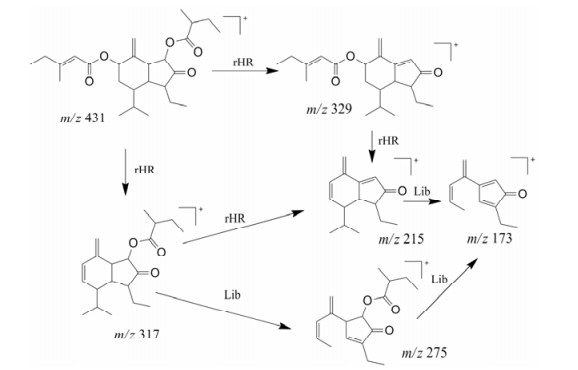
|
Figure 3 Fragmentation process of 7β-(3'-ethyl-cis-crotonoyloxy)-1α-(2'-methylbutyryloxy)-3(14)-dehydro-Z-notonipetranone |
Tussilagolactone 分子式为C18H42O8, 比款冬素酯多一个氧原子和14位取代基OAc[14], 该成分在1、7位取代基(分别为MesenO、MebuO)与款冬花素酯相同, 在正离子模式下产生m/z 507.294 9 [M+H]+和529.276 9 [M+Na]+, 在Mass Frontier 7.0中匹配的二级碎片包括m/z 447 [M+H-OAC]+、431 [M+H-OAC-O]+、347 [M+H-OAC-O-Mebu]+、317 [M+H-OAC-O-MesenO]+、233 [M+H-OAC-O-MesenO-Mebu]+, 可能的裂解规律如图 4所示。
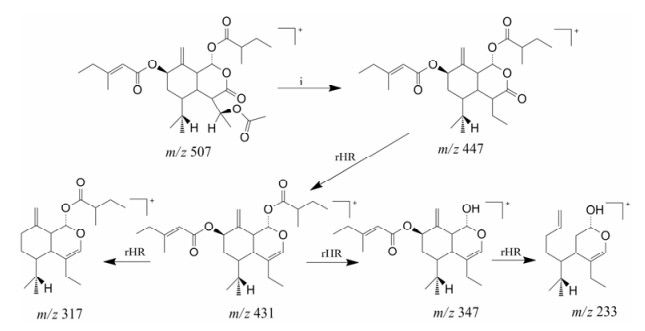
|
Figure 4 Fragmentation process of tussilagolactone |
阿魏酸的分子式为C10H10O4, 负离子模式下产生m/z 193.050 19 [M-H]-的准分子离子峰, 二级碎片有m/z 178、175、149、134, 负离子模式下Mass Frontier 7.0匹配度较差, 结合文献[11]裂解规律推断该物质为阿魏酸。
2.3 Ⅳ类化合物的质谱解析次级代谢物库中化合物3-O-咖啡酰基奎尼酸甲酯(21), 分子式为C17H20O9, 正离子模式下产生m/z 369.118 0 [M+H]+和391.284 0 [M+Na]+的准分子离子峰, 但无该准分子离子峰的二级碎片。此类物质还包括款冬中黄酮类物质山柰酚-3-O-葡萄糖苷[15], 倍半萜类物质8-angeloylxy-3, 4-epoxy-bisabola-7(14), 10-dien-2-one[16]、7β-(3'-ethylcis-crotonoyloyx)-5, 6-dehydro-3, 14-dehydro-Z-notonipetralactone[17]、7β-senecioyloxyoplopa-3(14)Z, 8(10)-dien-2-one[18]。
3 非靶标成分分析Ⅲ类化合物即为非靶标化合物, 该类化合物多为初级代谢产物, 通过Compound Discover 2.0及其关联的数据库(http://www.mzcloud.org)检索并与二级碎片进行相似性比对, 所鉴定的成分包括黄嘌呤、胆碱、苯丙氨酸、3-吲哚丙烯酸、水杨酸等20个化合物。匹配度均在70%以上, 其中腺苷匹配度最高为94.9%, 吲哚最低为71.2%, 其余物质大多在85%以上。
4 款冬花、叶比较无监督的模式识别方法PCA分析是通过降维技术把具有一定相关性的指标约化为几个综合指标, 可以反映数据的原始状态, 从而直观地显示不同样品之间的整体差异。以前两个主成分为坐标轴构建的得分散点图(R2: 0.72, Q2: 0.542)可见款冬花、叶可明显区分(图 5), 说明二者化学组成存在显著差异。
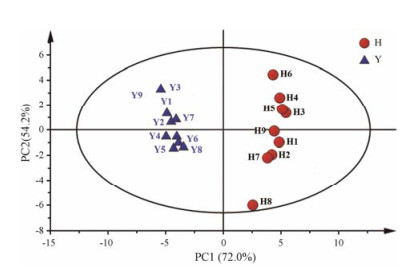
|
Figure 5 PCA score plots of the UPLC-MS spectra data of flower buds (H) and leaves (Y) |
运用GraphPad Prism 5.01软件对表 1化合物总离子流图谱峰未重叠物质进行单变量分析(图 6), 花中含量较高的化合物有黄酮类物质芦丁、山柰酚; 倍半萜类物质款冬素酯、款冬酮、款冬花酮、14-acetoxy-7β-(3'-ethyl-cis-crotonoyloxy)-lα-(2'-methylbutyryloxy)-notonipetranone、tussilagolactone、7β-(3'-ethyl-cis-crotonoyloyx)-5, 6-dehydro-3, 14-dehydro-Z-notonipe tralactone、8-angeloylxy-3, 4-epoxy-bisabola-7(14), 10-dien-2-one; 以及其他类物质脯氨酸、羟基戊二酸、苹果酸、色原酮。叶中含量较高的化合物有苯丙素类物质绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、异阿魏酸、阿魏酸, 肾形千里光碱以及次黄嘌呤、没食子酸、苯丙氨酸、3-吲哚丙烯酸、水杨酸、2, 4-二羟基苯甲酸等其他化合物。款冬叶中特有的成分是马栗树皮甙。金丝桃苷、槲皮素、咖啡酸、奎尼酸、亮氨酰脯氨酸、谷氨酰胺在花和叶中含量无显著差异。
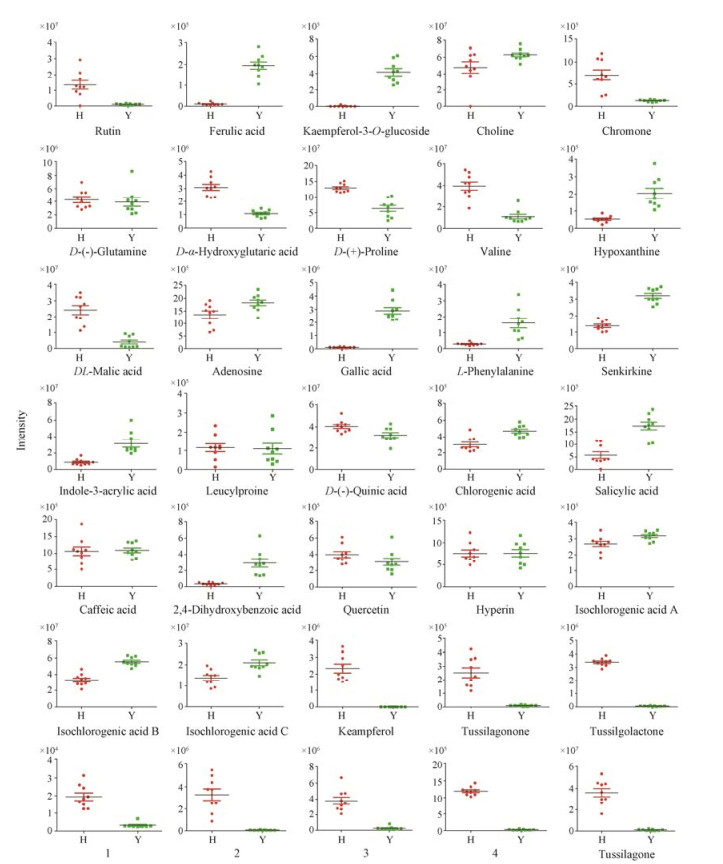
|
Figure 6 Quantification of compounds of flower buds (H) and leaves (Y) from T. farfara L. 1: 7β-(3'-Ethyl-cis-crotonoyloxy)-1α-(2'-methylbutyryloxy)-3(14)-dehydro-Z-notonipetranone; 2: 14-Acetoxy-7β-(3'-ethyl-cis-crotonoyloxy)-lα-(2'-methylbutyryloxy)-notonipetranone; 3: 7β-(3'-Ethyl-cis-crotonoyloyx)-5, 6-dehydro-3, 14-dehydro-Z-notonipetralactone; 4: 8-Angeloylxy-3, 4-epoxy-bisabola-7(14), 10-dien-2-one |
本文采用液质联用技术对款冬花、叶化学成分进行了比较。与前期研究相比, 新检测款冬代谢物4种, 即液质联用技术可以更加灵敏的检测款冬中的次级代谢产物, 与本课题组前期基于核磁共振和气质联用的分析互为补充, 全面揭示款冬花和叶的化学差异。通过靶标和非靶标结合的指认策略, 结合文献报道、标品比对及软件识别和数据库关联, 一共指认了款冬中43种化学成分。款冬花和叶含有相似的化学成分, 款冬酮、款冬花素酯等倍半萜类物质在花中的含量远远高于叶, 而绿原酸、异绿原酸等苯丙素类物质在叶中的含量高于花蕾; 黄酮类物质金丝桃苷、槲皮素在款冬花和叶中含量接近, 而芦丁、山柰酚在款冬花中含量较高, 与课题组之前的研究结果[6]基本一致。
本课题组前期研究显示款冬花和叶均具有明显的止咳化痰作用, 且叶的作用略优于花, 说明以绿原酸类为代表的苯丙素类成分与款冬花止咳化痰作用相关性较大[19], 也与其他课题组的研究结果一致[20]。鉴于款冬叶具有明显的资源和采收优势, 在后续工作中应对其是否可代替花蕾入药进行系统的研究。目前《中国药典》中款冬花的质量评价指标为款冬酮, 建议在款冬花质量标准提升中加入苯丙素类成分。文献报道款冬酮为代表的倍半萜类具有显著的抗炎作用, 但由于中药多为水煎入药, 而低极性的倍半萜类在水提物中含量较低, 这类成分与款冬花止咳化痰的关系也值得进一步研究。
| [1] | Li J, Zhang S, Qin XM, et al. Comparison on chemical constituents in raw and honey baked Farfarae Flos by NMR-based metabolomic approach[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 3009–3016. |
| [2] | Zhou XN. The Clinical Study of Compound MaxingShiGan Decoction Prevent and Treat RILI Caused by CCRT in Patients with Stage Ⅲ Non-small Cell Lung Cancer (NSCLC) (复方麻杏石甘汤防治Ⅲ期NSCLC同步放化疗所致放射性肺损伤的临床研究)[D]. Hangzhou: Zhejiang Chinese Medical University, 2016. |
| [3] | Liu KY. Studies on Therapeutic Basis of Ziwan Powder and Development of New Drug (紫菀散药效物质基础的研究及新药研制)[D]. Tianjin: Tianjin University, 2006. |
| [4] | Tys J, Szopa A, Lalak J, et al. A botanical and pharmacological description of petasites species[J]. Curr Issues Pharm Med Sci, 2015, 28: 151–154. |
| [5] | Xue SY, Li ZY, Zhi HJ, et al. Metabolic fingerprinting investigation of Tussilago farfara L. by GC-MS and multivariate data analysis[J]. Biochem Syst Ecol, 2012, 41: 6–12. DOI:10.1016/j.bse.2011.11.003 |
| [6] | Zhi HJ, Qin XM, Sun HF, et al. Metabolic fingerprinting of Tussilago farfara L. using 1H NMR spectroscopy and multivariate data analysis[J]. Phytochem Anal, 2012, 23: 492–501. DOI:10.1002/pca.v23.5 |
| [7] | Zhang F, Li M, Qiao L, et al. Rapid characterization of Ziziphi Spinosae Semen by UPLC/Q TOF MS with novel informatics platform and its application in evaluation of two seeds from Ziziphus species[J]. J Pharm Biomed Anal, 2016, 122: 59–80. DOI:10.1016/j.jpba.2016.01.047 |
| [8] | Liu YT, Hu YH, Xu WX, et al. Rapid identification on chemical constituents in Huangqi Jianzhong Tang by UHPLC coupled with hybrid quadrupole-orbittrap MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 964–970. |
| [9] | Zhang F, Li X, Li Z, et al. UPLC/Q-TOF MS-based metabolomics and qRT-PCR in enzyme gene screening with key role in triterpenoid saponin biosynthesis of Polygala tenuifolia[J]. PLoS One, 2014, 9: e105765. DOI:10.1371/journal.pone.0105765 |
| [10] | Zhou A, Li QL, Peng DY, et al. Analysis of xanthones in gamboge by HPLC-PDA-ESI/MS[J]. Acta Pharm Sin (药学学报), 2008, 43: 838–842. |
| [11] | Wang XM, Zhang F, Liu Y, et al. LC-MS/MS determination of caffeic acid, ferulic acid, and isoferulic acid in Rhizoma Cimicifugae[J]. Tianjin J Tradit China Med (天津中医药), 2014, 31: 686–689. |
| [12] | Han J, Ye M, Guo H, et al. Analysis of multiple constituents in a Chinese heal preparation Shuang-Huang-Lian oral liquid by HPLC-DAD-ESI-MSn[J]. J Pharm Biomed Anal, 2007, 44: 430–438. DOI:10.1016/j.jpba.2007.02.023 |
| [13] | Pu SB, Xu DR, Zhang M, et al. The detection of hepatotoxic pyrrolizidine alkaloids in flos by LC/MSn[J]. Chin J Nat Med, (中国天然药物), 2004, 2: 293–297. |
| [14] | Masao K, Noriko S. Studies on the Constituents of Tussilago farfara L. Ⅱ. Structures of new sesquiterpenoids isolated from the flower buds[J]. Chem Pharm Bull, 1992, 40: 2753–2755. DOI:10.1248/cpb.40.2753 |
| [15] | Liu YF, Yang LW, Wu B. Studies on the constituents of Tussilago farfara L.[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 2378–2381. |
| [16] | Park HR, Yoo MY, Seo JH, et al. Sesquiterpenoids isolated from the flower buds of Tussilago farfara L. inhibit diacylglycerol acyltransferase[J]. J Agric Food Chem, 2008, 56: 10493–10497. DOI:10.1021/jf801978r |
| [17] | Shi W, Han GQ, Gao JJ. Two news sesquiterpenoids from Tussilago farfara L.[J]. Chin Chem Lett, 1995, 6: 585–586. |
| [18] | Yasunori Y, Hirokazu K, Masao K, et al. Structures of oplopane-type sesquiterpenoids from the flower buds of Tussilago farfara L.[J]. Chem Pharm Bull, 1999, 47: 705–707. DOI:10.1248/cpb.47.705 |
| [19] | Li ZY, Zhi HJ, Zhang FS, et al. Metabolomic profiling of the antitussive and expectorant plant Tussilago farfara L. by nuclear magnetic resonance spectroscopy and multivariate data analysis[J]. J Pharm Biomed Anal, 2013, 75: 158–164. DOI:10.1016/j.jpba.2012.11.023 |
| [20] | Wu QZ, Zhao DX, Xiang J, et al. Antitussive, expectorant, and anti-inflammatory activities of four caffeoylquinic acids isolated from Tussilago farfara[J]. Pharm Biol, 2016, 54: 1117–1124. DOI:10.3109/13880209.2015.1075048 |
 2018, Vol. 53
2018, Vol. 53


