2. 广州中医药大学第二附属医院, 广东 广州 510120
2. The Second Affiliated Hospital, Guangzhou University of Chinese Medicine, Guangzhou 510120, China
蜘蛛香为败酱科植物蜘蛛香(Vleriana jatamansi Jones)的干燥根和根茎, 具有理气止痛、消食止泻、祛风除湿、镇惊安神的功效; 用于治疗腕腹胀痛、食积不化、腹泻痢疾、风湿痹痛、腰膝酸软、失眠等[1]。蜘蛛香药材含有挥发油、环烯醚萜、黄酮、生物碱、氨基酸等化学成分。目前研究认为, 蜘蛛香药材有较好的镇定、安眠等作用, 对于治疗肿瘤、HIV和帕金森病均有一定疗效, 其相关保健品及制剂是欧洲销售额最高的天然药物之一[2-4]。蜘蛛香具有较强的抗氧化活性, 并且特异性地作用于γ-氨基丁酸A (GABAA)受体调节神经递质释放, 保持GABA结构稳定, 并可通过抗氧化作用抑制肝癌细胞生长[5-7]。
本文采用不同浓度的甲醇对蜘蛛香药材进行提取, 采用2, 2-二苯基-1-苦肼(DPPH•)自由基清除能力实验对提取物的抗氧化活性进行分析。通过检测DPPH•在515 nm下吸收度降低的典型波形图, 对蜘蛛香甲醇提取物抗氧化活性进行评估, 原理如公式(1)所示, 其中AH为抗氧化剂和R•为自由基[8]。
| $ \begin{array}{l} {\rm{DPP}}{{\rm{H}}^ \cdot } + {\rm{AH}} \to {\rm{DPPH}} - {\rm{H}} + {\rm{A}} \cdot \\ {\rm{DPP}}{{\rm{H}}^ \cdot } + {\rm{R}} \cdot \to {\rm{DPPH - R}} \end{array} $ | (1) |
根据抗氧化能力差异, 对提取物中含有的极性和非极性成分进行分析及含量测定, 优化蜘蛛香药材提取条件, 并分析相关成分与提取物抗氧化能力之间的关系。采用DPPH•反应动力学曲线, 对蜘蛛香药材中的主要活性成分DPPH•自由基清除能力进行比较; 分析活性成分结构与自由基清除能力之间的相互关系, 为蜘蛛香药材抗氧化活性等功效研究提供方法和理论参考。
材料与方法药材和试剂 蜘蛛香对照药材(121179-201002)、绿原酸(110753-201718)、橙皮苷(110721-201617)、1, 3-O-二咖啡酰奎宁酸(111717-201402)、3, 5-二-O-咖啡酰奎宁酸(111782-201706)、4, 5-二-O-咖啡酰奎宁酸(111894-201102)、芹菜素(111901-201001)、异槲皮苷(111809-201403)、槲皮素(100081-201408)、缬草三酯(111840-201302)、乙酰缬草三酯(111981-201401)以及1β-乙酰缬草三酯等对照品均由中国食品药品检定研究院提供。2, 6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene, BHT)购于美国Sigma公司, 色谱级乙腈购于德国默克公司。色谱级甲酸和甲醇购于美国Fisher公司。去离子水(18.2 MΩ)经Millipore Milli-Q系统(美国Millipore Co.)超纯水器净化。其他所用试剂均为分析纯。
仪器 Agilent 1200高分离度快速液相色谱仪-6410B三重四极杆质谱系统(美国Agilent公司), Waters e2695高效液相色谱仪-2998 PDA检测器(美国Waters公司)。
蜘蛛香甲醇提取物的制备 蜘蛛香药材300.0 mg, 加入不同浓度的甲醇水溶液(0%、25%、50%、70%、80%、90%和100%) 2 mL, 充分振摇10 min, 吸取上清液1.5 mL于1.5 EP管, 3 000 r·min-1离心2 min, 用时制备。
DPPH•自由基清除能力测定 将待测溶液0.5 mL加入DPPH•甲醇溶液3.5 mL, 配成终浓度为6× 10-5 mol∙L-1的DPPH•甲醇溶液。以甲醇溶液为空白, 在515 nm波长进行测定, 每隔2 s记录吸收度值下降情况直到出现平台。
A515 = 12.509 × CDPPH -2.58 × 10-3
采用有效浓度(efficient concentration, EC)表示样品含量和抗氧化能力的关系, 采用抗自由基的能力(antiradical power, ARP)表示抗氧化能力, 其中抗氧化活性用EC50表示, ARP = 1/EC50[8, 9]。本文参考相关文献, 并根据本实验的研究对象为提取物的特点, 将以上分析方法进行改进, 采用tEC50表示DPPH•浓度下降到50%所需要的时间, 采用ARPtotal表示在到达稳定期时(或在反应检测停止点时) DPPH•浓度下降值的倒数, 即ARPtotal为1/EC(%)。其中tEC50越小, 表示样品半数DPPH•自由基清除效率越高; ARPtotal越大, 表示样品在检测反应时间内DPPH•自由基清除能力越强。
对照品配制 精密称取绿原酸、橙皮苷、3, 5-二-O-咖啡酰奎宁酸、4, 5-二-O-咖啡酰奎宁酸、缬草三酯、乙酰缬草三酯和1β-乙酰缬草三酯化学对照品, 配制浓度依次约为0、2、4、6、8和10 mg∙mL-1的系列对照品溶液。
色谱条件 Waters Sunfire C18 (250 mm × 4.6 mm, 5 μm)色谱柱, 极性流动相条件为乙腈(A) -0.1%甲酸/水(B), 梯度洗脱: 0~5 min, 2% A; 5~20 min, 2%~30% A; 20~30 min, 30%~70% A; 30~30.5 min, 70%~2% A; 30.5~35 min, 2% A。非极性流动相条件为乙腈-0.1%甲酸/水(85:15)。
方法学考察 精密称取绿原酸、3, 5-二-O-咖啡酰奎宁酸和4, 5-二-O-咖啡酰奎宁酸对照品10 mg, 置10 mL量瓶中, 加甲醇溶解并稀释至刻度, 摇匀。取该对照品溶液适量, 分别稀释成5.0、2.5、1.3、0.8、0.4、0.2和0.1 mg∙mL-1的对照品溶液, 分别进样10 μL。以对照品溶液进样量(μg)为横坐标(X), 峰面积积分值为纵坐标(Y), 计算回归方程:
Y = 2.31 × 106 X + 2.67 × 106, r2 = 0.998 6 (绿原酸)
Y = 4.13 × 106 X + 3.99× 105, r2 = 0.999 1 (3, 5-二-O-咖啡酰奎宁酸)
Y = 3.80 × 106 X + 1.61× 105, r2 = 0.999 1 (4, 5-二-O-咖啡酰奎宁酸)
质谱条件 采用电喷雾电离(ESI)离子源, 在负离子模式下采集数据, 经实验优化设定质谱参数如下: Capillary 4 000 V, Gas Flow 6 L·min-1, Nebulizer 15 psi (1 psi ≈ 6.9 kPa), Gas Temp 300 ℃, Fragmentor 135, 扫描范围m/z: 100~1 000。
结果 1 抗氧化活性测定对不同浓度甲醇提取的蜘蛛香提取物进行测定, 比较每份提取物的tEC50, 评估该提取物50%清除DPPH•自由基能力的强弱。在515 nm波长下, 记录700 s内波形图下降情况, 计算不同浓度甲醇提取物抗氧化能力, 如表 1所示。结果表明, 在25%~80%甲醇提取条件下, 蜘蛛香提取物均表现出较高的抗自由基能力, 其中25%甲醇提取物的抗自由基能力最强。在25%~50%条件下, 绿原酸、3, 5-二-O-咖啡酰奎宁酸和4, 5-二-O-咖啡酰奎宁酸含量较高。
| Table 1 Classification of antiradical efficiencies according to kinetic behavior. ARP: Antiradical power |
采用极性流动相系统进行分离。本文采用对照品比对、质谱分析及相关文献[2, 10], 对HPLC色谱中的主要色谱峰进行分析, 确认了5个主要成分, 分别是绿原酸、橙皮苷、咖啡酸、3, 5-二-O-咖啡酰奎宁酸和4, 5-二-O-咖啡酰奎宁酸。由图 1可见, 绿原酸、3, 5-二-O-咖啡酰奎宁酸和4, 5-二-O-咖啡酰奎宁酸3个色谱峰含量较高。未检出1, 3-O-二咖啡酰奎宁酸对应色谱峰。
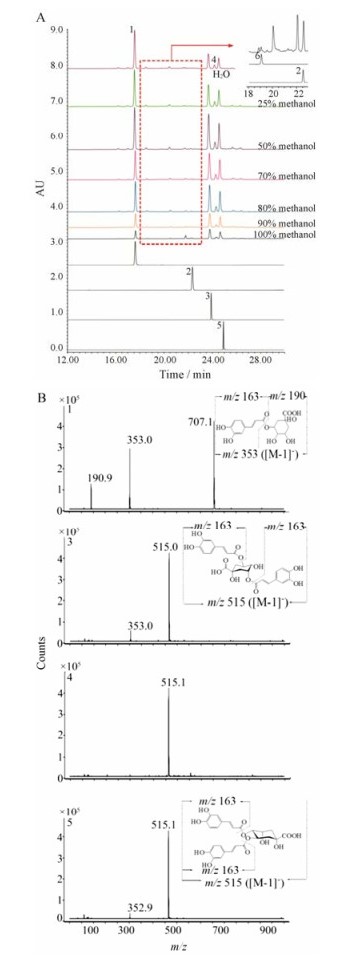
|
Figure 1 High performance liquid chromatography (HPLC) analysis of Vleriana jatamansi Jones in different methanol solu tion under polar condition. A: HPLC chromatogram; B: Two stage mass spectrometry (MS/MS) spectrum (1: Chlorogenic acid; 2: Hesperidin; 3: 3, 5-O-Dicaffeoylquinic acid; 4: Unknown; 5: 4, 5-O-Dicaffeoylquinic acid; 6: Caffeic acid) |
样品在110~0.1 μg内线性关系良好。检出限(LOD)均小于10.0 ng∙mL-1, 定量限(LOQ)均小于30.0 ng∙mL-1。理论塔板数均大于1×104, 实验准确性和重复性良好。溶液稳定性实验:对照品溶液在4 ℃下避光放置, 分别于0、4、8、12、16、20和24 h进样测定, 记录色谱图, 以峰面积计算含量的RSD在[1.21%, 1.81%]内, 表明对照品溶液在4 ℃下避光放置24 h基本稳定; 加样回收率在[85.1%, 102.3%]内。在不同浓度甲醇提取物中, 每克蜘蛛香样品中3种主要成分的含量见表 1。
2.1.2 橙皮苷和咖啡酸定性分析由于橙皮苷和咖啡酸含量较少, 进行了定性分析, 橙皮苷LOD为9.2 ng∙mL-1, LOQ为27.6 ng∙mL-1。咖啡酸LOD为2.6 ng∙mL-1, LOQ为7.8 ng∙mL-1。在不同浓度提取液中, 100%甲醇提取液咖啡酸含量较高, 但也仅略高于LOD为14.2 ng∙mL-1。
2.2 非极性化合物分析采用非极性流动相对非极性化合物进行分离, 所得主要色谱峰UV最大吸收均为254 nm, 与环烯醚萜酯类成分最大吸收峰值基本一致。在50%~100%甲醇溶液的提取条件下, 检出环烯醚萜类成分, 经对照品比对、质谱分析确认为缬草三酯、乙酰缬草三酯和1β-乙酰缬草三酯, 含量较极性化合物低。缬草三酯、乙酰缬草三酯和1β-乙酰缬草三酯的LOD和LOQ值在0.1~0.5 μg∙mL-1之间。精密度实验测定结果RSD为1.70%~2.2%, 回收率在95.0%~102.4%之间, 线性分别为r2 = 0.999 0, r2 = 0.998 1和r2 = 0.999 3。
3 蜘蛛香药材中主要成分DPPH•自由基清除能力分析 3.1 绿原酸等DPPH•自由基清除能力测定将不同浓度的绿原酸对照品按“DPPH•自由基清除能力测定”方法进行测定, 计算tEC50值和抗氧化能力(ARP), 结果见表 2, 表明绿原酸浓度越高抗氧化能力越强。以对照品溶液进样量的-ln值为横坐标(X), tEC50值为纵坐标(Y), 计算回归方程: Y = 15.823e0.9767x, r2; = 0.979 1。以BHT为阳性对照, 可见在相同浓度下, 绿原酸的DPPH•自由基清除能力优于阳性对照BHT。3, 5-二-O-咖啡酰奎宁酸和4, 5-二-O-咖啡酰奎宁酸DPPH•自由基清除能力见图 2。
| Table 2 Analysis of antiradical efficiencies of chlorogenic acid. BHT: Butylated hydroxytoluene |

|
Figure 2 Analysis of the six observed compounds of reaction kinetics |
将橙皮苷12.50 mg用甲醇溶解于50 mL量瓶中配制为对照品溶液。按“DPPH•自由基清除能力测定”方法进行测定。结果见图 2, 橙皮苷清除DPPH•自由基能力为EC~80% (t = 900 s)。
3.3 环烯醚萜类化合物DPPH•自由基清除能力测定对乙酰缬草三酯和1β-乙酰缬草三酯进行DPPH•自由基清除能力实验, 结果表明该类成分DPPH•自由基清除能力为EC~80% (t = 900 s), 如图 2所示。
讨论本文采用极性流动相和非极性流动相HPLC分离方法对蜘蛛香药材提取物的主要成分进行分析, 结果发现:在极性流动相HPLC分离条件下, 绿原酸、3, 5-二-O-咖啡酰奎宁酸和4, 5-二-O-咖啡酰奎宁酸为3种主要活性成分, 其结构均含有咖啡酰基, 其中邻羟基苯酚结构是主要的供H基团, 可与DPPH•自由基结合, 表现出较强的DPPH•自由基清除能力。
另据文献[11]报道, 蜘蛛香药材中含有芹菜素、异槲皮苷和槲皮素等成分, 但在本文HPLC条件下未检测到相应成分。在非极性流动相HPLC分离条件下, 环烯醚萜酯类化合物是主要成分。环烯醚萜类化合物是蜘蛛香的特征性成分, 也是主要活性成分, 在体内清除氧自由基能力较强, 有明显抑制肿瘤细胞生长的效果。环烯醚萜酯中的三元氧环是其在体内发挥生物学作用的重要结构基团[12]。本文认为, 环烯醚萜酯的抗氧化作用较绿原酸类化合物反应缓和, 在体内作用中, 三元氧环通过开环产生供H基团, 表现出一定的抗氧化能力。其作用机制与药物氯吡格雷和普拉格雷的作用机制较为相似, 通过将氯吡格雷活泼的甲基转化为三元环结构的普拉格雷, 从而有效地提升原研药物的药效[13]。
| [1] | Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. Part 1. Beijing: China Medical Science Press, 2015: 368. |
| [2] | Shi JL. Study on the Medicinal Plant Resources of Valeriana in China (国产缬草属药用植物资源的研究)[D]. Beijing: Beijing University of Chinese Medicine, 2004. |
| [3] | Tamura S, Shimizu N, Fujiwara K, et al. Bioisostere of valtrate, anti-HIV principle by inhibition for nuclear export of Rev[J]. Bioorg Med Chem Lett, 2010, 20: 2159–2162. DOI:10.1016/j.bmcl.2010.02.038 |
| [4] | Fernández S, Wasowski C, Paladini AC, et al. Sedative and sleep-enhancing properties of linarin, a flavonoid-isolated from Valeriana officinalis[J]. Pharmacol Biochem Behav, 2004, 77: 399–404. DOI:10.1016/j.pbb.2003.12.003 |
| [5] | Mclntire SL, Jorgensen E, Kaplan J, et al. The GABAergic nervous system of Caenorhabditis elegans[J]. Nature, 1993, 364: 337–341. DOI:10.1038/364337a0 |
| [6] | Kakehashi A, Kato A, Ishii N, et al. Valerian inhibits rat hepatocarcinogenesis by activating GABA(A) receptor-mediated signaling[J]. PLoS One, 2014, 9. |
| [7] | Young SZ, Bordey A. GABA's control of stem and cancer cell proliferation in adult neural and peripheral niches[J]. Physiology, 2009, 24: 171–185. DOI:10.1152/physiol.00002.2009 |
| [8] | Brandwilliams W, Cuvelier ME, Berset C. Use of a free radical method to evaluate antioxidant activity[J]. Lebenson Wiss Technol, 1995, 28: 25–30. DOI:10.1016/S0023-6438(95)80008-5 |
| [9] | Whittaker A, Vazzana C, Vecchio V, et al. Evaluation of direct and indirect effects of flavonoids, mineral elements and dry weight on antiradical scavenging activity in leaf material of field-grown Trifolium pratense cultivars using path analysis[J]. Field Crops Res, 2009, 113: 1–11. DOI:10.1016/j.fcr.2009.04.001 |
| [10] | Fu L, Chu QC, Huang BK, et al. Determination of polyphe nolic constituents in Valerianajatamansi Jones by capillary electrophoresis with electrochemical detection[J]. Chin J Anal Chem (分析化学), 2005, 33: 161–164. |
| [11] | Okon IS, Zou MH. Mitochondrial ROS and cancer drug resistance:implications for therapy[J]. Pharmacol Res, 2015, 100: 170–174. DOI:10.1016/j.phrs.2015.06.013 |
| [12] | Lin S, Fu P, Chen T, et al. Minor valepotriates from Valeriana jatamansi and their cytotoxicity against metastatic prostate cancer cells[J]. Planta Med, 2015, 81: 56–61. |
| [13] | Serebruany V. Prasugrel versus clopidogrel[J]. New Engl J Med, 2008, 358: 1299–1301. |
 2018, Vol. 53
2018, Vol. 53


