抑郁症是以心境低落为主要临床特征的一类心境障碍[1]。西方学者预测, 2030年, 抑郁症的疾病负担将位列首位[2]。我国抑郁症发病率呈逐年上升势态, 给家庭和社会带来了沉重的心理和经济负担[3]。目前, 抗抑郁化药主要有单胺氧化酶抑制剂和三环类抗抑郁药, 然而作用单一, 不良反应大, 对少数患者有效[4], 传统中药在延缓抑郁症进程、减轻不良反应、保护神经细胞等方面取得了较大进展[5], 受到了越来越多学者的关注。
交泰丸出自明代《韩氏医通》, 由黄连、肉桂两味药物以10:1组成[6], 具有交通心肾、镇静安神的功效[7]。目前, 已有多篇文献[8-11]报道, 交泰丸具有一定的抗抑郁作用。交泰丸中君药为黄连, 黄连中主要成分为以小檗碱为主的生物碱, 抗抑郁作用效果明显[12]。目前常见的是交泰丸中生物碱在健康大鼠体内的药代动力学[13, 14], 在抑郁大鼠体内药代动力学变化尚未见报道。慢性不可预见性温和应激(chronic unpredictable mild stress, CUMS)抑郁模型是较为理想的抑郁动物模型, 模拟了慢性不可预见性刺激诱发抑郁的过程及生理生化改变[15], 本文采用CUMS模型, 通过对正常大鼠及CUMS抑郁模型大鼠灌胃给予交泰丸后的血浆中各种生物碱含量检测, 绘制药时曲线, 揭示其在正常和抑郁大鼠体内的药动学差异, 以期能为临床合理用药提供依据。
材料与方法仪器 Waters Quattro Micro液质联用仪(美国Waters公司), Masslynx 4.0色谱工作站; CPA225D型电子天平(德国Sartorius公司); Legend Micro 17R型冷冻离心机(美国Thermo公司); Drict-Q5超纯水机(美国Millipore公司); Labconco离心浓缩仪(美国Labconco公司)。
药品与试剂 黄连购自于安徽万生中药饮片有限公司, 肉桂药材购自于安徽省六山市国泰饮片有限公司, 由江苏省中医院临床药理科居文政教授鉴定为毛茛科植物黄连的干燥根茎和樟科植物肉桂的干燥树皮。对照品:盐酸小檗碱(批号: 16031814)、盐酸药根碱(批号: 15092116)、表小檗碱(批号: 16070805)、盐酸黄连碱(批号: 16061705)、盐酸巴马汀(批号: 16022614)、延胡索乙素(批号: 16030905)均购自于成都曼斯特生物科技有限公司, 盐酸巴马汀纯度≥94%, 其余纯度均≥98%。超纯水由Millipore超纯水系统制备; 甲醇、乙腈(色谱纯)购自德国Merck公司。
动物 雄性SD大鼠, 20只, 体重(175 ± 10) g, 由南通大学动物实验中心提供, 许可证号: SCXK (苏) 2014-0001。实验前适应性饲养一周, 保持12 h昼夜节律, 室温22 ± 2 ℃, 自由摄食饮水。
交泰丸的制备 取交泰丸原方20倍量的饮片(黄连300 g, 肉桂30 g)倒入5 L圆底烧瓶中, 加入10倍量的纯水浸泡2 h后双提法回流2 h, 粗滤, 挥发油4 ℃保存, 剩余药渣再加入8倍量的纯水继续双提法回流2 h, 粗滤, 合并挥发油, 剩余药渣加入6倍量的纯水继续双提法回流1 h, 过滤, 合并挥发油。合并滤液, 将药物浓缩约为495 mL, 加入挥发油, 用超纯水调节体积至500 mL (浓度为0.66 g·mL-1)。
交泰丸中5种生物碱的含量测定方法 色谱质谱条件: Agilent Zorbax SB-C18 (150 mm× 2.1 mm, 5 μm), 流动相为乙腈-水(含0.1%甲酸) = 45:55;流速: 0.2 mL·min-1; 柱温: 30 ℃; 进样量: 5 μL。内标为延胡索乙素。离子化模式:正离子; 定量模式:多反应监测模式(MRM); 毛细管电压: 3 500 V; 干燥气温度: 350 ℃。具体测定条件见表 1。
| Table 1 MRM parameters of five analytes and internal standard (IS) |
造模与给药 将20只大鼠随机分为空白对照组和模型组, 对照组4只/笼饲养, 模型组单笼饲养, 正常饮食, 饮水。适应7天后, 开始实验。采用Katz法造模, 使模型组在21天内接受以下10种刺激因子: ①潮湿垫料、②禁食24 h、③禁水24 h、④热刺激(5 min)、⑤束缚应激2 h、⑥夹尾(5 min)、⑦ 4 ℃冰水游泳(5 min)、⑧触摸陌生异常物品、⑨昼夜颠倒24 h、⑩水平振荡(10 min), 持续3周, 确认造模成功后, 第22天, 禁食不禁水12 h, 灌胃给予交泰丸3 g·kg-1。于给药前及给药后0.083、0.167、0.333、0.667、1、1.5、2、3、5、8、12和24 h眼眶取血约0.3 mL于肝素化试管中, 4 000 r·min-1离心10 min, 取上层血浆于-20 ℃保存待测。
体重变化 两组大鼠于造模前及造模21天后进行体重称量。
旷场实验 造模21天后, 将大鼠放入高40 cm, 长宽均为50 cm, 内壁涂黑, 底而平均分为25个10 cm × 10 cm的小方格的箱内底面中心, 同时进行摄像和计时, 以5 min内大鼠穿越箱底面的方格数为水平得分(三爪以上跨入), 穿越一格得1分; 以双前肢抬起次数为垂直得分(两前肢离地1 cm以上), 双前肢离地一次得1分。
糖水偏爱实验 造模21天后, d1:给予每只大鼠两瓶1%蔗糖水, 每瓶各200 mL; d2:给予每只大鼠一瓶装有1%蔗糖水, 另一瓶纯净水, 每瓶各200 mL; d3:所有大鼠均禁食禁水; d4:给予每只大鼠两瓶定量的水(一瓶1%蔗糖水, 一瓶纯净水), 1 h后交换两瓶位置, 计算大鼠在2 h内的糖水消耗量, 糖水偏好(%) =糖水消耗量/(糖水消耗量+纯净水消耗量)×100。
血浆中5-羟色胺(5-HT)、去甲肾上腺素(NE)的含量测定 按文献[15]方法, 测定给药前所取血浆中5-HT、NE的含量。
溶液的配制 精密称取盐酸巴马汀、盐酸黄连碱、表小檗碱、盐酸药根碱、盐酸小檗碱对照品适量, 分别溶于10 mL量瓶中, 加含0.1%盐酸的甲醇定容, 摇匀, 得各对照品储备液浓度分别为1.17、1.18、1.1、0.97和1.48 mg·mL-1。精密吸取各储备液适量, 加甲醇逐级稀释成8个不同浓度的混合标准品储备液HB1-8, 浓度见表 2。精密称取延胡索乙素适量, 配制成浓度为1.1 mg·mL-1内标储备液, 精密吸取储备液适量, 配制成21 ng·mL-1的内标溶液。各储备液均置于4 ℃冰箱中保存。
| Table 2 Concentration of five analytes in mixed standard solutions (ng·mL-1) |
色谱质谱条件 同“交泰丸中5种生物碱的含量测定方法”色谱质谱条件, 进样量为10 μL。
血浆样品处理 精密吸取血浆样品50 μL, 加入内标溶液10 μL, 涡旋15 s, 加入乙腈100 μL, 涡旋15 s, 振荡3 min, 12 000 r·min-1离心10 min, 取上清液40 ℃ N2吹干, 流动相50 μL复溶, 振荡3 min, 12 000 r·min-1离心10 min, 取上清液10 μL进样分析。
色谱行为 在本色谱条件下, 分别对大鼠空白血浆、空白血浆+混合对照品溶液及内标溶液、血浆样品适量, 按“血浆样品处理”方法处理, 进样测定。
线性关系及LLOQ 取空白血浆50 μL, 加入配制好的混合对照品系列溶液10 μL, 内标溶液10 μL, 按“血浆样品处理”方法处理, 分别计算各化合物的峰面积(Ai)与相应内标的峰面积(As)的比值为Y, 以比值Y对各成分的浓度X进行线性回归, 得回归方程。
精密度和准确度 以大鼠空白血浆配制高、中、低3个质量浓度的质控样品(n = 5), 按“血浆样品处理”项下方法操作。连续测定3天。根据随行标准曲线计算实测浓度, 考察准确度和精密度。
基质效应 分别精密吸取低、中、高的混合对照品10 μL, 加入内标溶液10 μL, 复溶液30 μL, 涡旋3 min, 于12 000 r·min-1离心5 min, 取上清液进样分析, 记录峰面积(A1)。除不加内标外, 另按“血浆样品处理”项操作提取空白血浆数管, 挥干溶剂后同上操作, 记录峰面积(A2)。基质效应(%)为A2和A1的比值(A2/A1)。
提取回收率 按“血浆样品处理”项配制并测定低、中、高3个质量浓度的血浆质控样品, 每个浓度平行3份, 记录各分析物峰面积(A3), 提取回收率(%)为A3和A2的比值(A3/A2)。
稳定性 考察了含药血浆在不同保存条件下的稳定性。血浆样品在室温保存12 h、-20 ℃冷冻保存30天、反复冻融3次, 以及血浆样品经预处理后在10 ℃进样器放置24 h。
统计分析 药动学参数采用DAS1.0软件计算, 采用SPSS19.0进行独立样本t检验比较正常组与模型组药动学参数的差异, 统计结果均用(x±s)表示, P < 0.05表示差异具有统计学意义。
结果 1 交泰丸中5种生物碱的含量用于灌胃的交泰丸混悬液中含有巴马汀、黄连碱、表小檗碱、小檗碱、药根碱含量分别为5.66 ± 0.18、7.43 ± 0.14、5.27 ± 0.16、28.3 ± 0.78和3.33 ± 0.12 mg·mL-1。巴马汀、黄连碱、表小檗碱、小檗碱和药根碱的回归方程分别为Y = 0.016 3 X + 0.004 7、Y = 0.005 6 X + 0.001 8、Y = 0.019 4 X + 0.003 3、Y = 0.013 2 X + 0.027、Y = 0.011 5 X + 0.002 8; R2均大于0.999, 线性范围分别为3.66~234、3.66~234、1.95~125、19.53~1 250和1.47~94 ng·mL-1; 精密度RSD值均小于3.97%;准确度均在99.78%~105.57%之间, RSD值均小于4.12%;重复性RSD值均小于3.64%;加样回收率在85.95%~94.32%之间, RSD值均小于3.49%; 8 h内稳定性RSD值均小于3.25%, 均符合含量测定方法学的要求。
2 造模确认经过21天造模, 与空白组相比, 模型组体重极显著偏低(P < 0.01);行为学测试结果显示, 与正常组相比, 模型组大鼠旷场实验的水平得分、垂直得分均极显著偏低(P < 0.01)、糖水偏好百分比极显著偏低(P < 0.01), 行为学显示造模成功。与空白组相比, 模型组中5-HT含量极显著偏低, NE含量极显著增高, 表明单胺类神经递质发生紊乱, 显示造模成功。结果见表 3。
| Table 3 The results of behavioral test. n = 10, x± s. *P < 0.05, **P < 0.01 vs control group |
表小檗碱、盐酸药根碱、盐酸黄连碱、盐酸巴马汀、盐酸小檗碱和内标延胡索乙素的保留时间分别为2.98、2.92、3.11、3.54、3.79和2.92 min, 5种待测物与内标分离良好, 互不干扰, 且血浆中内源性杂质不影响分析物的测定, 基线平稳。见图 1。其中小檗碱与表小檗碱为同分异构体, 共用一个离子对, 在色谱上分离度良好, 表明该方法专属性强。

|
Figure 1 Representation MRM chromatograms of five alkaloids and internal standard. A: Blank plasma; B: Plasma samples; C: Plasma added with reference standards. Ⅰ: Coptisine; Ⅱ: Jatrorrhizine; Ⅲ: Palmatine; Ⅳ: Epiberberine; Ⅴ: Berberine; Ⅵ: Tetrahydropalmatine |
5种生物碱的回归方程及LLOQ见表 4。
| Table 4 Standard curves and LLOQ of 5 kinds of analytes |
结果见表 5, 结果均符合生物样品检测要求。
| Table 5 Accuracy, precision and matrix effect of 5 kinds of analytes |
结果见表 5, 结果均符合生物样品检测要求。
3.5 提取回收率巴马汀、黄连碱、表小檗碱、小檗碱、药根碱的提取回收率分别为78.53%~110.00%、72.09%~81.62%、81.98%~94.43%、79.52%~102.22%、77.3%~97.55%。
3.6 稳定性血浆样品在室温保存12 h、-20 ℃冷冻保存30天、反复冻融3次, 以及血浆样品经预处理后在10 ℃进样器放置24 h均稳定, RSD均小于10%。
4 生物碱的药代动力学 4.1 药时曲线巴马汀、黄连碱、表小檗碱、小檗碱、药根碱5种生物碱在正常大鼠和抑郁大鼠体内的药时曲线见图 2。
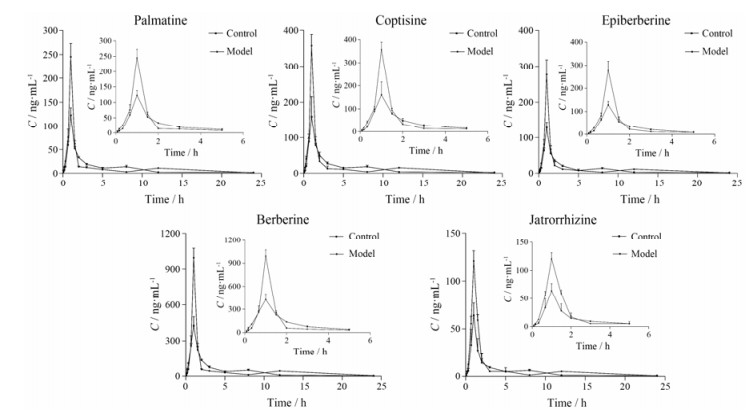
|
Figure 2 Mean plasma concentration-time curves of 5 alkaloids in rats with an oral administration of Jiaotai pill. n = 10, x± s |
将正常组和模型组的大鼠药时曲线分别经DAS1.0处理, 分别按一室、二室、三室模型以最小二乘法拟合, 结果表明:巴马汀、黄连碱、表小檗碱、小檗碱、药根碱5种生物碱均符合一室模型(W = 1/CC), 药动学参数见表 6。与正常组相比, 模型组的主要药动学差异如下: 5种生物碱的Cmax、AUC0-t均极显著增加, 巴马汀、黄连碱、小檗碱、药根碱AUC0-∞极显著增加。
| Table 6 Main pharmacokinetic parameters of 5 kinds of analytes in rats. n = 10, x± s. *P < 0.05, **P < 0.01 vs control group |
本实验建立了大鼠血浆样品中5种生物碱含量测定的方法, 考察了用乙腈、甲醇、三氯乙酸蛋白沉淀, 乙酸乙酯、氯仿萃取等方法, 最终确立了用乙腈蛋白沉淀的前处理方法。由于这几种生物碱中存在同分异构体, 共用一个离子通道, 需要在液相上将其分开。流动相考察了乙腈和甲醇作为有机相, 用乙腈做有机相, 峰形和出峰时间均优于甲醇, 故选择乙腈, 水相考察了0.1%甲酸、0.05%甲酸、0.1%甲酸(含2 mmol·L-1乙酸铵), 0.1%甲酸为水相, 信号最优, 且峰形良好, 同分异构体分离良好。巴马汀、黄连碱、表小檗碱、小檗碱、药根碱这5种生物碱在同一大鼠体内药时曲线趋势几乎一致, 主要由于这5种生物碱结构相似, 均为异喹啉类生物碱[16], 在同一生物体中具有相似的代谢过程。
本实验采用10种不同的刺激, 对大鼠进行为期21天的造模, 行为学结果以及单胺类递质均显示造模成功。首次研究了交泰丸中5种生物碱在抑郁状态下的药代动力学, 并比较了正常和抑郁模型大鼠体内的药动学差异, 与正常组相比, 交泰丸中黄连碱、表小檗碱、小檗碱、药根碱在抑郁大鼠体内的t1/2无显著性差异, 巴马汀t1/2显著高于正常组, 且该5种生物碱的t1/2均有提高的趋势; 5种生物碱的tmax无显著性差异。交泰丸中巴马汀、黄连碱、表小檗碱、小檗碱、药根碱在抑郁大鼠体内峰浓度分别为正常大鼠的1.99、2.14、2.15、2.3、1.82倍, AUC0-t分别为1.23、1.25、1.29、1.29、1.46倍, AUC0-∞分别为1.21、1.25、1.24、1.30、1.43倍, 除表小檗碱AUC0-∞无显著性差异外, 其他均有显著性差异, 表明交泰丸中这5种生物碱在抑郁大鼠体内有较好的吸收, 生物利用度高于正常组。
抑郁状态的大鼠具有单胺类神经递质紊乱、下丘脑-垂体-肾上腺(HPA)轴功能低下、炎症因子增加等病理状态, 可能导致体内一些酶活性的改变, 臧雨馨等[17]发现不可预见温和性刺激造成的抑郁状态大鼠体内CYP450酶活性发生变化, 这很有可能是交泰丸中5种生物碱成分在正常组和抑郁组大鼠体内药时曲线不同的原因。Brzozowska等[18]发现P-糖蛋白(P-gp)表达的缺失可能导致抑郁症, 而小檗碱等生物碱是P-gp的底物[19], 抑郁状态下P-gp的下调会导致生物碱血浆暴露量增加。此外, Zhu等[20]发现抑郁状态大鼠肠道菌群会发生改变, 而生物碱在体内的吸收代谢与肠道菌群关系密切[21], 这也可能导致生物碱血药浓度在抑郁大鼠体内的变化。抑郁症机制复杂多变, 交泰丸中以小檗碱为代表的5种生物碱在抑郁状态下血浆暴露量发生显著性变化, 可能是以上一种或是多种因素共同导致, 具体机制有待深入研究。值得注意的是, 抑郁症可能导致药物血药浓度在体内的变化, 提示临床上对抑郁症病人用药剂量应适当调整。
| [1] | Shi B, Tian J, Xiang H, et al. A 1H NMR plasma metabonomic study of acute and chronic stress models of depression in rats[J]. Behav Brain Res, 2013, 241: 86–91. DOI:10.1016/j.bbr.2012.11.036 |
| [2] | Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013:a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2014, 384: 766–781. DOI:10.1016/S0140-6736(14)60460-8 |
| [3] | Wang XD, Qiao MQ, Zhang ZJ, et al. The research progress in TCM treatment of major depression[J]. J Nanjing Uuiv Tradit Chin Med (南京中医药大学学报), 2016, 32: 93–96. |
| [4] | Wilson E, Lader M. A review of the management of antidepressant discontinuation symptoms[J]. Ther Adv Psychopharmacol, 2015, 5: 357–368. DOI:10.1177/2045125315612334 |
| [5] | Wang R, Liu JC, Luo CJ, et al. Research progress of traditional Chinese medicine monomer on anti-depression[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2016, 34: 1669–1672. |
| [6] | Zhang JY, Zhang B, Duan CC, et al. Theoretical basis and application of treating diabetes with Jiaotai pill[J]. World Chin Med (世界中医药), 2016, 11: 554–557. |
| [7] | Zhao L, Jiang SJ, Lu FE, et al. Effects of berberine and cinnamic acid on palmitic acid-induced intracellular triglyceride accumulation in NIT-1 pancreatic β-cells[J]. Chin J Integr Med, 2016, 22: 496–502. DOI:10.1007/s11655-014-1986-0 |
| [8] | Wu K, Shi JZ, Qu LS, et al. Pharmacological study on the antidepressant effect of Jiaotai pills[J]. J Guiyang Coll Tradit Chin Med (贵阳中医学院学报), 2009, 31: 29–31. |
| [9] | Yang S, Pan Y, Song YQ, et al. Effects of Jiaotai Pill on behavior and monoamine neurotransmitters of depression rat model[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 4218–4223. |
| [10] | Yu CQ, Wang Y, Gao S, et al. Study on the antidepressant effect of Jiaotai pill with different proportions[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2012, 18: 225–228. |
| [11] | Zhe Q, Sulei W, Weiwei T, et al. Effects of Jiaotaiwan on depressive-like behavior in mice after lipopolysaccharide administration[J]. Metab Brain Dis, 2017, 32: 415–426. DOI:10.1007/s11011-016-9925-8 |
| [12] | Shen JD, Ma LG, Hu CY, et al. Berberine up-regulates the BDNF expression in hippocampus and attenuates corticosterone-induced depressive-like behavior in mice[J]. Neurosci Lett, 2016, 614: 77–82. DOI:10.1016/j.neulet.2016.01.002 |
| [13] | Huang ZY. The Pharmacokinetic and Metabonomics Studies of Jiao-Tai-Pill in the Treatment of Type 2 Diabetes Mellitus (交泰丸的药代动力学及其治疗2型糖尿病的代谢组学研究)[D]. Wuhan: Huazhong University of Science and Technology, 2011. |
| [14] | Bai N, Li JY, Chen YD, et al. Effects of Cinnamomi Cortex on pharmacokinetics of berberine in Coptidis Rhizoma based on Jiaotai Pill[J]. Chin Tradit Pat Med (中成药), 2012, 34: 442–445. |
| [15] | Isingrini E, Belzung C, Freslon JL, et al. Fluoxetine effect on aortic nitric oxide-dependent vasorelaxation in the unpredictable chronic mild stress model of depression in mice[J]. Psychosom Med, 2012, 74: 63–72. DOI:10.1097/PSY.0b013e31823a43e0 |
| [16] | Wang L, Ye XL, Li XG, et al. Metabolism, transformation and distribution of Coptis chinensis total alkaloids in rat[J]. China J Chin Mater Med (中国中药杂志), 2010, 35: 2017–2020. |
| [17] | Zang YX, Sun BT, Zhao WZ, et al. Study of change in activity of hepatic drug metabolism enzymes in rat model of chronic unpredictable mild stress[J]. Acta Pharm Sin (药学学报), 2015, 50: 319–325. |
| [18] | Brzozowska NI, Smith KL, Zhou C, et al. Genetic deletion of P-glycoprotein alters stress responsivity and increases depression-like behavior, social withdrawal and microglial activation in the hippocampus of female mice[J]. Brain Behav Immun, 2017, 65: 251–261. DOI:10.1016/j.bbi.2017.05.008 |
| [19] | Zhang Y, Cui YL, Gao LN, et al. Effects of β-cyclodextrin on the intestinal absorption of berberine hydrochloride, a P-glycoprotein substrate[J]. Int J Biol Macromol, 2013, 59: 363–371. DOI:10.1016/j.ijbiomac.2013.04.074 |
| [20] | Zhu X, Sun Y, Zhang C, et al. Effects of berberine on a rat model of chronic stress and depression via gastrointestinal tract pathology and gastrointestinal flora profile assays[J]. Mol Med Rep, 2017, 15: 3161–3171. DOI:10.3892/mmr.2017.6353 |
| [21] | Chen F, Wen Q, Jiang J, et al. Could the gut microbiota reconcile the oral bioavailability conundrum of traditional herbs[J]. J Ethnopharmacol, 2016, 179: 253–264. DOI:10.1016/j.jep.2015.12.031 |
 2018, Vol. 53
2018, Vol. 53


