肿瘤组织并非由单一的、孤立存在的肿瘤细胞组成, 而是包括肿瘤细胞和血管内皮细胞的多细胞系统, 且每种细胞又与肿瘤微环境之间存在复杂的相互作用关系[1]。实体瘤的生长取决于肿瘤细胞和肿瘤血管内皮细胞的相互作用, 血管新生(angiogenesis)是肿瘤生长和转移的重要病理基础和条件, 而肿瘤的生长又刺激血管内皮细胞的增殖[2]。目前对肿瘤体外研究所采用的常规单层肿瘤细胞培养的方法与肿瘤的体内生存环境存在较大差距, 造成了对肿瘤研究的体内外实验结果存在较大差异, 限制了新型药物靶向递送系统的进一步临床应用。因此, 如果能够建立一个可以模拟肿瘤体内生长微环境的培养体系, 实现肿瘤细胞与内皮细胞的共同培养与相互作用, 从而在体外构建与体内组织结构、功能性状相近的血管化的肿瘤组织, 将有利于在体外更好地实现对肿瘤组织的研究, 进而加速新型药物靶向递送系统的临床应用速度。
体外构建两种或多种细胞的共培养体系, 常采用两种细胞的直接接触混合共培养[3]、海藻酸钠凝胶法[4]和Transwell间接接触法[5]等。其中, 直接接触共培养的方法操作简单、成本较低, 但无法调节两种细胞分泌的细胞因子, 使得其可以持续有效地作用于相应的细胞, 不利于对体内肿瘤微环境的模拟。海藻酸钠凝胶法采用生物材料和组织工程的方法, 实现对肿瘤细胞和血管内皮细胞的同时包载。该方法虽然可以在3D水平上实现两者的共培养, 但往往对所使用的生物材料要求较高, 而且水凝胶在交联过程中所使用到的交联剂对细胞有害, 生物材料本身也会对细胞的共培养造成一定的影响。此外, 复杂的操作也不利于体外研究。利用Transwell间接接触共培养的方法, 既可以利用Transwell板的上/下室将内皮细胞和肿瘤细胞隔开培养, 又可以利用Transwell培养板中半透膜实现两种细胞所分泌细胞因子的持续有效的相互作用, 可以很好地模拟体内肿瘤细胞和血管内皮细胞的相互作用关系。
乳腺癌是全世界女性最常见的恶性肿瘤, 是引起世界女性死亡的重要病因, 且近年来发病率逐年上升并呈现年轻化[6]。现有研究表明[7], 约25%~30%乳腺癌患者在10~15年后会发生远处转移, 而导致原发性乳腺癌复发、转移的重要因素之一就是肿瘤新生血管的生成。对乳腺癌细胞与血管内皮细胞进行体外共培养, 可以考察两种细胞的细胞外基质中旁分泌、自分泌以及双向分泌可溶性生物因子介导的生物信号通路对彼此发生发展的影响, 有助于更真实地模拟乳腺癌的体内微环境, 可为下一步针对乳腺癌的体内靶向递送释药系统的研究提供更真实的体外细胞模型。本研究将以乳腺癌细胞(human breast adenocarcinoma cells, MCF-7)为模型, 人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)模拟肿瘤血管内皮细胞, 采用Transwell间接接触法构建MCF-7细胞与HUVECs细胞的体外双层共培养系统。将分别对共培养的两种细胞的细胞活性、形态、电阻、周期和血管内皮细胞因子(vascular endothelial growth factor, VEGF)含量等进行全面考察与表征。
材料与方法材料与试剂 DMEM, 胎牛血清(fetal bovine serum, FBS) (美国Gibico公司); 磷酸盐缓冲液(phosphate buffer solution, PBS, Hyclone公司); 无水乙醇(国药集团化学试剂有限公司); CCK-8 [cell counting kit-8, 东仁化学科技(上海)有限公司]; 二甲基亚砜(Sigma公司); 戊二醛固定液(2.5%, 电镜专用; 北京雷根生物技术有限公司); 4%多聚甲醛(Beijing Solarbio Science & Technology Co., Ltd.); 细胞核染色液DAPI、细胞周期与细胞凋亡检测试剂盒(碧云天生物技术有限公司); human VEGF immunoassay kit (human VEGF-A ELISA for lysates, RayBiotech公司)。
主要仪器 CO2细胞培养箱(1501), 全自动酶标仪(MULTISKANFC) (Thermo公司); 细胞计数仪(30 L, 生命科学); 低温离心机(3K15, Sigma公司); 流式细胞仪(ACCUR C6, 美国BD公司); 倒置荧光显微镜(IX2-FLA-1)、激光共聚焦显微镜(FV1000) (奥林巴斯公司); 透射电镜(TEM-1400HC-HC, 日本JEOL公司); Transwell细胞培养板(美国Corning公司)。
细胞模型 购自北京协和细胞资源共享平台的HUVECs和冻存于中国医学科学院药物研究所药物制剂室的MCF-7细胞经复苏后均培养于含10% FBS的DMEM培养液中, 在37 ℃、5% CO2培养箱中孵育, 每1~2天更换一次培养液。
MCF-7和HUVECs细胞体外双层共培养模型的建立 分别在Transwell的上、下室种入1×105个HUVECs细胞和MCF-7细胞, 上、下室分别加入2 mL/0.5 mL (6孔板/24孔板)和3 mL/1 mL (6孔板/24孔板)含有FBS的DMEM细胞培养液, 于5% CO2、37 ℃细胞培养箱中培养过夜。次日将接种了HUVECs细胞的Transwell上室转移到接种了MCF-7细胞的下室中, 利用Transwell将MCF-7细胞和HUVECs细胞置于同一培养体系中, 构建肿瘤细胞与肿瘤血管内皮细胞共生长模型。为了进行对比, 分别在Transwell板上/下室以同样的细胞数接种HUVECs和MCF-7细胞并以同样的条件进行单独培养, 培养周期为5~7天。本实验中, 除细胞活性测定采用24孔Transwell培养板进行双层细胞培养外, 其余的检测表征如TEM分析细胞形态、激光共聚焦显微镜观察细胞形态、细胞电阻的测定、细胞周期和VEGF蛋白的测定均采用6孔Transwell培养板进行培养。
细胞活性测定 分别将MCF-7细胞、HUVECs细胞以及两者共培养的双层细胞按照以上步骤种植于24孔细胞培养板、24孔Transwell细胞培养板上室和24孔Transwell细胞培养板下/上室进行培养。分别于第1、3、5和7天测定不同细胞的活性:在规定时间点, 分别用冷PBS洗HUVECs和MCF-7细胞2遍, 向种植HUVECs的上室加入CCK-850 μL, 种植MCF-7细胞的下室中加入CCK-8 100 μL, 轻晃使其混合均匀。于CO2细胞培养箱中培养3 h后转移至96孔板, 使用全自动酶标仪进行细胞活性检测。
TEM分析细胞形态 分别将MCF-7细胞、HUVECs细胞以及双层细胞按照以上步骤种植于6孔细胞培养板、6孔Transwell培养板上室和6孔Transwell培养板下/上室进行培养。于第5天停止培养, 分别用冷PBS清洗2遍, 胰酶消化细胞并用细胞培养液2 mL终止消化, 吹打均匀并收集。于1 000 r·min-1离心5 min, 弃上清, 用PBS 10 mL清洗并再次离心弃上清。收集离心管底部的细胞团块, 在保证细胞团块不被吹散的情况下, 缓慢向离心管中加入2.5%戊二醛, 置4 ℃冰箱保存, TEM进行形貌观察。
激光共聚焦显微镜观察细胞形态 双层和单层培养的HUVECs细胞培养5天后终止培养, 分别用PBS清洗2遍, 4%多聚甲醛室温1 mL固定30 min。固定结束后, PBS清洗2遍。1 mL DAPI室温避光染色5 min, 2 mL PBS清洗2遍并封片, 4 ℃避光保存, 于次日进行激光共聚焦观察。
细胞电阻的测定 采用细胞电阻仪分别测定1、3和5天的单层HUVECs、共培养HUVECs和空白细胞培养液的电阻, 以考察单层培养和双层共培养的细胞电阻值的不同。
流式细胞仪测定细胞周期 分别将MCF-7细胞、HUVECs细胞以及双层细胞按照以上步骤种植于6孔培养板、6孔Transwell培养板上室和6孔Transwell培养板下/上室进行培养。于第5天停止培养, 2 mL PBS清洗细胞, 胰酶消化细胞并于2 000 r·min-1离心5 min, 弃上清。PBS调整细胞浓度, 取1×106个细胞于1.5 mL离心管中, 2 000 r·min-1离心5 min, 弃上清, 加入70%冷乙醇, 并将细胞吹散均匀后于4 ℃冰箱放置6 h。随后低温离心机离心(300 ×g, 5 min)弃上清, PBS清洗3遍后加入RNase A, 37 ℃培养30 min后加入400 μL PI, 4 ℃避光反应30 min, 过细胞筛, 流式细胞仪测定细胞周期。
VEGF蛋白的测定 分别将MCF-7细胞、HUVECs细胞以及双层细胞按照以上步骤种植于6孔培养板、6孔Transwell培养板上室和6孔Transwell培养板下/上室进行培养。种植量为1×105个细胞/皿。按照以上培养双层细胞模型的步骤, 对MCF-7和HUVECs细胞进行共培养, 于第5天弃上清, 用不含FBS的DMEM培养液培养16 h, 采用人VEGF定量分析酶联免疫检测试剂盒进行VEGF蛋白含量的测定(具体操作按照试剂盒说明书进行)。
统计学方法 所有实验均重复3~6次, 实验数据均以均值±标准差(x±s)表示。组间比较采用单因素方差分析, 两组间样本比较采用t检验, P < 0.05表示有显著性差异。
结果 1 模拟体内肿瘤微环境的MCF-7和HUVECs的双层细胞模型的构建本研究中, HUVEC和MCF-7的双层细胞模型的建立采用基于Transwell培养板的非接触共培养方式, 具体如图 1所示。HUVECs细胞生长在Transwell上室底面, 而MCF-7肿瘤细胞则在Transwell下室底面生长。由于上室底面具有一定孔径(0.4 μm)的基底膜, Transwell上下两室同时生长的两种细胞能各自分泌可溶性因子通过基底膜进行交换, 从而起到相互促进生长的作用。
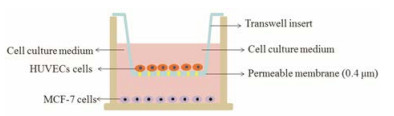
|
Figure 1 The scheme on co-culture of MCF-7 and HUVECs cells in the transwell plate |
采用CCK-8试剂盒检测单层细胞和双层共培养细胞在不同时间点的细胞活性, 结果如图 2所示。与单层MCF-7和HUVECs细胞相比, 共培养的MCF-7和HUVECs均表现出更高的细胞活性。以HUVECs细胞表现尤为明显, 共培养第5天, 双层HUVECs较单层HUVECs的细胞活性增加约54%, 而双层MCF-7细胞活性较单层MCF-7细胞活性增加值约为32%。此外, 单层MCF-7和HUVECs细胞的活性均随时间的增加而增强, 单层MCF-7细胞活性增加更明显。而双层共培养的MCF-7和HUVECs细胞在前5天的活性随时间的增加而增强, 于第5天达到峰值, 随后细胞活性降低。该实验结果提示, HUVECs与MCF-7细胞的双层模型建立的最佳培养时间为5天。因此, 本研究对于双层细胞模型的考察指标均以培养5天为准。
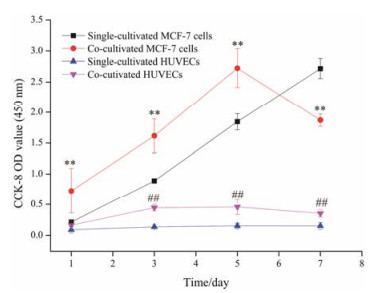
|
Figure 2 Cell activity (absorbance at 450 nm detected by CCK-8) of single-or co-cultivated MCF-7 and HUVECs cells on different time points. n = 6, x±s. **P < 0.01 vs single-cultivated MCF-7 cells at the indicated day, respectively; ##P < 0.01 vs single-cultivated HUVECs at the indicated day, respectively |
采用TEM考察了共培养的MCF-7和HUVECs细胞形态的变化, 结果如图 3所示。与单层培养细胞相比, 共培养的MCF-7和HUVECs细胞均出现形貌改变:整个细胞变大、结构变疏松、细胞核增大, 且可见明显的畸形细胞核膜。采用DAPI对HUVECs的细胞核染色, 激光共聚焦显微镜观察单层HUVECs和双层HUVECs细胞的形态。结果如图 4所示, 与TEM结果相一致, 单层培养的HUVECs细胞呈现出脐静脉内皮细胞典型的梭形形貌, 且紧致规则的细胞核分布在细胞内。而共培养的HUVECs细胞由于受到肿瘤细胞MCF-7的影响, 其形貌发生了明显改变:细胞整体形态失去了梭形形态, 结构疏松, 细胞核明显增大且变得畸形, 几乎占满了整个细胞。

|
Figure 3 TEM morphological results of single-or co-cultivated MCF-7 and HUVECs cells. a: Single-cultivated MCF-7 cells; b: Co-cultivated MCF-7 cells; c: Single-cultivated HUVECs cells; d: Co-cultivated HUVECs cells |
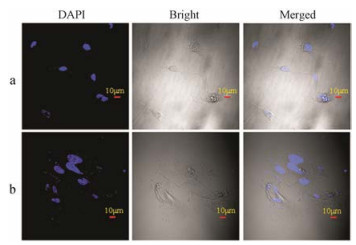
|
Figure 4 Confocal microscopy results of (a) single-or (b) co-cultivated HUVECs cells |
细胞电阻值可以反映细胞之间的连接紧密程度[8]。细胞电阻仪测定的单层HUVECs和双层HUVECs细胞在不同时间点(1、3和5天)的细胞电阻值结果(表 1)显示:单层HUVECs细胞的电阻值随时间的增加而增加, 而双层HUVECs细胞的电阻值随时间的增加呈下降趋势。双层共培养HUVECs细胞的电阻值于第3天开始小于单层HUVECs的细胞电阻值。这可以解释为由于共培养的HUVECs的细胞形态发生了变化, 细胞间连接松散(图 3、4), 使得其细胞活性虽然高于单层培养的HUVECs的细胞活性, 但电阻值却偏低。此外, 双层HUVECs的细胞电阻值随时间呈下降趋势则说明其所受肿瘤细胞影响的程度可能与时间呈正比。
| Table 1 Transepithelial electrical resistance of single-or co-cultivated HUVECs cells on different time points. n = 6, x±s. #P < 0.05, ##P < 0.01 vs single-cultivated HUVECs at the indicated day, respectively |
流式细胞仪测定了单层培养和双层共培养MCF-7和HUVECs细胞的细胞周期。G1期为DNA合成前期, S期为DNA合成期, DNA是控制肿瘤增殖、代谢的主要成分。G2期为DNA合成后期, M期为分裂期。其中S期是细胞增殖的重要时期, 反映细胞的增殖活跃状态[9, 10]。由表 2和图 5结果可知, 与单层培养MCF-7和HUVECs细胞相比, 双层共培养的MCF-7和HUVECs细胞的S期所占比重明显高于单层培养的细胞, 这个结果与细胞活性结果相一致, 说明双层共培养的两种细胞可以彼此相互促进增殖。
| Table 2 Cell cycle distribution of single-or co-cultivated MCF-7 and HUVECs cells after culturing for 5 days. n = 3, x±s. **P < 0.01 vs single-cultivated MCF-7 cells; ##P < 0.01 vs single-cultivated HUVECs |
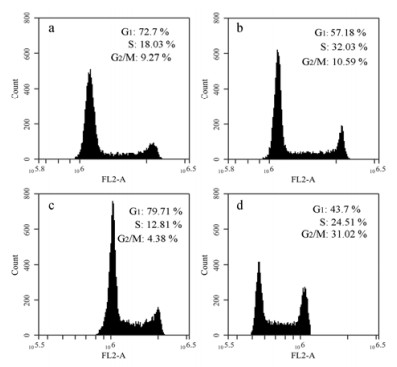
|
Figure 5 Flow cytometry analysis for cell cycles of single-cultivated MCF-7 cells (a), co-cultivated MCF-7 cells (b), single-cultivated HUVECs (c) and co-cultivated HUVECs (d), respectively. n = 3, x±s |
VEGF是介导新生血管生成的重要因素, 可强烈促使血管内皮细胞进行有丝分裂, 进而形成新的血管, 被认为是促进肿瘤血管生成最强的细胞因子[11]。采用人VEGF定量分析酶联免疫检测试剂盒测定了单层和双层共培养MCF-7和HUVECs细胞中VEGF蛋白含量(图 6)。由图可知, 双层共培养的MCF-7和HUVECs均较单层培养的细胞表现出更高的VEGF含量, 其中以HUVECs中VEGF含量增加更明显, 增加值可达52%, 而双层MCF-7较单层MCF-7细胞中VEGF含量增加值约为42%。该结果证明了肿瘤细胞与血管内皮细胞共培养的相互作用关系:肿瘤血管内皮细胞分泌的细胞因子可以促进肿瘤细胞中VEGF蛋白含量的升高, 进而诱导出更多新生的肿瘤血管。
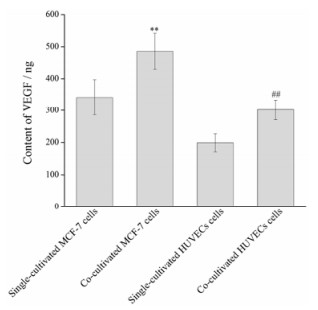
|
Figure 6 VEGF content of single-or co-cultivated MCF-7 and HUVECs cells. n = 6, x±s. **P < 0.01 vs single-cultivated MCF-7 cells; ##P < 0.01 vs single-cultivated HUVECs cells |
HUVECs来源于大静脉, 虽具有分化增殖的潜能和新生血管内皮细胞的特性, 但一般认为与肿瘤来源的微血管内皮细胞有明显区别。实践中肿瘤血管内皮细胞难以获得且培养困难, 而现有研究证明[12], 肿瘤细胞培养的上清液刺激后的HUVECs会一定程度上具有肿瘤血管内皮细胞的特性。因此, 本实验选择HUVECs用于模拟肿瘤血管内皮细胞。
在体内, 肿瘤血管内皮细胞由于长期处于肿瘤微环境中, 其细胞表型、功能甚至基因均较正常内皮细胞会表现出显著不同。体外肿瘤细胞与肿瘤血管内皮细胞的共培养可以模拟体内的肿瘤微环境, 使得肿瘤细胞和肿瘤血管内皮细胞均会表现出不同于两者单独培养的一些特征。当肿瘤细胞与内皮细胞共培养后, 肿瘤细胞会通过各种方式包括分泌相应的细胞因子如VEGF等降低内皮细胞的刚性、增加内皮细胞的变形性、扩大内皮细胞间缝隙、打破血管内皮屏障、提高内皮细胞的通透性以实现肿瘤细胞的侵袭转移[13-16]。恶性肿瘤血管的生成过程会受到多种细胞因子的调控, 其中VEGF是最重要的血管生成调控因子, 是目前已知的最强的血管通透剂, 也是唯一引起血管内皮细胞高特异性增殖反应的细胞因子[17]。本研究结果表明, 与单独培养的MCF-7和HUVECs细胞相比, 共培养的MCF-7和HUVECs细胞均表现出明显的高VEGF含量表达。共培养的MCF-7与HUVECs细胞形态也发生了明显变化:细胞整体增大、结构疏松、细胞核比例增大、核膜变形等。尤其是共培养的HUVECs细胞, 失去了其梭形形貌、细胞结构变的严重疏松, 通透性增加, 导致其细胞电阻值随时间的增加而降低, 且较单独培养的HUVECs细胞的电阻值明显较低, 这在体内可能会为肿瘤细胞下一步的侵袭和转移提供理论基础。
在体内, 肿瘤组织能大量分泌VEGF刺激血管内皮细胞的生成从而诱导肿瘤血管的大量不规则增殖。同时, 肿瘤血管的大量生成又为肿瘤的增殖和转移提供氧气和营养物质, 刺激肿瘤的大量增殖[18]。本研究采用孔径为0.4 μm的半透膜法(Transwell培养板)进行MCF-7和HUVECs细胞的体外共培养, 两种细胞各自所分泌的细胞因子可以通过0.4 μm的小孔持续有效地发挥作用, 这种共培养方式可以更真实模拟体内肿瘤组织中肿瘤细胞和肿瘤血管内皮细胞通过分泌可溶性因子进行间接作用的情况。因此, 在本研究中, 共培养的MCF-7和HUVECs细胞均表现出较单独培养的细胞更高的细胞活性、更强的细胞增殖活力(细胞周期中处于S期和G2/M期比例较高)和更多的VEGF蛋白含量。本研究所构建的MCF-7和HUVECs细胞的体外共培养模型有望为抗血管生成和诱导肿瘤凋亡的双重疗法的研究提供更真实模拟体内肿瘤微环境的体外研究模型。
| [1] | Sun Y. Tumor microenvironment and cancer therapy resistance[J]. Cancer Lett, 2016, 380: 205–215. DOI:10.1016/j.canlet.2015.07.044 |
| [2] | Guo DB, Xu ST, Wang NT, et al. Prodrug-embedded angiogenic vessel-targeting nanoparticle:a positive feedback amplifier in hypoxia-induced chemo-photo therapy[J]. Biomaterials, 2017, 144: 188–198. DOI:10.1016/j.biomaterials.2017.08.032 |
| [3] | Zheng LD, Feng T, He MX, et al. Antitumor effect of breast cancer stem cell co-culture supernatant on breast cancer cells in vitro[J]. Acta Pharm Sin (药学学报), 2016, 51: 552–557. |
| [4] | Wang JJ. Effects of Endothelial Cells (ECS) on Breast Cancer Cells by Co-culture System (共培养系统中血管内皮细胞对乳腺癌细胞影响的研究)[D]. Harbin: Harbin Institute of Technology, 2015. |
| [5] | Lu S, Chen TT, Bie MJ, et al. Establishment of in vitro co-culture system for tumor vascular endothelial cells[J]. J Sichuan Univ (Med Sci Edi)(四川大学学报-医学版), 2013, 44: 308–312. |
| [6] | Wang Y, Qing S, Gong T, et al. Matrix stiffness regulates cell uptake of nanoparticles in 2D and 3D cultures of breast cancer cells[J]. Acta Pharm Sin (药学学报), 2017, 52: 1324–1330. |
| [7] | Liu Q. Research progress of angiogenesis of breast cancer[J]. Med Inno China (中国医学创新), 2013, 10: 162–164. |
| [8] | Zhang QQ, Song SX, Xu XM, et al. An in vitro model of tumor microvessel based on co-culture system[J]. Tumor (肿瘤), 2004, 24: 226–229. |
| [9] | Truelson JM, Fisher SG, Beals TE, et al. DNA content and histologic growth pattern correlate with prognosis in patients with advanced squamous cell carcinoma of the larynx[J]. Cancer, 1992, 70: 56–62. DOI:10.1002/(ISSN)1097-0142 |
| [10] | Meng QS, Zhang PC, Yin Q, et al. Photo-sensitive liposomes loading doxorubicin hydrochloride reverse drug resistance of breast cancer[J]. Acta Pharm Sin (药学学报), 2017, 52: 809–820. |
| [11] | Xu HF, Kou FX, Ye HZ, et al. Highly sensitive antibody-aptamer sensor for vascular endothelial growth factor based on hybridization chain reaction and pH meter/indicator[J]. Talanta, 2017, 175: 177–182. DOI:10.1016/j.talanta.2017.04.073 |
| [12] | Xiang BD, Lv MD, Huang JF, et al. Study of inducing normal endothelial cells acquires the characteristics of tumor-derived endothelium[J]. J Sun Yat-Sen Univ (Med Sci), 2005, 26: 354–357. |
| [13] | Mierke CT. Cancer cells regulate biomechanical properties of human microvascular endothelial cells[J]. J Biol Chem, 2011, 286: 40025–40037. DOI:10.1074/jbc.M111.256172 |
| [14] | Mierke CT, Zitterbart DP, Kollmannsberger P, et al. Breakdown of the endothelial barrier functions in tumor cell transmigration[J]. Biophys J, 2008, 94: 2832–2846. DOI:10.1529/biophysj.107.113613 |
| [15] | Strell C, Entschladen F. Extravasation of leukocytes in comparison to tumor cells[J]. Cell Commun Signal, 2008, 6: 10–23. DOI:10.1186/1478-811X-6-10 |
| [16] | Zhao C, Li JX, Liu XM, et al. Research progress in mechanism of tumor angiogenesis[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2017, 35: 130–132. |
| [17] | Zhen ZY, Jing QL, Zhan ZW, et al. Tumor-targeting dual peptides-modified cationic liposomes for delivery of siRNA and docetaxel to gliomas[J]. Biomaterials, 2014, 35: 5226–5239. DOI:10.1016/j.biomaterials.2014.03.017 |
| [18] | Núnez C, Capelo JL, Igrejas G, et al. An overview of the effective combination therapies for the treatment of breast cancer[J]. Biomaterials, 2016, 97: 34–50. DOI:10.1016/j.biomaterials.2016.04.027 |
 2018, Vol. 53
2018, Vol. 53


