2. 上海洛启生物医药技术有限公司, 上海 201318
2. Shanghai Novamab Biopharmaceuticals Co., Ltd., Shanghai 201318, China
针对免疫检查点的最新免疫抗体药物治疗技术, 能够对肿瘤细胞进行精准免疫应答, 具有针对性强、效价高、来源安全等多种优势, 成为免疫治疗未来的核心所在[1]。以程序性死亡受体1 (programmed death receptor-1, PD-1)/PD-1配体1 (PD-1 ligand 1, PD-L1)免疫检查点抗体阻断疗法为代表的免疫治疗在治疗黑色素瘤和非小细胞肺癌等实体瘤的临床应用中获得了重大成功[2]。然而这些肿瘤疗法也存在不同程度的耐受和失效, 因此开发针对新的肿瘤免疫检查点的治疗性抗体药物显得尤为重要。
T细胞免疫球蛋白黏蛋白-3 (T cell immunoglobulin and mucin-domain-containing molecule-3, TIM-3)是一类主要存在于全分化型分泌干扰素-γ (interferon-γ, IFN-γ)的CD4+辅助性T细胞1 (T helper cell 1, Th1)、CD8+细胞毒性T细胞(cytotoxic T cell, CTL)以及调节性T细胞(regulatory T cell, Treg)、先天免疫细胞(树突细胞、自然杀伤细胞、单核细胞)表面的特异标志物[3]。研究显示, TIM-3是肿瘤免疫应答的负调控因子, 可与肿瘤细胞表面的半乳糖凝集素-9 (galectin-9, Gal-9)、磷脂酰丝氨酸(phosphatidylserine, PtdSer)、高迁移率族蛋白B-1 (high mobility group box-1, HMGB-1)、癌胚抗原相关细胞粘附分子1 (carcinoembryonic antigen-related cell adhesion molecule 1, CEACAM-1)等配体结合, 进而减弱机体的抗肿瘤免疫应答[3-8]。
与PD-1和细胞毒性T细胞相关蛋白-4 (cytotoxic T lymphocyte associate protein-4, CTLA-4)等免疫检查点分子相比, TIM-3作为肿瘤抗体药物开发的靶点有两个优势:一是TIM-3主要选择性表达于肿瘤浸润性T细胞中, 因此, TIM-3作为治疗靶点, 可以减少对正常组织和免疫效应分子的伤害[9, 10]; 二是TIM-3的胞内尾端并不包括任何免疫受体酪氨酸抑制基序(immunoreceptor tyrosine based inhibitory motif, ITIM)或免疫受体络氨酸转换基序(immunoreceptor tyrosine based switch motif, ITSM), 这与包含ITIM/ITSM的受体作用机制不尽相同, 提示TIM-3将是其他包含ITIM/ITSM的检查点受体(如PD1、CTLA-4)的绝佳合作靶点[9, 11]。
相对于其他免疫检查点抗体药物如PD-1等治疗性单抗药物, TIM-3阻断性单克隆抗体药物的研究起步较晚, 尚处在研究初期。目前, 国际上处于临床试验阶段的TIM-3抗体仅有TESARO公司的单克隆抗体药物TSR-022以及诺华(Novartis)公司的单克隆抗体药物MGB453[12]。此外, 一些针对TIM-3/PD-1双重阻断的抗体药物也正处在早期研究阶段, 如美国专注癌症药物开发的Curis公司。上述表明, 目前针对TIM-3靶点的治疗性抗体药物研发仍具有很大的应用前景及医疗价值。
治疗性抗体药物由于其特异性高, 性质均一, 逐步成为肿瘤和免疫系统类疾病的主要治疗手段, 在肿瘤等疾病的治疗中发挥着重大作用, 成功应用于多种肿瘤的治疗中, 并取得可观的疗效[13]。传统的单克隆抗体一直是治疗性抗体药物的研究重点, 但随着抗体治疗领域的不断拓展, 传统的单克隆抗体逐步显现出开发周期长、稳定性较低、保存条件苛刻等缺陷[14]。在不断的创新与发展中, 一种被称为纳米抗体(nanobody, Nb)的新型基因工程抗体逐渐成为抗体药物研发中的新兴力量。纳米抗体由骆驼或羊驼等骆驼科动物中特有的“重链抗体” (heavy-chain antibodies, HCAbs)衍生而来。重链抗体天然缺失轻链, 只包含一个重链可变区(variable domain of heavy chain of HCAb, VHH)和两个常规恒定区CH2与CH3[15, 16]。而纳米抗体是单独克隆出重链抗体VHH区域的单域抗体, 其长度更是在几个纳米级别, 由于其分子质量只有传统抗体的十分之一, 兼具了传统抗体与小分子药物的优势, 几乎完美克服了传统抗体的缺陷。因此, 纳米抗体作为一种新型的抗体, 显现了其强大的医学价值和市场前景。目前国内外针对TIM-3纳米抗体的开发尚未见报道, 本研究通过免疫骆驼, 成功构建了高质量的特异性针对TIM-3的噬菌体展示纳米抗体文库, 并初步筛选获得了29个序列差异的TIM-3纳米抗体, 继而完成TIM-3稳转细胞株的构建, 进一步筛选获得多个具有较高特异性和亲和力的纳米抗体, 以期为TIM-3阻断型特异性纳米抗体药物的开发提供基础。
材料与方法噬菌体展示纳米抗体文库的构建 首先, 将待表达抗原TIM-3基因片段扩增后构建入Fc片段融合蛋白表达载体框架, 得到相应的TIM-3-Fc融合蛋白瞬时表达载体。之后利用高效哺乳动物细胞HEK 293F瞬时表达系统, 加之优化后的Protein A亲和层析纯化工艺, 得到可溶的高纯度的TIM-3-Fc融合蛋白。将获得的TIM-3抗原免疫2~3岁新疆双峰驼(Camelur bactrianus), 每周1次, 共免疫7次, 刺激淋巴B细胞表达抗原特异性的纳米抗体。7次免疫结束后, 提取骆驼100 mL外周血淋巴细胞并使用RNA提取试剂盒(美国QIAGEN公司)提取总RNA, 再应用Super-Script Ⅲ FIRST STRAND SUPERMIX试剂盒(美国Invitrogen公司)将提取的RNA反转录成cDNA。用巢式PCR扩增编码重链抗体的可变区核酸片段:第一轮PCR:上游引物: GTCCTGGCTGCTCTTCTACAAGGC; 下游引物: GGTACGTGCTGTTGAACTGTTCC; 第二轮PCR:上游引物: GATGTGCAGCTGCAGGAGTCTGGRGGAGG; 下游引物: GGA CTAGTGCGGCCGCTGGAGACGGTGACCTGGGT。回收目标重链单域抗体核酸片段, 并使用限制性内切酶PstⅠ及NotⅠ将其克隆进入噬菌体展示用载体pMECS中。产物随后电转化至大肠杆菌电转感受态细胞TG1中, 构建针对TIM-3的噬菌体展示纳米抗体文库, 并通过库容检测和插入率鉴定对文库质量进行评估。
TIM-3特异性噬菌体展示纳米抗体文库的淘选 用TIM-3-Fc融合蛋白每孔10 μg包被平板, 4 ℃放置过夜。第二天用1%脱脂牛奶室温封闭2 h后, 加入噬菌体100 μL (5×1011 cfu, 本研究构建的骆驼纳米抗体噬菌展示文库), 室温作用1 h。之后用PBST (PBS中含有0.05%吐温-20)洗5遍, 以洗掉不结合的噬菌体。最后用三乙基胺(100 mmol·L-1)将与TIM-3特异性结合的噬菌体解离下来, 并感染处于对数期生长的大肠杆菌TG1, 扩增并收集噬菌体用于下一轮的筛选。相同筛选过程重复3~4轮。由此, 阳性克隆被富集, 最终利用噬菌体展示技术从TIM-3噬菌体免疫文库中筛选获得特异性TIM-3纳米抗体。
酶联免疫吸附实验(ELISA)鉴定并获取TIM-3特异性单个阳性克隆 经过3~4轮淘选后, 将所获得的TIM-3特异性结合阳性噬菌体感染大肠杆菌并铺板。之后随机挑选单菌落分别培养, 裂解菌体释放表达抗体上清用于阳性特异性纳米抗体的鉴定。用TIM-3-Fc融合蛋白包被平板4 ℃过夜(Fc蛋白作为阴性对照), 将获得的裂解上清分别加入含有TIM-3-Fc和Fc蛋白的孔中, 室温反应1 h。洗涤之后加入一抗小鼠抗-HA标签抗体, 室温孵育1 h。洗涤之后加入二抗山羊抗-小鼠免疫球蛋白G (immunoglobulin G, IgG)碱性磷酸酶标记抗体, 室温孵育1 h。洗涤之后加入碱性磷酸酶显色底物, 405 nm波长读取吸收值。当样品孔OD值大于对照孔OD值3倍以上时, 判为阳性克隆孔。将阳性克隆孔的菌转移至含有100 μg·mL-1氨苄霉素的LB中培养并提取质粒进行测序。利用序列比对软件Vector NTI Advance分析各个阳性克隆的蛋白序列。根据阳性克隆测序结果中氨基酸序列的差异对TIM-3特异性纳米抗体进行分类。
TIM-3纳米抗体在宿主菌大肠杆菌中的表达和纯化 将测序分析所获得的29个TIM-3特异性克隆扩大培养, 提取相应的质粒, 并电转至表达型宿主菌大肠杆菌WK6中, 将电转培养的细胞涂布于含100 μg·mL-1氨苄青霉素的LB固体培养基上, 37 ℃倒置培养过夜。挑选单菌落接种、培养过夜, 第二天将过夜菌种转接扩增, 37 ℃摇床培养至OD600 = 0.6~1时, 加入1 mmol·L-1 IPTG诱导, 28 ℃摇床培养过夜。第二天, 离心收集菌体, 并将菌体裂解以获得抗体粗提液, 然后利用镍离子亲和层析柱纯化抗体蛋白, 最终得到纯度达90%以上的纳米抗体蛋白。
TIM-3稳转细胞株的构建 首先将TIM-3基因序列扩增后插入pLVX-EF1α-puro载体, 构建pLVX-EF1α-puro-TIM-3慢病毒质粒。TIM-3稳转细胞株的建立方法如下:将HEK 293T细胞传代于含5 mL DMEM完全培养基的10 cm直径培养皿中, 将Opti-MEM培养基(Invitrogen公司) 250 μL与3 μg包装质粒(pLP1:pLP2:VSVG = 1:1:1)、1 μg慢病毒质粒混匀, 然后加入Polyfect转染试剂(QIAGEN公司) 20 μL, 充分混匀, 室温放置10 min, 加入到含HEK 293T细胞的培养皿中, 37 ℃, 5% CO2培养箱中培养2天。收集上清至50 mL离心管中, 培养皿中换新鲜DMEM培养基10 mL继续培养1天。收集上清至前一日50 mL离心管中, 4 000 r·min-1, 离心5 min, 将上清用0.45 μm滤器过滤至新的离心管中。加入5×慢病毒浓缩液, 充分混匀, 置于4 ℃过夜。第二天4 000 ×g, 4 ℃离心25 min, 去上清, 以DMEM培养基1 mL重悬慢病毒。将收获的TIM-3慢病毒颗粒与DMEM培养基9 mL混匀, 加入至新传代的HEK 293T细胞中。每隔2天重新消化细胞, 用2.0 μg·mL-1 puromycin进行筛选。筛选3~4轮后, 利用流式细胞技术检测稳转细胞株是否构建成功。
流式细胞技术检测TIM-3稳转细胞株 首先, 根据处于临床Ⅰ期研究阶段的TIM-3抗体(TSR-022, 专利号: US20150218274A1)序列, 将其重链和轻链合成出来, 分别构建入pFUSE-hIgG1e4-Fc1载体。进一步利用HEK 293F真核表达体系以及protein A蛋白纯化系统获得TIM-3阳性抗体(bench marker, BMK), 以用于TIM-3稳转细胞株的鉴定。在流式细胞检测中, 将1.5×106个HEK 293T TIM-3稳转细胞分至3个离心管中, 3 000 r·min-1、4 ℃、离心4 min, 弃上清, 沉淀用100 μL预冷的PBS重悬, 每5×105细胞加入6 μg抗体(实验组加入TIM-3阳性抗体BMK或者同型对照抗体AF70-Fc, 空白组不加抗体), 混匀后4 ℃孵育20 min。500 μL PBS洗一遍, 沉淀用200 μL PBS重悬, 每管中加入goat-anti-human (FITC) 1 μL, 混匀后4 ℃孵育20 min。预冷PBS洗一遍后弃上清, 沉淀用200 μL预冷PBS重悬, 利用流式细胞仪(美国BD公司)检测TIM-3阳性细胞的比例。
筛选具有高特异性、高亲和力的TIM-3纳米抗体 将1.65×107个HEK293T TIM-3稳转细胞(HEK 293T作为阴性细胞对照)重悬于冰冷的PBS中, 并转移至U型96孔板的33个孔中, 每孔细胞样品100 μL。然后在每孔中加入6 μg抗体(实验组为29株TIM-3纳米抗体, 同型对照为PD-1、PD-L1或CTLA-4纳米抗体, 空白组不加抗体), 混匀后4 ℃孵育20 min。PBS洗一遍后, 用含二抗mouse-anti-His (Alexa Fluor 488)的抗体稀释液100 μL重悬, 混匀后4 ℃孵育20 min。PBS洗一遍用200 μL PBS重悬, 利用流式细胞仪检测纳米抗体与稳转细胞表面TIM-3结合的阳性细胞的比例。
结果 1 TIM-3噬菌体展示纳米抗体免疫文库的构建TIM-3噬菌体展示纳米抗体文库的构建及筛选过程如图 1所示。建库过程中, 巢式PCR第一次PCR获得VHH-h-CH2-CH3片段, 约为700 bp (图 2A), 以此为模板进行第二次PCR获得VHH片段, 约为400 bp (图 2B)。通过梯度稀释将文库涂布于平板上, 并通过计算生长的单克隆数目进行库容测定, 本研究所获免疫文库库容为1×109 cfu, 其结果如下图 2C所示。与此同时, 从文库中随机挑取24颗克隆进行菌落PCR检测, 结果表明所建文库的插入率达到91.7%, 菌落PCR结果如图 2D所示。由此可见, 本项目构建的高质量噬菌体展示文库具有很好的库容和插入率, 为高质量TIM-3抗体的筛选提供了很好的材料基础。
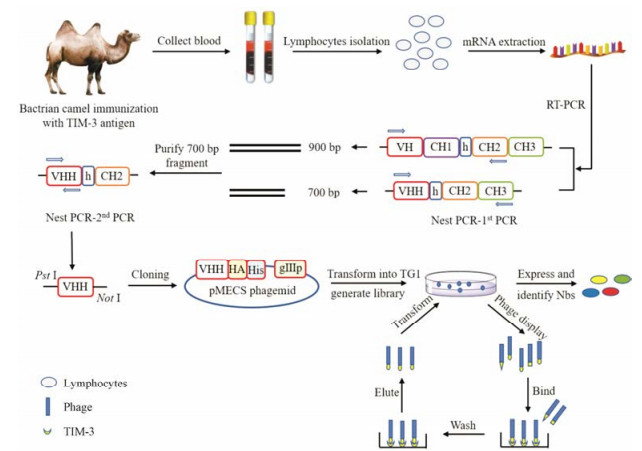
|
Figure 1 Scheme of strategy to construct the TIM-3 immunized library and selecting anti-TIM-3 Nbs. TIM-3, T cell immunoglobulin and mucin-domain-containing molecule-3; Nb, Nanobody |

|
Figure 2 Construction of TIM-3 phage display library. (A) VHH-h-CH2-CH3 genes were generated by round 1 overlap PCR. (B) VHH genes were generated by round 2 overlap PCR. (C) The capacity of the TIM-3 library was measured by counting the clone numbers after gradient dilution. (D) The correct insertion rate was estimated by randomly selecting 24 clones and performing PCR |
在建立了高质量的噬菌体展示文库后, 本研究进行了吸附-洗脱-扩增的亲和淘选过程。淘选过程中, 每一轮均使用5×1011 cfu噬菌体与TIM-3-Fc抗原进行吸附结合。为了评估筛选效果, 将阳性筛选的噬菌体(与抗原特异性结合的噬菌体)和阴性筛选的噬菌体(与Fc结合的噬菌体)分别感染处于对数期生长的大肠杆菌TG1, 然后对菌液连续梯度稀释进行培养, 通过长出的克隆数目比值计算文库富集倍数(+/-)。如图 3所示, 经过三轮亲和淘选, 文库逐步得到富集, 富集结果如图 3A所示:文库经三轮淘选过程后最终出现314倍富集(图 3B)。由图可知, 本研究已经成功地进行了TIM-3噬菌体展示纳米抗体文库的淘选。
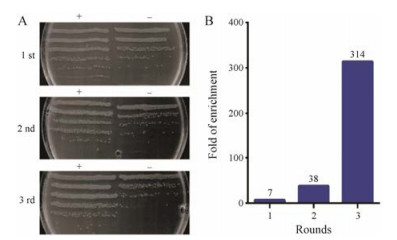
|
Figure 3 The enrichment effect of TIM-3 phage display nanobody library after affinity screening. (A) The enrichment result was displayed for three rounds of panning. (B) The statistical result of enrichment fold |
从上述2~3轮筛选铺板的培养皿中, 随机挑选1 000个单菌落并接种于含有氨苄抗生素的TB培养基中, 生长至对数期后, 加入终浓度1 mmol·L-1 IPTG, 28 ℃培养过夜; 等量标签蛋白Fc作为阴性对照。当样品孔OD值大于对照孔OD值3倍以上时, 判为阳性克隆孔; PE-ELISA结果共出现435颗阳性克隆, 其比值(ratio: +/-)在3~30之间, 部分鉴定结果(其中96个克隆的鉴定结果)如图 4所示。
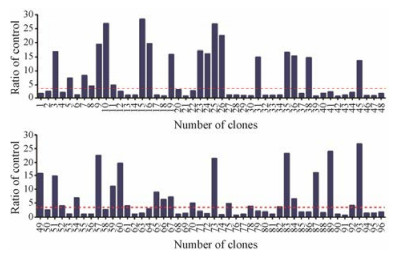
|
Figure 4 Periplasmic extract ELISA was performed to identify positive clones. The ratio higher than 3 was considered as positive |
将PE-ELISA鉴定出的TIM-3特异性阳性克隆转至含氨苄青霉素的培养液中培养, 提取质粒并进行测序。利用序列对比软件Vector NTI Advance分析各个克隆株的基因序列, 将抗体互补决定区(complementarity-determining regions, CDRs) CDR1、CDR2、CDR3序列相同的视为同一克隆株, 而其中序列有差异的株视为不同克隆株, 以此标准最终获得29株序列不同的纳米抗体(图 5)。

|
Figure 5 Twenty-nine kinds of different amino acid sequences of anti-TIM-3 Nbs were identified |
将前面测序分析所获得不同克隆株的质粒pMECS-Nbs电转至表达菌株WK6中, 并将其涂布在含有氨苄青霉素和葡萄糖的培养平板上, 37 ℃培养过夜, 通过一步法Ni柱亲和层析制备纳米抗体蛋白。经SDS-PAGE检测显示, 获得了29株纳米抗体, 纯度均达到90%以上, 结果如图 6所示。

|
Figure 6 Purification of TIM-3-specific Nbs, which were detected by SDS-PAGE |
首先, 制备了TIM-3 BMK阳性抗体, 以用于后续TIM-3稳转细胞株的鉴定。合成出目前处于临床Ⅰ期研究阶段的TIM-3抗体(TSR-022)的重链及轻链, 构建入pFUSE-hIgG1e4-Fc1载体。进一步利用真核细胞瞬时表达系统和亲和蛋白纯化工艺, 获取高纯度TIM-3 BMK抗体。图 7A显示成功获得高纯度的TIM-3 BMK抗体, 重链及轻链大小均在正确位置。然后利用慢病毒转染系统构建了TIM-3稳转细胞株。通过流式细胞技术进行检测, 如图 7B所示TIM-3稳转细胞株的阳性细胞比例可达到98.1%, 由此表明已成功构建了高质量的TIM-3稳转细胞株, 该稳转细胞株的构建为高亲和力、高特异性TIM-3纳米抗体的筛选和后续功能性阻断型TIM-3纳米抗体的筛选研究提供了重要的基础。
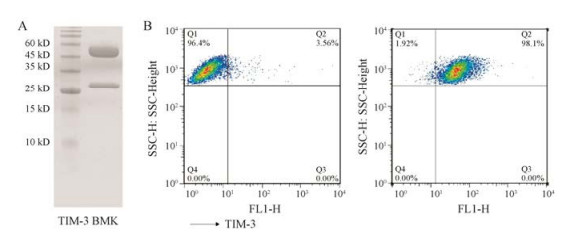
|
Figure 7 Construction of TIM-3 stable cell line. (A) Expression and purification of TIM-3 BMK. (B) Detection of TIM-3 stable cell line through flow cytometric analysis. The left was TIM-3 stable cell line incubated with AF70-Fc, which was used as negative control, and the right was TIM-3 stable cell line incubated with TIM-3 BMK. BMK: Bench marker |
本研究利用构建的TIM-3稳转细胞株进一步对纯化出的29个原核表达的纳米抗体进行特异性和亲和力筛选。以HEK293T作为阴性细胞对照, 研究结果显示, 29种TIM-3纳米抗体与HEK293T均无结合(图中未显示), 有12种与TIM-3稳转细胞株有结合, 表明此12株TIM-3纳米抗体具有特异性结合TIM-3的能力, 其中10种TIM-3纳米抗体与稳转株表面的TIM-3结合力超过80%, 而同型阴性对照抗体(PD-1、PD-L1和CTLA-4纳米抗体)与稳转株表面的TIM-3无结合(图 8), 以上实验表明淘选获得的29种纳米抗体中有10种对TIM-3抗原显示了较高的特异性和亲和力。后续还将利用饱和性结合实验, 确定此10株纳米抗体与TIM-3的解离平衡常数KD。以上结果为进一步TIM-3纳米抗体的功能性阻断作用研究提供了数据支持。
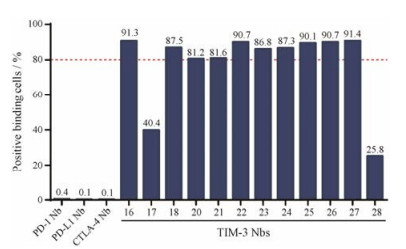
|
Figure 8 Screening TIM-3 Nbs with high affinity by flow cytometric analysis. TIM-3 stable cell line incubated with PD-1 Nb, PD-L1 Nb or CTLA-4 Nb were selected as negative controls |
TIM-3是T细胞衰竭的重要标志[17, 18]。大量研究显示TIM-3与肿瘤免疫逃逸正相关, 阻断TIM-3可促进机体的抗肿瘤免疫反应[7, 19, 20]。介于其主要表达于肿瘤浸润性T细胞中这种精准的作用方式, TIM-3可以作为免疫抑制剂和肿瘤免疫治疗的特异性靶标。纳米抗体作为来源于骆驼动物的VHH片段, 是新一代抗体药物研发的热点, 跨国药企如Ablynx公司积极推进纳米抗体药物的研发, 多个品种进入了Ⅱ/Ⅲ期临床, 而国内纳米抗体还仅仅处于萌芽状态[21, 22]。因此, 本研究开展了TIM-3纳米抗体药物的前期研究工作, 期望能够带动国内新型抗体药物快速开发。
通过对骆驼免疫TIM-3抗原, 扩增了骆驼重链抗体VHH基因, 建立噬菌体展示纳米抗体免疫文库, 再利用噬菌体展示技术从文库中筛选获得TIM-3抗原特异性的纳米抗体。本研究成功构建了TIM-3噬菌体展示纳米抗体免疫文库, 库容大小在109 cfu。并进一步筛选获得了29株序列不同的TIM-3纳米抗体, 将为下一步治疗性TIM-3纳米抗体的研究提供了宝贵资源。
本研究还成功构建了pLVX-EF1α-puro-TIM-3慢病毒质粒, 通过慢病毒转染系统将TIM-3高效表达于HEK 293T细胞膜表面, 阳性细胞率约98.1%, 建立了高质量的稳定表达TIM-3的HEK 293T细胞株。TIM-3稳转细胞株的构建为本研究筛选获得10株特异性强、亲和力高的TIM-3纳米抗体, 也为进一步筛选能够有效阻断TIM-3及其配体相互作用的阻断性纳米抗体提供了重要的条件, 为后续TIM-3功能性抗体的开发奠定了重要的基础。
后续研究中, 本课题组将进一步在已获得的10株具较好特异性和亲和力的TIM-3纳米抗体的基础上, 借助TIM-3稳转细胞株进一步筛选阻断型纳米抗体, 并对候选TIM-3纳米抗体进行人源化、抗原表位的研究; 在生物学功能和作用机制上, 系统地研究候选纳米抗体对T细胞激活与增殖、NK细胞杀伤能力及调节性T细胞抑制的影响, 揭示其作用机制; 最终通过小鼠肿瘤模型验证候选TIM-3纳米抗体在体内对肿瘤的抑制效果, 获得具有生物活性的抑制肿瘤生长的纳米抗体候选分子。在本文已有的工作基础上继续深入研究, 期望开发具有自主知识产权的TIM-3全人源化纳米抗体创新药物。
成功研发的TIM-3阻断型纳米抗体, 可以配合其他肿瘤靶标抗体开发出更多的双特异性, 甚至是多特异性新一代抗体药物。这些随后开发的“升级”产品将具备高靶向性、高效率等更多优势; 而通过本项目研发TIM-3阻断型纳米抗体获得的经验及建立的技术平台将大大简化后续系列产品的研发过程。
| [1] | Enblad G, Karlsson H, Loskog AS. CAR T-cell therapy:the role of physical barriers and immunosuppression in lymphoma[J]. Hum Gene Ther, 2015, 26: 498–505. DOI:10.1089/hum.2015.054 |
| [2] | Mandai M. PD-1/PD-L1 blockage in cancer treatment-from basic research to clinical application[J]. Int J Clin Oncol, 2016, 21: 447. DOI:10.1007/s10147-016-0969-x |
| [3] | Freeman GJ, Casasnovas JM, Umetsu DT, et al. TIM genes:a family of cell surface phosphatidylserine receptors that regulate innate and adaptive immunity[J]. Immunol Rev, 2010, 235: 172–189. DOI:10.1111/j.0105-2896.2010.00903.x |
| [4] | Anderson AC. Tim-3, a negative regulator of anti-tumor immunity[J]. Curr Opin Immunol, 2012, 24: 213–216. DOI:10.1016/j.coi.2011.12.005 |
| [5] | Dardalhon V, Anderson AC, Karman J, et al. Tim-3/galectin-9 pathway:regulation of Th1 immunity through promotion of CD11b+Ly-6G+ myeloid cells[J]. J Immunol, 2010, 185: 1383–1392. DOI:10.4049/jimmunol.0903275 |
| [6] | Chiba S, Baghdadi M, Akiba H, et al. Tumor-infiltrating DCs suppress nucleic acid-mediated innate immune responses through interactions between the receptor TIM-3 and the alarmin HMGB1[J]. Nat Immunol, 2012, 13: 832–842. DOI:10.1038/ni.2376 |
| [7] | Mattei F, Schiavoni G. TIM-3 as a molecular switch for tumor escape from innate immunity[J]. Front Immunol, 2012, 3: 418. |
| [8] | Huang YH, Zhu C, Kondo Y, et al. CEACAM1 regulates TIM-3-mediated tolerance and exhaustion[J]. Nature, 2015, 517: 386–390. DOI:10.1038/nature13848 |
| [9] | Anderson AC. Tim-3:an emerging target in the cancer immunotherapy landscape[J]. Cancer Immunol Res, 2014, 2: 393–398. DOI:10.1158/2326-6066.CIR-14-0039 |
| [10] | Gao X, Zhu Y, Li G, et al. TIM-3 expression characterizes regulatory T cells in tumor tissues and is associated with lung cancer progression[J]. PLoS One, 2012, 7: e30676. DOI:10.1371/journal.pone.0030676 |
| [11] | Ferris RL, Lu B, Kane LP. Too much of a good thing? Tim-3 and TCR signaling in T cell exhaustion[J]. J Immunol, 2014, 193: 1525–1530. DOI:10.4049/jimmunol.1400557 |
| [12] | Greil R, Hutterer E, Hartmann TN, et al. Reactivation of dormant anti-tumor immunity -a clinical perspective of therapeutic immune checkpoint modulation[J]. Cell Commun Signal, 2017, 15: 5. DOI:10.1186/s12964-016-0155-9 |
| [13] | Zhao C, Hu Z, Cui B. Recent advances in monoclonal anti-body-based therapeutics[J]. Acta Pharm Sin (药学学报), 2016, 52: 837–847. |
| [14] | Omidfar K, Daneshpour M. Advances in phage display technology for drug discovery[J]. Expert Opin Drug Discov, 2015, 10: 651–669. DOI:10.1517/17460441.2015.1037738 |
| [15] | De Meyer T, Muyldermans S, Depicker A. Nanobody-based products as research and diagnostic tools[J]. Trends Biotechnol, 2014, 32: 263–270. DOI:10.1016/j.tibtech.2014.03.001 |
| [16] | De Vos J, Devoogdt N, Lahoutte T, et al. Camelid single-domain antibody-fragment engineering for (pre)clinical in vivo molecular imaging applications:adjusting the bullet to its target[J]. Expert Opin Biol Ther, 2013, 13: 1149–1160. DOI:10.1517/14712598.2013.800478 |
| [17] | Zhu S, Lin J, Qiao G, et al. Tim-3 identifies exhausted follicular helper T cells in breast cancer patients[J]. Immunobiology, 2016, 221: 986–993. DOI:10.1016/j.imbio.2016.04.005 |
| [18] | Zhang Y, Cai P, Li L, et al. Co-expression of TIM-3 and CEACAM1 promotes T cell exhaustion in colorectal cancer patients[J]. Int Immunopharmacol, 2017, 43: 210–218. DOI:10.1016/j.intimp.2016.12.024 |
| [19] | Li C, Chen X, Yu X, et al. Tim-3 is highly expressed in T cells in acute myeloid leukemia and associated with clinicopa thological prognostic stratification[J]. Int J Clin Exp Pathol, 2014, 7: 6880–6888. |
| [20] | Folgiero V, Cifaldi L, Li Pira G, et al. TIM-3/Gal-9 interaction induces IFNγ-dependent IDO1 expression in acute myeloid leukemia blast cells[J]. J Hematol Oncol, 2015, 8: 36. DOI:10.1186/s13045-015-0134-4 |
| [21] | Van Heeke G, Allosery K, De Brabandere V, et al. Nanobodies (R) as inhaled biotherapeutics for lung diseases[J]. Pharmacol Ther, 2017, 169: 47–56. DOI:10.1016/j.pharmthera.2016.06.012 |
| [22] | Ta AN, McNaughton BR. Antibody and antibody mimetic immunotherapeutics[J]. Future Med Chem, 2017, 9: 1301–1304. DOI:10.4155/fmc-2017-0057 |
 2018, Vol. 53
2018, Vol. 53


