2. 中国医学科学院, 北京协和医学院药物研究所 神经科学中心, 北京 100050
2. Neuroscience Center, Institute of Materia Medica, Peking Union Medical College, Chinese Academy of Medical Sciences, Beijing 100050, China
阿尔茨海默病(Alzheimer's disease, AD)是一种严重的中枢神经系统退行性疾病, 主要临床表现为进行性的认知功能减退。神经病理学特征主要包括淀粉样蛋白(β-amyloid protein, Aβ)[1-3]沉积形成的细胞外老年斑(senile plaque, SP), Tau蛋白过度磷酸化[4]形成的神经细胞内神经原纤维缠结、神经元丢失及伴随的胶质细胞增生等[5, 6]。有文献表明, 注射冈田酸(okada acid, OKA)到啮齿动物的大脑会引起Tau蛋白磷酸化, 导致认知缺陷。说明OKA可用作实验工具研究神经变性的机制和探究阿尔茨海默病的病理研究靶标, 并可用于临床药物的开发[7]。
除脂肪组织外, 人体脂肪在中枢神经系统(central nervous systerm, CNS)内的含量最高。在CNS中, 脂肪并不存储于脂肪组织中, 而是通过脂肪酸组成髓鞘层, 继而包绕脑与脊髓内的轴索。CNS来源的脂肪因子可以由不同脑区内的非脂肪细胞类型与核团生成, 如调节饮食行为的下丘脑弓状核。以往有关痴呆的研究认为神经退行性病变与血管病变进程能够影响多个脑区及核团, 在此病程中脂肪因子可能通过激活胶质细胞等加重炎症反应, 进而加剧神经退行性病变进程[8, 9]。然而近年来, 关于高脂饮食与AD的研究对此类结果产生质疑[10]。在柳叶刀近期报道的[11, 12]一项历时10年、由超过13.5万名受试者参与的大型流行病学研究结果中指出, 与脂肪摄入量较低、主要通过碳水化合物获取能量的人群相比, 适当提高脂肪摄入量, 不仅没有增加心血管疾病的患病风险, 反而降低了总死亡率, 颠覆了以往的高脂饮食对心血管疾病的损伤论断, 提示高脂饮食是否真的对脑神经系统造成损伤作用。基于此, 本文探究短期内的高脂饮食对冈田酸所致脑认知功能损伤的影响并检测其可能的生物学机制, 为阿尔茨海默病的日常预防及辅助治疗提供理论和实验依据。
材料与方法实验动物 雄性SD大鼠, 体重200~220 g。北京维通利华实验技术有限公司购买(合格证号11400700223216)。
药品与试剂 脂肪供能比为60%的高脂纯化饲料(H10060), 购自北京华阜康生物科技股份有限公司; BCA法蛋白浓度测定试剂盒(北京普利莱基因技术有限公司); OKA (78111-17-8, Sigma公司); TAU抗体(ab64193)、p-tau (S396)抗体(ab32057), 购自Abcam公司; 含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase, caspase)-1抗体(22915-1-AP)、NLRP3抗体(19771-1-AP), 购自Proteintech公司。
阿尔茨海默病动物模型建立 将24只雄性SD大鼠随机分为正常组、OKA组、高脂饮食联合OKA组, 每组8只。正常组:右侧脑室定位注射生理盐水5 μL, 饲养给予正常饲料; OKA组:右侧脑室定位注射OKA (40 ng·μL-1) 5 μL, 饲养给予正常饲料; 高脂饮食联合OKA组:右侧脑室定位注射OKA 5 μL, 当天起饲养给予高脂饲料[7, 13-15] (图 1)。
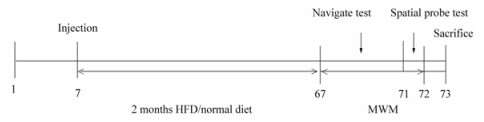
|
Figure 1 Design of the experiment. HFD: High-fat diet; MWM: Morris water maze |
Morris水迷宫实验检测大鼠空间记忆能力 2个月高脂饮食后进行Morris水迷宫实验, 检测各组大鼠空间记忆能力。隐藏平台搜索实验:每天按随机顺序依次从平台所在象限对侧的入水点将大鼠面向池壁放入, 设置时间为60 s, 规定时间内未找到平台记为逃避期60 s, 引导鼠上平台, 每只鼠平台停留时间为10 s, 每天测量1次, 共测量4天。空间搜索实验:第5天撤掉平台, 选择之前平台所在象限对侧入水点入水, 测量60 s内动物在目标象限的时间和穿越目标象限的次数, 并统计大鼠游泳速度。
尼氏染色 大鼠腹腔注射10%水合氯醛麻醉, 灌注固定。选择海马部位进行石蜡包埋切片, 片厚4 μm。切片脱腊至水, 蒸馏水稍洗; 加1%甲苯胺蓝溶液后置于54 ℃孵箱内浸染25 min, 蒸馏水稍洗, 95%乙醇分化30 s; 无水乙醇脱水, 二甲苯透明, 中性树胶封片。
Western blot 大鼠断头处死, 冰上分离海马, 液氮速冻后加入RIPA裂解液超声破碎, 以BCA法测定蛋白浓度, 加入1/4体积5×loading buffer后95 ℃处理10 min, 样品-40 ℃保存。蛋白上样量为70 μg, 分离胶浓度12%, 将蛋白转印至PVDF膜后以5% BSA封闭1 h, 一抗4 ℃孵育过夜, PBS洗5 min×3次, 二抗室温孵育2 h, PBS洗5 min×3次, 加入ECL发光液显影。使用Quality one 4.6.2凝胶分析软件对蛋白条带进行灰度分析。
统计学分析 实验数据用x±s表示, 采用Graphpad Prism 5统计分析软件进行统计分析。数据组间比较采用单因素方差分析(one-way ANOVA)结合Newman-keuls post-hoc检验。以P < 0.05为具有统计学差异。
结果 1 高脂饮食对冈田酸诱导大鼠认知功能影响的行为学检测实验动物脑室注射OKA或生理盐水后给予2个月高脂饮食(对照组及OKA组给予正常饮食, 图 1), 随后进行Morris水迷宫定位航行实验。在4天的连续训练过程中, 各组大鼠逃避潜伏期逐渐缩短, OKA组和OKA联合高脂饮食组与对照组大鼠相比逃避潜伏期延长, 第4天OKA联合高脂饮食组逃避潜伏期明显低于OKA组。第5天撤去平台进行Morris水迷宫空间探索实验, OKA联合高脂饮食组在第一次穿越目标象限时间和穿越平台次数的测试中均优于OKA组, 且3组间游泳速度无明显差异性, 排除速度影响, 提示OKA造模后采用短期高脂饮食处理在认知行为学测试中的表现优于正常饮食组(图 2)。
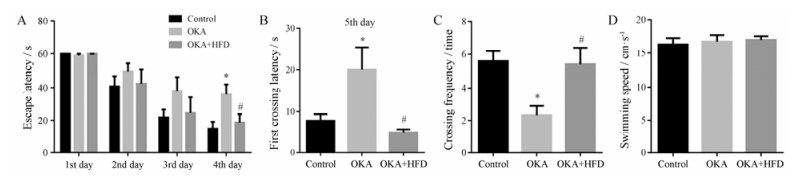
|
Figure 2 HFD attenuated memory deficits induced by okada acid (OKA) injection in the lateral ventricle of rats. (A) Escape latency to platform in the four days of navigate test. (B) First crossing latency of the target quadrant in spatial probe test. (C) Numbers of platform crossing in spatial probe test. (D) The swimming speed. n = 8, x±s. *P < 0.05 vs control; #P < 0.05 vs OKA |
尼氏染色结果显示, OKA组与对照组相比, CA1区和DG区神经元明显减少, 且细胞皱缩, 并形成大量空泡结构, 表明OKA对海马神经元造成损伤; 而OKA联合高脂饮食组细胞数目明显多于OKA组, 且形态正常, 皱缩现象缓解, 未见明显的空泡结构, 提示高脂饮食对OKA造成的神经元损伤具有明显的保护作用(图 3)。

|
Figure 3 High fat diet attenuated neuron damage in hippocampus caused by OKA. Nissl's staining of hippocampus CA1 of control group (A), OKA group (B) and OKA+HFD group (C). Black arrows indicated the cell damage. Scale bar = 20 μm. Nissl's staining of dentate gyrus of control group (D), OKA group (E), and OKA+HFD group (F). Scale bar = 50 μm |
正常情况下, Tau蛋白通过磷酸化维持细胞的正常形态和物质运转, 而在AD患者脑中Tau蛋白异常磷酸化导致微管稳定性改变, 引起神经纤维缠结(neurofibrillary tangles, NFTs), 导致神经细胞的大量死亡, 是AD发病机制中一个极为重要的因素。Western blot结果显示, 与对照组相比, OKA组的Tau S396位点磷酸化水平明显增加, OKA后给予高脂饮食处理降低了OKA诱导的异常磷酸化水平, 与行为学及尼氏病理染色结果相一致(图 4)。

|
Figure 4 HFD reduced the high phosphorylation of Tau (S396). Western blot results of Tau protein, p-Tau (S396) and β-actin. n = 3, x±s. *P < 0.05 vs control; #P < 0.05 vs OKA |
OKA组与control组相比, NLRP3含量明显增加, cleaved-caspase-1活化增加, 提示炎性因子表达增多。而OKA给予高脂饮食可明显缓解NLRP3及caspase-1信号通路的活化, 提示高脂饮食降低了炎症通路的激活(图 5)。
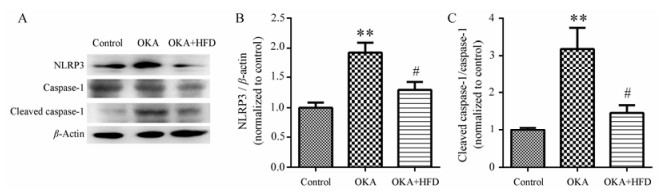
|
Figure 5 HFD alleviated the activation of NLRP3/caspase-1 inflammation pathway. Western blot results of NLRP3, cleaved caspase-1, caspase-1 and β-actin. n = 3, x±s. **P < 0.01 vs control; #P < 0.05 vs OKA |
NFTs是AD发病中一个极为重要的因素, 由异常磷酸化的Tau蛋白组成。正常情况下Tau蛋白可以通过磷酸化来维持细胞的正常形态和物质运转, 而在AD患者脑中, Tau蛋白发生异常磷酸化, 导致神经细胞的大量死亡。OKA是蛋白磷酸酶PP2A的特异抑制剂, 可引起神经细胞Tau蛋白异常高度磷酸化。本实验中侧脑室注射OKA造成Tau蛋白磷酸化明显增加, 表明认知功能损伤模型建立成功。
炎症反应涉及细胞内炎症小体的相互作用, 组织损伤可诱发固有免疫应答从而激活caspase依赖的炎性反应。炎症小体位于细胞质内, 可激活caspase家族, 尤其是caspase-1, 通过诱导caspase-1切割并释放IL-1和IL-8等促炎因子, 最终产生炎症反应。已有文献[16]报道, 在中枢神经系统中, 神经细胞表面均表达IL-1和IL-8的受体, 且不同类型的炎症小体在不同神经细胞中各司其职, 发挥神经免疫炎症的调节功能。有研究表明, 中枢神经系统炎症和自噬功能障碍参与神经退行性疾病。NLRP3炎症小体介导的caspase-1与神经系统疾病具有特异性[17]。
上世纪90年代就有研究报道高脂饮食是AD发病的危险因素[18, 19], 高脂饮食能通过增加Aβ产生、诱导神经炎症、促进Tau蛋白过度磷酸化、损伤突触可塑性及胆碱能神经系统而降低认知功能, 成为AD发病的危险因素。而近期又有研究表明, 脂肪摄入较多的人群死亡率比脂肪摄入少的人群低23%, 脑卒中几率也更小[9, 10]。提示高脂饮食可能不仅不会对机体造成以前研究认为的损伤, 甚至在某种程度上发挥了保护性作用。在本实验结果中发现了类似的现象。首先采用侧脑室脑定位注射OKA以建立认知功能障碍模型, 但在给予高脂饮食喂养2个月后发现大鼠认知功能损伤没有被加剧, 反而有减缓的趋势。在行为学上表现为减弱OKA所致的空间学习记忆能力损伤。尼氏染色也提示神经元损伤在高脂饮食组得到明显缓解。Western blot结果表明高脂饮食组减少了Tau蛋白的异常磷酸化, 因此对其可能的机制进行推测, 认为其一是高脂饮食通过介导NLRP3/caspase1通路, 减少了炎症因子的表达。其二可能是由于中枢神经系统是人体内除脂肪组织外, 脂肪含量最多的部位, 短期的高脂饮食可能对脑神经产生一定的营养作用, 使其对OKA造成的神经损伤产生保护作用。
以上结果提示, 适度的高脂饮食对神经系统可能起到一定的保护作用, 为阿尔茨海默病的日常预防及辅助治疗提供了一个新的思路及理论依据, 但不同的高脂饮食含量比和不同作用时程对于AD的影响及具体机制仍有待进一步的探究。
| [1] | Hardy J, Allsop D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease[J]. Trends Pharmacol Sci, 1991, 12: 383–388. DOI:10.1016/0165-6147(91)90609-V |
| [2] | Mudher A, Lovestone S. Alzheimer's disease-do tauists and baptists finally shake hands?[J]. Trends Neurosci, 2002, 25: 22–26. DOI:10.1016/S0166-2236(00)02031-2 |
| [3] | Gong HC, Wang YL, Wang HW. Epigenetic mechanisms of Alzheimer's disease and related drug research[J]. Acta Pharm Sin (药学学报), 2013, 48: 1005–1013. |
| [4] | Iqbal K, Alonso AC, Chen S, et al. Tau pathology in Alzheimer disease and other tauopathies[J]. Biochim Biophys Acta, 2005, 1739: 198–210. DOI:10.1016/j.bbadis.2004.09.008 |
| [5] | Selkoe DJ. Translating cell biology into therapeutic advances in Alzheimer's disease[J]. Nature, 1999, 399: A23–A31. DOI:10.1038/399a023 |
| [6] | Tiraboschi P, Hansen LA, Thal LJ, et al. The importance of neuritic plaques and tangles to the development and evolution of AD[J]. Neurology, 2004, 62: 1984–1989. DOI:10.1212/01.WNL.0000129697.01779.0A |
| [7] | Kamat PK, Rai S, Swarnkar S, et al. Molecular and cellular mechanism of okadaic acid (OKA)-induced neurotoxicity:a novel tool for Alzheimer's disease therapeutic application[J]. Mol Neurobiol, 2014, 50: 852–865. DOI:10.1007/s12035-014-8699-4 |
| [8] | Kiliaan AJ, Arnoldussen IA, Gustafson DR. Adipokines:a link between obesity and dementia?[J]. Lancet Neurol, 2014, 13: 913–923. DOI:10.1016/S1474-4422(14)70085-7 |
| [9] | Calvoochoa E, Hernándezortega K, Ferrera P, et al. Short-term high-fat-and-fructose feeding produces insulin signaling alterations accompanied by neurite and synaptic reduction and astroglial activation in the rat hippocampus[J]. J Cereb Blood Flow Metab, 2014, 34: 1001–1008. DOI:10.1038/jcbfm.2014.48 |
| [10] | Gratuze M, Julien J, Morin F, et al. High-fat, high-sugar, and high-cholesterol consumption does not impact tau pathogenesis in a mouse model of Alzheimer's disease-like tau pathology[J]. Neurobiol Aging, 2016, 47: 71–73. DOI:10.1016/j.neurobiolaging.2016.07.016 |
| [11] | Dehghan M, Mente A, Zhang X, et al. Associations of fats and carbohydrate intake with cardiovascular disease and mortality in 18 countries from five continents (PURE):a prospective cohort study[J]. Lancet, 2017, 390: 2050–2062. DOI:10.1016/S0140-6736(17)32252-3 |
| [12] | Mente A, Dehghan M, Rangarajan S, et al. Association of dietary nutrients with blood lipids and blood pressure in 18 countries:a cross-sectional analysis from the PURE study[J]. Lancet Diabetes Endocrinol, 2017, 5: 774–787. DOI:10.1016/S2213-8587(17)30283-8 |
| [13] | Arendt T, Holzer M, Fruth R, et al. Paired helical filament-like phosphorylation of tau, deposition of β/A4-amyloid and memory impairment in rat induced by chronic inhibition of phosphatase 1 and 2A[J]. Neuroscience, 1995, 69: 691–698. DOI:10.1016/0306-4522(95)00347-L |
| [14] | Arendt T, Holzer M, Fruth R, et al. Phosphorylation of tau, Aβ-formation, and apoptosis after in vivo inhibition of PP-1 and PP-2A[J]. Neurobiol Aging, 1998, 19: 3–13. DOI:10.1016/S0197-4580(98)00003-7 |
| [15] | Song XY, Hu JF, Chu SF, et al. Ginsenoside Rg1 attenuates okadaic acid induced spatial memory impairment by the GSK3β/tau signaling pathway and the Aβ formation prevention in rats[J]. Eur J Pharmacol, 2013, 710: 29–38. DOI:10.1016/j.ejphar.2013.03.051 |
| [16] | Qiao C. The novel roles and mechanism of NLRP3-Caspase-1 inflammasome in the patheogenesis of Parkinson's disease[D]. Nanjing: Nanjing Medical University, 2016. |
| [17] | Wang D, Zhang J, Jiang W, et al. The role of NLRP3-CASP1 in inflammasome-mediated neuroinflammation and autophagy dysfunction in manganese-induced, hippocampal-dependent impairment of learning and memory ability[J]. Autophagy, 2017, 13: 914–927. DOI:10.1080/15548627.2017.1293766 |
| [18] | Kanoski SE, Davidson TL. Western diet consumption and cognitive impairment:links to hippocampal dysfunction and obesity[J]. Physiol Behav, 2011, 103: 59–68. DOI:10.1016/j.physbeh.2010.12.003 |
| [19] | Zhang XC, Dong F, Jun R, et al. High dietary fat induces NADPH oxidase-associated oxidative stress and inflammation in rat cerebral cortex[J]. Exp Neurol, 2005, 191: 318–325. DOI:10.1016/j.expneurol.2004.10.011 |
 2018, Vol. 53
2018, Vol. 53


