2. 河北省食品药品审评认证中心, 河北 石家庄 050091;
3. 北京大学药学院, 北京 100191
2. Hebei Center For Food And Drug Evaluation and Certification, Shijiazhuang 050091, China;
3. School of Pharmaceutical Sciences, Peking University, Beijing 100191, China
病变组织及受损细胞的新陈代谢往往导致细胞外酸化, 如果能够找到一种可以靶向细胞外酸性环境的载体, 对于改善细胞外酸性环境相关的癌症、缺血性中风、神经外伤和感染等病理状态具有积极的意义。但是这种方法的应用具有一定的难度, 因为病变组织胞外pH值与正常组织pH值相差甚微(约低0.5~0.8个pH单位)[1]。这种差别在生物学上可使细胞功能改变, 但从化学角度而言差别非常小, 调节靶向因子的化学性质非常困难。
低pH插入肽(pH low insertion peptides, pHLIPs)的发现为胞外微酸环境敏感靶向给药系统的发展提供了新的契机。pHLIP由侧翼序列和跨膜(transmembrane, TM)序列组成(图 1), 其中侧翼序列由质子化氨基酸残基构成, TM序列由疏水残基构成。TM序列影响pHLIP与膜相互作用, 侧翼-1 (氨基端)与pHLIP的水溶性相关, 通常含有极性带电残基[2-5]。膜插入侧翼-2 (羧基端)不仅与pHLIP的水溶性有关而且影响pHLIP进出细胞膜的比率[6]。随着对pHLIP生物物理学性质的不断了解, 基于pHLIP具有低pH靶向行为这一特点, 考虑将其作为诊断或治疗药物的载体。学者们首先对pHLIP是否可用于将细胞不可渗透药物易位到细胞中进行研究。Wijesinghe等[7]借助pHLIP成功将荧光小分子药物、肽核酸和鬼笔毒素递送至肿瘤细胞内, 建立了治疗药物细胞内传递的新方法, 实现了药物分子细胞水平的靶向递送。在此基础上, 进一步预测pHLIP或许可以在体内选择性靶向酸性肿瘤。Andreev等[8]首次使用肿瘤模型鼠证实了pHLIP具有体内靶向能力。

|
Figure 1 Sequence of pH low insertion peptide (pHLIP) |
随着对pHLIP研究的不断深入, 发现野生型pHLIP [pHLIP (WT)]的应用受到一些关键因素的限制, 如体内清除慢、羧基端所带电荷对膜插入过程的影响。学者们尝试通过对pHLIP氨基酸序列进行调整, 设计具有更好性能的pHLIP衍生物。目前pHLIP序列调节方式主要包括: ①切除或反转野生型pHLIP序列的膜插入末端[9]; ②用谷氨酸残基、带正电的赖氨酸残基或质子化的非标准氨基酸残基(γ-羧基酸、α-氨基乙二酸)替换跨膜区部分或全部天冬氨酸[10]。经序列调节产生的pHLIP衍生物, 如pHLIP变体3 (切除膜插入末端), 可减少pHLIP所带电荷, 加快pHLIP进入细胞膜形成跨膜螺旋的过程, 提高其肿瘤靶向性。pHLIP变体7, 在保持良好靶向性的同时加快在血液中的消除速度, 有利于实现药物的体内递送。可以借鉴当前pHLIP的序列调节方法发展更为先进的pHLIP衍生物。值得注意的是, pHLIP第14位、第25位天冬氨酸及第20位脯氨酸是其具有pH依赖靶向活性的重要结构, 当pHLIP序列中这三个位置的氨基酸发生改变后可能会使pHLIP失去膜插入活性[10]。
pHLIP多肽家族成员的序列一般含有天然和/或非天然氨基酸, 这些氨基酸在低pH条件下具有疏水性或呈现质子化状态。疏水残基保证了pHLIP与膜的亲和性, 质子化残基保证了pHLIP在中性pH条件下的水溶性[8, 11, 12]。作为一种适度疏水性肽, 正常pH条件下与细胞膜有高度亲和性, 但在低pH条件下可以折叠插入细胞膜, 可用于检测病变组织细胞表面pH[10, 13]。本文从单分子靶向转运和纳米载体靶向递送两方面对pHLIP的应用研究进行分述。pHLIP介导的载体递送系统见图 2。
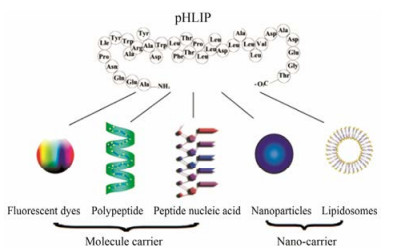
|
Figure 2 pHLIP-mediated carrier system |
pH降低促使pHLIP形成跨膜螺旋并插入细胞膜, 这一折叠过程可释放2 kJ·mol-1的能量[2], 这些能量可用于促进极性药物穿过细胞膜。多数药物分子通过二硫键连接在pHLIP插入末端, 转运到靶细胞中并在细胞质中释放, 如荧光染料、环肽、极性毒素和肽核酸等。pHLIP单分子靶向转运过程的跨膜环节具有以下特点:速度快、pH及浓度依赖性, 并且可通过调节pHLIP插入末端的疏水性调节其靶向性。
1.1 pHLIP介导荧光染料靶向转运研究用特定生物标记物标记肿瘤细胞表面, 研究发现生物标记物在肿瘤表面及肿瘤间的表达不同, 这影响了药物对肿瘤细胞的靶向性。健康组织细胞外pH约为7.4, 肿瘤细胞表面pH值存在梯度:靠近细胞膜处的pH最低(约6.0~6.2)[14], 随着与膜距离的增加, pH逐渐升高, 所以将荧光染料与pHLIP连接形成的荧光探针可靶向肿瘤细胞。
pHLIP荧光探针曾被广泛用于不同肿瘤模型系统的靶向研究, 如pHLIP与近红外荧光染料Alexa750结合形成的荧光探针可以靶向胰腺导管腺瘤。有学者[15, 16]将pH敏感型pHLIP变体7与近红外荧光染料Alexa750结合, 基于人S2VP10和S2013胰腺癌异种移植模型鼠的多光谱光声层析成像技术(multispectral optoacoustic tomography, MSOT)分析表明, 形成的荧光探针对模型鼠的胰腺导管瘤有靶向作用, 首次实现了MSOT对pH敏感靶向探针体内分布的表征。这一研究预示MSOT和其他酸敏感靶向制剂的联合使用可用于提高胰腺导管腺癌的成像效果, 同时也可尝试将酸敏感靶向制剂与MSOT联用的方法用于其他实体肿瘤成像。Cruz-Monserrate等[17, 18]使用荧光标记的pHLIPs作为胰腺导管腺癌的成像方法, 发现在人移植瘤胰腺导管腺癌病变的基因工程模型鼠的病变组织中可检测到荧光标记的pHLIP, 说明pHLIP介导荧光染料可用于胰腺癌诊断。目前胰腺导管腺癌的常规诊断需要进行伤害性检查(如内镜超声检查), 常规诊断的风险高但准确性相对较低, 使用pHLIP荧光探针对实体肿瘤进行成像不仅可以提高癌症诊断的准确性而且降低了诊断的伤害性。
pHLIP荧光探针还可作为乳腺癌的成像工具, 有学者在皮下注射4T1细胞的乳腺癌模型鼠肿瘤部位检测到荧光标记的pHLIP, 表明pHLIP介导荧光染料可用于乳腺癌的诊断[17, 18]。Tapmeier等[19]将pHLIP变体3与Alexa546荧光染料组装成pHLIP-Alexa546探针, 该探针以序列特异性方式靶向自发性乳腺癌BALB/neu-T模型鼠肿瘤细胞。使用核磁共振波谱分析, 结果显示pHLIP变体3只在pH低于6.7的肿瘤组织中有保留, 说明pHLIP可特异性识别pH较低的肿瘤组织。Adochite等[20]选用4T1乳腺癌异种移植的BALB/c模型鼠对3种pHLIP变体(变体3、变体7和WT)与8种荧光染料[Alexa546、Alexa647、Alexa750、Cy5.5、DyLight 680、DyLight 680 4×PEG-conjugate (DyP680)、IRDye®680RD (IR680)及IRDye®800CW (IR800)]所形成共聚物的生物分布及肿瘤靶向性进行研究。结果表明, 荧光标记的pHLIP均具有明显的肿瘤靶向性, 其中Alexa546与pHLIP所形成共聚物的肿瘤靶向性最好且在肝脏、肾脏和肌肉中积累较少。该课题组给模型鼠注射荧光标记的pHLIP, 发现24 h后模型鼠肌肉和肝脏组织中的荧光信号逐渐减弱, 而肿瘤组织和肾脏中荧光信号基本不变, 表明荧光标记的pHLIP在pH值正常的组织中可被清除, 这对未来pHLIP靶向成像用于临床研究具有重要意义。
Golijanina等[21]用吲哚花青绿ICG标记pHLIP, 进行人膀胱上皮癌及根治性膀胱切除术癌前期病变靶向研究。发现ICG-pHLIP对肌层浸润性和非肌层浸润性膀胱上皮癌均具有靶向作用, 且目前研究未发现ICG-pHLIP对非肿瘤组织有损害作用, 所以使用ICG-pHLIP成像有助于膀胱癌早期诊断。同时发现ICG-pHLIP对根治性膀胱切除术癌前期病变也具有准确的靶向性, 其灵敏性高达97%, 专属性达100%, 但假如靶向膀胱癌假阳性坏死组织的专属性降低至80%。ICG-pHLIP有望用于尿道上皮癌早期检测, 同时ICG-pHLIP靶向成像的成功为膀胱癌靶向治疗提供了可能性。
1.2 多肽类 1.2.1 毒素鹅膏蕈碱具有体外抑癌作用, 但因具有一定极性不可穿过细胞膜, 且易被肝细胞选择性吸收导致肝损伤, 所以临床应用受限。pHLIP可靶向酸性病变组织如肿瘤和炎症部位, 为细胞不可渗透性药物的抗癌研究提供了可能。pHLIP介导α-鹅膏蕈碱进入癌细胞后以pH依赖方式引起癌细胞凋亡[22], 从而发挥抗癌作用。
鹅膏蕈碱与反人类上皮细胞黏膜抗体结合后, 有抑制细胞增殖及胰腺瘤生长的作用。将鹅膏蕈碱通过二硫键与pHLIP插入末端(羧基端)连接, 可将鹅膏蕈碱靶向转运到癌细胞中, 并通过二硫键的裂解将鹅膏蕈碱释放到细胞质中诱导细胞凋亡[22]。Moshnikova等[23]提出pHLIP以pH依赖方式介导极性毒素RNA聚合酶Ⅱ抑制剂α-鹅膏蕈碱进入肿瘤细胞, 并在48 h内诱导癌细胞凋亡。水溶性肽pHLIP折叠产生的能量可用来将细胞不可渗透性药物α-鹅膏蕈碱以跨膜转运的方式转运到癌细胞的细胞质中。
1.2.2 环肽pHLIP可促进鬼笔环肽的易位, 介导鬼笔环肽进入肿瘤细胞并抑制肿瘤细胞增殖。将鬼笔环肽连接在pHLIP羧基末端, 在微酸性条件下pHLIP成功介导鬼笔环肽进入靶细胞并通过二硫键的裂解将鬼笔环肽释放到靶细胞的细胞质中[24]。为了更易发挥鬼笔环肽的抗癌作用, 可通过调节疏水链的长度来改变药物分子的极性, 从而扩大极性药物的应用。Wijesinghe等[7]首次尝试通过二元胺的连接调节疏水链的长度从而调整极性药物鬼笔环肽的疏水性。使用生物物理学方法和荧光显微镜法对实验进行观察, 结果表明pHLIP可以穿过脂质囊泡及癌细胞的细胞膜, 将连接在其羧基末端的极性环肽递送至靶细胞。在低pH条件下, 连接在pHLIP羧基末端的类鬼笔环肽药物以浓度依赖方式抑制癌细胞增殖。此研究为极性药物的抗癌应用提供了新的思路, 除对靶向载体的结构进行调节外也可尝试通过调节药物的疏水性来提高药物靶向转运的能力。
1.2.3 微管抑制因子微管抑制因子单甲基澳瑞他汀E (monomethylauristatin E, MMAE)对乳腺肿瘤细胞具有强大的细胞毒性, pHLIP与MMAE结合形成pHLIP-MMAE后可在不引起明显质膜扰动的前提下以浓度和pH依赖方式抑制癌细胞增殖。相比生理pH值, 在低pH条件下pHLIP-MMAE对癌细胞的抗增殖作用更强。Burns课题组[25]使用Fmoc固相合成法合成pHLIP (WT)及pHLIP变体[pHLIP (D25E)] (表 1), 使用反向高效液相色谱仪对pHLIP (WT)及其变体pHLIP (D25E)进行纯化, 并通过电离飞行时间质谱仪进行检测, 证明pHLIP及其变体pHLIP (D25E)成功合成。然后将MMAE与pHLIP (WT)及pHLIP (D25E)分别连接得到共聚物pHLIP (WT)-MMAE和pHLIP (D25E)-MMAE。使用HeLa和MDA-MB-231细胞进行实验, 在低pH条件下, pHLIP (WT)-MMAE可有效抑制HeLa细胞和MDA-MB-231乳腺癌细胞增殖; 而在pH 7.4条件下, pHLIP (WT)-MMAE及pHLIP (D25E)-MMAE对这两种细胞几乎没有增殖抑制作用。使用MDA-MB-231异种移植模型鼠对Alexa750-pHLIP (WT)-MMAE的体内肿瘤靶向性进行评价, 静脉注射后在模型鼠肿瘤组织中发现荧光标记的pHLIP (WT)-MMAE, 证明pHLIP (WT)-MMAE体内肿瘤靶向性的存在。该课题组[26]进一步使用Fmoc固相合成法合成了pHLIP变体pHLIP (WT)、pHLIP (D25E)、pHLIP (P20G)、pHLIP (R11Q)、pHLIP (R11Q; D14Up)和pHLIP (D14Gla; D25Aad) (表 1), 将微管抑制因子单甲基澳瑞他汀F (monomethyl auristatin F, MMAF)与以上6种pHLIP变体分别连接, 得到6种不同共聚物: pHLIP (WT)-MMAF、pHLIP (D25E)-MMAF、pHLIP (P20G)-MMAF、pHLIP (R11Q)-MMAF、pHLIP (R11Q; D14Up)-MMAF和pHLIP (D14Gla; D25Aad)-MMAF。使用HeLa细胞进行细胞毒性实验, 发现6种pHLIP-MMAF共聚物均具有pH选择性及浓度依赖性, 且在低pH条件下的细胞毒性均大于生理pH条件下的细胞毒性。在低pH条件下, pHLIP (WT)-MMAF的肿瘤增殖抑制作用最强, pHLIP (D25E)-MMAF肿瘤增殖抑制作用弱于pHLIP (WT)-MMAF, 且pH选择性最低。基于HeLa异种移植及携带表皮样癌A431的肿瘤模型鼠, 该课题组对pHLIP (WT)-MMAF的体内治疗效果进行评价, 发现pHLIP (WT)-MMAF在一定浓度内可有效抑制HeLa异种移植模型鼠肿瘤的生长, 但对携带表皮样癌A431肿瘤模型鼠作用较弱, 这可能源于表皮样癌A431细胞对澳瑞他汀的敏感性较低。Burns课题组[26]使用Fmoc固相合成法成功合成了pHLIP及其衍生物, 解决了pHLIP由于肽链长及疏水性强难合成这一问题。另外从该课题组的研究中可以发现在这些实验条件下, pHLIP变体的肿瘤抑制作用虽然弱于pHLIP (WT), 但是不同pHLIP变体与奥瑞他汀所形成的共聚物在不同pH条件下对不同癌细胞株的治疗效果之间存在差异, 所以可以通过调节pHLIP (WT)的序列发展更为优良的pHLIP变体, 进一步用于奥瑞他汀抗癌治疗作用的研究。
| Table 1 Sequences of pHLIP variants[26] |
蛋白酶激活受体(protease-activated receptor, PAR1)与多种肿瘤侵袭及转移相关, 被学者们视为肿瘤治疗的一个靶点。P1AP肽是一种PAR1异构肽, 该异构肽可抑制PAR1的表达。Burns课题组[27]证实P1AP与pHLIP的偶联物(pHLIP-P1AP)以浓度及pH依赖方式抑制PAR1的活性并诱导肿瘤细胞凋亡。该课题组进行流式细胞术分析, 结果表明MDA-MB-231细胞表面高表达PAR1, 而MCF7和HeLa细胞则几乎不表达PAR1。pHLIP-P1AP的处理结果显示, 在低pH和正常pH条件下, MCF7和HeLa细胞活性均无显著差异。相反, MDA-MB-231细胞在低pH条件增殖明显受到抑制。可见, pHLIP-P1AP的抗增殖作用与细胞表面PAR1的表达水平相关。在此基础上, 该课题组[28]借助pHLIP的导引对不同抗菌肽[KLAK、KGGK、KKKK、KAAK、KLLK、(KLAKLAK)2及KLAKLAK]抗癌细胞增殖作用进行评价。在发现低pH条件下, pHLIP-KLAK以浓度和pH依赖方式抑制MDA-MB-231肿瘤细胞增殖。但生理pH条件下, pHLIP-KLAK不影响MDA-MB-23细胞的活性。此外, 在所有pHLIP-4氨基酸抗菌肽共聚物中, pHLIP-KGGK的细胞增殖抑制作用最强, 这是由于pHLIP-KGGK共聚物的酸性更强。pHLIP-(KLAKLAK)2和pHLIP-KLAKLAK共聚物相比其他pHLIP-抗菌肽共聚物具有更强的细胞增殖抑制作用, 研究显示, 这两种共聚物并不是通过破坏肿瘤细胞膜的完整性诱导细胞凋亡, 而是以pH依赖方式穿过细胞膜、扰乱线粒体膜电位从而发挥抗增殖作用。Burns课题组[28]的研究首次实现了使用pHLIP转运膜受体调节肽, 尽管目前研究只针对PAR1受体, 但人类基因中包括100多个受体, 所以利用pHLIP介导多肽靶向于肿瘤细胞表达的蛋白酶激活受体颇有希望。
1.3 肽核酸反义核酸(microRNA antagonists, anti-miR)可通过影响多种基因的表达治疗癌症, 然而只有将anti-miR运送至肿瘤细胞内才能发挥抗癌作用。但是, anti-miR分子一般较大且有极性, 所以难以转运至细胞内。Wagner等[29]进行了pHLIP介导anti-miR寡聚核苷酸肽的体内靶向性研究。将anti-miR-155肽核酸通过二硫键连接在pHLIP末端, 从而把anti-miR-155肽核酸转运至肿瘤细胞内。实验表明, 细胞摄取及pHLIP-anti-miR肽核酸转运只能在细胞外pH 6.2环境下进行, 生理条件(pH 7.4)下则不能发生。此外, 寡聚核苷酸肽药物还可用于自发弥散性转基因淋巴瘤模型鼠。Cheng等[30]构建了表达miR-155的转基因模型鼠(mir-155LSLtTA模型鼠), 这种mir-155LSLtTA模型鼠在2~3个月龄时可发育成弥散性淋巴瘤模型鼠。研究显示, 连接pHLIP后anti-miR肽核酸在肝脏中的分布显著降低。同时观察到pHLIP-anti-miR具有肾脏靶向作用, 这可能是由于肾小管呈微酸性。该课题组随后又证明了pHLIP-anti-miR-155可抑制mir-155LSLtTA模型鼠肿瘤细胞增殖。静脉注射低剂量pHLIP-anti-miR-155可以抑制皮下淋巴瘤生长及转移, 不连接pHLIP的anti-miR-155肽核酸则没有此作用。pHLIP的介导解决了anti-miR较大分子尺寸和极性阻碍细胞跨膜转运的难题, 开创了anti-miR抗癌研究的新传递方式。
HOX转录反义RNA (HOTAIR)与癌症发生密切相关, Özeş等[31]设计合成了一种具有降低HOTAIR表达的肽核酸, 记为PNA3。研究表明PNA3可沉默HOTAIR的表达, 但难以直接靶向肿瘤微酸环境。为此, 该课题组将pHLIP与PNA3连接形成pHLIP-PNA3, 使用高度耐铂卵巢癌细胞(A2780_CR5)进行实验, 发现pHLIP-PNA3在pH 6.0条件下可明显降低A2780_CR5细胞的存活率, 而在生理pH条件下, 对A2780_CR5细胞无明显影响。此外, pHLIP-PNA3可恢复A2780_CR5细胞对化疗药物顺铂(CDDP)的敏感性。基于携带A2780_CR5细胞模型鼠的研究发现, pHLIP-PNA3与CDDP联合使用可使模型鼠肿瘤体积减小, 并且显著提高模型鼠的存活率。
心肌肥大、心力衰竭及心肌缺血等均与miRNA失调相关, pHLIP-anti-miR靶向转运研究具有治疗心脏疾病的潜力。Bernardo等[32, 33]使用心力衰竭模型鼠、冠状动脉阻塞心肌缺血模型鼠及低流速心肌缺血模型鼠等进行研究, 结果表明pH敏感型WT-pHLIP、pHLIP变体3及附着有WT-pHLIP的脂质体均只对病变心肌组织有靶向作用, 而非pH敏感型K-pHLIP变体7及附着有PEG的脂质体对病变心肌组织及正常心肌组织无选择性靶向作用。pHLIP-anti-miR肽核酸的构建为未来anti-miR偶联药物的研究提供了新思路。
2 靶向纳米载体递送系统的研究除了上述荧光探针等分子外, pHLIP也可介导纳米载体靶向转运至细胞表面, 如纳米粒和脂质体。
2.1 金纳米系统金纳米粒是一种优良的新型纳米载体, 其粒径一般在1~150 nm, 具有毒性低、易于与药物分子结合且制备简单等优点。这种载体可用于小分子药物及生物大分子药物的靶向递送[34], 在药物靶向递送系统中具有广阔应用前景。Davies等[35]报道过一种与pHLIP有关的新型纳米载体递送系统pHLIP-EuL-Au, 这种纳米载体递送系统由pHLIP、发光铕络合物和金纳米粒组成, 其中金纳米粒作为发光络合物和pHLIP的连接中介。这种新型纳米载体递送系统可将每个纳米粒中大约640镧系探针传递并内化至血小板。在此基础上, 该课题组进一步研究发现这种纳米载体递送系统只靶向pH 6.5的异常血小板而对pH 7.4的正常血小板无靶向作用, 说明这种pHLIP纳米载体递送系统对微酸环境具有靶向性。
金纳米粒在肿瘤诊疗领域的应用非常广泛, 有学者[36, 37]将纳米金共价结合在pHLIP的氨基末端形成纳米金-pHLIP偶联物, 并对纳米金-pHLIP偶联物和未连接pHLIP的纳米金粒子进行肿瘤靶向性比较。研究表明无论是血管内给药还是肿瘤内给药, 纳米金-pHLIP偶联物的肿瘤靶向性都明显优于未连接pHLIP的纳米金粒子。Antosh等[38]使用A594细胞对pHLIP-纳米金与纳米金的肿瘤细胞摄取率进行分析。结果发现, 与纳米金的细胞摄取率相比, pHLIP-纳米金的细胞摄取率显著提高(约34%)。随后该课题组又比较了正常生理pH条件下(pH 7.4)与微酸条件下(pH 6.0) pHLIP-纳米金的细胞摄取率, 发现微酸条件下pHLIP-纳米金的细胞摄取率相比正常生理pH条件提高了53%。Yu等[39]使用静电学方法成功将二氢卟酚e6 (Ce6)和pHLIP同时吸附于空心金纳米球(HAuNS)表面, 合成具有pH靶向性及NIR光热治疗效果的HAuNS-pHLIP-Ce6。在激光照射5 min内HAuNS-pHLIP-Ce6便可对肿瘤产生光热治疗作用, 随后由于静电作用的减弱将药物释放于靶细胞中。近期, 有报道用pHLIPs修饰金纳米星(GNS), 成功设计了一种pH应答式多功能纳米制剂GNS-pHLIP。使用MCF-7细胞及其模型动物对GNS-pHLIP的体外及体内靶向性进行研究, 在pH 6.4条件下GNS-pHLIP的细胞内化作用相比GNS提高了1倍。GNS-pHLIP在模型动物肿瘤部位的积累量较GNS-mPEG显著增加, 且光热治疗后具有明显肿瘤抑制作用[40]。由此可见, GNS-pHLIP在肿瘤成像及治疗中具有良好的潜在应用价值。
2.2 脂质体Reshetnyak课题组[41]首次将pHLIP修饰于脂质体表面, 用于介导神经酰胺的选择性传递。研究显示pHLIP修饰的脂质体可促进pH依赖的细胞膜融合及脂质交换, 使细胞摄取率及载体中的负载药物释放度提高, 进而实现细胞增殖抑制。基于缺血模型小鼠的实验证明, pHLIP修饰于脂质体后可靶向酸性缺血组织, 而该载体对正常心肌组织没有靶向性, 将脂质体与PEG结合的形式对酸性缺血组织则没有靶向性[32]。
该团队的另一项研究证实, 联合pHLIP与脂质体可选择性地将短杆菌肽靶向转运到癌细胞。短杆菌肽插入癌细胞的细胞膜后可使质子流进细胞质, 扰乱其他一价阳离子(如钠离子和钾离子)进出细胞膜的动态平衡, 进而导致细胞凋亡[42]。这说明细胞内外空间离子平衡对于维持细胞正常功能非常重要, 离子膜电导率的变化将导致细胞凋亡。但是, 只有在低pH条件下, pHLIP修饰的载短杆菌肽脂质体才具有这种促凋亡效应。在微酸环境下, pHLIP插入细胞膜促使载有短杆菌肽的脂质体膜与细胞膜融合, 从而使短杆菌肽插入肿瘤细胞膜并在细胞膜上形成纳米孔扰乱细胞膜离子平衡诱导癌细胞凋亡[40]。
2.3 其他有学者将含有游离半胱氨酸的pHLIP连接于载多柔比星介孔硅纳米粒表面(pHLIPss-MSN)[43]。研究显示, 在生理pH 7.4条件下, pHLIPss-MSN纳米载体与细胞膜松散结合; 在pH 6.5条件下, pHLIPss以螺旋形式插入到脂膜, 随后将载有药物的MSN迅速转运到细胞内, 最后通过二硫键裂解及pHLIP解离将药物释放到细胞质。该研究对pHLIPss-MSN的血清中稳定性进行考察, 结果显示, 随着孵育时间延长, pHLIPss-MSN和pHLIPss的转运能力均逐渐降低, 12 h后pHLIPss-MSN在低pH条件下仍然具有促转运效果, 而pHLIPss不再具有该作用, 说明MSN可抑制pHLIPss在血清中分解, 更有效地保留其跨膜转运功能。
超顺磁性氧化铁纳米粒(superparamagnetic iron oxide nanoparticles, SPION)是一种用于非侵入性肿瘤核磁共振成像(magnetic resonance imaging, MRI)的造影剂, Wei等[44]将PEG化的极性右旋赖氨酸(poly-D-lysine, PDL)、pHLIP和SPION组装构建一种pH敏感型SPION纳米粒SPION-PDL-pHLIP。该课题组选用Bel-7402肝癌细胞进行实验, 结果表明在酸性环境下pHLIP可提高SPION的细胞累积量。在此基础上, 对SPION-PDL-pHLIP的体内肿瘤靶向性进行考察, 基于肝癌H22肿瘤模型鼠和人黑色素瘤B16-F1模型鼠的核磁共振及荧光成像结果表明, SPION-PDL-pHLIP选择性积聚在肿瘤部位, 使肿瘤部位的MIR成像对比度显著增强, MRI的敏感性和特异性均得到提高。
与pHLIP作为单分子转运体(单个药物分子与单个pHLIP连接)相比, pHLIP介导纳米载体(多个pHLIP附着于纳米载体表面)的靶向转运能够发挥多个pHLIP的协同作用, 更有效地促进细胞膜变形[2]。pHLIP介导的纳米载体可促进脂质交换膜融合, 同时将疏水药物转运至细胞膜亦或将极性药物转运至细胞质。
3 结论借助化疗方法治疗癌症的最大问题是药物给健康组织带来的毒性, 使用pHLIP将药物以低pH依赖方式靶向转运至癌细胞, 在保证药物对癌细胞有杀伤效应的前提下大大减小了其对健康组织的毒性。pHLIPs家族具有非常广阔的应用前景, 不仅可用于靶向酸性病变组织, 还可通过改变氨基酸序列调节pHLIP性质, 进而调节其药动学特性及靶向性。此外, pHLIP可用于研究新型药物递送系统: ①单分子转运研究可适用于将极性药物传递到病变组织; ② pHLIPs与脂质体或纳米粒的结合可促进细胞膜变形融合, 有效运送药物至细胞质或细胞膜。
| [1] | Hashim AI, Zhang X, Wojtkowiak JW, et al. Imaging pH and metastasis[J]. NMR Biomed, 2011, 24: 582–591. |
| [2] | Andreev OA, Engelman DM, Reshetnyak YK. Targeting diseased tissues by pHLIP insertion at low cell surface pH[J]. Front Physiol, 2014, 5: 97. |
| [3] | Hunt JF, Earnest TN, Bousché O, et al. A biophysical study of integral membrane protein folding[J]. Biochemistry, 1997, 36: 15156–15176. DOI:10.1021/bi970146j |
| [4] | Reshetnyak YK, Segala M, Andreev OA, et al. A monomeric membrane peptide that lives in three worlds:in solution, attached to, and inserted across lipid bilayers[J]. Biophys J, 2007, 93: 2363–2372. DOI:10.1529/biophysj.107.109967 |
| [5] | Barrera FN, Weerakkody D, Anderson M, et al. Roles of carboxyl groups in the transmembrane insertion of peptides[J]. J Mol Biol, 2011, 413: 359–371. DOI:10.1016/j.jmb.2011.08.010 |
| [6] | Karabadzhak AG, Weerakkody D, Wijesinghe D, et al. Modulation of the pHLIP transmembrane helix insertion pathway[J]. Biophys J, 2012, 102: 1846–1855. DOI:10.1016/j.bpj.2012.03.021 |
| [7] | Wijesinghe D, Engelman DM, Andreev OA, et al. Tuning a polar molecule for selective cytoplasmic delivery by a pH (low) insertion peptide[J]. Biochemistry, 2011, 50: 10215–10222. DOI:10.1021/bi2009773 |
| [8] | Andreev OA, Dupuy AD, Segala M, et al. Mechanism and uses of a membrane peptide that targets tumors and other acidic tissues in vivo[J]. Proc Natl Acad Sci U S A, 2007, 104: 7893–7898. DOI:10.1073/pnas.0702439104 |
| [9] | Weerakkody D, Moshnikova A, Thakur MS, et al. Family of pH (low) insertion peptides for tumor targeting[J]. Proc Natl Acad Sci U S A, 2013, 110: 5834–5839. DOI:10.1073/pnas.1303708110 |
| [10] | Musial-Siwek M, Karabadzhak A, Andreev OA, et al. Tuning the insertion properties of pHLIP[J]. Biochim Biophys Acta, 2010, 1798: 1041–1046. DOI:10.1016/j.bbamem.2009.08.023 |
| [11] | Andreev OA, Karabadzhak AG, Weerakkody D, et al. pH (Low) insertion peptide (pHLIP) inserts across a lipid bilayer as a helix and exits by a different path[J]. Proc Natl Acad Sci U S A, 2010, 107: 4081–4086. DOI:10.1073/pnas.0914330107 |
| [12] | Thévenin D, An M, Engelman DM. pHLIP-mediated translocation of membrane-impermeable molecules into cells[J]. Chem Biol, 2009, 16: 754–762. DOI:10.1016/j.chembiol.2009.06.006 |
| [13] | Scott HL, Nguyen VP, Alves DS, et al. The negative charge of the membrane has opposite effects on the membrane entry and exit of pH-low insertion peptide[J]. Biochemistry, 2015, 54: 1709–1712. DOI:10.1021/acs.biochem.5b00069 |
| [14] | Deacon JC, Engelman DM, Barrera FN. Targeting acidity in diseased tissues:mechanism and applications of the membrane-inserting peptide, pHLIP[J]. Arch Biochem Biophys, 2015, 565: 40–48. DOI:10.1016/j.abb.2014.11.002 |
| [15] | Reshetnyak YK. Imaging tumor acidity:pH-low Insertion peptide probe for optoacoustic tomography[J]. Clin Cancer Res, 2015, 21: 4502–4504. DOI:10.1158/1078-0432.CCR-15-1502 |
| [16] | Kimbrough CW, Khanal A, Zeiderman M, et al. Targeting acidity in pancreatic adenocarcinoma:multispectral optoacoustic tomography detects pH-low insertion peptide probes in vivo[J]. Clin Cancer Res, 2015, 21: 4576–4585. DOI:10.1158/1078-0432.CCR-15-0314 |
| [17] | Cruz-Monserrate Z, Roland CL, Deng D, et al. Targeting pancreatic ductal adenocarcinoma acidic microenvironment[J]. Sci Rep, 2014, 4: 4410. |
| [18] | Karabadzhak AG, An M, Yao L, et al. pHLIP-FIRE, a cell insertion-triggered fluorescent probe for imaging tumors demonstrates targeted cargo delivery in vivo[J]. ACS Chem Biol, 2014, 9: 2545–2553. DOI:10.1021/cb500388m |
| [19] | Tapmeier TT, Moshnikova A, Beech J, et al. The pH low insertion peptide pHLIP variant 3 as a novel marker of acidic malignant lesions[J]. Proc Natl Acad Sci U S A, 2015, 112: 9710–9715. DOI:10.1073/pnas.1509488112 |
| [20] | Adochite RC, Moshnikova A, Golijanin J, et al. Comparative study of tumor targeting and biodistribution of pH (low) insertion peptides (pHLIP® peptides) conjugated with different fluorescent dyes[J]. Mol Imag Biol, 2016, 18: 686–696. DOI:10.1007/s11307-016-0949-6 |
| [21] | Golijanina J, Aminc A, Moshnikovab A, et al. Targeted imaging of urothelium carcinoma in human bladders by an ICG pHLIP peptide ex vivo[J]. Proc Natl Acad Sci U S A, 2016, 113: 11829–11834. DOI:10.1073/pnas.1610472113 |
| [22] | Moldenhauer G, Salnikov AV, Lüttgau S, et al. Therapeutic potential of amanitin-conjugated anti-epithelial cell adhesion molecule monoclonal antibody against pancreatic carcinoma[J]. J Natl Cancer Inst, 2012, 104: 622–634. DOI:10.1093/jnci/djs140 |
| [23] | Moshnikova A, Moshnikova V, Andreev OA, et al. Anti-proliferative effect of pHLIP-amanitin[J]. Biochemistry, 2013, 52: 1171–1178. DOI:10.1021/bi301647y |
| [24] | Reshetnyak YK, Andreev OA, Lehnert U, et al. Translocation of molecules into cells by pH-dependent insertion of a transmembrane helix[J]. Proc Natl Acad Sci U S A, 2006, 103: 6460–6465. DOI:10.1073/pnas.0601463103 |
| [25] | Burns KE, Robinson MK, Thévenin D. Inhibition of cancer cell proliferation and breast tumor targeting of pHLIP-monomethyl auristatin E conjugates[J]. Mol Pharm, 2015, 12: 1250–1258. DOI:10.1021/mp500779k |
| [26] | Burns KE, Hensley H, Robinson MK, et al. Therapeutic efficacy of a family of pHLIP-MMAF conjugates in cancer cells and mouse models[J]. Mol Pharm, 2017, 14: 415–422. DOI:10.1021/acs.molpharmaceut.6b00847 |
| [27] | Burns KE, Thévenin D. Down-regulation of PAR1 activity with a pHLIP-based allosteric antagonist induces cancer cell death[J]. Biochem J, 2015, 472: 287–295. DOI:10.1042/BJ20150876 |
| [28] | Burns KE, McCleerey TP, Thévenin D. pH-selective cytotoxicity of pHLIP-antimicrobial peptide conjugates[J]. Sci Rep, 2016, 6: 28465. DOI:10.1038/srep28465 |
| [29] | Wagner E. Tumor-targeted delivery of anti-microRNA for cancer therapy:pHLIP is key[J]. Angew Chem Int Ed Engl, 2015, 54: 5824–5826. DOI:10.1002/anie.201502146 |
| [30] | Cheng CJ, Bahal R, Babar IA, et al. MicroRNA silencing for cancer therapy targeted to the tumour microenvironment[J]. Nature, 2015, 518: 107–110. DOI:10.1038/nature13905 |
| [31] | Özeş AR, Wang Y, Zong X, et al. Therapeutic targeting using tumor specific peptides inhibits long non-coding RNA HOTAIR activity in ovarian and breast cancer[J]. Sci Rep, 2017, 7: 894. DOI:10.1038/s41598-017-00966-3 |
| [32] | Bernardo BC, Ooi JY, Lin RC, et al. miRNA therapeutics:a new class of drugs with potential therapeutic applications in the heart[J]. Future Med Chem, 2015, 7: 1771–1792. DOI:10.4155/fmc.15.107 |
| [33] | Sosunov EA, Anyukhovsky EP, Sosunov AA, et al. pH (Low) insertion peptide (pHLIP) targets sischemic myocardium[J]. Proc Natl Acad Sci U S A, 2013, 110: 82–86. DOI:10.1073/pnas.1220038110 |
| [34] | Cui T, Hong J, Ding Y, et al. Polymer-modified gold nanoparticles for cancer therapy[J]. Acta Pharm Sin (药学学报), 2016, 51: 281–286. |
| [35] | Davies A, Lewis DJ, Watson SP, et al. pH-controlled delivery of luminescent europium coated nanoparticles into platelets[J]. Proc Natl Acad Sci U S A, 2012, 109: 1862–1867. DOI:10.1073/pnas.1112132109 |
| [36] | Kyrychenko A. NANOGOLD decorated by pHLIP peptide:comparative force field study[J]. Phys Chem Chem Phys, 2015, 17: 12648–12660. DOI:10.1039/C5CP01136A |
| [37] | Yao L, Daniels J, Moshnikova A, et al. pHLIP peptide targets nanogold particles to tumors[J]. Proc Natl Acad Sci U S A, 2013, 110: 465–470. DOI:10.1073/pnas.1219665110 |
| [38] | Antosh MP, Wijesinghe DD, Shrestha S, et al. Enhancement of radiation effect on cancer cells by gold-pHLIP[J]. Proc Natl Acad Sci U S A, 2015, 112: 5372–5376. DOI:10.1073/pnas.1501628112 |
| [39] | Yu M, Guo F, Wang J, et al. A pH-driven and photorespon sivenanocarrier:remotely-controlled by near-infrared light for stepwise antitumor treatment[J]. Biomaterials, 2016, 79: 25–35. DOI:10.1016/j.biomaterials.2015.11.049 |
| [40] | Tian Y, Zhang Y, Teng Z, et al. pH-Dependent transmembrane activity of peptide-functionalized gold nanostars for computed tomography/photoacoustic imaging and photothermal therapy[J]. ACS Appl Mater Interfaces, 2017, 9: 2114–2122. DOI:10.1021/acsami.6b13237 |
| [41] | Yao L, Daniels J, Wijesinghe D, et al. pHLIP®-mediated delivery of PEGylated liposomes to cancer cells[J]. J Control Release, 2013, 167: 228–237. DOI:10.1016/j.jconrel.2013.01.037 |
| [42] | Wijesinghe D, Arachchige MC, Lu A, et al. pH Dependent transfer of nano-pores into membrane of cancer cells to induce apoptosis[J]. Sci Rep, 2013, 3: 3560. DOI:10.1038/srep03560 |
| [43] | Zhao Z, Meng H, Wang N, et al. A controlled-release nanocarrier with extracellular pH value driven tumor targeting and translocation for drug delivery[J]. Angew Chem Int Ed Engl, 2013, 52: 7487–7491. DOI:10.1002/anie.201302557 |
| [44] | Wei Y, Liao R, Mahmood AA, et al. pH-responsive pHLIP (pH low insertion peptide) nanoclusters of superparamagnetic iron oxide nanoparticles as a tumor-selective MRI contrast agent[J]. Acta Biomater, 2017, 55: 194–203. DOI:10.1016/j.actbio.2017.03.046 |
 2018, Vol. 53
2018, Vol. 53


