2. 美国休斯顿卫理公会研究所, 休斯顿 Tx 77054;
3. 日本冲绳科学技术大学院大学, 冲绳 904-0495
2. Houston Methodist Research Institute, Tx 77054, USA;
3. Okinawa Institute of Science and Technology Graduate University, Okinawa 904-0495, Japan
光动力学治疗(photodynamic therapy, PDT)自20世纪70年代开始应用于人类肿瘤的治疗, 经过40多年的努力已经取得了大量的研究成果, 并在临床上得到了广泛的应用, 发展成为继手术、化疗和放疗之后又一治疗肿瘤的重要手段。PDT涉及光敏剂、激发光和氧气3个基本元素, 其基本原理:首先, 光敏剂经过适当的光照激发后从基态跃迁至单线态, 然后通过“系间穿越”形成能量稍低的三线态。相比单线态, 三线态更加稳定、寿命更长, 能够直接与生物大分子或者细胞膜作用而形成自由基, 进而与氧气反应生成超氧自由基、过氧化氢、羟基自由基等活性物(Ⅰ型机制); 三线态也可直接将能量传递给氧气生成活性成分单线态氧(singlet oxygen, 1O2) (Ⅱ型机制), 通常认为1O2是PDT的主要活性成分[1, 2]。
在PDT的3个基本元素中, 光敏剂最为关键, 也是限制其在临床上广泛应用的主要瓶颈。目前临床上使用的光敏剂仍以卟啉类衍生物为主, 其激发波长大多在紫外和可见光区(单光子激发), 而在光动力学治疗窗(650~950 nm)的消光系数却较低, 对组织的穿透能力弱(仅数毫米), 并且容易对正常组织造成光损伤, 极大地限制了PDT在临床上的应用。双光子PDT采用近红外光(600~900 nm)作为光源, 由于近红外光较少被血红蛋白、水等物质吸收, 组织穿透能力强, 能够有效增加治疗深度(2 cm); 同时近红外光可以显著降低对正常组织光损伤的风险, 能够有效克服上述难题。
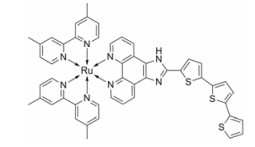
卟啉类衍生物是最早进行双光子光敏剂研究的对象, 作为临床上已广泛使用的光敏剂, 其生物安全性比较可靠。卟啉类衍生物通过延伸共轭体系显著提升了双光子吸收截面(two-photon absorption crosssection, σ), 但仍然面临两个主要问题:水溶性差, 影响细胞摄取; 在水溶液中易聚集引起荧光淬灭。金属(铱、钌)配合物具有较好的水溶性和脂水分配系数, 有利于细胞摄取, 但是其σ不足, 在一定程度上限制了其在双光子PDT中的应用[3]。另外, 纳米技术也广泛应用于改善光敏剂光物理学性质上, 目前报道的用于双光子PDT的纳米粒主要包括半导体量子点、碳纳米材料、二氧化硅基纳米颗粒、金纳米颗粒和聚合物纳米材料等[4]。本文主要对近年来钌多吡啶类配合物在该领域的进展进行全面的总结。钌多吡啶类配合物具有良好的水溶性、生物相容性、易于结构修饰、有效的1O2产生能力、较高的热稳定性、较长的三线态寿命和潜在的双光子吸收性质等优势, 在光敏剂的研发中备受关注[5]。最近, TLD1433 (图 1)成为首个获批进入临床试验阶段的钌多吡啶类光敏剂, 用于非肌肉浸润性膀胱癌的光动力学治疗, 0.6 mg·mL-1 TLD1433经525 nm光照激发(90 J·cm-2)能够诱导大多数肿瘤的全深度坏死, 由于采用单光子激发治疗深度仅有1 mm, 并且容易引起治疗部位周围正常组织发生局部炎症反应[6]。尽管TLD1433未能实现双光子PDT, 但也极大地鼓舞了该领域的研发热情。相比于在单光子PDT中的应用, 钌多吡啶类配合物在双光子PDT中的应用起步较晚, 但近年来呈现高速发展的态势。
|
Figure 1 he structure of TLD1433 |
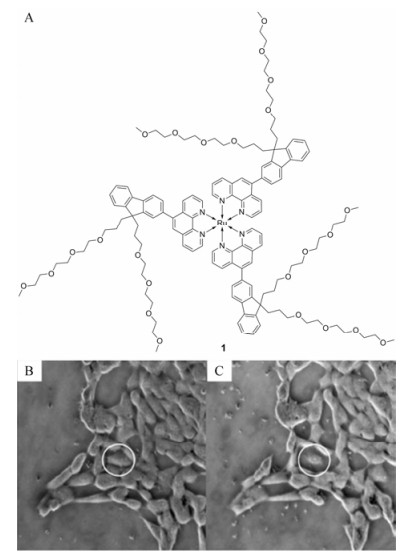
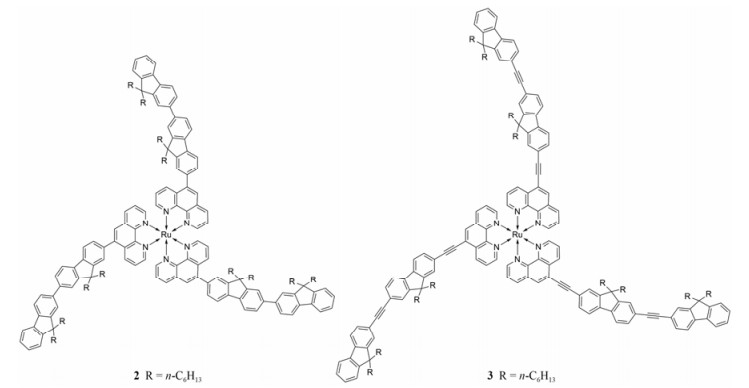
2009年Lemercier课题组[5]使用聚乙二醇(PEG)对钌菲罗啉配合物外围进行修饰, 改善其脂水分配系数, 使其既具有一定的水溶性, 同时又具有足够的脂溶性跨越细胞膜。光谱数据显示, 该配合物1 (图 2A)在乙腈中的荧光量子产率(emission quantum yields, Φem)为0.09, 荧光寿命(emission lifetime, τ)为500 ns, 740 nm下的σ接近40 GM (1 GM = 1×10-50 cm4·s-1·photon-1)。当大鼠胶质瘤细胞(F98)暴露于含有20 μmol·L-1配合物1的培养基, 光照激发前细胞保持正常形态(图 2B), 当使用脉冲激光(740 nm、300 mW)照射5 min后, 发现被照射区域的细胞形态明显收缩凋亡(图 2C), 而未照射区域的细胞形态没有发生明显变化, 充分体现了PDT在空间选择性上的优势, 这也是钌多吡啶类配合物作为光敏剂首次应用于体外双光子PDT的报道。通过扩大配体的共轭体系, Lemercier等[7-9]又合成了一系列钌菲罗啉的配合物, 其中配合物2和3 (图 3)的光物理学性质最为突出, 其τ分别达到2 500和2 700 ns, σ分别达到330 GM (740 nm)和380 GM (810 nm), 有望应用于双光子成像和光动力学治疗。
|
Figure 2 Molecular structures of ruthenium (Ⅱ) polypyridyl complex 1 (A). Phase contrast images of F98 cells before (B) and after (C) a 5 min irradiation (740 nm, 300 mW). Reproduced with permission[5]. Copyright 2009, Royal Society of Chemistry |
|
Figure 3 Molecular structures of ruthenium(Ⅱ) polypyridyl complexes 2 and 3 |
2015年, Chao课题组[10]设计并合成了4个钌菲罗啉配合物4~7 (图 4), 其中配合物6和7通过不同的连接基引入三苯基膦阳离子基团(TPP), 利用TPP较强的疏水性和良好的细胞内膜结合能力靶向线粒体。这些配合物具有较好的光物理学性质(Φem: 0.031~0.037; σ: 124~198 GM)。配合物7在线粒体中的积累量达到85.3%, 远高于配合物4和5。同样含有TPP的配合物6在线粒体中的积累量却低于配合物4和5, 这可能是由于中间连接基的长度导致配合物母核和TPP距离过近, 影响到TPP的线粒体靶向作用。对双光子PDT效果的评价, 作者采用了多细胞球模型(3D multicellular spheroids, 3D MCSs)。相比于单层细胞模型, 3D MCSs能够更好地模拟肿瘤细胞在体内的生物学行为, 被广泛应用于生物活性评价。生物活性评价发现:这些配合物能够有效产生1O2并且都能显著抑制HeLa-3D MCSs的生长, 其中配合物7的抑制作用最强。通过对比配合物7在单光子(450 nm、12 J·cm-2)和双光子(830 nm、800 J·cm-2)激发下的光毒性(photocytotoxicity)发现:双光子激发不仅具有更深的穿透能力, 而且其IC50达到1.9 μmol·L-1, 治疗指数(the ratio of dark-to-light toxicity, PI)高于52, 因此配合物7有望成为双光子PDT的候选光敏剂。

|
Figure 4 Schematic structures and photophysical properties of complexes 4-7 |
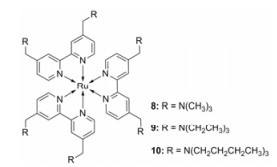
随后该课题组又报道了一组靶向溶酶体的钌多吡啶类配合物8~10 (图 5)[11]。钌多吡啶母核外围6个季胺盐正离子的引入不仅提高了配合物的水溶性, 增强了配合物与细胞膜的亲和能力, 而且显著改善了配合物的光物理学性质。尤其是配合物8, 其τ达到800 ns, σ达到250 GM (800 nm), 同时具有很好的光稳定性和1O2产生能力, 是一个很有潜力的双光子PDT光敏剂。配合物8不仅对溶酶体有很好的靶向作用, 而且在HeLa-3D MCSs中光毒性的IC50达到1.9 μmol·L-1, PI高于250 (800 nm、10 J·cm-2)。
|
Figure 5 Molecular structures of complexes 8-10 |
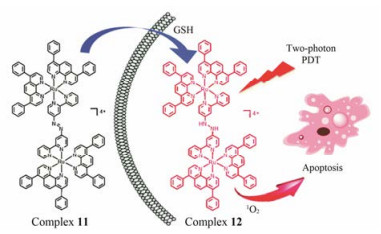
谷胱甘肽(GSH)是体内非常重要的抗氧化物质。研究发现, 细胞内GSH的浓度(~10 mmol·L-1)显著高于细胞外的浓度(~2 mmol·L-1)[12], 且肿瘤治疗过程中耐药性的产生与GSH浓度的升高相关[13], 同时GSH在肿瘤细胞内的浓度高于在正常细胞内的浓度[14]。2017年Chao课题组[15]利用高浓度的GSH使细胞内维持在一定还原态的微环境, 选择性地在细胞内活化光敏剂用于双光子PDT。根据这一原理, 作者设计并合成了一个新的钌多吡啶配合物11, 由于分子中偶氮连接基的强吸电子作用使其不能发射荧光。但在生物体内, 配合物11能够经摄取进入细胞内, 其偶氮基团被高浓度的GSH还原生成新的配合物12, 在光照激发下能够有效产生1O2并且其最大σ为210 GM (810 nm), 可以作为双光子PDT的光敏剂(图 6)。生物实验研究表明, 在肿瘤细胞(HeLa)内, 配合物11活化生成12的累积量要高于在正常细胞(LO2)内的累积量, 并且主要集中于线粒体内。在HeLa单层细胞模型和3D MCSs中, 配合物11能够有效地转化为配合物12, 继而在双光子激发(810 nm)下生成1O2。光毒性实验显示:配合物11对HeLa-3D MCSs的IC50为5.71 μmol·L-1 (PI = 19), 并且能够显著抑制HeLa-3D MCSs的生长。
|
Figure 6 Schematic illustration of GSH activation and phototoxicity of complex 11. Reproduced with permission[15]. Copyright 2017, Royal Society of Chemistry |
最近, Chao课题组又报道了一组光物理学性质突出的氟化钌多吡啶配合物, 其σ达到163~191 GM (825 nm)[16]。氟化钌多吡啶配合物分别与HeLa-3D MCSs共同孵育6 h后, 经双光子激发(825 nm、360 J·cm-2), 其光毒性数据显示13 (图 7A)的治疗效果最为突出(IC50 = 0.61 μmol·L-1, PI = 101.6)。荧光成像结果显示:这些配合物与HeLa细胞共孵育0.5 h时, 主要分布于细胞膜; 延长共孵育时间至4 h时, 配合物同时分布于细胞膜和线粒体, 此时再进行光照激发可以同时影响细胞膜和线粒体的功能, 二者可协同发挥治疗作用(图 7B)。进一步的小鼠体内光毒性实验结果显示, 配合物13在65.8 μg·kg-1剂量下, 给药后6 h经双光子激发(800 nm、1.18 W·cm-2, 25 min), 不仅能够显著缩小肿瘤体积(图 7C), 同时没有发现明显的系统毒性。

|
Figure 7 Molecular structure of complex 13 (A). Schematic illustration of the fluorinated ruthenium (Ⅱ) complex 13 ablating the cytomembrane (outside) and the mitochondria (inside) synergistically under two-photon laser irradiation (B). Tumor volumes with time of the mice under different treatments (C). Reproduced with permission[16]. Copyright 2017, American Chemical Society |
Zhang等[17]将烷化剂(苯丁酸氮芥, CHL)引入到钌多吡啶配合物分子中, 期望实现化疗和PDT作用的结合。尽管配合物14 (图 8)具有突出的光物理学性质[τ: 1.34 μs, σ: 118 GM (850 nm)], 但受钌多吡啶母核空间作用的影响, CHL的烷基化作用有所降低。荧光成像数据显示, 14对线粒体具有靶向作用, 并且在双光子激发(800 nm、~8 mW, 10 min)下, 配合物14 (5 μmol·L-1)能够显著破坏HeLa细胞形态的完整性, 诱导肿瘤细胞凋亡。

|
Figure 8 Molecular structures of complex 14 |
2014年Boeuf等[18]将配合物1和15 (图 9A)分别负载于聚乙丙交酯(PLGA)制成纳米颗粒应用于双光子PDT。负载钌多吡啶配合物的纳米粒的粒径约为100 nm, 表面带负电荷(~ -33 mV), 配合物负载效率约为1% (1 μg·mg-1)。光照条件(白光)下, 纳米粒的结构受到破坏从而促使配合物从纳米粒中释放出来发挥PDT作用。生物活性研究发现, 配合物1和15本身具有暗毒性(photocytotoxicity without irradiation, IC50分别为2.9和0.46 nmol·L-1), 而负载配合物的纳米粒没有细胞毒作用。初步光毒性实验显示, 负载配合物15的纳米粒(15@PLGA)具有较好的PI, 因此作者进一步测定了该纳米粒在双光子光照条件下对C6胶质瘤细胞的光毒性。实验组双光子激发区域细胞形态发生明显收缩(图 9B, C), 而对照组细胞形态未发生明显变化(图 9D, E), 证明负载钌多吡啶配合物15的纳米粒能够有效实现双光子PDT作用。该纳米粒的优势在于可以利用肿瘤组织的高通透性和滞留效应(EPR)在肿瘤组织富集, 并且能够实现双光子激发下钌多吡啶配合物的释放以及1O2的产生, 配合物和1O2二者协同诱导肿瘤细胞凋亡。
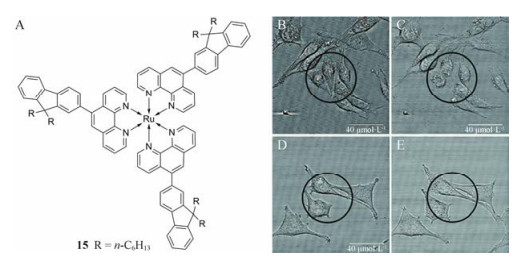
|
Figure 9 Molecular structures of complex 15(A). Confocal contrast images of C6 glioma cells treated with 15@PLGA (15, 5 nmol·L-1) before (B) and after (C) irradiation (740 nm, 0.025 mW·cm-2, 3 min), untreated cells before (D) and after (E) irradiation were considered as control. Reproduced with permission[18]. Copyright 2014, Wiley |
随后, Lemercier课题组[19]又将配合物16 (图 10A)通过硅氢化反应以共价键的形式连接到多孔硅纳米粒(pSiNPs)上, 然后利用硅烷化反应对其(pSiNPs-Ru)表面进行进一步的PEG修饰, 提高其(pSiNPs-Ru-PEG)分散度及生物相容性, 最后将甘露糖分子连接于PEG末端用于选择性识别肿瘤组织(pSiNPs-Ru-PEG-Man, 图 10B)。双光子(800 nm)激发下的光毒性数据显示, 配合物16修饰后的多孔硅纳米粒(pSiNPs-Ru)的光毒性最强(细胞活力: 36%); 进一步的PEG修饰虽然显著降低了pSiNPs-Ru的光毒性(细胞活力: 80%), 但PEG修饰在提高纳米材料分散度, 避免纳米材料在生物体内快速被清除中发挥重要作用; 得益于甘露糖的肿瘤细胞靶向识别作用, pSiNPs-Ru-PEG-Man的光毒性有所提高(细胞活力: 69%)。
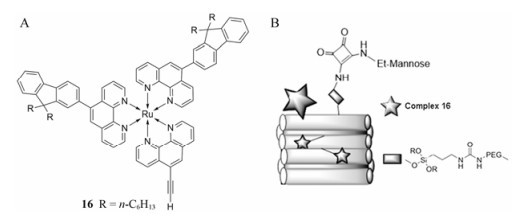
|
Figure 10 Molecular structures of complex 16 (A). Schematic illustration for the construction of pSiNPs-Ru-PEG-Man (B). Reproduced with permission[19]. Copyright 2016, Royal Society of Chemistry |
2015年, Chao课题组[20]将配合物17和18 (图 11A)分别以非共价键形式(π-π相互作用)吸附于单层碳纳米管(SWCNT), 作为光敏剂应用于双光子PDT。在双光子激发下, SWCNT的光热作用(PTT)能够促使配合物从SWCNT释放, 进而发挥配合物的PDT作用(图 11B)。配合物17和18的最大σ分别为494和428 GM, 分别吸附于SWCNT后(Ru@SWCNTs), 双光子激发下在体外均能有效产生1O2, 无论是在HeLa单层细胞模型还是在3D MCSs中, 二者的活性都明显优于配合物自身的活性, 并且在裸鼠的HeLa肿瘤模型中, 二者均能够显著缩小肿瘤体积(图 11C)。通过非共价键吸附于SWCNT的钌多吡啶配合物具有双光子光热和光动力学治疗双重作用, 在肿瘤治疗上有很好的应用潜力。

|
Figure 11 Molecular structures of complexes 17 and 18 (A). Schematic illustration of Ru@SWCNTs for photothermal therapy (PTT) and two-photon photodynamic therapy (TPPDT) with 808 nm irradiation (B). Tumor growth curves for different mice groups after irradiation (808 nm, 0.25 W·cm-2, 5 min) (C). Reproduced with permission[20]. Copyright 2015, American Chemical Society |
Chen等[21]将Ru(bpy)32+(图 12)包裹在UiO-67金属有机框架(MOFs)中制成平均粒径~92 nm的纳米粒。由于MOFs的空间限制作用, 在一定程度上改善了包裹在其中的Ru(bpy)32+的光物理学性质。因此, 该纳米粒可以实现肿瘤细胞(A549)内双光子荧光成像(880 nm), 并且在白光(λ > 400 nm、200 mW·cm-2, 10 min)激发下, 该纳米粒(200 μg·mL-1)能够诱导78%的A549肿瘤细胞凋亡。

|
Figure 12 Molecular structures of ruthenium polypyridyl complexes Ru(bpy)32+, 19 and 20 |
Zhang等[22]也将配合物19, 20和Ru(bpy)32+ (图 12)分别通过离子交换的方式包裹于MOFs中, 并测定了这些体系在双光子激发下1O2产生能力。在钌菲罗啉-MOFs体系中, 不仅钌菲罗啉配合物19和20自身具有较强的电子离域共轭体系, MOFs也能进一步延伸配合物的共轭体系, 限制配合物由于聚集导致的淬灭效应。因此, 该体系表现出较强的1O2产生能力, 有望应用于双光子PDT。
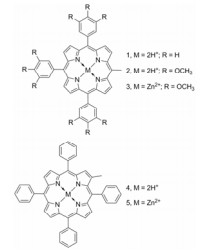
3 钌多吡啶-卟啉偶合物卟啉类是最早用于PDT的光敏剂, 由于在光治疗窗的消光系数低, σ偏小(~20 GM), 无法满足双光子PDT的要求, 同时卟啉类光敏剂大多水溶性差、易聚集, 也在一定程度上限制了其在药学上的应用[23]。Ke等[24-29]将卟啉类光敏剂与钌多吡啶类配合物通过中间连接基连接形成钌多吡啶-卟啉类偶合物(表 1, Dn-Ln-An)。水溶性钌多吡啶基团(An)的引入显著改善了偶合物的脂水分配系数, 增强了细胞对偶合物的摄取能力, 同时偶合物分子的σ也得到了很大提高(100~1 100 GM)。
| Table 1 The fragment structures of ruthenium (Ⅱ) polypyridyl-porphyrin conjugates (Dn-Ln-An) |
如表 2所示, 偶合物的σ都显著高于卟啉单元母核, 这主要得益于偶合物分子内π共轭体系的延伸以及卟啉和钌多吡啶单元之间不对称的D-π-A结构诱导产生的分子极化作用[24]。Meso-乙炔基桥连的偶合物22具有最大的π共轭体系, 其最大σ达到1 104 GM (800 nm), 1O2的产生能力(singlet oxygen quantum yields, Φ∆, 0.93)相对于meso-四苯基卟啉(H2TPP, 0.55)提高了近1倍。生物实验研究表明, 偶合物22不仅能够快速被细胞摄取, 而且具有线粒体靶向作用。该偶合物(5 μmol·L-1)与HeLa细胞共孵育1 h, 然后经双光子激发(850 nm、~8 mW, 5 min)后, 90%细胞形状发生变化或失去完整性[25]。
| Table 2 Molecular structures and photophysical properties of ruthenium (Ⅱ) polypyridyl-porphyrin conjugates (Dn-Ln-An) |
偶合物23和24的共轭体系略弱于偶合物22, 其σ分别为555和485 GM。偶合物23在双光子激发条件(800 nm、~8 mW, 30 min)下能够诱导约70%肿瘤细胞凋亡; 偶合物24尽管具有较大的σ, 但是不易被细胞摄取, 致使其PDT效果不理想[26]。由于席夫碱桥连基团的电子传递能力弱于炔基, 偶合物31的σ次之(390 GM)。双光子成像显示, 偶合物31 (5 μmol·L-1)与HeLa细胞共孵育4 h后, 经双光子激发(850 nm、~8 mW, 20 min)能够诱导超过50% HeLa细胞凋亡[24]。
在其他偶合物分子中, meso-取代苯基与卟啉环呈垂直取向阻碍了分子共轭体系的延伸, 因此这些偶合物的σ没有表现出实质的差别(106~228 GM)[27-29]。偶合物21的Φem (0.12)和Φ∆ (0.55)与meso-四苯基卟啉接近, 尽管其σ仅有178 GM, 但得益于易被细胞摄取及溶酶体靶向作用, 偶合物21表现出较好的双光子PDT效果[27]。相对于偶合物25~27, 偶合物28~30的卟啉单元含有金属锌离子, 其Φem明显降低。偶合物27分子中含有水溶性的PEG链导致其不易被细胞摄取。相比之下, 偶合物25和26易于被细胞摄取, 且分别定位于溶酶体和线粒体。进一步的光毒性实验显示, 在连续的双光子激发(850 nm、~8 mW)过程中, 偶合物26能够从线粒体释放到胞浆, 再分布到细胞核, 进而破坏核膜诱导肿瘤细胞凋亡, 表现出较好的双光子PDT效果[28]。
4 展望钌多吡啶类配合物在双光子PDT中的应用近年来取得了较大的进展, 随着研究的不断深入, 对钌多吡啶类配合物在应用中遇到的问题也逐渐有了更深刻的理解和认识, 在后续研究过程中如能很好地解决这些问题, 将有助于尽早将钌多吡啶类配合物推到临床应用阶段。
首先, 要进一步增强钌多吡啶配合物的σ, 提高双光子激发的效率, 目前主要通过配体修饰的方式, 延伸共轭体系, 增加σ。共轭体系的延伸一般随着脂溶性的增强, 脂溶性增强有利于细胞的摄取, 但是对于作为药物应用的光敏剂来说, 水溶性过强影响细胞摄取, 脂溶性过强则无法有效输送至病变部位, 同时可能会出现因疏水性过强而引起聚集, 影响光敏剂的1O2产生能力。因此兼顾两亲性更符合药物代谢动力学的要求[30, 31]。与此同时, 通过配体修饰改善钌多吡啶配合物的光物理学性质还要考虑合成的难易, 产物成分是否单一, 因为钌多吡啶配合物自身的八面体构型, 在配体修饰过程中有可能会出现立体异构体的问题, 只有严格控制光敏剂成分和纯度, 才能有效把握光敏剂的质量和治疗效果。
其次, 提高钌多吡啶配合物的靶向性。目前第三代光敏剂的研发不仅要求光敏剂具有突出的光物理学性质, 较强的1O2产生能力, 还要具有肿瘤靶向功能。1O2的寿命在10~320 ns, 作用距离为10~55 nm, 因此其作用时间和空间有限, 提高光敏剂的靶向性能够有效提高光敏剂的PDT效果[32]。如利用靶向配体(TPP)靶向细胞器; 利用过度表达的酶或蛋白质(GSH, ALP)靶向肿瘤细胞或者组织; 利用肿瘤特殊的微环境(pH敏感基团, EPR效应)靶向肿瘤组织等。
此外, 纳米技术的飞速发展也极大推动了钌多吡啶配合物在双光子PDT中的应用。利用纳米材料(聚乙二醇、金属有机框架、介孔二氧化硅、碳纳米管等)对光敏剂进行共价或者非共价修饰, 不仅能改善现有光敏剂的光物理学性质, 提高其输送效率, 降低其暗毒性, 而且还能显著提高光敏剂的靶向性。
可以预见, 随着生物技术和纳米技术等多领域研究的不断深入, 将为钌多吡啶类配合物在双光子PDT上的应用提供更广阔的设计思路和解决方案。
| [1] | Mari C, Pierroz V, Ferrari S, et al. Combination of Ru(Ⅱ) complexes and light:new frontiers in cancer therapy[J]. Chem Sci, 2015, 6: 2660–2686. DOI:10.1039/C4SC03759F |
| [2] | Zeng L, Gupta P, Chen Y, et al. The development of anticancer ruthenium (Ⅱ) complexes:from single molecule compounds to nanomaterials[J]. Chem Soc Rev, 2017, 46: 5771–5804. DOI:10.1039/C7CS00195A |
| [3] | Sun Z, Zhang L, Wu F, et al. Photosensitizers for two-photon excited photodynamic therapy[J]. Adv Funct Mater, 2017. DOI:10.1002/adfm.201704079 |
| [4] | Shen Y, Shuhendler A, Ye D, et al. Two-photon excitation nanoparticles for photodynamic therapy[J]. Chem Soc Rev, 2016, 45: 6725–6741. DOI:10.1039/C6CS00442C |
| [5] | Boca S, Four M, Bonne A, et al. An ethylene-glycol decorated ruthenium (Ⅱ) complex for two-photon photodynamic therapy[J]. Chem Commun (Camb), 2009(30): 4590–4592. DOI:10.1039/b907143a |
| [6] | Lazic S, Kaspler P, Kolodzieyski L, et al. TLD1433-mediated photodynamic therapy as a novel intravesical treatment for bladder cancer:in vitro, in vivo and good laboratory practice toxicology validation[J]. Photodiagnosis Photodyn Ther, 2017, 17: A7. |
| [7] | Lemercier G, Bonne A, Four M, et al. 3MLCT excited states in Ru(Ⅱ) complexes:reactivity and related two-photon absorption applications in the near-infrared spectral range[J]. CR Chim, 2008, 11: 709–715. DOI:10.1016/j.crci.2007.11.012 |
| [8] | Four M, Riehl D, Mongin O, et al. A novel ruthenium (Ⅱ) complex for two-photon absorption-based optical power limiting in the near-IR range[J]. Phys Chem Chem Phys, 2011, 13: 17304–17312. DOI:10.1039/c1cp21661a |
| [9] | Mongin O, Four M, Chevreux S, et al. Two-photon absorption engineering of 5-(fluorenyl)-1, 10-phenanthroline-based Ru(Ⅱ) complexes[J]. Chimia, 2015, 69: 666–669. DOI:10.2533/chimia.2015.666 |
| [10] | Liu J, Chen Y, Li G, et al. Ruthenium (Ⅱ) polypyridyl complexes as mitochondria-targeted two-photon photodynamic anticancer agents[J]. Biomaterials, 2015, 56: 140–153. DOI:10.1016/j.biomaterials.2015.04.002 |
| [11] | Huang H, Yu B, Zhang P, et al. Highly charged ruthenium (Ⅱ) polypyridyl complexes as lysosome-localized photosensitizers for two-photon photodynamic therapy[J]. Angew Chem Int Ed Enql, 2015, 54: 14049–14052. DOI:10.1002/anie.201507800 |
| [12] | Wu G, Fang Y, Yang S, et al. Glutathione metabolism and its implications for health[J]. J Nutr, 2004, 134: 489–492. DOI:10.1093/jn/134.3.489 |
| [13] | Chen Z, Mutoh M, Sumizawa T, et al. An active efflux system for heavy metals in cisplatin-resistant human KB carcinoma cells[J]. Exp Cell Res, 1998, 240: 312–320. DOI:10.1006/excr.1998.3938 |
| [14] | Gamcsik M, Kasibhatla M, Teeter S, et al. Glutathione levels in human tumors[J]. Biomarkers, 2012, 17: 671–691. DOI:10.3109/1354750X.2012.715672 |
| [15] | Zeng L, Kuang S, Li G, et al. A GSH-activatable ruthenium (Ⅱ)-azo photosensitizer for two-photon photodynamic therapy[J]. Chem Commun (Camb), 2017, 53: 1977–1980. DOI:10.1039/C6CC10330H |
| [16] | Qiu K, Wang J, Song C, et al. Crossfire for two-photon photodynamic therapy with fluorinated ruthenium (Ⅱ) photosensitizers[J]. ACS Appl Mater Interfaces, 2017, 9: 18482–18492. DOI:10.1021/acsami.7b02977 |
| [17] | Zhang J, Pan M, Su C. Synthesis, photophysical properties and in vitro evaluation of a chlorambucil conjugated ruthenium (Ⅱ) complex for combined chemo-photodynamic therapy against HeLa cells[J]. J Mater Chem B, 2017, 5: 4623–4632. DOI:10.1039/C7TB00702G |
| [18] | Bœuf G, Roullin G, Moreau J, et al. Encapsulated ruthenium (Ⅱ) complexes in biocompatible poly(d, l-lactide-co-glycolide) nanoparticles for application in photodynamic therapy[J]. ChemPlusChem, 2014, 79: 171–180. DOI:10.1002/cplu.201300242 |
| [19] | Knežević N, Stojanovic V, Chaix A, et al. Ruthenium (Ⅱ) complex-photosensitized multifunctionalized porous silicon nanoparticles for two-photon near-infrared light responsive imaging and photodynamic cancer therapy[J]. J Mater Chem B, 2016, 4: 1337–1342. DOI:10.1039/C5TB02726H |
| [20] | Zhang P, Huang H, Huang J, et al. Noncovalent ruthenium (Ⅱ) complexes-single-walled carbon nanotube composites for bimodal photothermal and photodynamic therapy with near-infrared irradiation[J]. ACS Appl Mater Interfaces, 2015, 7: 23278–23290. DOI:10.1021/acsami.5b07510 |
| [21] | Chen R, Zhang J, Chelora J, et al. Ruthenium (Ⅱ) complex incorporated UiO-67 metal-organic framework nanoparticles for enhanced two-photon fluorescence imaging and photodynamic cancer therapy[J]. ACS Appl Mater Interfaces, 2017, 9: 5699–5708. DOI:10.1021/acsami.6b12469 |
| [22] | Zhang W, Li B, Ma H, et al. Combining ruthenium (Ⅱ) complexes with metal-organic frameworks to realize effective two-photon absorption for singlet oxygen generation[J]. ACS Appl Mater Interfaces, 2016, 8: 21465–21471. DOI:10.1021/acsami.6b05817 |
| [23] | Du E, Hu X, Roy S, et al. Taurine-modified Ru(Ⅱ)-complex targets cancerous brain cells for photodynamic therapy[J]. Chem Commun (Camb), 2017, 53: 6033–6036. DOI:10.1039/C7CC03337K |
| [24] | Ke H, Ma W, Wang H, et al. Synthesis, singlet-oxygen photogeneration, two-photon absorption, photo-induced DNA cleavage and cytotoxic properties of an amphiphilic β-Schiff-base linked Ru(Ⅱ) polypyridyl-porphyrin conjugate[J]. J Lumin, 2014, 154: 356–361. DOI:10.1016/j.jlumin.2014.04.024 |
| [25] | Ke H, Wang H, Wong W, et al. Responsive and mitochondria-specific ruthenium (Ⅱ) complex for dual in vitro applications:two-photon (near-infrared) induced imaging and regioselective cell killing[J]. Chem Commun (Camb), 2010, 46: 6678–6680. DOI:10.1039/c0cc01848a |
| [26] | Zhang J, Wong K, Wong W, et al. Two-photon induced luminescence, singlet oxygen generation, cellular uptake and photocytotoxic properties of amphiphilic Ru(Ⅱ) polypyridyl-porphyrin conjugates as potential bifunctional photodynamic therapeutic agents[J]. Org Biomol Chem, 2011, 9: 6004–6010. DOI:10.1039/c1ob05415e |
| [27] | Poon C, Chan P, Man C, et al. An amphiphilic ruthenium (Ⅱ)-polypyridyl appended porphyrin as potential bifunctional two-photon tumor-imaging and photodynamic therapeutic agent[J]. J Inorg Biochem, 2010, 104: 62–70. DOI:10.1016/j.jinorgbio.2009.10.004 |
| [28] | Zhang J, Zhou J, Chan C, et al. Comparative studies of the cellular uptake, subcellular localization, and cytotoxic and phototoxic antitumor properties of ruthenium (Ⅱ)-porphyrin conjugates with different linkers[J]. Bioconjug Chem, 2012, 23: 1623–1638. DOI:10.1021/bc300201h |
| [29] | Xu Z, Yu F, Wu F, et al. Synthesis, DNA photocleavage, singlet oxygen photogeneration and two photon absorption properties of ruthenium-phenanthroline porphyrins[J]. J Porphyr Phthalocya, 2015, 19: 1046–1052. DOI:10.1142/S1088424615500790 |
| [30] | Li Z, Wang J, Zhou Y, et al. Lead compound optimization strategy (3)-structure modification strategies for improving water solubility[J]. Acta Pharm Sin (药学学报), 2014, 49: 1238–1247. |
| [31] | Hong Y, Zhou Y, Wang J, et al. Lead compound optimization strategy (4)-improving blood-brain barrier permeability through structural modification[J]. Acta Pharm Sin (药学学报), 2014, 49: 789–799. |
| [32] | Abrahamse H, Hamblin M. New photosensitizers for photodynamic therapy[J]. Biochem J, 2016, 473: 347–364. DOI:10.1042/BJ20150942 |
 2018, Vol. 53
2018, Vol. 53