酒精性肝病(alcohol liver disease, ALD)是由过量酒精摄取导致的肝脏损伤, 包括酒精性脂肪肝(alcoholic fatty liver, AFL)、酒精性肝炎(alcohol hepatitis, AH)和肝纤维化/硬化(alcoholic hepatic fibrosis/cirrhosis, AHF/AC)等[1], 在临床中常合并存在。研究发现, 90%以上酗酒者易患脂肪肝, 其中10%~35%将发展为酒精性肝炎, 约8%~20%的慢性嗜酒者会进一步发展为肝硬化, 严重情况下会演变为肝癌[1]。随着酒精生产工艺的简化和普及, 人类对酒精的摄取量不断增加, 由饮酒引发的健康问题也日益严峻。至2009年, 由饮酒导致的死亡人数占全球死亡人数总量的3.8%[2]。2013年, 中国成为仅次于英国的第二饮酒大国[3]。北京302医院统计, 在2002~2013年间, 医院接收的酒精性肝病患者(7 422)占所有肝病患者总人数(188 902)的3.93%, 酒精性肝病患者的住院率也由1.68% (2002年)增至4.59% (2013年)。其中, 严重酒精性肝炎的患病率以2.4倍/年的速度不断攀升[4], 其90天及1年内死亡率分别高达29%和56%[5]。目前, 临床缺乏针对性的治疗药物及方法, 多采用戒酒、营养支持、抗炎保肝药物改善患者肝脏生化指标、糖皮质激素改善重症酒精性肝炎患者的生存率[5]、抗肝纤维化药物阻止细胞外基质沉积或促进其降解等措施[6-8], 而这些被动治疗手段存在疗效较差及不良反应等较多问题。因此, 探讨ALD的发病机制并寻找有效治疗手段一直是该领域的研究热点。
迄今为止, 研究者们多集中于探讨酒精性肝病的发病机制; 虽然许多假说被提出, 但其系统性认知尚未完全构建。如何高效模拟人类酒精性肝病的动物模型具有十分重要的研究价值与临床意义。目前普遍使用的短期动物模型包括急性酒精灌胃模型、Gao-binge模型和酒精液体饲料联合四氯化碳注射诱导的肝纤维化模型等。上述模型分别代表酒精性肝病的不同发病阶段。综上, 本研究将结合临床诊断标准与芯片数据, 着重探讨各模型诱导指标与临床数据的切合度及相对优势。
CCL2 (C-C motif chemokine receptor-2), 又称单核细胞趋化蛋白1 (monocyte chemotactic protein 1, MCP-1), 是趋化因子家族的成员。单核细胞、巨噬细胞和肝星状细胞经多种生化因子刺激后, 均可分泌CCL2[9, 10]。研究表明, CCL2在酒精性肝病患者血浆中的mRNA和蛋白表达水平均显著增高[11], 并在酒精诱导的肝脏炎症、脂质沉积中发挥重要的病理作用[12]。但是在酒精性肝病各阶段的动物模型中, CCL2的变化趋势报道较少。CCL2能否成为潜在的生物标记物仍然未有定论。
综上, 本研究结合临床诊断标准与芯片数据, 对3种较为普遍的酒精性肝病短期模型进行探讨, 筛选出建模方便、较为高效的动物模型并探索CCL2在各阶段酒精性肝病作为潜在生物标记物的可能性。
材料与方法药物与主要试剂 四氯化碳, 由天津市科密欧化学试剂有限公司提供; 乙醇, 购于美国Burdick & Jackson公司; Lieber-DeCarli液体饲料和糊精, 由南通特罗菲饲料科技有限公司提供; 丙氨酸转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)试剂盒、甘油三脂(triglyceride TG)试剂盒, 购于南京建成生物工程研究所; RT试剂盒、SYBR Premix EX TaqTM, 购于日本Takara公司。
动物 C57BL/6J小鼠, 雄性, 8~10周, 体重24~26 g, 中山大学东校区实验动物中心[SCXK (粤) 2011-0029]提供, SPF级。
主要仪器 5417-R低温高速离心机、梯度PCR仪, 德国Eppendderf公司。Multiskan Go多功能酶标仪, 美国Thermo Fisher公司。METTLER AE260电子天平, 美国METTLER TOLEDO公司。7500 Real Time PCR System, 美国Applied Biosystems公司。Mini-protein3电泳系统、Mini Trans-Blot转移系统, 美国Bio-Rad公司。ImageQuant LAS 4000曝光成像仪, 美国General Electric公司。
急性酒精性肝损伤模型[13] 8~10周C57BL/6J雄性小鼠, 随机分为对照组及造模组, 每组5只。造模组按照6 g·kg-1剂量灌胃40%乙醇, 每12 h一次, 共3次。对照组给予等热量等体积的糊精。于最后一次给药6 h后, 乙醚麻醉, 处死并收取样本。实验期间, 自由饮水饮食。
短期酒精性肝炎模型[14] 根据Gao-binge模型, 选取8~10周C57BL/6J雄性小鼠称重, 按体重进行配对分组, 每组6只。首先, 均给予Lieber-DeCarli对照液体饲料(脂肪热量35%)适应5天。于第6天, 造模组更换为Lieber-DeCarli 5% (v/v)酒精液体饲料; 共10天。第11天7~9点, 造模组灌胃给予5 g·kg-1乙醇, 对照组给予等热量等体积糊精。9 h后, 处死并收取样本。实验期间, 自由饮用液体饲料。
短期酒精性肝纤维化模型[15, 16] 按体重将8~10周C57BL/6J雄性小鼠配对分组, 每组4只。对照组给予Lieber-DeCarli对照液体饲料。第1~2天, 造模组给予含有1%乙醇(v/v)的Lieber-DeCarli酒精液体饲料, 第3~4天, 酒精含量翻倍。适应期后, 再用2% Lieber-DeCarli酒精液体饲料喂养2周。期间, 造模组腹腔注射四氯化碳(1 μL·g-1, 以1:3的比例溶于橄榄油), 对照组注射橄榄油, 每周2次。最后一次给药后72 h, 处死并收取样本。实验期间, 自由饮用液体饲料。
血清中ALT、AST检测 收取血液样本, 室温放置1 h后, 4 ℃、3 000 r·min-1离心15 min, 取血清; 按试剂盒说明书的相应操作步骤, 进行ALT、AST水平的测定。
肝组织及血清中TG检测[17] 按照TG定量试剂盒的使用说明进行肝组织及血清中TG定量, 并测定样品中的蛋白含量, 计算肝组织内的TG含量。
肝组织病理形态学观察 在肝脏右叶的同一部位, 取大小相同的肝组织, 放置于10%中性福尔马林中固定。经脱水, 包埋后, 制成石蜡切片, 厚度约5 μm, 再进行HE染色及Masson Trichrome染色。油红染色:取相同位置大小的肝组织, 制成冰冻切片, 再进行油红染色。用光学显微镜观察肝组织病理学病变的程度。
肝组织中IL-6和CCL2 mRNA表达的测定 取同一部位的肝组织50 mg, 采用Trizol法提取总RNA。IL-6引物为F: 5'-CCACGGCCTTCCCTACTTC-3', R: 5'-TGGGAGTGGTATCCTCTGTGAA-3'; CCL2的引物为F: 5'-CTTCTGGGCCTGCTGTTCA-3', R: 5'-CC AGCCTACTCATTGGGATCA-3'。参照SYBR Green Assay试剂盒说明书进行逆转录反应, 再将逆转录得到的cDNA进行real-time PCR扩增, 扩增步骤: 94 ℃ 1 min; 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 40个循环; 95 ℃ 10 s, 65 ℃ 45 s, 40 ℃ 60 s。
临床芯片数据的获取及处理 利用Gene Expression Omnibus在线数据库, 搜索酒精性肝病的临床芯片数据, 获取人源化样本全血或肝脏中IL-6和CCL2的表达结果[为实验组除以对照组的对数值(log2 ratio)]。将结果数据进行2n换算, 得到实验组除以对照组的倍数值, 再进行统计。
数据分析 用GraphPad Prism 5软件进行数据分析, 实验结果均以x±s表示, 采用t检验, P<0.05具有统计学意义。
结果 1 急性酒精性肝损伤病理指标变化在体重和肝重方面(图 1A), 对照组与造模组小鼠体重均呈下降趋势。但造模组体重下降更为明显, 两组具有显著性差异(P < 0.01)。同时, 造模组小鼠肝脏重量有上升的趋势, 肝重比(5.3 ± 0.08) %显著增加(P < 0.01), 是对照组(4.8 ± 0.13) %的1.12倍。

|
Figure 1 Under acute alcohol exposure, liver histological lesions was induced, along with the decreased gene expression levels of hepatic IL-6 and CCL2. C57B/6 male mice (18-20 g) were challenged with acute exposure three times during 24 h. A: Growth curve, liver weight and liver/body weight ratio of mice; B: Histological analysis of liver samples; C: Serum ALT and AST levels; D: TG levels in serum and liver; E: The hepatic mRNA levels of IL-6 and CCL2; F: The whole blood mRNA levels of IL-6 and CCL2 in trial subject exposed to single intake of orange juice and alcohol. The analysis was performed on the liver transcriptome data set GSE20489 from the Gene Expression Omnibus (GEO). n = 5, x± s. *P < 0.05, **P < 0.01 |
在组织病理学方面(图 1B), 造模组小鼠肝脏组织出现了明显的水样性病变, 肝小叶中央区的胞浆内可见大量空泡, 并有大量的脂质沉积。
在生化指标方面, 相比于对照组血清ALT (7.3 ± 2.1) U·L-1、AST (11.4 ± 2.9) U·L-1, 造模组小鼠血清指标ALT (9.8 ± 1.8) U·L-1、AST (22.9 ± 3.9) U·L-1有上升的趋势, 但无显著差异(图 1C)。造模组肝脏TG显著升高(1.2 ± 0.2) mmol·gprot-1 (P < 0.01), 血清TG含量(2.3 ± 0.16) mmol·L-1却无明显变化(图 1D)。
在细胞因子方面(图 1E), 给予3次酒精灌胃后, 造模组细胞因子IL-6和CCL2 mRNA表达下降明显, 其中IL-6 mRNA表达下降了90% (P < 0.01), CCL2下降了51% (P < 0.05)。临床芯片数据结果显示(图 1F), 急性饮酒过量患者大约在2 h左右, 全血中酒精浓度达到峰值, 而全血中IL-6和CCL2 mRNA表达水平有显著性下降, 其中在169 min时, IL-6和CCL2的基因表达水平降至最低, 为对照组的70%与30%左右。结果表明, 小鼠急性酒精性肝损伤模型的炎症因子IL-6和CCL2 mRNA表达与急性饮酒过量患者(GEO数据库: GSE20489)全血中IL-6和CCL2 mRNA表达变化的结果相一致。
2 短期酒精性肝炎模型的病理指标变化在体重和肝重方面(图 2A), 对照组与造模组小鼠体重变化趋势大致相同。至实验结束, 对照组、造模组小鼠体重分别为(24.9 ± 0.7) g、(22.5 ± 0.5) g。造模组肝脏质量[(1.1 ± 0.03) g, P < 0.01]与肝重比[(4.9 ± 0.18)%, P < 0.001]明显高于对照组[分别为(0.9 ± 0.03) g、(3.7 ± 0.04)%]。
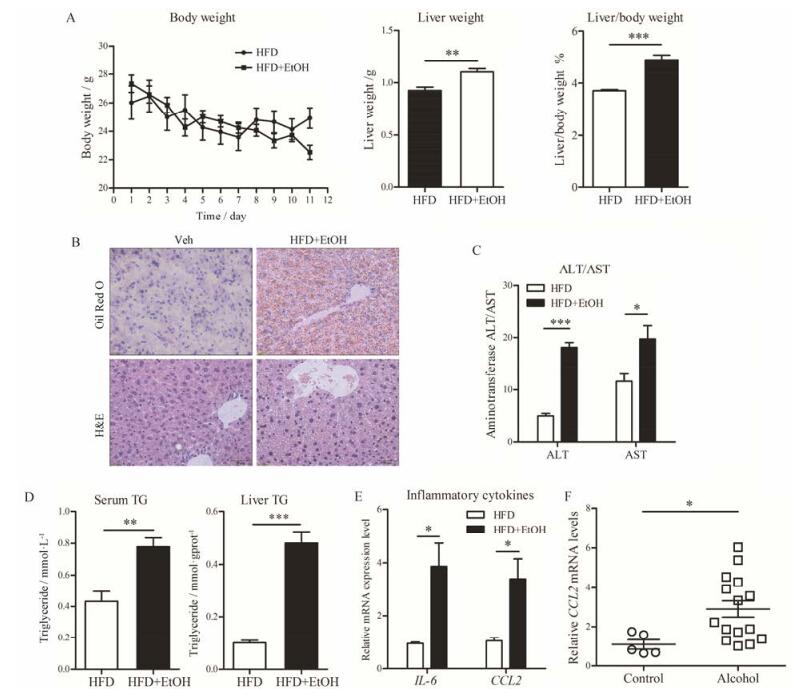
|
Figure 2 Chronic-plus-single-binge ethanol feeding induced liver injury, inflammation and fatty liver. Ethanol-fed group (24-28) g was allowed free access to HFD+EtOH for 10 days, and control group was pair-fed with the control diet. At day 11, ethanol-fed and pair-fed mice were gavaged a single dose of ethanol (5 g·kg-1) or isocaloric maltose dextrin. A: Growth curve, liver weight and liver/body weight ratio of mice; B: Histological analysis of liver samples; C: Serum ALT and AST levels; D: TG levels in serum and liver; E: The hepatic mRNA levels of IL-6 and CCL2; F: The hepatic gene expression levels of CCL2 in patients with alcoholic hepatitis and normal livers. The analysis was performed on the liver transcriptome data set GSE28619 from the Gene Expression Omnibus (GEO). n = 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001. HFD: Lieber-DeCarli diet containing high-saturated fat; HFD+EtOH: The ethanol Lieber-DeCarli diet containing high-saturated fat and 5% (v/v) ethanol |
在组织病理学方面(图 2B), 对照组肝小叶结构清晰, 肝索排列整齐, 汇管区存在轻微的水样性病变与脂质沉积; 模型组肝组织存在大面积的脂质沉积, 汇管区可见炎性细胞浸润和明显的水样性病变。除此之外, 造模组肝细胞还出现肿胀、胞浆内脂肪性小泡等病理现象。
在生化指标方面, 与对照组血清中ALT (5.1 ± 0.5) U·L-1和AST (11.6 ± 1.6) U·L-1相比, 造模组小鼠血清中ALT (18.1 ± 0.9) U·L-1 (P < 0.001)和AST (19.7 ± 2.5) U·L-1 (P < 0.05)明显升高, 且具有统计学意义(图 2C)。同时, 造模组小鼠血清、肝脏匀浆中TG含量(0.8 ± 0.06) mmol·L-1、(0.5 ± 0.04) mmol·gprot-1, 均明显高于对照组血清、肝脏匀浆中的TG含量(P < 0.001, 图 2D)。上述实验结果与临床相关指标变化趋势相同(表 1)[6, 18]。
| Table 1 Clinical diagnosis standard of alcoholic liver disease |
在细胞因子方面(图 2E), 造模组给予酒精液体饲料后, 肝脏细胞因子IL-6和CCL2 mRNA表达水平显著性升高, 分别是对照组的3.24倍(P < 0.05)和4倍(P < 0.05)。临床芯片数据显示(图 2F), 酒精性肝炎患者(GEO数据库: GSE28619)的肝脏CCL2 mRNA表达水平是健康人的3倍(P < 0.05), Gao-binge模型小鼠肝脏中炎症因子CCL2 mRNA表达情况与此结果相一致。
3 短期酒精性肝纤维化模型的病理指标变化在体重和肝重方面(图 3A), 造模组小鼠的体重的变化与对照组相似, 于第10天开始有逐步上升趋势。结束实验后, 对照组肝脏重量为(0.9 ± 0.02) g, 而造模组小鼠的肝脏重量(1.0 ± 0.03) g明显增加(P < 0.01), 其肝重比(5.2 ± 0.13) %也明显高于对照组[(4.2 ± 0.02) %, P < 0.001]。

|
Figure 3 In CCl4-alcohol diet induced liver fibrosis model, although histological section indicated obvious fibrotic lesion, some pathological parameters were barely changed. C57BL/6 male mice (18-20 g) were fed with 2% alcoholic diet for up to 17 days. CCl4 were given at day 4, 7, 11 and 14 for a total of 4 times. Liver and blood samples were then harvested 72 h after the last injection at day 14. A: Growth curve, liver weight and liver/body weight ratio of mice; B: Histological analysis of liver samples; C: Serum ALT and AST levels; D: TG levels in serum and liver; E: The hepatic levels of IL-6 and CCL2; F: The hepatic mRNA levels of CCL2 and IL-6 in patients with different stage of liver fibrosis. The analysis was performed on the liver transcriptome data set GSE84044 from the Gene Expression Omnibus (GEO). n = 4-5, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 |
在组织病理学方面(图 3B), 两组肝组织都呈现轻微的水样病变, 肝细胞水肿, 肝索排列紊乱, 部分肝细胞胞浆存在空泡, 并有明显脂质沉积, 但是, 造模组肝细胞胞浆存在空泡的现象更为显著, 数量更多, 肝小叶中央区存在明显的中性粒细胞浸润。组织经Masson Trichrome染色, 可标记生成的胶原蛋白(蓝色区域)。由此可见, 对照组无纤维化生成迹象, 而造模组的肝组织切片小胆管以汇管区为中心轻度纤维组织增生。
在生化指标方面(图 3C), 与对照组小鼠相比, 造模组小鼠血清中ALT (6.2 ± 0.7 U·L-1, P = 0.056)和TG (2.4 ± 0.2 mmol·L-1, P < 0.01)水平显著上升, 而AST (8.7 ± 0.8 U·L-1)及肝脏中TG含量(0.4 ± 0.05 mmol·gprot-1)却无明显差异, 或略有下降(图 3D)。上述指标与临床数据相比不尽相同(表 1)。
在细胞因子方面(图 3E), 肝脏组织细胞因子IL-6 mRNA表达水平, 与对照组相比, 下降了55% (P < 0.05), 并具有显著性差异; 而CCL2 mRNA的表达虽受到影响, 有下降的趋势, 却无统计学意义。该
数据与临床肝纤维化患者(GEO数据库: GSE84044)的样本测试结果有一定的差异(图 3F)。
讨论随着生活水平不断提高及中国“酒文化”影响, 我国酒精消耗量不断攀升, 由饮酒引发的健康问题日益严峻[1]。酒精性肝病已成为威胁人类健康的第二大肝脏疾病。因其机制复杂, 各种因素相互作用等原因, 其机制尚未完全阐述清楚。因此, 建立高效的动物模型, 为探索发病机制与寻找有效治疗药物提供实验基础, 具有极大的研究价值与临床意义。
结合前期工作, 本研究着重探讨了3种短期动物模型的可操作性, 及与各时期临床诊断标准(表 1)的相关程度。结果显示, 在急性酒精性肝损伤病理模型中, 肝组织出现明显的炎性浸润和脂肪变性; 细胞因子IL-6和CCL2的基因表达水平显著性降低, 该结果与临床芯片数据相似。上述结果表明, 该模型能模拟急性酒精摄取引发的肝损伤, 诱导部分相关指标, 但在肝重和血清生化指标方面的诱导作用并不显著。同样, 在短期酒精性肝纤维化模型中, 肝重增加, 肝组织出现炎性浸润、脂肪变性、汇管区纤维组织增生及IL-6的mRNA表达水平下调, 但血清中AST变化并不显著。参考表 1及临床芯片数据, 此模型部分指标变化趋势与酒精性肝纤维化临床诊断指标有一定的差异。
另一方面, Gao-binge模型的造模组小鼠体重、肝重和肝重比显著性增加, 血清生化指标ALT、AST、TG和肝脏中TG含量均大幅度升高, 肝组织炎性浸润和脂肪变性明显, 细胞因子IL-6和CCL2的mRNA水平显著升高。将实验结果与临床诊断指标及芯片数据相比较, 发现两者变化趋势相似。此对比结果表明, Gao-binge模型能较好地模拟人类酒精性脂肪肝肝炎, 诱导作用显著, 得到的病理指标也较为全面。此外, Gao-binge模型建立所需16天, 远少于传统Lieber-DeCarli模型(4~8周), 模型建立期间无需手术, 操作难度低, 更为方便。实验过程中, 给予小鼠Lieber-DeCarli 5% (v/v)酒精液体饲料, 酒精摄取量约每天每只0.4 g, 等效于人类每日饮酒120 g, 较好地模拟了人类2周内大量饮酒(乙醇量 > 80 g·day-1)从而导致酒精性肝病的行为。第16天灌胃高剂量酒精(5 g·kg-1), 诱导肝脏炎症, 也进一步模拟了长期酗酒患者一次醉酒后导致的急性酒精性肝炎。综上, Gao-binge模型的建模方法相对简单, 诱导的指标较为全面, 且与临床指标变化趋势相似, 能够较好地模拟酒精性脂肪性肝炎, 是研究酒精性肝病与筛选有效治疗药物较为理想的模型。
随着研究深入, 还发现CCL2在酒精诱导的肝组织损伤中发挥着重要的作用[12], 且在酒精性肝病患者血浆中显著升高[11], 随着酒精性肝炎的加重而上调[19]。本实验结果显示, 肝组织CCL2的基因表达水平在急性酒精性肝损伤模型中下调, 在酒精性肝炎模型中大幅度上调, 且均与对应时期的临床芯片数据结果相一致。说明CCL2在酒精性肝病的不同阶段表达水平不同, 有可能成为酒精性肝病潜在的生物标记物, 对酒精肝病各阶段的动物模型选择及评价有一定的参考价值。
本研究表明, Gao-binge模型能较好地模拟人类酒精性脂肪性肝炎, 诱导的病理指标较为全面。CCL2不仅具有成为酒精性肝病生物标记物的可能, 其表达结果还对酒精肝病各阶段的动物模型选择及评价有一定的参考价值。今后, 本课题组的工作将集中于研究CCL2在酒精性肝病各阶段中发挥的作用, 进一步探索CCL2成为酒精性肝病生物标记物的可能性, 并拓展CCL2的临床应用范围, 为CCL2成为酒精性肝病潜在治疗靶点的假设提供更充分的研究依据。
| [1] | Qiu P, Li X, Kong DS, et al. Recent advances in alcoholic liver diseases[J]. Chin Pharmacol Bull (中国药理学通报), 2014, 30: 160–163. |
| [2] | Rehm J, Mathers C, Popova S, et al. Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders[J]. Lancet, 2009, 373: 2223–2233. DOI:10.1016/S0140-6736(09)60746-7 |
| [3] | Wang HX, Ma LX, Yin QL, et al. Prevalence of alcoholic liver disease and its association with socioeconomic status in north-eastern China[J]. Alcohol Clin Exp Res, 2014, 38: 1035–1041. DOI:10.1111/acer.12321 |
| [4] | Huang A, Chang BX, Sun Y, et al. Disease spectrum of alcoholic liver disease in Beijing 302 Hospital from 2002 to 2013:a large tertiary referral hospital experience from 7422 patients[J]. Medicine (Baltimore), 2017, 96: e6163. DOI:10.1097/MD.0000000000006163 |
| [5] | Thursz MR, Richardson P, Allison M, et al. Prednisolone or pentoxifylline for alcoholic hepatitis[J]. N Engl J Med, 2015, 372: 1619–1628. DOI:10.1056/NEJMoa1412278 |
| [6] | Chinese Society of Hepatology, CMA. Guidelines for the diagnosis and treatment of alcoholic liver diseases[J]. J Clin Hepatol (中华肝脏病杂志), 2010, 2: 49–53. |
| [7] | Zhao SS, Shao RG, He HW. Potential targets for anti-liver fibrosis[J]. Acta Pharm Sin (药学学报), 2014, 49: 1365–1371. |
| [8] | Hu QW, Liu GT. Advances in the research of anti-hepatic fibrosis drugs[J]. Acta Pharm Sin (药学学报), 2006, 41: 7–11. |
| [9] | Carr MW, Roth SJ, Luther E. Monocyte chemoattractant protein 1 acts as a T-lymphocyte chemoattractant[J]. Proc Natl Acad Sci U S A, 1994, 91: 3652–3656. DOI:10.1073/pnas.91.9.3652 |
| [10] | Xu LL, Warren MK, Rose WL, et al. Human recombinant monocyte chemotactic protein and other C-C chemokines bind and induce directional migration of dendritic cells in vitro[J]. J Leukoc Biol, 1996, 60: 365–371. |
| [11] | Degré D, Lemmers A, Gustot T, et al. Hepatic expression of CCL2 in alcoholic liver disease is associated with disease severity and neutrophil infiltrates[J]. Clin Exp Immunol, 2012, 169: 302–310. DOI:10.1111/cei.2012.169.issue-3 |
| [12] | Pranoti M, Aditya A, Arlene L, et al. An essential role for MCP-1 in alcoholic liver injury:regulation of pro-inflammatory cytokines and hepatic steatosis[J]. Hepatology, 2011, 54: 2185–2197. DOI:10.1002/hep.24599 |
| [13] | Kirpich I, Ghare S, Zhang JW, et al. Binge alcohol-induced microvesicular liver steatosis and injury are associated with down-regulation of hepatic Hdac 1, 7, 9, 10, 11 and upregulation of Hdac 3[J]. Alcohol Clin Exp Res, 2012, 36: 1578–1586. DOI:10.1111/acer.2012.36.issue-9 |
| [14] | Bertola A, Mathews S, Ki SH, et al. Mouse model of chronic and binge ethanol feeding (the NIAAA model)[J]. Nat Protoc, 2013, 8: 627–637. DOI:10.1038/nprot.2013.032 |
| [15] | Karaca G, Xie GH, Moylan C, et al. Role of Fn14 in acute alcoholic steatohepatitis in mice[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308: G325–G334. DOI:10.1152/ajpgi.00429.2013 |
| [16] | Sanjoy R, Dian JC, Palash M, et al. Inhibition of apoptosis protects mice from ethanol-mediated acceleration of early markers of CCl4-induced fibrosis but not steatosis or inflammation[J]. Alcohol Clin Exp Res, 2012, 36: 1139–1147. DOI:10.1111/acer.2012.36.issue-7 |
| [17] | Zhong LP, Li J, Wang FZ, et al. Protective effect and underlying mechanism of cordycepin on non-alcoholic fatty liver in ob/ob mice[J]. Acta Pharm Sin (药学学报), 2017, 52: 106–112. |
| [18] | Nyblom H, Berggren U, Balldin J, et al. High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking[J]. Alcohol Alcohol, 2004, 39: 336–339. DOI:10.1093/alcalc/agh074 |
| [19] | Fisher NC, Neil DA, Williams A, et al. Serum concentrations and peripheral secretion of the beta chemokines monocyte chemoattractant protein 1 and macrophage inflammatory protein 1alpha in alcoholic liver disease[J]. Gut, 1999, 45: 416–420. DOI:10.1136/gut.45.3.416 |
 2018, Vol. 53
2018, Vol. 53


