2. 山西大学化学化工学院, 山西 太原 030006;
3. 山西大学中药功效物质与新药创制山西省重点实验室, 山西 太原 030006;
4. 山西大学化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
5. 山西省农业科学院生物技术研究中心, 山西 太原 030031;
6. 美国路易斯维尔大学医学院, 路易斯维尔 40292;
7. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. Colleage of Chemrtry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. The Efficacy of Chinese Medicine Material and New Drug Key Lab of Shanxi Provience, Shanxi University, Taiyuan 030006, China;
4. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China;
5. Biotechnology Research Certer, Shanxi Academy of Agriculture Science, Taiyuan 030031, China;
6. Medical College, University of Louisville, Louisville 40292, American;
7. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
中国药典2015版规定的正品黄芪药材为豆科草本植物黄芪属蒙古黄芪Astragalus membranaceus (Fisch.) Bge.var.mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的干燥根[1, 2]。山西恒山山脉(浑源、应县等)产的仿野生蒙古黄芪(下称“恒山黄芪”), 具有主根粗长、分枝少、粉性足、豆腥味浓、味甜等特点, 是公认的道地药材。
目前黄芪商品交易按等级进行, 山西主要的黄芪生产企业分别建立规格等级标准, 依据直径判别黄芪等级高低[3]。各产地加工时, 首先切头去尾将侧根剪下混合在主根根条中, 再按粗细将根条分成不同等级的根段, 直径大、等级高、售价也高。本课题组[4]前期对市场上不同商品规格等级黄芪药材中的指标性成分的含量差异进行研究比较, 发现直径细、等级低的黄芪根中黄芪甲苷含量反而高, 黄酮类成分的结果与商品规格等级的划分无显著相关性; 屠鹏飞课题组[5]研究发现二、三等级的黄芪药材中毛蕊异黄酮葡萄糖苷含量并不比一等黄芪药材中的低。因此, 目前商品规格等级标准(直径)和质量评控指标并不能体现黄芪药材的质量优劣。
作为中药材商品规格等级标准, 不仅要能从表观特征区分不同规格等级药材, 同时还能反应出生长年限及品质优劣, 尤其是根类的中药材, 生长年限越长, 次生代谢产物积累越多, 药效才能越好。例如人参以年久者质佳, 素有“七两为参, 八两为宝”说法。人参的生长年限通过芦头的个数来判别, 一般3~4年的人参是不长芦头的, 到5~6年生长出芦头, 看芦头的多少可以分辨人参的年龄和品质[6]; 王文全课题组[7]研究发现随着生长年限的增加, 黄芪药材中黄酮及皂苷类成分含量呈逐年升高的趋势, 且生长年限对这两类成分的积累影响较大。可见药材的质量与生长年限密切相关, 准确判断生长年限, 不仅对适时采挖, 保证黄芪药材品质至关重要, 而且对黄芪质量研究具有重要意义。然而, 黄芪不同于人参, 尚不能从地上部分和根、茎等外观形态鉴定生长年限。
近年来“草本植物生长轮”得到越来越多的关注, Dietz等[8-10]对16科35种双子叶多年生草本植物的根进行研究, 发现绝大多数根横切面存在着代表年限的生长轮结构。彭华胜课题组[11]研究发现黄芪根中有生长轮, 可作为鉴定年限的依据。本文拟运用石蜡切片与徒手切片技术对黄芪根中的生长轮现象进行观察, 研究不同年限黄芪根及同一黄芪根中上、下段生长轮数目差异, 总结生长轮与直径和实际生长年限的相关性, 建立一种快速简便的以生长轮数目为依据的黄芪生长年限鉴定方法。同时根据黄芪根上端、中部及下端生长轮数目逐渐减少的现象, 建立以生长轮数目为依据的黄芪分段方法, 以此为依据利用HPLC-UV-ELSD同时测定方法, 阐明了绝对生长年限黄芪根段与12种指标成分的对应关系。找到黄酮类和皂苷类成分随生长年限的的积累规律, 从而为划分药材等级, 建立可控的商品规格等级标准及临床合理用药奠定基础。
材料与方法材料 不同生长年限的恒山黄芪药材由课题小组于2015年9月28日, 前往山西浑源泽青芪业有限公司黄芪GAP基地采挖, 经山西大学中医药现代研究中心秦雪梅教授鉴定为蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. Mongholicus (Bge.) Hsiao的干燥根。
仪器与试剂 手摇切片机(德国Reichert Jung)、Waters e2695高压泵、Waters 2489紫外可见检测器、Chromachem ELSD检测器、Empower色谱工作站、Sartorius BSA124S分析天平、TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司)、SC-3160低速离心机(安徽中科中佳科学仪器有限公司); 间苯三酚(德州润昕实验仪器有限公司)。
对照品 毛蕊异黄酮葡萄糖苷、芒柄花苷、(6aR, 11aR)-9, 10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷(紫檀烷苷)、8, 2'-二羟基-3', 4'-二甲氧基异黄烷-7-O-β-D-葡萄糖苷(异黄烷苷)、毛蕊异黄酮、芒柄花素、3-羟基-9, 10-二甲氧基紫檀烷(紫檀烷)、7, 2'-二羟基-3', 4'-二甲氧基异黄烷(异黄烷)和黄芪皂苷Ⅰ、Ⅱ、Ⅲ、Ⅳ均购于上海永恒生物科技有限公司, 批号依次为20150408、20150425、20150318、20150328、20150321、20140526、20150625、20150012、20140312、20150223、20150312、20150423, 质量分数均大于98%。
年限鉴别取样 分别选取1~6年生具有代表性的黄芪药材主根各30条, 测量根总长度。去掉芦头及空心部分, 平均分为5段, 按从上至下测量每一段的上端直径及最后一段的末端直径, 依次编号为A至E。见表 1。
| Table 1 Sample information. n = 30, x ± s |
徒手切片 将已阴干的黄芪根段冲洗至无杂物, 编号, 用冷水全部浸湿, 装入塑料袋内密封, 放在60 ℃烘箱中24 h后检查, 保证其柔软度适合用单面刀片切割。徒手切成2~3 mm厚度薄片后, 放入盛水的培养皿中待观测。挑选形态完整的薄片于载玻片上, 在样本上先滴适量浓盐酸溶液, 再滴一定量的间苯三酚, 用滤纸引流, 在体视显微镜下观测木质部中逐渐形成的粉红色环的数目, 记录并拍照。
石蜡切片法 取与徒手切片相同的黄芪根材料, 切成厚度约1 cm的根段, 按照常规石蜡切片技术[12]流程脱水、包埋, 德国Reichert Jung手摇切片机进行切片, 厚度约为20 μm。番红、固绿染色, 透明封片后, 在OLYMPUS SZX16型体视显微镜下观察切片显微特征以大小导管群间隔排列形成的围绕着根中心的同心圆环结构判断生长轮数目。
含量测定取样 选用不同年限黄芪样本的A段部分, 共40批黄芪样本, 编号为1~40的样本。
对照品溶液的制备 分别精密称取对照品毛蕊异黄酮葡萄糖苷、芒柄花苷、紫檀烷苷、异黄烷苷、毛蕊异黄酮、芒柄花素、紫檀烷、异黄烷、黄芪皂苷Ⅳ、Ⅲ、Ⅱ和Ⅰ共12种成分分别至10 mL量瓶中, 用甲醇各自溶解, 摇匀, 分别制成1.870、1.360、1.362、0.601、0.522、1.254、1.226、1.046、0.979、0.500、0.582和1.972 mg·mL-1的对照品储备液。再分别吸取适量至25 mL量瓶中, 用甲醇溶解, 摇匀, 分别制成质量浓度为56.5、81.3、75.5、86.8、19.9、18.4、24.5、83.7、53.9、43.7、63.4和108.9 μg·mL-1的对照品溶液。
供试品溶液的制备 取黄芪粉末1.5 g, 精密称定, 置圆底烧瓶中, 加甲醇60 mL, 加热回流3 h, 滤过, 回收溶剂至干, 残渣加甲醇溶解, 转移至5 mL量瓶中, 加甲醇至刻度, 摇匀, 即得。
HPLC色谱条件 参考实验室建立的12种成分同时测定的方法[13], 并对洗脱条件进行优化[14]。流动相为乙腈(A)-水(B), 体积流量1.0 mL·min-1, 蒸发光检测器参数:空气泵压力为0.5 MPa, 气体流速为2.5 L·min-1, 漂移管温度为105 ℃, 增益值为1.0; Venusil MP C18色谱柱(250 mm × 4.6 mm, 5 μm), 紫外检测波长230 nm, 柱温25 ℃, 进样量20 μL。梯度洗脱条件为: 0~8 min, 0~20% A; 8~15 min, 20%~30% A; 15~30 min, 30%~43% A; 30~40 min, 43%~60% A; 40~50 min, 60%~100% A; 50~60 min, 100%A; 60~66 min, 100%~20% A。
方法学考察
标准曲线的绘制 标准曲线的绘制过程中, 包含5个浓度梯度, 将以上配制的对照品储备液分别逐级稀释。对照品毛蕊异黄酮苷系列浓度分别为0.935、0.312、0.078、0.039、0.019、0.010 mg·mL-1; 对照品芒柄花苷、紫檀烷苷、毛蕊异黄酮、芒柄花素和紫檀烷浓度系列分别为0.680、0.340、0.170、0.085、0.043、0.021 mg·mL-1; 0.681、0.341、0.170、0.085、0.043、0.021 mg·mL-1; 0.276、0.138、0.069、0.035、0.017、0.009 mg·mL-1; 0.627、0.314、0.157、0.078、0.039、0.020 mg·mL-1; 0.613、0.307、0.153、0.077、0.038 mg·mL-1; 对照品异黄烷、异黄烷苷浓度系列分别为0.523、0.262、0.131、0.065、0.033 mg·mL-1; 0.301、0.100、0.025、0.013、0.003 mg·mL-1; 对照品黄芪皂苷Ⅰ浓度系列为0.657、0.329、0.164、0.082、0.411、0.021 mg·mL-1; 对照品黄芪皂苷Ⅱ浓度系列为0.291、0.146、0.073、0.036、0.018 mg·mL-1; 对照品黄芪皂苷Ⅲ浓度系列为0.250、0.125、0.031、0.008、0.004 mg·mL-1; 对照品黄芪皂苷Ⅳ浓度系列为0.245、0.061、0.153、0.008、0.004 mg·mL-1。过0.2 μm滤膜后, 进样20 μL。
精密度实验 吸取混合对照品溶液, 连续进样6次, 以12种成分的峰面积值计算RSD值。
重复性实验 精密称取1号黄芪样品6份, 按上述方法制备供试品溶液, 按上述色谱条件测定。以12种成分的含量结果计算RSD值。
稳定性实验 取1号黄芪药材, 按“供试品溶液的制备”方法制备供试品溶液, 分别于0、2、4、6、8、10、12、24 h后进样分析。以12种成分的峰面积计算RSD值。
加样回收率实验 取1号药材作为加样回收实验组, 以药材重复性实验中所得6组数据中的各成分质量分数的平均值作为该药材12成分量的真实值, 12种成分的具体质量浓度分别为: 0.852、0.247、0.296、0.018、0.012、0.158、0.028、0.324、0.023、0.195、0.022、0.521 mg·mL-1。按照药材各成分量的50%、100%和150%分别加入对照品储备液, 各对照品储备液浓度见“对照品溶液的制备”项, 在样品回流提取前, 用微量进样器或移液管分别向每组样品中加入一定量的对照品储备液, 与样品一起制备。加入各对照品计算质量分数, 每个质量分数平行备样3份样品, 一共9份, 计算回收率。
样品测定 取待测样品按“供试品溶液的制备”方法制备, 用5 mL量瓶定容至刻度, 吸取约1 mL至1.5 mL进样小瓶中, 测定峰面积。黄酮类成分, 对照品溶液和供试品溶液分别进样20 μL; 皂苷类成分, 对照品溶液和供试品溶液分别进样10 μL和20 μL, 用外标两点法测定。
数据处理 HPLC-UV-ELSD测定结果导入Graphpad Prism软件对比不同芪龄指标成分的含量差异, 总结黄酮和皂苷在黄芪不同生长时期中的变化规律。SIMCA-P13.0 (Umetrics, umea, 瑞典)软件进行偏最小二乘判别分析(PLS-DA)[15], 判断2~6年生各组散点图的分离情况, 用SPSS19.0软件进行聚类分析对偏最小二乘判别分析[16]进行验证。
结果与分析 1 黄芪根的结构解剖及生长轮黄芪根的横切面构造符合双子叶植物根的次生结构[17], 由周皮、次生韧皮部、维管形成层、次生木质部及中心初生木质部构成, 如图 1A所示。形成层是木质部与韧皮部的分界线, 该部位受外力作用易断裂, 是生长轮的形成点。次生木质部中, 由于周年生长季节变化, 形成大导管群和小导管群以及木纤维结构有规律的间断排列而形成生长轮, 其局部放大图如图 1B所示。
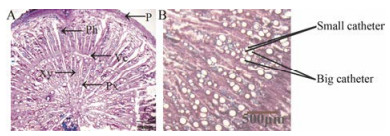
|
Figure 1 Structures anatomy of Astragali Radix root (A) and partial enlarged drawing (B). P: Periderm; Ph: Phloem; Vc: Vascular cambium; Xy: Secondary xylem; Px: Primary xylem |
对黄芪根去掉空心部分处的横截面进行生长轮数目的研究, 发现徒手切片和石蜡切片观察结果一致, 在次生木质部中, 生长轮数目与实际黄芪种植年限一致。一年生黄芪根直径小于0.5 cm, 只有中心区域的初生木质部结构, 大小导管排列不整齐, 尚未形成生长轮(图 2A), 二年生黄芪主根中心外就可以看到两圈明显的生长轮(图 2B), 三年生黄芪主根中心外出现3条生长轮(图 2C), 4~6年生黄芪主根生长轮数目依次增加(图 2D、E和F), 因为所有材料均是由2015年9月采集, 因此, 浑源1~6年生传统黄芪的生长轮用年限标记(图 3)。
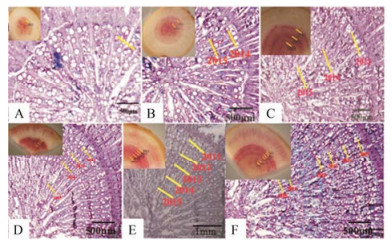
|
Figure 2 The growth rings of different years, Astragali Radix root. A-F: 1-6 year, separately |

|
Figure 3 The growth rings number of different diameter from 6 years old Astragali Radix root |
多种观测方法比较发现, 徒手切片法, 直接用肉眼观测木纤维的间隔排列可大致区分生长轮的界限, 间苯三酚-浓盐酸染色后便可清晰准确判别黄芪的实际生长年限, 观测到的生长轮数目与石蜡切片一致。
3 同一条根不同直径处的生长轮数目同一根黄芪上下端生长轮数目不一致, 上端较粗年轮数多, 下端越细年轮数越少。以6年生主根为例, 主根上端去掉空心部位处横截面生长轮的数目与实际种植年限一致(图 3A), 随横切面直径变小, 生长轮数目在减少。且横切面直径差为0.3 cm左右, 生长轮数目相差1 (图 3B); 直径相差约0.6 cm时, 生长轮数目相差2 (图 3C); 依次类推, 随直径的减小, 生长轮数目的变化情况(图 3D、E及F)。
4 方法学考察结果表明, 12种成分其浓度与响应值具有良好的线性关系, 相关系数r2均大于0.999, 标品与样品色谱图见图 4; 回归方程及其线性范围见表 2。精密度、重复性实验结果RSD值均小于3%表明该方法的精密度及重现性良好。稳定性实验结果表明各目标色谱峰相对保留时间及色谱峰面积比值无明显变化, 对照品的RSD值均在3%以内, 供试品溶液在24 h内稳定, 见图 4。
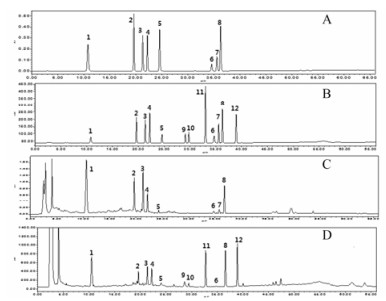
|
Figure 4 HPLC of reference substance (A and B) and Astragali Radix samples (C and D). 1: Calycosin-7-O-β-D-glucoside; 2: Ononin; 3: (6aR, 11aR)-9, 10-Dimethoxyptercarpan; 4: 8, 2'-Dihydroxy-3, 4-dimethoxyisoflavan-7-O-β-D-glucopyranoside; 5: Calycosin; 6: Formononetin; 7: (6aR, 11aR)-9, 10-Dimethoxyptercarpan; 8: 8, 2'-Dihydroxy-3, 4-dimethoxyisoflavan; 9: Astragaloside Ⅳ; 10: Astragaloside Ⅲ; 11: Astragaloside Ⅱ; 12: Astragaloside Ⅰ |
| Table 2 Regression data, equation precision, repeatability, system and stability. Y: Peak area; X: Concentration of compound (μg·mL-1) |
加样回收率实验结果表明12种指标性成分的回收率分布在90%~110%之间, RSD值均小于5.0%。说明该方法的准确度良好。
5 绝对生长年限总黄酮与总皂苷含量分析将8种黄酮的含量相加得到总黄酮的含量, 4种皂苷的含量相加得到总皂苷含量, 各个年限黄芪总黄酮和总皂苷的含量如图 5所示。
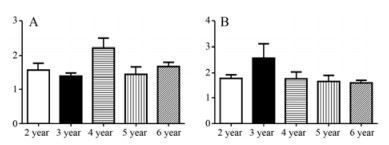
|
Figure 5 Quantitative analytical results of Austragali Radix samples. A: Total flavone; B: Total saponins |
从图中可以直观的看出, 对比不同绝对生长年限黄芪根中总黄酮和总皂苷的含量, 生长4年的黄芪中总黄酮含量明显高于其他生长年限, 不同年限之间含量有所波动, 但总量变化范围不大。总皂苷生长3年含量达到最高, 除3年之外, 其含量随着生长时间的延长缓慢下降。
6 绝对生长年限间多元统计分析首先采用偏最小二乘判别分析观察绝对生长2~6年黄芪各散点图分离情况, 根据分析结果判断样本间的差异是否符合实际情况, 理论上黄芪的年龄相近, 其内部的代谢差异相对年龄相差较大的小, 散点的平均距离也较近, 通过散点图可以直观的对年限间的差异做出快速判断。另外, 为了直接对比各组样本之间指标成分含量之间的差异, 用聚类分析对偏最小二乘判别分析进行验证, 分析结果如下。
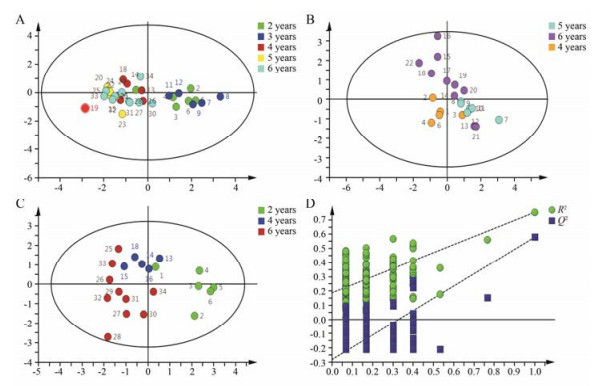
图 6A是2~6年生黄芪PLS-DA散点图, 结果显示不同生长年限样本可以分成两类: 2年和3年聚为一类, 4、5和6年聚为一类, 两类有较大的分离趋势; 图 6B进一步将绝对生长年限为4、5和6年的样本单独做PLS-DA散点图, 结果显示3个年限同样有分离趋势, 且5年和6年的聚集更加明显, 与4年生黄芪有分离趋势; 同样, 将间隔1年的样本单独进行分析如图 6C, 结果显示绝对年限为2、4和6年生的样本散点图能够完全区分开, 且2年生明显和6年生区分, 4年生相对靠近6年生黄芪; 模型验证完全成立(6D), 说明模型可靠。
|
Figure 6 PLS-DA score plot and permutation test model validation plot based on HPLC-UV-ELSD. A: PLS-DA score plot of 2-6 years; B: PLS-DA score plot of 4-6 years; C: PLS-DA score plot of 2, 4, 6 years; D: PLS-DA model validation plot of 2, 4, 6 years |
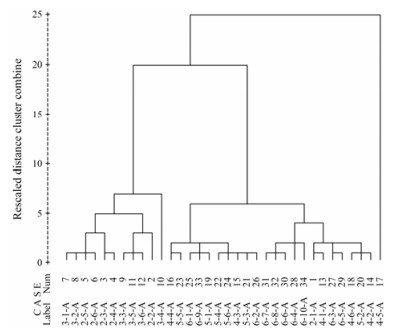
进一步采用聚类分析对所有A段样本进行分析, 结果显示除2-1-A外, 样本共分为两大类, 即以2年和3年的为一类, 绝对年限为4、5和6年的聚为一类; 对于绝对年限为4年的样本, 4-2-A、4-6-A、4-1-A与6年生的样本聚为一类; 4-3-A和4-4-A主要与5年生的样本聚为一类; 4-3-A和4-4-A又与3年生样本聚为一类, 说明绝对年限为4年的样本化学成分含量介于2年和6年之间。总体而言, 聚类分析的结果与PLS-DA分析结果类似, 而且也都比较符合实际情况(图 7)。
|
Figure 7 Cluster analysis of Astragali Radix from absolute 2-6 years |
传统使用的野生或仿野生(种子直播, 根垂直生长)黄芪至少生长6年以上, 且根深达1米左右, 致采挖异常困难而供不应求, 使之在上世纪60年代成为紧缺中药材。80年代发展的平栽(育苗移栽, 主根横卧于沟, 不断向下生长)种植方式, 其低成本生长特点, 使黄芪产量迅速扩大, 缓解了市场需求紧张, 也冲击了传统的仿野生芪资源。因此, 如何对仿野生芪与移栽芪进行化学成分、药效差异研究, 一直是中医药行业关注的问题[18]。本文从仿野生芪准确生长年限鉴别、不同成分化学差异研究得出以下结论。
利用徒手切片及石蜡切片技术识别黄芪生长轮鉴别绝对生长年限发现主根顶端去掉空心部分处横截面的生长轮数目与种子播种后实际生长年限一致, 此段为药材最上端, 直径最粗, 年限最长, 生长轮数目也最多。随着根往下生长, 直径减少, 木质部生长轮呈现递减的趋势, 说明木质部生长轮可作为判断黄芪根实际生长年限的依据。
对于具有散孔材的黄芪根, 木质部生长轮界限不清晰, 而纤维束环带界限清晰, 间隔均匀, 因此可同时采用徒手切片与石蜡切片方法相互验证生长年限, 在实际生产过程中, 一般采用徒手切片即可准确测定生长年限。研究为市场上黄芪的年限划分提供了简便、可靠的方法。
彭华胜课题组[11]研究发现利用徒手切片观测到的生长轮数目比实际生长年限少1轮, 通过本实验的研究得知不论是徒手切片还是石蜡切片均观察到这种现象, 原因在于黄芪的特殊的生长方式, 恒山黄芪每年四月中旬撒种, 九月底采挖, 故1年生黄芪实际上只生长了6个月, 2年生实际生长年限是18个月, 中心部位导管群未成圆环是第一年黄芪生长的结果, 故生长轮观测数比实际生长年限少1。
研究黄芪绝对生长年限的样本主要以2~6年生去掉空心部分进行实验, 即所有分段样本的A段, 这部分的实际生长时间最接近药材从播种到采挖年限, 因此绝对年限也最准确, 基于生长轮鉴别的绝对生长年限黄芪根, 以指标成分含量为基础, 比较总黄酮(8种黄酮)和总皂苷(4种皂苷)的差异, 分析了二者含量随生长时间延长的变化规律, 发现绝对生长4年的黄芪, 总黄酮的积累量达到最高值, 总皂苷的积累量变化比较有规律, 生长3年的黄芪植株, 总皂苷含量达到峰值, 除了3年生黄芪外, 总皂苷随生长年限的延长而含量递减。研究结果表明在划分规格等级时不仅要看以长度、直径, 还应考虑实际生长年限。
由多元统计结果可以看出, 散点各种分离情况比较符合实际情况, 也就是说不同年限成分含量的差异实际上是生长年限差异造成的, 且同一根黄芪上、下段生长年限的差异亦可导致成分含量差异。此外, 黄芪次生代谢产物积累还受到环境, 产地等诸多因素的影响[19]。因此, 各实验室进行黄芪质量研究时, 所取黄芪样品的实际生长年限及同一根上、下段年限的差异均可能影响检测结果的准确性, 导致无法有效评价黄芪品质。
质量稳定性和均一性是确保中药材质量及中医临床用药安全有效的关键和基础, 药材中的化学成分是发挥药效的物质基础, 易受到物种、产地、生态环境、生长年限、种植方式等多种因素的影响而发生变异[20], 研究不同因素对药用植物的成分及药效影响规律, 是药材质量评价领域的热点。本文研究结果表明石蜡切片技术结合间苯三酚-浓盐酸染色法能够准确地鉴别出黄芪的实际生长年限。建立以生长轮数目为依据的黄芪年限分段方法, 并结合多种分析手段的代谢组学技术和多元统计分析方法, 为进一步研究基于生长轮鉴定的绝对生长年限黄芪与化学成分积累的规律, 探明不同生长年限黄芪化学成分变化的内在关系及药效差异奠定基础, 同时为黄芪精细化商品等级规格标准的建立、临床合理用药提供依据。
致谢: 泽青芪业有限公司赵贵富在样品采集过程中给予的无私帮助以及黄芪药材在加工方法上的指导。| [1] | Editorial Commission of Chinese herbal medicine of State Administration of Traditional Chinese Medicine of the People's Republic of China. Chinese Herbal Medicine (中华本草)[M]. 11 Volume. Shanghai: Shanghai Science and Technology Press, 1999: 2974. |
| [2] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People, s Republic of China (中华人民共和国药典)[S]. 2015 ed. Beijing: China Medical Science Press, 2015: 283-284. |
| [3] | Wang YQ, Li ZY, Qin XM, et al. Verifi cation of specifi cation grading for Astragali Radix goods and consideration about the quality of Astragali Radix[J]. Chin Med Res Prac (现代中药研究与实践), 2016, 30: 61–67. |
| [4] | Niu QY, Wan YQ, Li ZY, et al. Evaluation of different goods quality grade Astragalus[J]. Chin Med Mat (中药材), 2015, 38: 1186–1190. |
| [5] | Shi ZY, Bao Z, Jiang Y, et al. Quantitative analysis of calycosin glycoside and formononetin in Radix Astragali from different sources[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 779–783. |
| [6] | Dong YJ, Zhang WJ, Zhang JK, et al. Research progress of ginseng age[J]. Chin Tradit Herb Drug (中草药), 2007, 38: 467–470. |
| [7] | Xin B, Ma SJ, Wang WQ, et al. Influence of different growing years on accumulation of flavonoids and saponins in Astragali Radix[J]. Chin Med Mat (中药材), 2015, 38: 1366–1369. |
| [8] | Dietz H, Schweingruber FH. Annual rings in native and introduced forbs of lower Michigan, U. S. A[J]. Can J Bot, 2002, 80: 642–649. DOI:10.1139/b02-048 |
| [9] | Dietz H, Ullmann I. Age-determination of dicotyledonous herbaceous perennials by means of annual rings:exception or rule?[J]. Ann Bot, 1997, 80: 377–379. DOI:10.1006/anbo.1997.0423 |
| [10] | Dietz H, Fattorini M. Comparative analysis of growth rings in perennial forbs grown in an alpine restoration experient[J]. Ann Bot, 2002, 90: 663–668. DOI:10.1093/aob/mcf247 |
| [11] | Wang J, Xie XM, Peng HS, et al. Developmental Anatomy of Medicinal Parts of Sophora flavescens as Well as Age Identification and Study of Accumulation of Secondary Metabolite of Astragalus (苦参药用部位发育解剖暨黄芪道地药材的年限鉴别及其次生代谢产物积累研究)[D]. Hefei: Anhui University of Chinese Medicine, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10369-1014172655.htm |
| [12] | Yu BS, Zhang Y. Biological Microscopy (生物学显微技术)[M]. Beijing: Beijing Agriculture University Press, 1989. |
| [13] | Qi LW, Yu QT, Li P, et al. Quality evaluation of Radix Astragali through a simultaneous determination of six major active isoflavonoids and four main saponins by high-performance liquid chromatography coupled with diode array and evaporative light scattering detectors[J]. J Chromatogr A, 2006, 1134: 162–169. DOI:10.1016/j.chroma.2006.08.085 |
| [14] | Xiong YF, Wang YQ, Qin XM, et al. Quality comparison between traditional and cultivated Astragalus membranaceus var. mongholicus grown in Shanxi Hengshan area[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1635–1643. |
| [15] | Ke CF, Wu XY, Li K, et al. Comparison of PLS-DA four models diagnostic statistics in metabolomics applications[J]. Chin J Health Stat (中国卫生统计), 2014, 31: 403–406. |
| [16] | Sun YZ, Guo LP, Huan LQ, et al. Application of multivariate statistical methods in research of Chinese medicinal materials resource ecology[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 1257–1260. |
| [17] | Zheng JC. Pharmabotany (药用植物学)[M]. Beijing: Peo-ple's Medicine Publishing House, 1999. |
| [18] | Qin XM, Li ZY, Sun HF, et al. Status and analysis of Astragali Radix resource in China[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 3234–3238. |
| [19] | Yang HJ, Fu J, Zhang HT, et al. Current status in studies on quality evaluation of Astragali Radix[J]. Chin J Pharm Anal (药物分析杂志), 2014, 34: 570–576. |
| [20] | Gairola S, Shariff NM, Bhatt A, et al. Influence of climate change on production of secondary chemicals in high altitude medicinal plants:issues needs immediate attention[J]. J Med Plants Res, 2010, 4: 1825–1829. |
 2018, Vol. 53
2018, Vol. 53


