2. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193;
3. 哈尔滨工业大学生命科学与技术学院, 黑龙江 哈尔滨 150080
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China;
3. School of Life Science and Technology, Harbin Institute of Technology, Harbin 150080, China
和厚朴酚(honokiol, HK)是厚朴中最为主要的两个活性成分之一, 具有多种生物学活性, 如抗菌、抗炎、中枢性肌肉松弛、神经抑制、降低胆固醇、抗血小板凝聚和抗肿瘤等[1-4]。和厚朴酚几乎不溶于水, 很难制备成普通的水溶性注射剂, 这使其药效不能充分发挥, 限制了其体内作用[5]。研究显示[6, 7], HK可有效抑制MCF-7、4T1等多种乳腺癌细胞的增殖。Zhang等[7]研究了HK脂质体联合多柔比星抑制4T1细胞增殖的机制, 但其仅限于体外研究, 且主要内容则为联合用药和逆转多药耐药性。HK单独用于抑制乳腺癌细胞的体内外研究不多见。乳腺癌作为我国女性高发的恶性肿瘤, 临床多用的手术治疗严重影响了患者的日后生活质量。而HK广泛的抗肿瘤作用[8-12], 有望给患者带来新的应对手段。
针对HK制剂的研究报道并不少见, 大多通过物理包封或化学偶联的方法制备HK脂质体[13]、胶束[14]等高分子载药系统, 以改善其理化性质, 提高其生物利用度。纳米混悬剂(NSps)作为一种新剂型, 在药物中加入少量表面活性剂作为稳定剂高度分散于分散介质中, 形成粒径在10~1 000 nm的亚微粒交替分散系统。本文应用沉淀法制备纳米混悬剂, 先将难溶性药物溶解, 再将其滴入反溶剂中, 使药物达到饱和而析出结晶[15]。
据文献[16, 17]报道, 聚乙烯吡咯烷酮(polyvinylpyrrolidone, PVP)可置换粒子表面H2O及OH-产生吸附层, 降低粒子表面自由能, 防止粒子聚集。随着PVP增加, 粒子在溶液中稳定性亦随之增加, 并且疏水性的HK与血浆蛋白较好结合, 同时血浆蛋白也是一种优良静脉注射辅料, 可以作为稳定剂来制备HK纳米混悬剂, 应用牛血清白蛋白(bovine serum albumin, BSA)作为一种稳定剂亦可防止HK被氧化, 并使给药系统具有一定的靶向性, 结构中多个疏水性的部位能与中性及带负电疏水性相结合, 提高药物在水溶液中的稳定性, 自身形成的交联结构保护药物免被破坏。本文利用PVP和BSA作为联合稳定剂制备HK纳米混悬剂(HK-NSps), 将HK包封在纳米粒内核改善其氧化不稳定的缺点, 体内外研究均显示显著提高了抗肿瘤效果。
材料与方法仪器和材料 Zetasizer Nano ZS 90型粒度仪/电位仪(英国Malvem Instruments公司); Ultimate 3000 Series高效液相色谱仪(美国Dionex有限公司); Maisch Symmetry C18色谱柱(250 mm × 4.6 mm, 5 μm); Tecan M1000多功能连续波长酶标仪(瑞士); JEM-1400透射电子显微镜(日本电子珠式会社)。HK (上海士峰生物科技有限公司, 纯度98.0%, 批号35354-74-6);聚乙烯吡咯烷酮(K30, 批号0712109, 分析纯)、羟丙基甲基纤维素(hydroxypropyl methyl cellulose, HPMC)、Tween-80 (批号1082106)、实验用水为去离子水、丙酮、二甲基亚砜(DMSO) (国药集团化学试剂有限公司); BSA (北京冬哥生物科技有限公司, 批号20110310);聚乙烯醇(polyvinyl alcohol, PVA, 货号: P4019, 美国Alfa Aesar公司); 泊洛沙姆(Poloxamer 188, P-188, 货号: P-7000, 美国Sigma公司); 紫杉醇注射液(paclitaxel, PTX, 北京协和药厂, 国药准字H10980069, 批号151108);乙腈(色谱纯, HiPure Chem公司)。
动物及细胞培养 健康Balb/c小鼠, 雌性, 体重18~20 g (北京维通利华实验动物技术有限公司, SPF级, 合格证号: 11400700215055, 许可证编号: SCXK (京) 2016-0011)。4T1乳腺癌细胞株(北京协和医学院基础医学研究所细胞中心); RPMI 1640培养基、胎牛血清、青霉素和链霉素双抗(美国Gibco公司); 96孔无菌培养板(美国Corning公司)。
HK-NSps制备及条件筛选
稳定剂种类考察 分别精密称取HPMC、PVA、PVP、P-188、Tween-80、BSA、P-188/BSA和PVP/BSA (含量均为0.25%, m/v)作为稳定剂溶解于20 mL去离子水, HK 100 mg溶解于4 mL丙酮, 在超声条件下(25 ℃、250 W), 将有机相注入到水相中制备纳米混悬剂, 45 ℃减压旋转蒸发除去丙酮, 考察不同稳定剂对HK-NSps粒径的影响。
超声功率的考察 精密称取BSA 50 mg、PVP 50 mg作为稳定剂共同溶解于20 mL去离子水, HK 100 mg溶解于4 mL丙酮, 分别在100 W、250 W和500 W超声功率, 超声温度25 ℃下将有机相注入到水相中制备纳米混悬剂, 45 ℃减压旋转蒸发除去丙酮, 考察不同功率对HK-NSps粒径的影响。
PVP与BSA比例的考察 精密称取BSA和PVP作为稳定剂共同溶解于20 mL去离子水(三者质量比满足mHK/m(BSA+PVP) = 1/1), HK 100 mg溶解于4 mL丙酮, 在超声条件下(25 ℃、250 W)将有机相注入到水相中, 分别在PVP/BSA比例为1:3、1:1和3:1下制备纳米混悬剂, 45 ℃减压旋转蒸发除去丙酮, 考察不同比例条件下对HK-NSps粒径的影响。
制备温度的考察 精密称取BSA 50 mg、PVP 50 mg作为稳定剂共同溶解于20 mL去离子水, HK 100 mg溶解于4 mL丙酮, 分别在5 ℃、25 ℃和45 ℃超声温度, 超声功率250 W下将有机相注入到水相中制备纳米混悬剂, 45 ℃减压旋转蒸发除去丙酮, 考察不同超声温度下对HK-NSps粒径的影响。
HK-NSps的体外评价
透射电镜表征 以HK含量计, 将制备的HK-NSps用去离子水稀释至0.1 g·L-1, 取5 μL滴在300目的铜网上, 5 min后吸去多余样品, 于阴凉晾干, 10 min后用0.5%醋酸铀溶液5 μL染色90 s, 自然晾干3 h, 于透射电镜下观察、拍照, 加速电压为80 kV。
载药量的测定 参照文献[18]建立HK高效液相色谱条件, 建立标准曲线:精密称取HK 5 mg于25 mL棕色量瓶中, 乙腈溶解、定容至刻度, 摇匀, 得到200 μg·mL-1母液, 以色谱乙腈逐步稀释, 得到一系列浓度分别为200、150、100、75、50、20、10、5和1 μg·mL-1标准溶液, 各取20 μL进行HPLC分析, 以色谱峰面积(Y)对HK标准溶液浓度(X, μg·mL-1)进行加权最小二乘法, 得到HK标准曲线方程Y = 0.794 3 X -0.555 8, R2 = 0.999 8, 线性范围为1~200 μg·mL-1。
取制备的HK-NSps 10 mL冻干, 精密称量冻干粉的重量为W2。用甲醇充分溶解破坏纳米粒, 使HK释放, HPLC测定冻干粉中HK所占重量为W1。按照如下公式计算载药量(DL):
| $ \rm{DL=}\left( {{\mathit{W}}_{1}}/{{\mathit{W}}_{2}} \right)\times 100\% $ |
HK-NSps室温放置稳定性考察 精密吸取HK-NSps溶液3 mL, 在室温下(25 ℃)放置, 考察其粒径随时间的变化, 分别在0、2、4、6、10、15和30天取样, 用Zetasizer nano ZS考察其平均粒径随时间的变化。另精密吸取HK-NSps 4 mL, 用甲醇充分溶解破坏纳米粒, 使HK释放, HPLC测定15天内HK含量变化。
不同介质中的粒径稳定性考察 精密吸取HK-NSps 1 mL, 分别滴加到等体积的2×PBS (磷酸盐缓冲液, pH 7.4)、1.8% NaCl溶液和10%葡萄糖溶液, 于4倍体积的人工胃液、人工肠液中37 ℃孵育, 不同时间点取样测定粒径变化。
人工胃肠液是按照《中国药典》中的方法进行配制。人工胃液:取1 mol·L-1稀盐酸16.4 mL, 加蒸馏水800 mL, 胃蛋白酶10 g, 混匀, 加水稀释至1 L; 人工肠液:磷酸二氢钾6.8 g加水500 mL, 用0.1 mol·L-1 NaOH调pH 6.8, 另取胰蛋白10 g, 加水溶解, 两液混合, 加水稀释至1L。
使用时取配制的人工胃肠液各4 mL放置于离心管中, 10 000 r·min-1离心10 min后, 过0.45 μm微孔滤膜, 与HK-NSps按4/1体积比混合, 从0 h开始间隔测定粒径。
体外释放 精密吸取HK-NSps溶液1 mL于透析袋(MWCO 8 000~14 000)中, 放置在50 mL具塞锥形瓶中, 以40 mL含有0.2% Tween-80的PBS为释放介质, 100 r·min-1磁力搅拌下在37 ℃恒温释放。分别在15、30 min和1、2、4、6、8、10、12、24、36、48、60、72、84 h取1 mL释放外液, HPLC测量释放介质中的药物含量, 计算累计释放率。每次取样后立即补充等温、新鲜的释放介质1 mL, 每24 h完全更换释放外液。另取HK乙醇溶液和HK混悬液(将HK药物粉末直接分散在纯水中超声而得), 以同样的方法考察体外释放。释放介质满足漏槽条件, 同一样品平行实验3份。
HK-NSps体内外药效学研究
HK-NSps对小鼠乳腺癌(4T1)细胞的抑制率 将HK-NSps以不含胎牛血清的培养基稀释成不同浓度备用, 同时将HK以DMSO溶解后以同样的培养基稀释成不同浓度。在37 ℃、5% CO2细胞培养箱中用含10%胎牛血清、100 u·mL-1青-链霉素的1640培养液培养4T1细胞, 细胞生长到对数期时用培养液配成单个细胞悬液, 以每孔1×104个细胞接种于96孔板中, 继续培养4T1细胞。24 h后弃去培养液, 各孔加200 μL含HK质量浓度分别为0 (对照组)、0.5、2.5、5、10、15、20、25和50 µg·mL-1的HK-NSps和HK溶液, 每个浓度6个复孔, 置于细胞培养箱中继续培养。24 h后各孔加入以PBS配制的5 g·L-1无菌MTT溶液20 µL, 继续孵育4 h后终止培养, 吸去每孔内液并加入DMSO 200 μL, 充分震荡10 min, 用酶标仪测其在570 nm波长处测定光吸收值(A)。计算不同浓度对4T1细胞抑制率(CI), 并根据GraphPad Prism软件计算半数抑制浓度(IC50)。
| $ \rm{CI=}\left( {{\mathit{A}}_{\rm{空白对照组}}}-{{\mathit{A}}_{\rm{实验组}}} \right)/{{\mathit{A}}_{\rm{空白对照组}}}\times 100\% $ |
HK-NSps 体内药效学实验液氮冻存的鼠源性4T1细胞复苏, 培养到对数期后消化成细胞悬液, 用PBS调整4T1细胞悬液浓度至每毫升1×107个瘤细胞。取Balb/c小鼠, 于右侧腋窝皮下接种4T1细胞悬液0.2 mL, 接种一段时间后筛选出肿瘤大小相对一致且肿瘤体积约200 mm3的小鼠60只进行实验。
将筛选出的60只Balb/c小鼠随机分为6组: HK-NSps高剂量组(60 mg·kg-1)、中剂量组(40 mg·kg-1)和低剂量组(20 mg·kg-1)均腹腔注射给药(ip), 阳性药紫杉醇注射剂组(4 mg·kg-1, ip), HK原料药混悬液灌胃组(60 mg·kg-1, ig)和生理盐水对照组(NS, ip)[19, 20]。HK原料药混悬液灌胃组每天给药1次, 其余5组每两天给药1次, 各组均连续给药6次。
在实验中, 对小鼠生存状态进行观察并每次给药前对小鼠体重及瘤体积进行称重及测量, 绘制小鼠体重、瘤体积变化曲线(肿瘤体积的计算公式为: V = 0.5 ab2, 其中a为肿瘤的长径, b为肿瘤的短径)。第6次给药24 h后, 将动物脱颈处死, 完整剥离皮下转移瘤体, 称量其质量(W), 计算实际抑瘤率(IR)。
| $ \rm{IR=}\left( 1-{{\mathit{W}}_{\rm{实验组}}}/{{\mathit{W}}_{\rm{对照组}}} \right)\times 100\% $ |
统计学处理 实验所得所有数据均以x ± s表示, 利用SPSS 15.0软件进行统计学分析, 数据采用单因素方差分析, 两组间分析采用LSD检验, 若P<0.05则认为差异有显著性意义。
结果 1 稳定剂的确定选择HPMC、PVA、PVP、P-188、Tween-80、BSA、P-188/BSA和PVP/BSA一系列不同的稳定剂制备HK-NSps, 通过测定其粒径及PDI (图 1)确定了BSA和PVP联合作为稳定剂有更小的粒径及PDI值, 可作为HK-NSps的稳定剂。
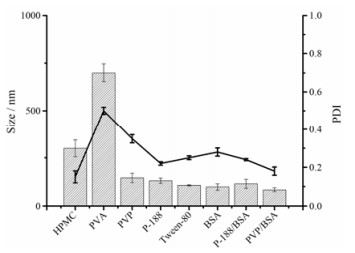
|
Figure 1 The influence of different stabilizer systems on the particle size and polydispersity index of honokiol nanosuspensions (HK-NSps). n = 3, x ± s. PDI: Polydispersity index; HPMC: Hydroxypropyl methl cellulose; PVA: Polyvinyl alcohol; PVP: Polyvinylpyrrolidone; P-188: Poloxamer 188; BSA: Bovine serum albumin |
不同超声功率对纳米混悬剂的粒径影响情况如图 2。在一定范围内随着超声强度的增大, HK-NSps的粒径减小。当超声强度达到250 W后, 再增加强度(500 W), 粒径未见太大变化, 最终确定250 W为最佳超声功率。
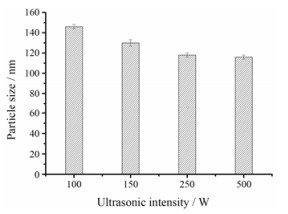
|
Figure 2 The impact of ultrasonic intensity on HK-NSps. n = 3, x ± s |
PVP与BSA比例对HK-NSps的制备有一定的影响, 结果见表 1。当PVP/BSA接近1:1时, 粒径、PDI及zeta电位均为最优。因此, 选择PVP/BSA为1:1用于制备HK-NSps。
| Table 1 Particle size and distribution of HK-NSps |
在制备过程中温度对纳米混悬剂的粒径也会有影响, 见图 3。随温度升高, 纳米混悬剂的粒径增大, 5 ℃下纳米混悬剂的粒径可达到最小。因此, 选用5 ℃作为最佳温度。
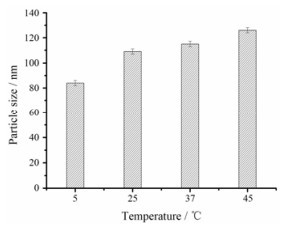
|
Figure 3 The impact of different preparation temperature on particle size of HK-NSps. n = 3, x ± s |
根据以上筛选结果, 最终确定HK-NSps制备最佳处方:精密称取BSA 10 mg、PVP 10 mg作为稳定剂共同溶解于4 mL去离子水中, 作为水相; 精密称取20 mg HK溶解于0.8 mL丙酮, 超声条件下(5 ℃、250 W)将有机相注入到水相中。45 ℃减压旋转蒸发除去丙酮, 利用Zetasizer nano ZS测量粒径、PDI值和zeta电位, 粒径分布如图 4所示, 和厚朴酚纳米混悬剂的平均粒径为(83.40±1.042) nm, PDI值为0.223±0.011, zeta电位为(-42.2±1.2) mV, 说明HK-NSps粒径较小、粒径分布均匀。
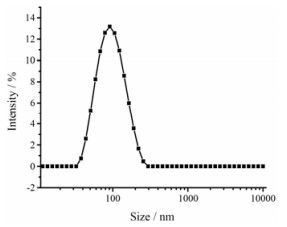
|
Figure 4 Particle size and distribution of HK-NSps |
经透射电镜下观察HK-NSps呈类球形, 分布较为均匀, 平均粒径为50 nm左右, 如图 5。HK-NSps载药量为48.62%, 这与理论值50%略有差距, 可能是实验过程中样品转移所带来的误差。

|
Figure 5 Transmission electron microscope images of HK-NSps |
纳米混悬剂在室温下放置0、2、4、8 h和2、4、10、15、30天, 粒径分别为83.4、83.47、83.42、84.24、85.14、85.41、86.09、86.13和86.21 nm, 粒径基本在85 nm左右, 并未见明显增加。室温放置15天内, HK含量在0、1、3、5、11、15天分别为18.11、17.87、17.91、18.02、17.92和18.01 mg, 含量基本保持在18 mg左右, 故可判定在25 ℃下, HK-NSps放置稳定, 但4 mL HK-NSps中药物含量未达到理论值20 mg, 可能是实验过程中样品转移所带来的误差。
HK-NSps在PBS缓冲液、NaCl溶液、葡萄糖溶液、人工胃肠液中均能够稳定存在, 12 h内在各介质中的平均粒径改变较小(图 6), 说明HK-NSps可用PBS缓冲液、NaCl溶液和葡萄糖溶液调成等渗溶液, 用于注射给药, 同时还可口服给药。
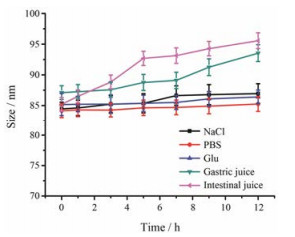
|
Figure 6 The stability of HK-NSps in different dispersed medium. n = 3, x ± s. PBS: Phosphate buffer solution; Glu: Glucose |
HK溶液体外释放很快, 在6 h时累计释放率大约90%, 其释放行为为透膜的被动扩散; HK原料药直接分散在水中得到混悬液, 其释放非常缓慢, 36 h时累积释放仅约20%, 之后几乎没有释放; 而HK-NSps则呈现出适当的释放速率, 在前12 h为相对快速的释放, 累积释放达到70%, 84 h时完全释放, 结果见图 7。适当的药物释放速率有望使HK-NSps在口服给药时获得比物理混悬液更高的生物利用度, 注射给药时相对平稳的血药浓度, 避免过大的峰谷给药效和治疗带来不利的影响。
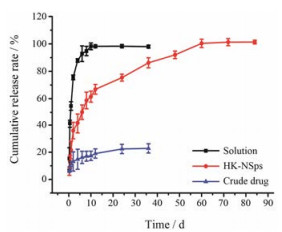
|
Figure 7 Cumulative HK release from HK-NSps in PBS at 37 ℃ with in 84 h. n = 3, x ± s |
在所有受试浓度下, HK-NSps比相应的溶液对4T1乳腺癌细胞具有更强的抑制作用, 结果见图 8。利用GraphPad Prism5软件计算给药24 h后HK-NSps和游离HK对4T1细胞的IC50值分别为8.36和37.58 μg·mL-1; SPSS数据软件分析显示两者IC50值之间具有显著性差异(P<0.01)。这说明, 将HK制备成纳米混悬剂后能够显著增加其体外抗肿瘤活性。纳米粒的体外增效效应在文献中多有报道, 并认为其原因可能是肿瘤细胞对载药纳米粒比游离药物具有更高的摄取[21]。
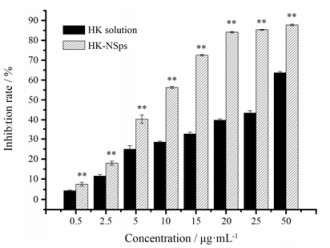
|
Figure 8 Proliferation inhibition of HK-NSps against 4T1 cells after 24 h of incubation. n = 3, x ± s. **P < 0.01 vs HK solution |
各组小鼠肿瘤体积变化趋势见图 9。肿瘤生长速度由快到慢依次为生理盐水组、低剂量HK-NSps组(20 mg·kg-1)、PTX注射液组(4 mg·kg-1)、高剂量灌胃组(60 mg·kg-1)、中剂量HK-NSps组(40 mg·kg-1)和高剂量HK-NSps组(60 mg·kg-1)。各给药组与生理盐水组相比, 抑瘤率均具有明显差异(P<0.001), 高剂量HK-NSps组对肿瘤抑瘤率最高(P<0.001)。结果显示, 高剂量HK-NSps组的肿瘤体积与生理盐水组、紫杉醇注射液组、低剂量HK-NSps组相比, 有显著性差异(P<0.001), 提示高剂量HK-NSps的作用效果明显优于紫杉醇注射液组和低剂量组。实验结束时, 按照瘤重计算的抑瘤率(表 2)也显示, 高剂量HK-NSps组的抑瘤率(67.28%)最高, 其次为中剂量HK-NSps组(55.67%)、原料药高剂量灌胃组(54.13%)和PTX注射液组(47.90%), 最后是低剂量HK-NSps组(21.48%)。这些数据说明, HK-NSps对抑制乳腺癌具有良好的开发前景。

|
Figure 9 The change of tumor volume of 4T1 tumor-bearing mice after ip administration of HK-NSps, paclitaxel (PTX) injection, normal saline (NS) and ig administration of crud drug. n = 10, x ± s. ***P < 0.001 vs normal saline group; ###P < 0.001 vs 60 mg·kg-1 of HK-NSps |
| Table 2 The in vivo antitumor inhibition rate of HK-NSps (ip), PTX injection (ip), and crude drug (ig) in 4T1 tumor-bearing mice. n = 10, x ± s. *P < 0.05, **P < 0.01 vs normal saline group; #P < 0.05 vs PTX injections; ∇P < 0.05 vs HK crude drug |
另外, 高剂量HK药物粉末混悬液口服给药, 其肿瘤体积随时间增长情况与中剂量HK-NSps腹腔注射组相近, 实验结束时两者的抑瘤率也很接近。这可能与原料药较高的给药频率和给药剂量较大有关。
在实验过程中各组4T1荷瘤小鼠的体重变化如图 10所示。生理盐水对照组的小鼠体重始终呈现出增长的趋势, 而高剂量HK-NSps组荷瘤小鼠的体重明显低于生理盐水组(P<0.05), 提示高剂量HK-NSps组可能具有一定的毒副作用。其他各组的体重与生理盐水组相比, 统计学分析未见明显差异。
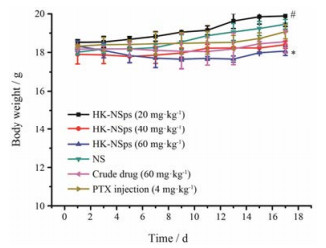
|
Figure 10 The body weight change of 4T1 tumor-bearing mice after ip administration of HK-NSps, PTX injection, normal saline and ig administration of crude drug. n = 10, x ± s. *P < 0.05 vs normal saline group; #P < 0.05 vs crude drug |
基于HK难溶、化学稳定性差等缺点, 并经前期对甲醇、乙醇和丙酮进行溶剂筛选, 3种溶剂制备的纳米混悬剂粒径差别不大, 丙酮略小, 且减压旋转蒸发时更容易除去, 故选用丙酮作为有机溶剂。处方筛选最终选择以PVP和BSA为稳定剂, 采用反溶剂沉淀法制备得到的HK-NSps呈类球形、粒径为(83.40±1.042) nm, 显著提高了其体内外抗肿瘤活性。
在药效学实验中, HK原料药混悬液灌胃给药, 目的是将其传统给药形式作为对照, 制备的HK-NSps呈胶体形式, 粒径小, 药物溶出快, 可注射给药。考察HK-NSps注射给药对药效的改善程度, 若采用每天给药, 抗肿瘤效果无疑会比原料药混悬液灌胃给药好, 但难以进一步比较。故本研究采用两天给药1次, 考查纳米剂型在减少给药次数和剂量的条件下, 能否保持相似甚至更好的药效。药效研究发现, 高剂量HK-NSps组的抑瘤率最高, 但与生理盐水组相比体重明显减轻, 未来在使用剂量方面尚需从药效和安全性两方面考虑, 以进一步探讨和优化。实验还发现, 原料药高剂量灌胃给药, 在较高的给药频率(每天给药)下, 也能取得较好的抑瘤率, 其抗肿瘤效果与中剂量的HK-NSps相当(两天给药1次)。鉴于中剂量HK-NSps总的给药剂量只有原料药组的2/3, 抑瘤率相近, 说明HK-NSps更有优势。
| [1] | Chen SZ. Research progress in anticancer effects and molecular targets of honokiol in experimental therapy[J]. Acta Pharm Sin (药学学报), 2016, 51: 202–207. |
| [2] | Shen L, Zhang F, Huang R, et al. Honokiol inhibits bladder cancer cell invasion through repressing SRC-3 expression and epithelial-mesenchymal transition[J]. Oncol Lett, 2017, 14: 4294–4300. DOI:10.3892/ol.2017.6665 |
| [3] | Pillai VB, Kanwal A, Fang YH, et al. Honokiol, an activator of Sirtuin-3(SIRT3) preserves mitochondria and protects the heart from doxorubicin-induced cardiomyopathy in mice[J]. Oncotarget, 2017, 8: 34082–34098. |
| [4] | Wang N, Wang Z, Nie S, et al. Biodegradable polymeric micelles coencapsulating paclitaxel and honokiol:a strategy for breast cancer therapy in vitro and in vivo[J]. Int J Nanomedicine, 2017, 12: 1499–1514. |
| [5] | Wang GJ, Zhao YJ, Dong JM. Synergistic antitumor effects of liposomal honokiol combined with hyperthermia in adenoid cystic carcinoma models[J]. Anhui Med Pharm J (安徽医药), 2016, 20: 1237–1240. |
| [6] | Cui J. Honokiol:a potent chemotherapy combined with TRAL in human MCF-7 breast cancer models[J]. Med Inf (医学信息), 2011, 24: 3321–3322. |
| [7] | Zhang Y, Bai HX, Shao YX, et al. Mechanism research on inhibition of 4T1 cells proliferation of the combination of honokiol liposome and adriamycin[J]. Chin J Lab Diagn (中国实验诊断学), 2012, 16: 983–985. |
| [8] | Lv X, Liu F, Shang Y, et al. Honokiol exhibits enhanced antitumor effects with chloroquine by inducing cell death and inhibiting autophagy in human non-small cell lung cancer cells[J]. Oncol Rep, 2015, 34: 1289–1300. DOI:10.3892/or.2015.4091 |
| [9] | Singh T, Prasad R, Katiyar SK. Inhibition of class Ⅰ histone deacetylases in non-small cell lung cancer by honokiol leads to suppression of cancer cell growth and induction of cell death in vitro and in vivo[J]. Epigenetics, 2013, 8: 54–65. DOI:10.4161/epi.23078 |
| [10] | Lin CJ, Chen TL, Tseng YY, et al. Honokiol induces autophagic cell death in malignant glioma through reactive oxygen species-mediated regulation of the p53/PI3K/Akt/mTOR signaling pathway[J]. Toxicol Appl Pharmacol, 2016, 304: 59–69. DOI:10.1016/j.taap.2016.05.018 |
| [11] | Chang KH, Yan MD, Yao CJ, et al. Honokiol-induced apoptosis and autophagy in glioblastoma multiforme cells[J]. Oncol Lett, 2013, 6: 1435–1438. DOI:10.3892/ol.2013.1548 |
| [12] | Bildstein L, Dubernet C, Couvreur P. Prodrug-based intra cellular delivery of anticancer agents[J]. Adv Drug Deliv Rev, 2011, 63: 3–23. DOI:10.1016/j.addr.2010.12.005 |
| [13] | Wu DQ. The preparation and characterization of honokiol liposome[J]. Pract Clin J Integr Tradit Chin West Med (实用中西医结合临床), 2014, 14: 86–88. |
| [14] | Cai Z, Pan WH. Honokiol/Pluronic F-127 micelles:preparation and its in vitro anti-tumor study[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2014, 31: 186–189. |
| [15] | He YL, Zhang YQ. Preparation methods of insoluble nanosuspension[J]. China Pharm (中国药房), 2016, 27: 556–559. |
| [16] | Zhou WH, Guo XZ. Preparation of semustine polyvinylpyrrolidone magnetic liposome[J]. J Clin Rehab Tissue Eng Res (中国组织工程研究与临床康复), 2009, 13: 496–500. |
| [17] | Dong XY, Yao HF, Ren FC, et al. Characteristics and anti-oxidant activity of bovine serum albumin and quercetin interaction in different solvent systems[J]. Spectrosc Spectral Anal (光谱学与光谱分析), 2014, 34: 162–166. |
| [18] | Ren H, He Y, Liu F, et al. Study on the HPLC determination of magnolol and honokiol and extraction technology of Houpo[J]. Pharm Clin Chin Mater Med (中药与临床), 2014, 5: 32–34. |
| [19] | Hong J, Sun Z, Li Y. Folate-modified annonaceous aceto-genins nanosuspensions and their improved antitumor efficacy[J]. Int J Nanomedicine, 2017, 12: 5053–5067. |
| [20] | Guo RQ, Wang QH, Wang XT, et al. Preparation of honokiol liposomes and their in vitro and in vivo suppression on breast cancer[J]. Drug Eval Res (药物评价研究), 2017, 40: 48–53. |
| [21] | Hong JY, Li YH, Li YJ, et al. Annonaceous acetogenins nanosuspensions stabilized by PCL-PEG block polymer:significantly improved antitumor efficacy[J]. Int J Nanomedicine, 2016, 11: 3239–3253. |
 2018, Vol. 53
2018, Vol. 53


