2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
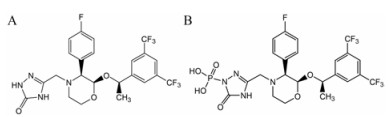
阿瑞匹坦(图 1A)是一种选择性的P物质/NK-1受体抑制剂, 临床上用于治疗由于肿瘤化疗引起的恶心及呕吐。福沙匹坦(化学结构见图 1B)是阿瑞匹坦的前药, 静脉滴注给药后, 在体内迅速发生水解, 血浆半衰期约为10 min[1-3]。
|
Figure 1 Chemical structures of aprepitant (A) and fosaprepitant (B) |
Azuma等[3]建立了测定人血浆中福沙匹坦和阿瑞匹坦的LC-MS/MS生物分析方法, 并应用于日本健康受试者单次静脉滴注0.15 g福沙匹坦, 考察了不同滴注浓度和不同滴注时间对药代动力学的影响。结果表明不同滴注浓度基本不影响其药代动力学, 而达峰浓度会随着滴注时间而变化。Lasseter等[4]报道了在健康受试者中, 福沙匹坦注射液的耐受性研究, 以及福沙匹坦与阿瑞匹坦的生物等效性试验。研究表明受试者能耐受不同剂量的福沙匹坦, 并且注射115 mg福沙匹坦与口服125 mg阿瑞匹坦具有生物等效性。另有Xu等[5]建立了LC-MS/MS法同时测定人血浆中福沙匹坦和阿瑞匹坦。但在上述文献中没有关于福沙匹坦的血浆稳定性的报道。
Peter等[6]研究了不同温度下, 福沙匹坦在HPLC色谱柱上的水解效率; 并考察了不同温度下, 福沙匹坦在乙腈-0.1%磷酸(50:50)溶液中的水解动力学。结果表明福沙匹坦的降解速度与温度具有正相关。
本实验着重考察了福沙匹坦在血浆样品中的稳定性, 在此基础上建立了快速、准确的LC-MS/MS法同时测定人血浆中福沙匹坦和阿瑞匹坦, 并将确证后的分析方法用于福沙匹坦双葡甲胺注射液的人体药动学研究。
材料与方法药品和试剂 福沙匹坦双葡甲胺(批号RS20150503, 纯度99.7%)、阿瑞匹坦(批号RS20140830, 纯度100.0%)由江苏豪森药业股份有限公司提供。d4-福沙匹坦双葡甲胺(批号2245-038A7, 纯度98.9%, 同位素纯度99.4%)、d4-阿瑞匹坦(批号2-OMK-58-1, 纯度98%, 同位素纯度98.7%)购于加拿大TRC公司。乙二胺四乙酸(国药集团化学试剂有限公司)为分析纯; 甲醇及乙腈(德国Merck公司)、浓氨水(德国Fluka公司)、醋酸铵(美国Alfa Aesar公司)均为色谱纯。去离子水由法国Millipore超纯水仪制备。人空白血浆由白求恩国际和平医院提供。
仪器 质谱系统为Triple quad 5500型三重四极杆串联质谱仪, 配备电喷雾电离源(ESI源); Analyst 1.6.2定量处理软件, 美国AB Sciex公司; 岛津液相色谱系统(包括LC-30AD型输液泵、SIL-30AC型自动进样器和CTO-20A型柱温箱), 日本岛津公司。
色谱条件 色谱柱为Cortex C18+色谱柱(50 mm × 2.1 mm, 2.7 μm, 美国Waters公司); 预柱: C18保护柱(4.0 mm × 3.0 mm ID, 美国Phenomenex公司); 流动相: A相(含有0.1 mmol·L-1 EDTA的10 mmol·L-1醋酸铵水溶液), B相(甲醇); 采用的梯度洗脱程序如下: 0~0.3 min, 57% B; 0.3~0.9 min, 57%~90% B; 0.9~2.4 min, 90% B; 2.4~2.5 min, 57% B; 2.5~4.0 min, 57% B。流速为0.4 mL·min-1, 柱温为40 ℃, 进样量为1.0 μL。
质谱条件 离子源为电喷雾电离源(ESI源), 负离子方式检测; 源喷射电压为-4 500 V; 温度为500 ℃; 离子源气体1 (N2)压力为50 psi; 离子源气体2 (N2) 55 psi; 气帘气体(N2)压力为35 psi, 扫描方式为多反应检测(MRM), 碰撞气压力为7 psi; 扫描时间为100 ms。待测物用于MRM检测的定量离子反应为: m/z 613.1→78.9 (福沙匹坦)、m/z 617.0→78.9 (d4-福沙匹坦)、m/z 533.2→275.1 (阿瑞匹坦)、m/z 537.2→279.1 (d4-阿瑞匹坦)。
标准系列样品和质控样品的制备 精密称取福沙匹坦双葡甲胺对照品各两份, 用甲醇-水(5:95, v/v)溶解并定容, 获得质量浓度为1.00 mg·L-1的福沙匹坦的储备液两份, 分别用于配制标准系列样品和质控样品。精密称取阿瑞匹坦对照品各两份, 用甲醇溶解并定容, 获得质量浓度为1.00 mg·L-1的阿瑞匹坦的储备液两份, 分别用于配制标准系列样品和质控样品。
以500 mmol·L-1醋酸铵(用浓氨水调节至pH 9.0):乙腈(90:10)稀释福沙匹坦储备液及质控储备液, 获得福沙匹坦溶液浓度为120、60、30、15、6.0、1.5、0.6、0.3 μg·mL-1的标准系列溶液及90、7.5、0.9、0.3 μg·mL-1的质控工作溶液; 以甲醇稀释阿瑞匹坦储备液及质控储备液, 获得阿瑞匹坦溶液浓度为80、40、20、10、4.0、1.0、0.4、0.2 μg·mL-1标准系列溶液和浓度为60、5.0、0.6、0.2 μg·mL-1的质控工作溶液。分别取上述福沙匹坦和阿瑞匹坦标准系列溶液及质控工作溶液各10.0 μL, 加入人空白血浆180 μL, 分别获得福沙匹坦/阿瑞匹坦的浓度为6.0/4.0、3.0/2.0、1.5/1.0、0.75/0.50、0.30/0.20、0.075/0.050、0.030/0.020和0.015/0.010 μg·mL-1的标准系列血浆样品和浓度为4.5/3.0、0.375/0.250、0.045/0.030和0.015/0.010 μg·mL-1的QC和LLOQ样品。本实验的血浆样品中均含有500 mmol·L-1醋酸铵(用浓氨水调节至pH 9.0, 20:1)。
血浆样品预处理 取血浆样品50.0 μL, 加入d4-福沙匹坦溶液(500 ng·mL-1) 25.0 μL、d4-阿瑞匹坦溶液(500 ng·mL-1) 25.0 μL和乙腈150 μL, 涡流1 min, 离心5 min (4 ℃, 14 000 r·min-1), 取1.0 μL进行LC-MS/MS分析。
稳定性
鉴于福沙匹坦的血浆半衰期很短, 推测其在体外条件下也可能不稳定, 需要全面考察, 优化保持稳定的条件, 使测定的浓度反映采血时的分析物浓度。
考察福沙匹坦在全血和血浆中的稳定性, 将未加入碱性缓冲液的血浆样品、全血样品和加入碱性缓冲液的血浆样品分别放置于室温、4 ℃和-20 ℃。按“血浆样品预处理”项下操作, 获得福沙匹坦浓度随时间的变化曲线。
考察加入碱性缓冲液的福沙匹坦/阿瑞匹坦血浆样品预处理后4 ℃放置24 h, 经历3次冷冻-解冻循环, -20 ℃和-70 ℃储存93天的稳定性。
标准曲线 样品处理按照“血浆样品预处理”项下操作, 以每个待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 用加权(W = 1/X2)最小二乘法进行回归运算, 求得的标准曲线的相关系数(r2)均大于0.99。
定量下限 取LLOQ血浆样品, 进行6样本分析, 连续测定3天, 并根据当日标准曲线计算每一样本的测得浓度, 计算该浓度的日内和日间精密度。
精密度和准确度 取福沙匹坦/阿瑞匹坦低、中、高浓度QC样品, 按“血浆样品预处理”项下操作, 每个浓度进行6样本分析, 分别在3日内测试, 测定日内、日间的精密度和准确度。
样品预处理回收率 取低、中、高3个浓度的质控样品, 按“血浆样品预处理”项下操作, 每一浓度进行6样本分析, 获得相应峰面积(A)。同时另取空白血浆50.0 µL, 加入200 µL乙腈, 涡流1 min, 离心5 min, 取150 μL上清液于另一试管中, 分别加入低、中、高三浓度对照质控溶液(福沙匹坦/阿瑞匹坦溶液浓度分别为0.045/0.030、0.375/0.250、4.5/3.0 μg·mL-1)和内标溶液, 涡流1 min后, 取1.0 µL进行LC-MS/MS分析, 获得相应峰面积(B) (n = 3)。以每一浓度两种处理方法的峰面积比值计算回收率, 计算公式为A/B×100%。
基质效应 分别取6个不同来源的受试者空白血浆和溶血血浆50.0 µL加入乙腈200 µL, 涡流1 min, 离心5 min, 取上清液150 µL于另一试管中, 加入福沙匹坦、阿瑞匹坦对照质控溶液(福沙匹坦/阿瑞匹坦溶液浓度分别为0.045/0.03、0.375/0.250、4.5/3.0 μg·mL-1)和内标溶液, 涡流混匀, 取1.0 µL进行LC-MS/MS分析, 获得相应峰面积(A)。同时另取50.0 µL水代替空白血浆, 按上述处理, 获得相应峰面积(B)。以每一浓度两种处理方法的峰面积比值计算基质效应, 计算公式为A/B×100%。以分析物和内标的基质效应比值计算内标归一化的基质效应。
选择性 取6个不同来源的人空白血浆和1份溶血的空白血浆样品以及相应人空白血浆配制的LLOQ样品进行LC-MS/MS分析, 考察是否有干扰测定。
人体药物动力学研究 临床试验在吉林大学第一医院伦理委员会批准后进行, 选取12名健康受试者(男女各半), 签署知情同意书后, 采取随机、开放静脉滴注给药150 mg福沙匹坦双葡甲胺。静脉滴注时间为30 min。分别在给药前(0 h), 开始给药后5、10、15、30和40 min、1、1.5、2、4、6、8、12、14、24、36、48和72 h由静脉采血。在2~8 ℃条件下离心分离血浆(3 500 r·min-1下离心10 min)。分离血浆3 mL, 立即加入150 μL醋酸铵缓冲液(含500 mmol·L-1醋酸铵, 以浓氨水调节至pH 9.0)。血浆样品于-70 ℃冰箱进行保存。采用WinNonlin 6.3软件以非房室模型法计算各待测物的药动学参数。
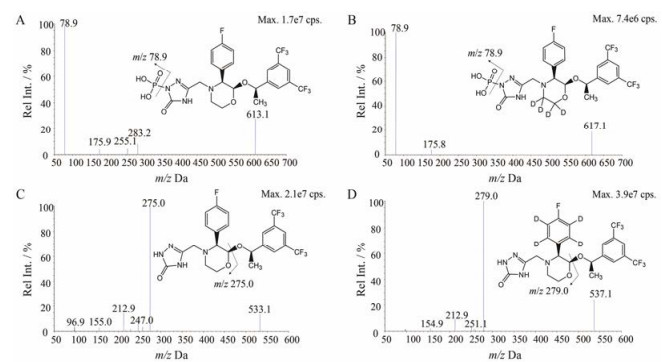
结果 1 质谱分析在上述质谱条件下, 福沙匹坦、阿瑞匹坦、内标d4-福沙匹坦和d4-阿瑞匹坦主要产生m/z 613.1、m/z 533.2、m/z 617.0、m/z 537.2的[M-H]-峰。选择性对[M-H]-峰进行产物离子扫描, 福沙匹坦和阿瑞匹坦的主要离子碎片为m/z 78.9和m/z 275.1, d4-福沙匹坦和d4-阿瑞匹坦的主要离子碎片为m/z 78.9和m/z 279.1, 将这些主要碎片作为定量分析时检测的产物离子。所有待测物和内标的产物离子扫描质谱图以及可能的断裂方式见图 2。
|
Figure 2 Product mass spectra of product ions of fosaprepitant (A), d4-fosaprepitant (B), aprepitant (C) and d4-aprepitant (D). Mass spectrometer was operated in negative MRM mode |
考察未经碱性缓冲液处理的血浆及全血样品(福沙匹坦浓度为750 ng·mL-1), 于不同温度放置不同时间的稳定性。结果表明未经碱性缓冲液处理的福沙匹坦全血样品于室温放置1 h降解约45%, 于4 ℃放置1 h降解约33%, 于-20 ℃放置30 min约降解9%, 放置1 h后降解约41%;未经碱性缓冲液处理的福沙匹坦血浆样品于室温放置1 h降解约40%, 于4 ℃放置1 h降解约40%, 于-20 ℃放置1 h降解约17%。
考察经碱性缓冲液处理的血浆样品(福沙匹坦浓度为750 ng·mL-1), 于不同温度放置不同时间的稳定性。结果表明加入碱性缓冲液的福沙匹坦/阿瑞匹坦血浆样品(福沙匹坦/阿瑞匹坦浓度为30.0/3 000、45.0/4 500 ng·mL-1)处理后于4 ℃放置24 h, 经历3次冷冻-解冻循环, -20 ℃和-70 ℃储存93天的稳定性。经碱性缓冲液处理的福沙匹坦血浆样品于室温放置约8 h稳定, 于4 ℃放置约8 h稳定, 于-20 ℃放置约10 h稳定(福沙匹坦的RE均在± 15%以内)。加入碱性缓冲液的福沙匹坦/阿瑞匹坦血浆样品预处理后4 ℃放置24 h, 经历3次冷冻-解冻循环, -20 ℃和-70 ℃放置93天均稳定(福沙匹坦/阿瑞匹坦的RE均在± 15%以内)。
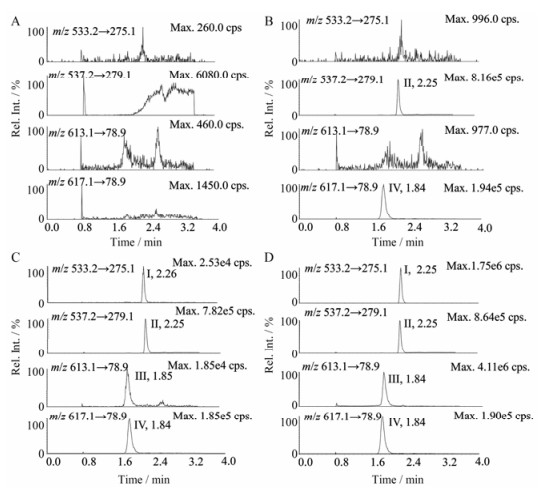
3 方法学验证 3.1 选择性取6个不同来源人空白血浆以及相应空白血浆配制的LLOQ样品进行LC-MS/MS分析。与空白对照对比, 空白血浆中的内源性物质不干扰待测物福沙匹坦、阿瑞匹坦及内标d4-福沙匹坦、d4-阿瑞匹坦的测定。典型色谱图见图 3。福沙匹坦的色谱保留时间约为1.84 min, 阿瑞匹坦的色谱保留时间约为2.25 min。
|
Figure 3 Typical MRM chromatograms of aprepitant (Ⅰ), d4-aprepitant (Ⅱ), fosaprepitant (Ⅲ), d4-fosaprepitant (Ⅳ) in human plasma. A: Blank plasma; B: Blank plasma spiked with 500 ng·mL-1 d4-fosaprepitant, 500 ng·mL-1 d4-aprepitant; C: Blank plasma spiked with 15.0 ng·mL-1 fosaprepitant, 10.0 ng·mL-1 aprepitant and 500 ng·mL-1 d4-fosaprepitant, 500 ng·mL-1 d4-prepitant; D: 5 min after 0.15 g fosaprepitant dimeglumine injection to a volunteer |
测定人血浆福沙匹坦和阿瑞匹坦的线性范围分别为15.0~6 000 ng·mL-1和10.0~4 000 ng·mL-1。典型标准曲线回归方程为:阿瑞匹坦, y = 0.002 97 x + 0.002 71 (r = 0.999 2);福沙匹坦, y = 0.005 55 x + 0.008 4 (r = 0.998 2)。
3.3 定量下限血浆样品(福沙匹坦/阿瑞匹坦血浆质量浓度分别为15.0/10.0 ng·mL-1)的福沙匹坦的日内精密度为3.7%, 日间精密度为5.7%, 相对误差为3.4%;阿瑞匹坦日内精密度为1.6%, 日间精密度为2.5%, 相对误差为-2.4%。结果表明LC-MS/MS同时测定人血浆中福沙匹坦和阿瑞匹坦的定量下限分别可达到15.0和10.0 ng·mL-1。
3.4 精密度和准确度精密度与准确度数据见表 1。每一浓度水平福沙匹坦的QC样品的日内精密度(RSD)均小于1.6%, 日间精密度(RSD)均小于3.3%, 相对误差(RE)在-8.2%~7.6%之间; 每一浓度水平的阿瑞匹坦的QC样品的日内精密度(RSD)均小于2.1%, 日间精密度(RSD)均小于6.1%, 相对误差(RE)在-2.8%~4.8%之间。待测物低、中、高质控样品的日内和日间的精密度和准确度均符合生物样品测定相关要求[7, 8]。
| Table 1 The intra- and inter-day precision and accuracy data of the QC sample of fosaprepitant and aprepitant (n = 18) |
福沙匹坦在低、中、高浓度的回收率分别为93.1%、101%和104%;阿瑞匹坦在低、中、高浓度的回收率分别为106%、110%和110%。
3.6 基质效应福沙匹坦在低、高浓度经内标校正的基质效应分别为94%和95%, 相对偏差均小于6%;阿瑞匹坦在低、高浓度经内标校正的基质效应分别为95%和96%, 相对偏差均小于2.2%。结果表明, 待测物和内标在本实验选择的色谱和质谱条件下, 可忽略基质效应的影响。
3.7 稀释效应血浆稀释5倍后, 测定福沙匹坦的精密度和准确度分别为0.2%和0.8%;阿瑞匹坦的精密度和准确度分别为0.5%和-3.9%。结果表明人血浆样品经空白人血浆稀释5倍后测定不影响结果的准确度。
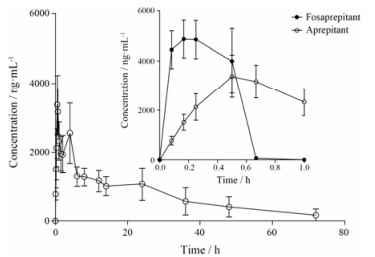
4 药动学研究将建立并经过验证的方法应用于福沙匹坦双葡甲胺注射剂的人体药动学研究, 受试者静脉滴注福沙匹坦双葡甲胺注射剂150 mg, 福沙匹坦和阿瑞匹坦的平均药时曲线见图 4。静脉滴注时间为30 min。福沙匹坦t1/2为0.19 ± 0.22 h, 约1 h低于定量下限, 血浆AUC0-t为2326 ± 661 ng·h·mL-1, Cmax为4 945 ± 958 ng·mL-1。阿瑞匹坦在滴注给药过程中迅速生成, tmax为1.12 ± 1.34 h, 迅速达峰, t1/2为18.2 ± 8.1 h, 消除缓慢, 血浆AUC0-t为54 886 ± 1 970 ng·h·mL-1, Cmax为3 450 ± 851 ng·mL-1。
|
Figure 4 Mean plasma concentration-time (x± s) profiles of fosaprepitant and aprepitant after 0.15 g fosaprepitant dimeglumine injection to 12 healthy Chinese volunteers |
由于福沙匹坦和阿瑞匹坦的极性相差大, 使得同时准确分析福沙匹坦和阿瑞匹坦存在一定的困难, 并且福沙匹坦在血浆中的稳定性较差。本实验通过梯度洗脱解决了福沙匹坦和阿瑞匹坦极性相差大而导致同时分析困难的问题; 通过对福沙匹坦在人血浆及全血中稳定性的考察, 发现了温度、pH和时间为其主要影响因素, 并找到了保证在血浆中不稳定前药福沙匹坦的稳定性的条件。本实验研究发现经500 mmol·L-1醋酸铵(用浓氨水调至pH 9.0)处理的血浆样品室温放置6 h、预处理后自动进样器放置24 h、-20 ℃和-70 ℃ 3次冷冻-解冻循环、-20 ℃和-70 ℃长期储存93天均能稳定; 水相选用较高浓度的10 mmol·L-1醋酸铵水溶液保证流动相pH的稳定, 使分析更加准确; 在水相中加入EDTA有效地解决了福沙匹坦与色谱柱上基团的非特性结合的问题。
本实验建立了LC-MS/MS法同时测定人血浆中福沙匹坦和阿瑞匹坦, 并进行了完整的方法学验证。通过对样品稳定性关键问题的优化, 提高了分析方法的可靠性。本方法已成功应用于福沙匹坦双葡甲胺注射剂在中国健康受试者的药动学研究。
| [1] | Aapro M, Carides A, Rapoport BL, et al. Aprepitant and fosaprepitant:a 10-year review of efficacy and safety[J]. Oncologist, 2015, 20: 450–458. DOI:10.1634/theoncologist.2014-0229 |
| [2] | Vania M, Amy G, Veronica A. Aprepitant:a new modality for the prevention of postoperative nausea and vomiting:an evidence-based review[J]. J Peroans Nur, 2015, 30: 406–417. DOI:10.1016/j.jopan.2014.11.013 |
| [3] | Azuma J, Fukase H. Pharmacokinetics of a single 150-mg intravenous infusion of fosaprepitant:effects of concentration and infusion time in healthy Japanese men[J]. Clin Pharm Drug Dev, 2013, 2: 394–399. DOI:10.1002/cpdd.58 |
| [4] | Lasseter KC, Gambale J, Jin B, et al. Tolerability of fosaprepitant and bioequivalency to aprepitant in healthy subjects[J]. J Clin Pharmacol, 2007, 47: 834–840. DOI:10.1177/0091270007301800 |
| [5] | Xu MJ, Chu JH, Wu T, et al. One kind of plasma fosaprepitant and aprepitant simultaneous detection: CN 105974016 A[P]. 2016-09-28. |
| [6] | Skrdla J, Abrahim A, Wu Y. An HPLC chromatographic reactor approach for investigating the hydrolytic stability of a pharmaceutical compound[J]. J Pharm Biomed Anal, 2006, 41: 883–890. DOI:10.1016/j.jpba.2006.02.005 |
| [7] | European Medicines Agency. Guideline on Bioanalytical Method Validation[S]. 2011-07-21[2017-08-14]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2011/08/WC500109686.pdf. |
| [8] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Vol 4. Beijing: China Medical Science Press, 2015: 363-368. |
 2018, Vol. 53
2018, Vol. 53


