大肠湿热证是中医和中兽医临床常见多发湿热证证型之一, 系指湿热侵犯肠道, 传导失职, 临床表现以苔黄、里急后重、黏液脓血便、腹泻、肛门灼热、腹痛、舌红, 苔腻为主[1]。现代医学研究认为大肠湿热证是溃疡性结肠炎的类型之一, 主要是由于多种感染性及传染性疾病尤其是病毒感染性疾病引起的一种累及结肠、直肠黏膜的慢性非特异性炎症性肠病。由于其病情缠绵, 治疗困难, 预后不佳而成为中西医结合领域的研究热点[2]。
苦豆草为豆科槐属多年生草本植物苦豆子(Sophora alopecuroides L.)的干燥地上部分, 别名苦豆子、苦甘草、布亚(维吾尔语), 广泛分布于中亚、西亚及我国西北地区荒漠较潮湿的地段。其味苦性寒, 具有清肠燥湿的功效, 主要用于急性菌痢、肠炎等疾病[3]。现代药物化学分析表明, 苦豆草主要化学成分为生物碱和黄酮类化合物, 包括苦参碱、氧化苦参碱、槐定碱、槐果碱、金雀花碱等物质。药效学研究表明苦豆草具有抗炎、抗病毒、抗癌、抑菌、增强免疫、杀虫等生物活性, 但对于其治疗疾病的作用机制尚不清楚[4, 5]。
代谢组学是系统生物学的重要分支, 通过考察生物体内源性代谢小分子的变化来探究药物及疾病对生物体的作用, 被广泛运用于临床疾病诊断、疾病早期检查以及药物作用评价等研究领域[6]。其从整体评价了外部因素对生物体内源性代谢组的系统作用, 这与中医所倡导的整体观念相一致, 在评价单味中药、中药方剂的毒性作用及治疗作用机制等研究领域具有重要的借鉴意义[7]。
因此, 本研究采用高温高湿、高糖高脂结合生物因子产肠毒性大肠杆菌的方法建立大肠湿热证大鼠模型, 通过一般行为学、血液学、炎性细胞因子、组织病理学观察等评价苦豆草对大肠湿热证的治疗作用, 然后基于超高效液相色谱与串联四级杆飞行时间二级质谱(UHPLC-Q/TOF-MS/MS)的代谢组学方法来探讨苦豆草对大肠湿热证模型大鼠血清中内源性代谢物的变化, 以分析苦豆草干预大肠湿热证的作用机制, 为今后苦豆草药物的基础研究及临床应用提供理论依据。
材料与方法仪器 2777C UPLC system, SYNAPT G2 XS QTOF (美国Waters公司); 全自动血液细胞分析仪BC-5300Vet (深圳迈瑞生物医疗电子股份有限公司); iMark型酶标仪(美国BIO-RAD公司)。
药品和试剂 苦豆子植株样品9月底采集于甘肃省武威市沙漠边缘, 经甘肃农业大学魏彦明教授鉴定为Sophora alopecuroides L., 保存于甘肃农业大学中兽医学实验室; 大肠杆菌(Escherichia coli O101) (中国兽医药品监察所, 菌号CVCC231);白介素1β (IL-1β)、白介素2 (IL-2)、白介素6 (IL-6)及肿瘤坏死因子α (TNF-α)测定试剂盒(北京奇松生物科技有限公司); 色谱纯甲酸、甲醇(美国Sigma-Aldrich公司); 水合氯醛(批号1402207, 上海展云化工有限公司); 牛肉膏(批号20131018)、蛋白胨(批号20140318, 北京奥博星生物技术有限责任公司); 营养琼脂(批号20140807, 青岛高科园海博生物技术有限公司); 56°红星二锅头(北京红星股份有限公司); 猪油市售。
实验动物 清洁级Wistar大鼠32只, 雌雄各半, 体质量(180±20) g, 由兰州大学实验动物中心提供, 许可证编号SCXK (甘) 2015-0005。室温调整在23± 1 ℃, 湿度在50%±5%, 12 h光照和12 h黑暗环境, 标准饮食, 自由饮水。所有大鼠适应性饲养7天后, 进行实验操作。动物福利和实验过程严格按照《关于善待实验动物的指导性意见》(中国科技部, 2006)相关规定, 由甘肃农业大学动物伦理委员会监督执行。
苦豆草药物制备 取洁净的苦豆子植株, 去除根部及豆荚部位, 将剩余部分研磨成粗粉, 得到苦豆草样品。称取苦豆草粗粉10 g, 加10倍量纯水, 浸泡30 min, 回流提取1.5 h, 过滤, 滤渣再加8倍量纯水回流提取1 h, 合并两次滤液, 减压浓缩, 定容至0.1 g·mL-1, 置4 ℃下保存备用。
大肠湿热证模型建立 依据大肠湿热证模型建立相关文献及本实验室建立的大肠湿热证模型复制方法[8, 9]。Wistar大鼠32只, 随机分为对照组(control group)、模型组(model group)、自愈组(ZY group)和苦豆草组(KDC group), 每组8只, 雌雄各半。大肠湿热证模型建立分为3个阶段: ①高糖高脂阶段:模型组, 自愈组及苦豆草组, 单日禁食, 双日灌服猪油(20 mL·kg-1), 并给予充足饲料及30%蜂蜜水, 共10天; ②高温高湿阶段:除对照组大鼠外, 其他大鼠每天灌服56°白酒(20 mL·kg-1), 置于高温仓(温度33±2 ℃, 湿度93%±2%) 12 h, 连续5天; ③攻毒阶段:将经过高温高湿阶段的大鼠腹腔注射浓度为1.8×109CFU·mL-1的产肠毒性大肠杆菌悬液(1 mL·kg-1) 2次, 中间间隔24 h, 自然适应1天, 模型建立成功。模型建立成功后处死模型组大鼠。自愈组不作处理, 苦豆草组灌服苦豆草提取液0.5 g·kg-1 (依据1977年版《中华人民共和国药典》[10]和2010版《中华人民共和国药典临床用药须知》[11], 苦豆草的人推荐剂量为3~5 g, 按照体表面积换算成大鼠的给药剂量), 连续5天。实验期间, 对照组大鼠处于室温环境, 每天灌服和腹腔注射等量生理盐水。实验结束后, 处死所有大鼠。
一般行为学观察 从被毛状态、精神状况、体重、体温、饮食、尿量及粪便形状色泽等方面观察大鼠一般行为学状态。
样品采集与处理 所有大鼠腹腔注射10%水合氯醛(4 mL·kg-1)麻醉, 腹主动脉采集血液, 分别用加EDTA-K2抗凝剂和不加抗凝剂的两种采血管收集血液, 一部分用于血液学分析, 另一部分静置1 h, 4 ℃下3 000 r·min-1离心10 min, 收集血清, 置-80 ℃下保存备用。组织样品回肠和结肠用10%中性福尔马林固定, 石蜡包埋, 用于组织切片制作。
血常规和细胞因子变化 运用全自动血液分析仪检测全血, 包括红细胞、白细胞、中性粒细胞、淋巴细胞等血液生理学指标。IL-1β、IL-2、IL-6及TNF-α的含量测定严格按照ELISA试剂盒说明书来操作。采用IBM SPSS 22.0进行统计分析, 组间数据的差异显著性用单因素方差分析(ANOVA)中Tukey post hoc方法进行检验, 显著性水平P<0.05被认为有统计学意义。
代谢组学血清样品制备 取-80 ℃条件下保存的血清样品, 先置于-20 ℃下20 min, 再置于4 ℃下冻融。为确保检测仪器的稳定性和重复性, 在本实验中首先取每个血清样品40 μL混匀作为质量控制(quality control, QC)样品。每个血清样品(包括QC)吸取40 μL, 加入甲醇120 μL振荡1 min, 置-20 ℃下30 min, 4 000 g×4 ℃下离心20 min。然后, 吸取样品20 μL用50%甲醇180 μL稀释制得检测样品。在UHPLC-MS/MS分析时, 首先用同一QC样品连续检测10次, 然后连续对10个待测样品进行检测, 每检测10个样品检测1次QC样品以验证检测系统的稳定性。
代谢组学色谱与质谱条件 色谱条件:色谱柱为ACQUITY UPLC BEH C18柱(100 mm × 2.1 mm, 1.7 μm); 流动相为0.1%甲酸水溶液(A)和0.1%甲酸甲醇溶液(B), 梯度洗脱程序为0~2 min, 0% B; 2~11 min, 0~100% B; 11~13 min, 100% B; 13~15 min, 0% B; 柱温50 ℃; 流速0.4 mL·min-1; 进样量10 μL。质谱条件:采用正负两种离子检测模式进行质谱分析。正负离子模式下, 毛细管电压及锥孔电压均为2 kV和40 V。采用MSE模式进行centroid数据采集, 一级扫描范围为50~1 200 Da, 扫描时间为0.2 s, 对所有母离子按照20~40 eV的能量进行碎裂, 采集所有的碎片信息, 扫描时间为0.2 s。在数据采集过程中, 对LE信号每3 s进行实时质量校正。同时, 每隔10个样品进行一次混合后质控样品的采集, 用于评估在样品采集过程中仪器状态的稳定性。
代谢组学数据处理与分析 利用商业软件Progenesis QI (Version 2.2) (美国Waters公司)提取代谢指纹轮廓图谱, 包括峰对齐、峰提取、归一化、去卷积和化合物鉴定等。基于QC样品信息对真实样品信号进行局部多项式回归拟合信号校正(quality control-robust LOESS signal correction, QC-RLSC)。采用SIMCA-P13.0 (Umetrics, Sweden)进行主成分分析(principal components analysis, PCA)和偏最小二乘法-判别分析(partial least-squares discriminant analysis, PLS-DA)。变量影响重要性因子(variable importance in the projection, VIP)代表变量对分组的贡献程度, fold-change代表经差异倍数分析后得到的差异倍数, q-value代表组间经t-test检验(IBM SPSS22.0)并经FDR (false discovery rate)校正后得到值。首先从对照组与模型组间筛选出VIP>1.0, fold-change ≥ 1.2或≤ 0.83和q-value<0.05三者交集的差异变量[12]。然后, 运用同样规则筛选出模型组和苦豆草组之间的差异变量, 最终两者再次取交集得到的差异变量即为苦豆草干预大肠湿热证模型的差异代谢物, 显著性水平P<0.05被认为有统计学意义。
潜在代谢标志物鉴定及代谢通路分析 依据差异代谢物的保留时间, m/z值, 运用HMDB (http://www.hmdb.ca)、KEGG (http://www.kegg.jp/kegg/)、Lipidomics Gateway (http://www.lipidmaps.org)等数据库来鉴定差异代谢物的结构及化学式。通过Metabo Analyst 3.0 (http://www.metaboanalyst.ca)平台中Pathway Analysis (MetPA)模块对鉴定出的差异代谢物进行代谢通路的构建及分析, 并结合KEGG数据库实现代谢网络的可视化, 最终确定苦豆草干预大肠湿热证大鼠的潜在代谢标志物。
结果 1 一般行为学观察整个实验过程中, 对照组大鼠精神状态、营养状况良好, 体重日渐增加, 体温正常, 被毛整洁、平滑而有光泽, 饮食欲正常, 排尿正常呈淡黄色, 粪便成形无异味。模型组大鼠精神沉郁、体瘦毛焦、体重下降、体温升高、尿液短赤、肛门红肿、大便溏泻、色黄恶臭。自愈组大鼠精神状态略有好转, 但依然食欲欠佳、被毛粗乱, 腹泻症状未明显减轻, 粪便稀软。经苦豆草治疗后, 模型大鼠精神状态好转, 腹泻症状减轻, 饮食欲逐渐恢复, 体温趋于正常。大肠湿热证症状表现严重程度依次为:模型组>自愈组>苦豆草组>对照组。
2 血常规和细胞因子评价与对照组相比, 大肠湿热证模型复制成功后, 模型组大鼠红细胞、白细胞、淋巴细胞、中性粒细胞、单核细胞数目, 血红蛋白浓度, 红细胞压积均显著升高, 血小板数目显著降低(P<0.05)。与自愈组相比较, 经苦豆草治疗后, 各项指标均显著回调, 接近对照组(P<0.05) (表 1)。
| Table 1 The effect of Sophora alopecuroides on blood routine. n = 8, x± s. aP < 0.05 vs control group; bP < 0.05 vs model group; cP < 0.05 vs ZY group. Control: Control group; Model: Large intestine dampness-heat syndrome (LIDHS) model group; ZY: Self-healing group of LIDHS model; KDC: Sophora alopecuroides treatment group |
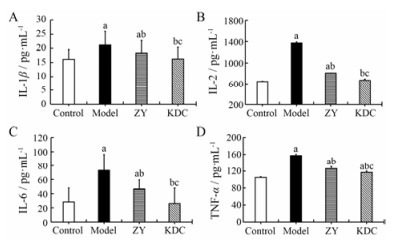
IL-1β、L-2、IL-6和TNF-α是重要的炎性细胞因子指征。与对照组相比较, 模型组4种炎性细胞因子均显著升高(P<0.05), 而自愈组和苦豆草组较模型组均显著降低。与自愈组相比较, 苦豆草组四项指标均显著降低(P<0.05), 且IL-1β、L-2和IL-6与对照组相比均不显著(P>0.05) (图 1)。结果表明, 大肠湿热证模型大鼠体内伴有严重的炎症反应, 经苦豆草治疗后, 相关指标得以缓解接近对照组, 表明苦豆草对大肠湿热证治疗效果良好。
|
Figure 1 The influence of Sophora alopecuroides on the proinflammatory cytokines among Control, Model, ZY and KDC group (n = 8, x± s). A: IL-1β; B: IL-2; C: IL-6; D: TNF-α. aP < 0.05 vs control group; bP < 0.05 vs model group; cP < 0.05 vs ZY group |
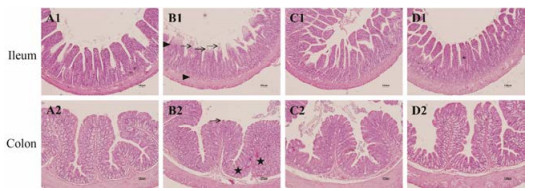
镜检见对照组大鼠的回肠、结肠黏膜上皮形态结构完整, 肠绒毛排列整齐, 纹状缘清晰可见(图 2, A1和A2);模型组大鼠的回肠、结肠部分黏膜上皮变性、坏死及脱落。肠绒毛形态结构破坏, 肠腺萎缩。结肠黏膜固有层结缔组织增生, 动脉及静脉中存在大量红细胞(图 2, B1和B2);经苦豆草治疗后, 回肠、结肠黏膜上皮逐渐恢复正常, 肠绒毛形态结构趋于完整, 纹状缘可见, 肠腺结构明显(图 2, D1和D2)。
|
Figure 2 Histopathological changes of the ileum and colon. A1-A2: Control group; B1-B2: Model group; C1-C2: ZY group; D1-D2: KDC group. "↑" indicates the degeneration, necrosis of mucosal epithelium. "▲" indicates hemorrhage and congestion. "★" indicates connective tissue hyperplasia and mucosal glands atrophy. Original magnification, ×100. The scale bar represents 100 μm |
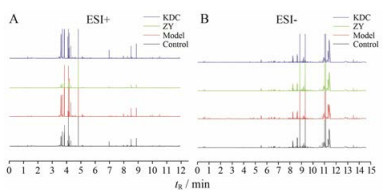
采用UHPLC-Q/TOF-MS/MS系统下正负两种离子模式对各组大鼠血清进行检测与分析, 得到总离子流图(图 3A和B)。在正负离子模式下, 不同实验组峰型和峰数量都存在一定的差异, 表明各组大鼠体内代谢受到明显干扰。
|
Figure 3 Total ion current chromatogram (TIC) for the metabonome analysis in rat serum among Control, Model, ZY and KDC groups. A: Positive ion mode (ESI+); B: Negative ion mode (ESI-) |
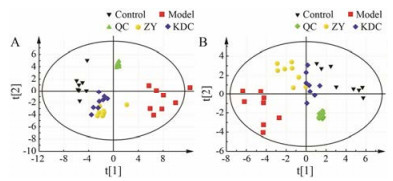
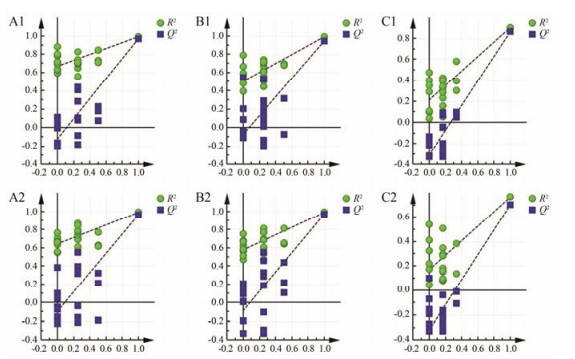
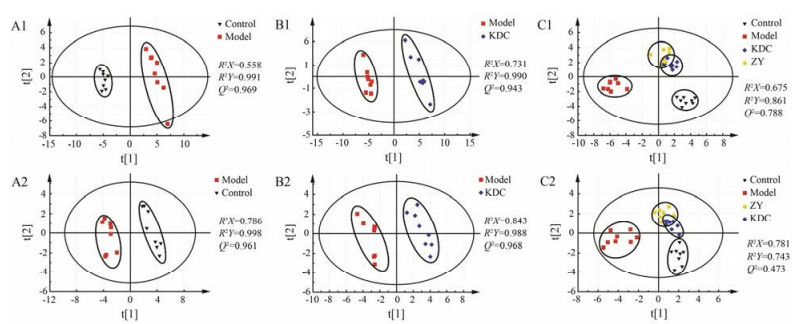
本研究采用SIMCA-P13.0进行PCA和PLS-DA模式识别判别分析。在PCA和PLS-DA得分图中每一个点代表一个大鼠血清样品。QC样品在正式检测前用于平衡“色谱-质谱”系统, 进而在样品检测过程中评价质谱系统的稳定性。从PCA得分图可以看出, 正负离子模式下QC样品聚类良好, 表明仪器稳定及采集的数据质量好(图 4)。通过PLS-DA模型排列实验表明随机排列y变量产生的R2、Q2值均小于原始值(其中, R2和Q2值分别表示在随机化y变量模型下对数据的解释程度和对模型的预测能力), 证明模型有效, 可以进行后续分析(图 5)。从PLS-DA得分图可以看出, 正负离子模式下对照组与模型组明显分离, 表明大肠湿热证模型建立过程中大鼠的代谢轮廓被干扰(图 6, A1和A2)。在正负离子模式下模型组与苦豆草组分离良好, 各自聚集成群且苦豆草治疗组更为接近对照组, 表明该模型预测能力较好也从侧面印证了苦豆草对大肠湿热证具有良好的治疗作用(图 6, B1、B2、C1和C2)。
|
Figure 4 PCA score plots of serum metabolic profiling among QC, Control, Model, ZY and KDC groups in ESI+ (A) and in ESI-(B) |
|
Figure 5 Permutation test plots for PLS-DA model validation in ESI+ and ESI-. Control vs model groups (A1, A2); Model vs KDC groups (B1, B2); All of groups (C1, C2) |
|
Figure 6 PLS-DA score plots of serum metabolic profiling among Control, Model, ZY and KDC groups in ESI+ (A1, B1, C1) and in ESI-(A2, B2, C3). Q2 is an appraisal criterion of the predictive ability of a model. R2X represents the capability wherein the primary components of variables are used to build the model and sample, whereas R2Y represents the conformity level of the sample with the model |
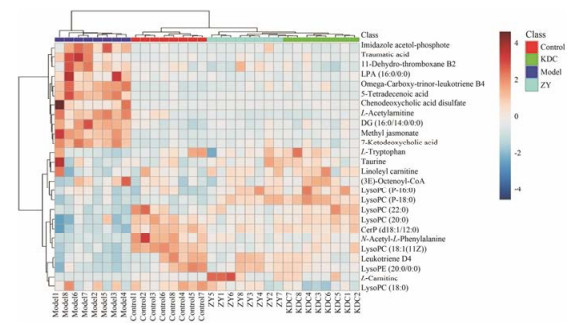
首先取VIP>1.0, fold-change ≥1.2或≤ 0.83和q-value<0.05三者的交集, 从对照组与模型组共筛选出63个差异变量, 然后采用同样的规则比较模型组和苦豆草组, 共筛选出47个差异变量, 两者取交集得到26个差异变量。采取质量偏差在±10 ppm范围内的高准确性准分子离子结合前面提到的现有数据库来鉴定差异代谢物, 热图分析表明各组分类良好(图 7)。
|
Figure 7 Heatmap visualization based on the levels of difference metabolites in Control, Model, ZY and KDC groups |
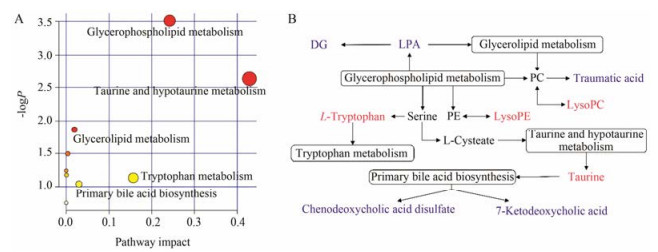
采用Metaboanalyst 3.0中MetPA模块Rattus norvegicus (Rat)路径分析数据库对筛选出的差异代谢物所涉及的代谢通路进行分析, 选取impact value>0.01的代谢路径作为苦豆草治疗大肠湿热证最为相关的代谢路径, 其涉及甘油磷脂代谢、牛磺酸和亚牛磺酸代谢、色氨酸代谢、甘油酯代谢和初级胆汁酸合成等5条代谢路径(图 8A)。为了进一步实现苦豆草治疗大肠湿热证模型大鼠代谢网络的可视化, 根据KEGG库和HMDB库绘制其代谢网络(图 8B), 选择与以上5条代谢路径最为相关的9种差异代谢物作为苦豆草治疗大肠湿热证潜在代谢标志物, 包括溶血磷脂酰乙醇胺[LysoPE (20:0/0:0)]; 溶血磷脂酰胆碱[LysoPC (P-16:0), LysoPC (P-18:0), LysoPC (18:0), LysoPC (20:0), LysoPC (22:0), LysoPC (18:1(11Z))]; 溶血磷脂酸[LPA (16:0/0:0)]; 甘油二酯[DG (16:0/ 14:0/0:0)]; 牛磺酸; 色氨酸; 鹅去氧胆酸硫酸氢盐; 2-十二碳烯二酸; 7-酮基脱氧胆酸(表 2, 图 9)。
|
Figure 8 Summary of pathway analysis with MetPA (A). Metabolic networks of potential metabolite markers in response to the preventive effect of Sophora alopecuroides for LIDHS (B). The red and blue respectively represent the content of metabolites increase and decrease after Sophora alopecuroides induced |
| Table 2 The identification results of potential metabolite markers |
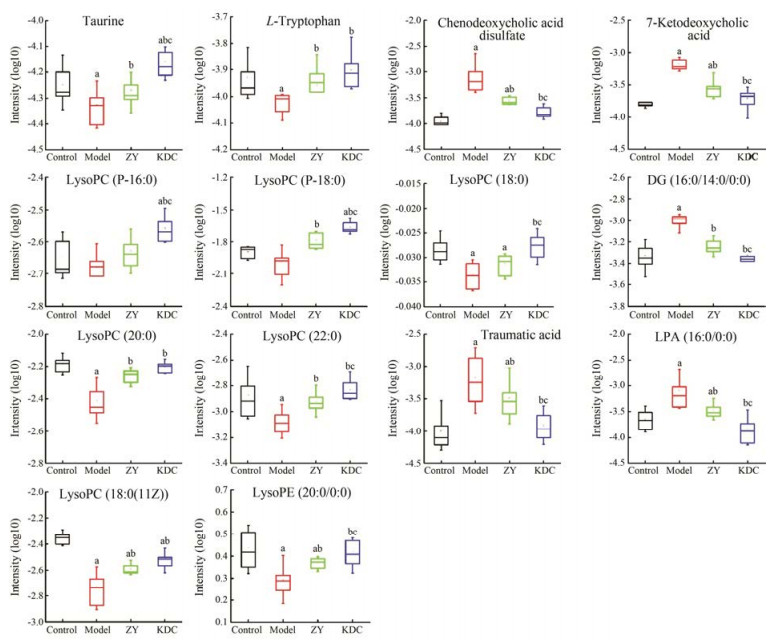
|
Figure 9 The relative concentration of potential metabolite markers. aP < 0.05 vs control group; bP < 0.05 vs model group; cP < 0.05 vs ZY group |
在中医和中兽医临床湿热病属于急性热病中一类具有特殊规律的疾病, 与湿热的气候环境、病原微生物的侵入及人体易感性体质有关。蜂蜜和猪油具有模拟过食肥甘厚味的作用, 其引起脾胃损伤, 致使体内内湿积聚; 酒能助湿又能助热; 湿热环境使外湿引动内湿, 湿邪日久多化热[13]; 生物因子大肠杆菌造成腹泻。因此, 通过高糖高脂饮食, 湿热环境, 结合生物因子产肠毒性大肠杆菌方法建立的大鼠模型被广泛运用于大肠湿热证证型解析和治疗药物的研究[9, 14]。鉴于近年来炎症性肠病较高的发病率, 本研究旨在评价苦豆草对大肠湿热证的治疗作用并结合代谢组学方法阐明其作用机制。
大肠湿热证本质与机体免疫反应及炎症过程密切相关[15]。白细胞、中性粒细胞、淋巴细胞及单核细胞数目是重要的炎症诊断指征。IL-1β、IL-2、IL-6及TNF-α是重要的促炎细胞因子。诸多实验及临床研究表明免疫应答异常是炎症性肠病组织损伤和炎症发生的重要内在因素, 而炎性细胞因子在该过程中发挥重要的作用。本研究发现大肠湿热证模型大鼠炎性细胞数目明显增加, 血清促炎细胞因子IL-1β、IL-2、IL-6及TNF-α含量显著升高, 表明大肠湿热证模型大鼠体内发生明显的炎症反应以及细胞因子的失衡, 这与前人研究一致[16]。此外, 大肠湿热证模型大鼠体内红细胞数目、红细胞压积和血红蛋白浓度较对照组明显升高, 表明模型大鼠由于极度腹泻致使机体内部脱水严重, 进而造成血液循环障碍。这些病理性因素共同导致模型大鼠肠道组织结构损伤、炎性渗出和淤血的病理变化。但经苦豆草治疗后, 以上指标均明显回调接近对照组, 肠道组织损伤得以缓解, 表明苦豆草对大肠湿热证具有良好的治疗效果。苦参碱和氧化苦参碱是苦豆草的主要活性成分, 现代药理学研究表明苦参碱和氧化苦参碱能够有效抑制NF-κB的转录活性, 降低各种炎性细胞因子IL-1β、IL-2、IL-6及TNF-α等基因的转录, 进而纠正炎症性肠病体内细胞因子的失衡, 并最终改善肠道炎症状态和氧化平衡[17-19]。因此, 研究认为苦豆草具有缓解大肠湿热证体内的炎症反应, 改善肠道组织损伤病理变化的作用。
近年来, 基于高通量数据研究平台代谢组学的方法被广泛运用于炎症性肠病相关代谢标志物及代谢路径的研究, 为炎症性肠病诊断和正确给药提供了现实的依据[20-22]。因此, 本研究基于UHPLC-Q/TOF-MS/MS代谢组学平台结合多变量数据统计分析方法, 对各组大鼠血清进行检测分析, 从动物机体内源性代谢小分子层面探究苦豆草治疗大肠湿热证作用机制。研究发现大肠湿热证大鼠经苦豆草干预后有9种差异代谢物可能是潜在的代谢标志物, 主要涉及氨基酸代谢、脂质代谢和初级胆汁酸合成等代谢路径。这些潜在的代谢标志物与代谢路径直接或间接相关联, 共同构成了苦豆草治疗大肠湿热证的代谢网络。
血清中各种氨基酸含量的变化对诊断和评价炎症性肠病扮演着重要的角色[23]。牛磺酸是机体内最为重要的游离氨基酸, 其由甲硫氨酸和半胱氨酸在肝细胞合成, 对肝脏脂肪代谢具有重要作用[24]。Cyp7a1基因编码的CYP7A1是胆汁酸合成的关键限速酶。研究表明, 牛磺酸可以通过提高CYP7A1酶的表达活性, 进而促进胆固醇和胆汁酸的分解代谢[25, 26]。本研究发现大肠湿热证模型大鼠血清中牛磺酸相对含量较对照组无明显变化, 但经苦豆草治疗后苦豆草组大鼠血清中显著高于大肠湿热证模型, 这与前人研究结果一致。鉴于造模过程中灌服大量的高脂高胆固醇食物, 可能是造成这一现象的主要原因, 但也从侧面印证了苦豆草具有调节机体内牛磺酸的含量进而促进胆固醇和胆汁酸的分解代谢。肠道菌群对胆汁酸代谢具有重要的作用, 鹅去氧胆酸硫酸氢盐和7-酮基脱氧胆酸是初级胆汁酸合成的产物[27]。本研究发现经腹腔注射大肠杆菌的大肠湿热证模型大鼠这两种胆汁酸代谢产物相对含量明显上升, 表明大肠杆菌打破了正常大鼠肠道菌群的平衡, 更进一步促进了大肠湿热证的发生和发展。色氨酸代谢与炎症性肠病发病密切相关。犬尿氨酸路径和5-HT路径是色氨酸代谢的重要组成部分。犬尿氨酸是色氨酸代谢的重要产物, 研究表明犬尿氨酸可以促进活化Th细胞凋亡, 诱导免疫抑制Treg细胞的分化进而抑制免疫反应。在炎症性肠病中, 5-HT不仅参与肠道炎症反应, 而且对肠道的蠕动、敏感度及物质分泌密切相关[28, 29]。本研究发现在大肠湿热证模型大鼠血清中色氨酸含量较对照组明显下降, 表明其体内发生显著的炎症反应, 这与前人研究结果一致。在经苦豆草治疗后, 色氨酸含量上升表明苦豆草可能通过犬尿氨酸路径和5-HT路径干扰大肠湿热证大鼠[30], 进而抑制肠道炎症的发生和发展。
甘油磷脂是细胞膜结构的重要组成成分。能量代谢紊乱、内皮功能障碍、细胞膜破坏及炎症等原因是造成甘油磷脂代谢异常的重要原因。研究表明在炎症性肠病患者中, 活性期患者血清中低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)的含量低于缓解期患者, 可能是炎症反应过程中促炎细胞因子TNF-α及IL-1影响了脂蛋白脂肪酶的表达, 进而加速了LDL和VLDL的水解, 并最终导致肝脏代谢紊乱造成胆汁淤积[27, 31, 32]。这与本研究在大肠湿热证模型大鼠血清中甘油酯代谢产物溶血性磷脂酸、甘油二酯, 胆汁酸代谢产物鹅去氧胆酸硫酸氢盐和7-酮基脱氧胆酸中含量升高的结果一致。磷脂酰胆碱和磷脂酰乙醇胺是甘油磷脂代谢的重要产物, 其经磷酸二酯酶A2水解分别形成溶血磷脂酰乙醇胺和溶血磷脂酰胆碱。溶血磷脂酰胆碱在肝细胞损伤、修复、能量代谢、脂肪酸和胆汁酸生物合成及炎症过程中发挥重要作用[33]。研究表明溶血磷脂酰胆碱是胆汁淤积型疾病中重要的生物标志物, 通常在胆汁淤积的疾病过程中, 溶血磷脂酰胆碱含量降低, 这与本研究在大肠湿热证模型大鼠血清中测定的溶血磷脂酰胆碱较对照组降低一致[34]。溶血磷脂酰胆碱对包括单核细胞、嗜中性粒细胞和吞噬细胞在内的免疫细胞具有调节作用。通过清除入侵的细菌, 增加中性粒细胞的活性, 进而降低TNF-α及IL-1β含量[35]。本研究结果发现经苦豆草治疗后大肠湿热证大鼠的血清中溶血磷脂酰胆碱含量上升, 促炎细胞因子含量下降, 表明苦豆草对缓解大肠湿热证大鼠体内炎症反应具有重要的作用。
| [1] | Lu YH, Cong LL. Study on the Chinese medical syndrome distribution of ulcerative colitis[J]. Chin J Integr Tradit West Med (中国中西医结合杂志), 2012, 32: 450–454. |
| [2] | Wang XY, Tian DL. The etiology, pathology characters of ulcerative colitis and guide of TCM syndrome differentia-tion and treatment[J]. J Beijing Univ Tradit Chin Med (北京中医药大学学报), 2007, 30: 554–555, 559. |
| [3] | Yang QL, Gu ZY, H H. Reaearch progress of traditional Chinese medicine Sophora alopecuroide[J]. Northwest Pharm J (西北药学杂志), 2011, 26: 232–236. |
| [4] | Liao CY, Liang J, Yang Y, et al. Summary of pharmacology and application of Sophora alopecuroide[J]. Chin J Ethnomed Ethnopharm (中国民族民间医药), 2009, 18: 6–8. |
| [5] | Zhao FG. Study on alkaloids from Sophora alopecuroide L.[J]. Acta Pharm Sin (药学学报), 1980, 15: 182–183. |
| [6] | Nicholson JK, Lindon JC, Holmes E. 'Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29: 1181–1189. DOI:10.1080/004982599238047 |
| [7] | Wang X, Sun H, Zhang A, et al. Potential role of me-tabolomics apporoaches in the area of traditional Chinese medicine:as pillars of the bridge between Chinese and Western medicine[J]. J Pharm Biomed Anal, 2011, 55: 859–868. DOI:10.1016/j.jpba.2011.01.042 |
| [8] | Yao W, Yang C, Wen Y, et al. Treatment effects and mechanisms of Yujin Powder on rat model of large intestine dampness-heat syndrome[J]. J Ethnopharmacol, 2017, 202: 265–280. DOI:10.1016/j.jep.2017.03.030 |
| [9] | Zhu M, He QH, Xun JN. Research progress on disease and syndrome combined animal models with TCM damp-heat syndrome[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2017, 32: 656–658. |
| [10] | National Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China:Part 1(中华人民共和国药典:一部)[M]. Beijing: People's Medical Publishing House, 1977: 325. |
| [11] | National Pharmacopoeia Committee. Notes on Clinical Medication of People's Republic of China Pharmacopoeia:Vol Chinese Herbal Medicine (中华人民共和国药典临床用药须知:中药饮片卷)[M]. Beijing: China Medical Science and Technology Press, 2010: 212. |
| [12] | Feng Q, Liu Z, Zhong S, et al. Integrated metabolomics and metagenomics analysis of plasma and urine identified microbial metabolites associated with coronary heart disease[J]. Sci Rep, 2016, 6: 22525. DOI:10.1038/srep22525 |
| [13] | Li DX, Liu YC. Basic Theroy of Traditional Chinese Medicine (中医基础理论)[M]. 2nd ed. Beijing: People's Medical Publishing House, 2014. |
| [14] | Zheng XW. Study of animal model of Fu-organ syndrome[J]. J Zhejiang Univ Tradit Chin Med (浙江中医学院学报), 2000, 24: 46–47. |
| [15] | Li X, Wei LB, Luo BD, et al. Enteric pathologic changes SD rat models with large intestinal damp-heat[J]. J Hebei Tradit Chin Med Pharm (河北中医药学报), 2004, 19: 4–5. |
| [16] | Suo T, Wu HG, Shi DR. The interleukin with ulcerative colitis[J]. World Chin J Digestol (世界华人消化杂志), 2006, 14: 405–411. |
| [17] | Wang XJ, Deng HZ, Jiang B, et al. The natural plant product sophocarpine ameliorates dextran sodium sulfate-induced colitis in mice by regulating cytokine balance[J]. Int J Colorectal Dis, 2012, 27: 575–581. DOI:10.1007/s00384-011-1352-z |
| [18] | Hu H, Wang S, Zhang C, et al. Synthesis and in vitro inhibitory activity of matrine derivatives towards pro-inflammatory cytokines[J]. Bioorg Med Chem Lett, 2010, 20: 7537–7539. DOI:10.1016/j.bmcl.2010.09.075 |
| [19] | Li Q, Lai Y, Wang C, et al. Matrine inhibits the proliferation, invasion and migration of castration-resistant prostate cancer cells through regulation of the NF-κB signaling pathway[J]. Oncol Rep, 2016, 35: 375–381. DOI:10.3892/or.2015.4341 |
| [20] | De Preter V. Metabolomics in the clinical diagnosis of inflammatory bowel disease[J]. Dig Dis, 2015, 33: 2–10. |
| [21] | Soubieres AA, Poullis A. Emerging role of novel biomarkers in the diagnosis of inflammatory bowel disease[J]. World J Gastrointest Pharmacol Ther, 2016, 7: 41–50. DOI:10.4292/wjgpt.v7.i1.41 |
| [22] | Sands BE. Biomarkers of inflammation in inflammatory bowel disease[J]. Gastroenterology, 2015, 149: 1275–1285. e2. DOI:10.1053/j.gastro.2015.07.003 |
| [23] | Hisamatsu T, Okamoto S, Hashimoto M, et al. Novel, objective, multivariate biomarkers composed of plasma amino acid profiles for the diagnosis and assessment of inflammatory bowel disease[J]. PLoS One, 2012, 7: e31131. DOI:10.1371/journal.pone.0031131 |
| [24] | Ridlon JM, Wolf PG, Gaskins HR. Taurocholic acid metabolism by gut microbes and colon cancer[J]. Gut Microbes, 2016, 7: 201–215. DOI:10.1080/19490976.2016.1150414 |
| [25] | Li T, Chiang JY. Bile acid signaling in metabolic disease and drug therapy[J]. Pharmacol Rev, 2014, 66: 948–983. DOI:10.1124/pr.113.008201 |
| [26] | Murakami S, Fujita M, Nakamura M, et al. Taurine ameliorates cholesterol metabolism by stimulating bile acid production in high-cholesterol-fed rats[J]. Clin Exp Pharmacol Physiol, 2016, 43: 372–378. DOI:10.1111/cep.2016.43.issue-3 |
| [27] | He X, Zheng N, He J, et al. Gut microbiota modulation attenuated the hypolipidemic effect of simvastatin in high-fat/cholesterol-diet fed mice[J]. J Proteome Res, 2017, 16: 1900–1910. DOI:10.1021/acs.jproteome.6b00984 |
| [28] | Qu C, Yuan ZW, Yu XT, et al. Patchouli alcohol ameliorates dextran sodium sulfate-induced experimental colitis and suppresses tryptophan catabolism[J]. Pharmacol Res, 2017, 121: 70–82. DOI:10.1016/j.phrs.2017.04.017 |
| [29] | Nowak EC, De Vries VC, Wasiuk A, et al. Tryptophan hydroxylase-1 regulates immune tolerance and inflammation[J]. J Exp Med, 2012, 209: 2127–2135. DOI:10.1084/jem.20120408 |
| [30] | Liu GQ, Yuan HN, Xie L, et al. The effects of Sophora alopecuroide alkaloids on monoamine metabolism and dopamine and 5-HT receptors in rats[J]. Acta Pharm Sin (药学学报), 1987, 22: 645–649. |
| [31] | Dawiskiba T, Deja S, Mulak A, et al. Serum and urine metabolomic fingerprinting in diagnostics of inflammatory bowel diseases[J]. World J Gastroenterol, 2014, 20: 163–174. DOI:10.3748/wjg.v20.i1.163 |
| [32] | Spoettl T, Hausmann M, Klebl F, et al. Serum soluble TNF receptor Ⅰ and Ⅱ levels correlate with disease activity in IBD patients[J]. Inflamm Bowel Dis, 2007, 13: 727–732. |
| [33] | Yang J, Zhao X, Liu X, et al. High performance liquid chromatography-mass spectrometry for metabonomics:potential biomarkers for acute deterioration of liver function in chronic hepatitis B[J]. J Proteome Res, 2006, 5: 554–561. DOI:10.1021/pr050364w |
| [34] | Song DJ, Pan JQ, Li PX, et al. Research progress of lyso-phosphatidylcholines for liver diseases[J]. Chin Phar-macol Bull (中国药理学通报), 2014, 30: 1642–1646. |
| [35] | Drobnik W, Liebisch G, Audebert FX, et al. Plasma ceramide and lysophosphatidylcholine inversely correlate with mortality in sepsis patients[J]. J Lipid Res, 2003, 44: 754–761. DOI:10.1194/jlr.M200401-JLR200 |
 2018, Vol. 53
2018, Vol. 53


