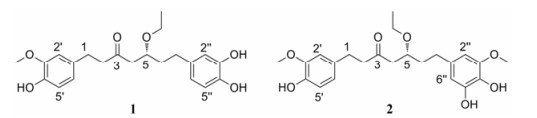
干姜是姜科多年生草本植物姜Zingiber officinale Rosc的干燥根茎[1], 主产于四川西部、广东、湖北、福建、广西西部、贵州等地区, 通常切片或切块生用; 干姜味道辛辣, 属性偏热, 归属于脾、胃、心、肺经, 其功效主要有驱散寒气, 润肺化痰饮, 回阳通脉, 去燥去湿。干姜中含有姜辣素、挥发油、二苯庚烷等化学成分[2]。现代药理学表明, 干姜中特有的二苯基庚烷类成分, 是存在于姜科植物中的一类比较特殊的化合物, 是具有1, 7-二取代苯基并以庚烷骨架为母体结构的化合物的统称, 可分为线性二苯基烷类和环状二苯基庚烷类化合物[3], 该类化合物属多酚类物质, 具有多种生物学和药理学活性, 包括抗氧化、抗肝毒性、抗炎、抗增殖、止吐、抗肿瘤等[4-10]。姜黄中发现的姜黄素同属于二苯庚烷类化合物, 在治疗肝脏疾病方面显示出良好的应用前景[11]。为了进一步揭示干姜的物质基础, 扩大干姜的药用价值, 本实验采用各种分离技术从干姜中分离鉴定了2个新的线型二苯庚烷类化合物, 结构见图 1。
|
Figure 1 Structures of compounds 1 and 2 |
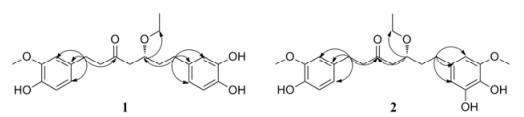
化合物1 黄棕色油状物, UV (MeOH) λmax (logε) 204 nm (1.82)、282 (0.20) nm; IR显示该结构中含有羟基(3 423 cm-1)、酮羰基(1 707 cm-1)、苯环(1 604、1 515、1 451 cm-1); ESI-MS [M+Na]+ m/z 411.177 9 (Calcd. 411.177 8), 提示化合物1的分子式为C22H28O6。1H NMR (500 MHz, CD3OD)数据(表 1)显示两组ABX耦合系统的苯环质子信号δH 6.74 (1H, d, J = 2.0 Hz, H-2')、6.67 (1H, d, J = 8.0 Hz, H-5')、6.46 (1H, dd, J = 2.0, 8.0 Hz, H-6')、6.68 (1H, d, J = 2.0 Hz, H-2")、6.64 (1H, d, J = 8.0 Hz, H-5")和6.59 (1H, dd, J = 2.0, 8.0 Hz, H-6"), 在13C NMR (125 MHz, CD3OD)谱中, δC 56.4为甲氧基信号, δC 211.7为酮羰基碳信号。δH 3.42 (2H, m)、1.09 (1H, t, J = 7.0 Hz), δC 15.8、65.6提示为乙氧基结构片段。13C NMR (125 MHz, CD3OD)谱中高场区6个碳信号和δC 211.7, 再结合两个苯环质子信号, 提示该化合物为二苯庚烷类化合物, 在HMBC谱中(图 2), δH 2.74 (2H, m, H-1)与δC 113.2 (C-2')、120.6 (C-6')、134.1 (C-1')、211.7 (C-3)、46.4 (C-2)有相关, δH 2.49 (2H, m, H-7)与δC 116.3 (C-2")、121.8 (C-6")、134.8 (C-1")、76.4 (C-5)、37.5 (C-6)有相关, 提示两个ABX系统的苯环分别与C-1和C-7相连, δH 1.68 (2H, m, H-6)与δC 134.8 (C-1")、76.4 (C-5)、31.8 (C-7)有相关, 提示δC 37.5在C-6位, δC 76.4在C-5位, 又由于δH 3.72 (1H, m, H-5)与δC 31.8 (C-7)、65.6 (5-OCH2-)、211.7 (C-3)相关, 进一步证实乙氧基连在C-5位, 酮羰基连在C-3位。δH 3.81 (3H, s, 3'-OCH3)与δH 6.74 (1H, d, J = 2.0 Hz, H-2')有NOE关系, δH 2.74 (2H, m, H-1)与δC 113.2 (C-2')有HMBC相关, 表明C-1相连的苯环被甲氧基取代。在1H-1H COSY谱中, δH 3.72 (1H, m, H-5)与δH 1.68 (2H, m, H-6)、δH 2.62、2.51 (2H, d, H-4)有相关, 进一步证实了结构的准确性。化合物1绝对构型的确定是根据文献[12, 13]报道的化合物5的旋光值([α]D -16.9)与本文的([α]D +15.173)刚好相反, 表明化合物1与文献中化合物5的绝对构型相反。综上所述, 确定化合物1的结构为3-酮-5R-乙氧基-1-(3-甲氧基-4-羟基苯基)-7-(3, 4-二羟基苯基)庚烷。
| Table 1 1H NMR (500 MHz in CD3OD) and 13C NMR (125 MHz in CD3OD) spectral data of compounds 1 and 2 |
|
Figure 2 Key HMBC correlations of compounds 1 and 2 |
化合物2 黄棕色油状物, UV (MeOH) λmax (logε) 204 nm (1.31)、282 (0.29) nm; IR显示该结构中含有羟基(3 399 cm-1)、酮羰基(1 706 cm-1)、苯环(1 606、1 514、1 454 cm-1); ESI-MS [M+Na]+ m/z 441.188 1 (Calcd. 441.188 3)。1H NMR (500 MHz, CD3OD)和13C NMR (125 MHz, CD3OD)数据(表 1)显示与化合物1相似, 同为二苯庚烷类化合物, 两组苯环质子信号δH 6.75 (1H, d, J = 1.5 Hz, H-2')、6.68 (1H, d, J = 8.0 Hz, H-5')、6.60 (1H, dd, J = 1.5, 8.0 Hz, H-6')、6.29 (1H, d, J = 2.0 Hz, H-2")、6.29 (1H, d, J = 2.0 Hz, H-6"), 分别为ABX系统和四取代, δC 56.6、56.3为两个甲氧基碳信号, δC 211.7为酮羰基碳信号。δH 3.40 (2H, m)、1.09 (1H, t, J = 7.0 Hz), δC 15.8、65.6提示有乙氧基结构。在HMBC谱中δH 2.74 (2H, m, H-1)与δC 113.2 (C-2')、121.7 (C-6')、134.0 (C-1')、211.7 (C-3)、46.4 (C-2)有相关, δH 2.49 (2H, m, H-7)与δC 104.7 (C-2")、109.8 (C-6")、133.8 (C-1")、76.3 (C-5)、37.4 (C-6)有相关, 提示ABX系统的苯环和四取代的苯环分别与C-1和C-7相连, δH 1.70 (2H, m, H-6)与δC 133.8 (C-1")、76.3 (C-5)、30.3 (C-7)有相关, 提示δC 37.4在C-6位, δC 76.3在C-5位, 又由于δH 3.71 (1H, m, H-5)与δC 30.3 (C-7)、65.6 (5-OCH2-)、211.7 (C-3)相关, 进一步证实乙氧基和酮羰基分别连接在C-5和C-3位。δH 3.80 (3H, s, 3'-OCH3)与δH 6.75 (1H, d, J = 2.0 Hz, H-2')有NOE关系, δH 2.74 (2H, m, H-1)与δC 113.2 (C-2')有HMBC相关, δH 3.81 (3H, s, 3"-OCH3)与δH 6.29 (1H, d, J = 2.0 Hz, H-2")有NOE关系, δH 2.49 (2H, m, H-7)与δC 104.7 (C-2")有HMBC相关, 表明C-1和C-7相连的苯环分别在C-3'和C-3"被甲氧基取代。以上阐述显示化合物2与化合物1仅在于苯环的取代位置的差异, 且旋光值差异甚微, 故确定化合物2的结构为3-酮-5R-乙氧基-1-(3-甲氧基-4-羟基苯基)-7-(3-甲氧基-4, 5-二羟基苯基)庚烷。
实验部分Bruker maxis HD型飞行时间质谱仪(德国); Bruker AVANCE Ⅲ 500核磁共振仪, TMS做内标; 制备液相色谱仪(YMC-Pack ODS-A, 250 mm × 10 mm, 5 μm, 赛普锐思北京科技); Diaion HP-20、MCI Gel CHP-20 (日本三菱); Sephadex LH-20 (Parmacia Biotech公司); 柱色谱硅胶、GF254硅胶薄层板(青岛海洋化工厂); 浓硫酸茴香醛显色剂、分析纯和色谱纯试剂(天津四友精细化学品有限公司)。
本研究所选的干姜, 购自安徽亳州, 产地为四川省宜宾市, 经河南中医药大学董诚明教授鉴定为姜科草本植物姜Z.officinale Rosc的干燥根茎。
1 提取与分离干姜20 kg, 用乙酸乙酯回流提取3次, 每次200 L/ 2 h, 将乙酸乙酯提取液减压浓缩、干燥, 提取后剩余的药渣用50%乙醇回流提取3次, 每次用100 L/2 h。再将3次50%乙醇提取液浓缩, 此浓缩物上Diaion HP-20大孔吸附树脂, 用水、乙醇梯度洗脱得到10%、30%、50%、70%、95%乙醇部位, 将各部位减压浓缩干燥, 取50%的乙醇部位(80 g) MCI湿法上样, 甲醇梯度洗脱, 得10%、30%、50%、70%、95%的甲醇部位, 所得的30%甲醇洗脱物(18 g)过ODS柱, 甲醇-水(10%→100%)洗脱, 得到组分A~G。组分B (2.83 g)经Sephadex LH-20, 100%的甲醇洗脱, 得到组分B1~B4, B2 (1.2 g)经硅胶柱色谱(90:1, 80:1, 70:1, 60:1, 50:1, 40:1二氯甲烷:甲醇梯度洗脱), 得到的组分再经半制备HPLC分离纯化, 流动相为乙腈-水(31:69), 得化合物1 (3.5 mg)、化合物2 (2.1 mg)。
2 结构鉴定化合物1 黄棕色油状物, [α]D20+15.173 (c 0.026, MeOH); HR-TOF-MS [M+Na]+ m/z 411.177 9 (Calcd. 411.177 8), 分子式为C22H28O6; IR (max) 3 423、2 929、1 707、1 604、1 515、1 451、1 370、1 271、1 077、1 031 cm-1, UV (MeOH) λmax (logε) 204 (1.82) nm、282 (0.20) nm。1H NMR (500 MHz, CD3OD)和13C NMR (125 MHz, CD3OD)数据见表 1。
化合物2 黄棕色油状物, [α]D20+15.230 (c 0.012, MeOH); HR-TOF-MS [M+Na]+ m/z 441.188 1 (Calcd. 441.188 3), 分子式为C23H30O7; IR (max) 3 399、2 929、1 706、1 606、1 514、1 454、1 369、1 269、1 085、1 031 cm-1, UV (MeOH) λmax (logε) 204 (1.31) nm、282 (0.29) nm。1H NMR (500 MHz, CD3OD)和13C NMR (125 MHz, CD3OD)数据见表 1。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2015, 13. |
| [2] | Lu CJ, Ou M, Wang NS, et al. Review on the study of chemical composition of ginger[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2003, 14: 215–217. |
| [3] | Wang ZY. Study on Chemical Constituents of Dried Ginger and Yizhi Ren (干姜和益智仁化学成分研究)[D]. Hefei: Anhui University, 2010. |
| [4] | Chun KS, Kang JY, Kim OH, et al. Effects of yakuchinone A and yakuchinone B on the phorbol ester-induced expression of COX-2 and iNOS and activation of NF-JB inmouse skin[J]. J Environ Pathol Toxicol Oncol, 2002, 21: 131–139. |
| [5] | An N, Zou ZM, Tian Z, et al. Diarylheptanoids from the rhizomes of Alpinia officinarum and their anticancer activity[J]. Fitoterapia, 2008, 79: 27–30. DOI:10.1016/j.fitote.2007.07.001 |
| [6] | Fan GJ, Kang YH, Han YN, et al. Platelet-activating factor (PAF) receptor binding antagonists from Alpinia officinarum[J]. Bioorg Med Chem Lett, 2007, 17: 6720–6722. DOI:10.1016/j.bmcl.2007.10.054 |
| [7] | Matsuda H, Ando S, Kato T, et al. Inhibitors from the rhizomes of Alpinia officinarum on production of nitric oxide in lipopolysaccharide-activated macrophages and the structural requirements of diarylheptanoids for the activity[J]. Bioorg Med Chem, 2006, 14: 138–142. DOI:10.1016/j.bmc.2005.08.003 |
| [8] | Yang Y, Kinoshita K, Koyama K, et al. Structure-antie-metic-activity of some diarylheptanoids and their analogues[J]. Phytomedicine, 2002, 9: 146–152. DOI:10.1078/0944-7113-00091 |
| [9] | Hiroe K, Yayoi K, Nobuji N. 1, 1-Diphenyl-2-picrylhydrazyl radical-scavenging active compounds from greater cardamom (Amomum subulatum Roxb.)[J]. J Nutr Sci Vitaminol, 2001, 47: 167–171. DOI:10.3177/jnsv.47.167 |
| [10] | Tao QF, Xu Y, Rosanna Y, et al. Diarylheptanoids and a monoterpenoid from the rhizomes of Zingiber officinale:anti-oxidant and cytoprotective properties[J]. J Nat Prod, 2008, 71: 12–17. DOI:10.1021/np070114p |
| [11] | Sun Y, Peng ML. Recent advances in curcumin and its derivatives for treatment of liver diseases[J]. Acta Pharm Sin (药学学报), 2014, 49: 1483–1490. |
| [12] | Masanori K, Mari S, Yasuo N, et al. New diarylheptanoids from Alnus japonica and their antioxidative activity[J]. Chem Pharm Bull, 2005, 53: 1519–1523. DOI:10.1248/cpb.53.1519 |
| [13] | Gonzalez-Laredo RF, Helm RF, Chen J, et al. Two acylated diarylheptanoid glycosides from red alder bark[J]. J Nat Prod, 1998, 61: 1292–1294. DOI:10.1021/np980083l |
 2018, Vol. 53
2018, Vol. 53


