2. 西南大学药学院, 重庆 400715
2. College of Pharmaceutical, Southwest University, Chongqing 400715, China
喜马拉雅紫茉莉为紫茉莉科(Nyctaginaceae)植物喜马拉雅紫茉莉(Mirabilis himalaica)的干燥根, 藏语名为巴朱, 为藏药五根之一[1]。藏药志记载, 喜马拉雅紫茉莉味甘、辛; 引黄水, 温肾, 壮阳, 可治疗腰、下腹、关节痛及下半身寒[2]。现代药理实验证明, 喜马拉雅紫茉莉具有抗生育、抗肿瘤的活性。文献报道从喜马拉雅紫茉莉中分离得到43个化合物, 主要为黄酮、苯丙酸衍生物、糖类和萜类等[3, 4]。为更好的开发利用喜马拉雅紫茉莉药用资源, 本文对采自西藏林芝地区的喜马拉雅紫茉莉乙酸乙酯部位进行了研究。通过硅胶柱色谱、Sephadex LH-20柱色谱以及半制备HPLC等方法分离得到3个化合物, 经UV、1H NMR以及13C NMR等波谱解析手段鉴定了结构, 分别为喜马拉雅紫茉莉酮(1) (图 1)、丁香脂素(2)和落叶松树脂醇(3)。其中1为新化合物, 2和3为首次从喜马拉雅紫茉莉中分离得到。
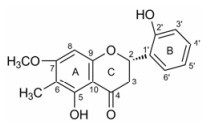
|
Figure 1 Structure of compounds 1 |
化合物1为白色无定型粉末。HR-ESI-MS: m/z: 299.092 7 [M-H]- (Calcd. C17H16O5, 299.091 9), 提示化合物1的分子式为C17H16O5。紫外光谱(UV)显示在214、289 nm处分别有最大吸收, IR谱中显示该化合物结构含有羰基(1 747 cm-1)、苯环(1 612、1 571 cm-1)、羟基(3 554、3 485、3 471、3 406 cm-1); 1H NMR谱中显示δH 5.70 (H-2)、3.04 (H-3), 13C NMR谱中显示δC 77.2 (C-2)、41.9 (C-3)、196 (C-4), 表明化合物1为二氢黄酮类化合物[5]。
化合物1的1H NMR谱中显示了一个芳环上的单峰信号: δH 6.12 (1H, s, H-8), 为五取代的A环。1H NMR谱还显示有4个芳香环质子信号: δH 7.35 (1H, dd, J = 7.7, 1.4 Hz, H-6')、7.25 (1H, dd, J = 15.5, 1.6 Hz, H-4')、6.98 (1H, td, J = 7.5, 1.0 Hz, H-5')和6.89 (1H, dd, J = 8.1, 0.9 Hz, H-3') (表 1), 根据峰的裂分和偶合常数特征表明这4个氢质子信号组成了ABCD自旋体系, 为苯环上具有邻位二取代的芳氢质子信号, 是B环上的信号[6]。此外, 1H NMR谱中还显示了1个甲基信号δH 2.02 (3H, s, H-6)、1个亚甲基信号δH 3.04 (2H, m, C-3)、1个甲氧基信号δH 3.86 (3H, s, H-7)及1个羟基信号δH 12.05 (1H, s, H-5)。13C NMR谱中共显示出17个碳信号, 包括12个芳香碳信号、1个羰基碳信号δC 196.2、2个脂肪碳信号δC 77.2和41.9、1个甲基碳信号δC 6.8和1个甲氧基碳信号δC 55.9。
| Table 1 1H NMR (400 MHz) and 13C NMR (100 MHz) data of compound 1(in CDCl3) |
HMBC谱(图 2)给出δH 12.05 (OH)与δC 106.6 (C-6)、160.6 (C-5)和102.9 (C-10)相关, δH 2.02 (CH3)与δC 165.7 (C-7)、106.6 (C-6)和160.6 (C-5)相关, δH 3.86 (CH3O)与δC 165.7 (C-7)相关, 表明羟基、甲基和甲氧基分别取代在5位、6位和7位。HMBC谱还显示δH 3.04 (CH2)、7.35 (CH)和6.98 (CH)都与δC 77.2 (C-2)相关, 表明B芳环取代在2位。其余H-4'与C-6'的相关, H-3'与C-1'、C-2'和C-5'相关, H-8与C-6、C-7和C-9相关及OH-2'与C-1'、C-3'的HMBC相关关系, 进一步证实了化合物1的结构。

|
Figure 2 Key HMBC (arrows) and 1H-1H COSY (bold bonds) of compound 1 |
化合物1的CD谱显示在291.5 nm处有负Cotton效应, 在333.5 nm处有正Cotton效应, 因此确定C-2的构型为S[7]。
综上, 确定化合物1为一个新的二氢黄酮类化合物, 命名为(2S)-5-hydroxy-2-(2'-hydroxyphenyl)-7-methoxy-6-methylchroman-4-one, 即喜马拉雅紫茉莉酮。
实验部分Sephadex LH-20 (日本三菱化学公司); GF254薄层硅胶板(烟台江友硅胶开发有限公司); Modelu-3010紫外分光光度计(日本日立公司); 制备HPLC用甲醇(色谱纯, 美国Fisher Scientific公司); LC-MS-8030液相色谱质谱联用仪、LC-6AD液相色谱仪(日本岛津公司); YMC-Pack ODS-A半制备柱, Bruker Avance 400 MHz核磁共振仪(德国Bruker公司, TMS为内标); 水(怡宝纯净水, 华润怡宝有限公司), 其余试剂为分析纯。
植物材料于2012年采自西藏林芝地区西藏农牧学院藏药材基地, 经西藏农牧学院兰小中教授鉴定为喜马拉雅紫茉莉, 凭证标本(CM-2012-002)保存于西南大学药学院药物分析教研室。
1 提取分离喜马拉雅紫茉莉干燥根6.65 kg, 粉碎, 经95%乙醇浸提3次, 70%丙酮浸提3次, 每次浸提48 h, 合并浸提液, 用旋转蒸发仪蒸干, 得浸膏1 137.08 g, 将浸膏悬浮于蒸馏水中, 依次用石油醚、乙酸乙酯、正丁醇萃取, 得100.19 g乙酸乙酯萃取物。乙酸乙酯萃取物过正相硅胶柱色谱(100~200目), 经石油醚-乙酸乙酯(100:0→0:100)体系梯度洗脱, 得10个流分(Fr.1~Fr.10)。Fr.3 (5.56 g)过正相硅胶柱色谱, 经石油醚-乙酸乙酯(100:0→75:25)体系梯度洗脱得3个亚组分(Fr.3.1~Fr.3.3), Fr.3.1经半制备液相得化合物1(9.51 mg, tR = 64 min)。Fr.7 (1.98 g)过正相硅胶色谱柱, 经二氯甲烷-甲醇(100:0→75:25)梯度洗脱得6个亚组分(Fr.7.1~Fr.7.6), Fr.7.3经Sephadex LH-20及半制备HPLC得化合物2(27.57 mg, tR = 64 min)。Fr.6 (2.61 g)过正相硅胶柱色谱, 经石油醚-乙酸乙酯(100:0→73:27)体系梯度洗脱, 得6个亚组分(Fr.6.1~Fr.6.6), Fr.6.5经Sephadex LH-20及半制备HPLC得化合物3(1.18 mg, tR = 44 min)。
2 结构鉴定化合物1 白色粉末(CDCl3); [α]D20-267 (c 0.06, MeOH); UV (MeOH) λmax (logε): 214 (1.76)、289 (1.26) nm; IR (KBr) νmax: 3 554、3 485、3 471、3 406、2 920、2 852、2 362、2 333、1 747、1 612、1 571、1 286、1 246、1 197、1 157、970、896、869、812、746、623 cm-1; CD (MeOH) λmax (Δε): 291.5 (-29.94)、333.5 (6.51) nm; HR-ESI-MS: m/z: 299.092 7 [M-H]- (Calcd C17H16O5, 299.091 9); 1H NMR (400 MHz, CDCl3)和13C NMR (100 MHz, CDCl3)数据见表 1。
化合物2 白色粉末(CHCl3), 1H NMR (CDCl3, 400 MHz): δH 6.57 (4H, s, H-2, 6, 2', 6'), 5.59 (2H, s, -OH), 4.72 (2H, d, J = 4.0 Hz, H-7, 7'), 4.27 (2H, dd, J = 9.0, 6.7 Hz, H-9b, H-9'b), 3.88 (14H, dd, 4-OCH3, H-9a, H-9'a), 3.09 (2H, m, H-8, 8'); 13C NMR (CDCl3, 100 MHz): δC 147.2 (C-3, 5, 3', 5'), 134.3 (C-4, 4'), 132.1 (C-1, 1'), 102.7 (C-2, 2', 6, 6'), 86.1 (C-7, 7'), 71.8 (C-9, 9'), 56.4 (-OCH3), 54.3 (C-8, 8')。以上数据与文献[8, 9]报道一致, 鉴定为丁香脂素。
化合物3 白色粉末(CHCl3), 1H NMR (CDCl3, 400 MHz): δH 6.89 (1H, s, H-2), 6.86 (1H, s, H-6), 6.84 (1H, d, J = 8.6 Hz, H-2'), 6.81 (1H, d, J = 8.2 Hz, H-5), 6.70 (1H, s, H-5'), 6.69 (1H, s, H-6'), 4.79 (1H, d, J = 6.6 Hz, H-7), 4.05 (1H, m, Hb-9'), 3.88 (6H, d, J = 7.5 Hz, OCH3-3, 3'), 3.79 (1H, d, J = 6.5 Hz, Hb-9), 3.74 (1H, m, Ha-9'), 3.64 (1H, m, Ha-9), 2.92 (1H, dd, J = 13.5, 5.1 Hz, Ha-7'), 2.73 (1H, d, J= 6.1 Hz, H-8'), 2.55 (1H, dd, J = 13.4, 10.7 Hz, Hb-7'), 2.41 (1H, m, H-8); 13C NMR (CDCl3, 100 MHz): δC 146.6 (C-3'), 146.5 (C-3), 145.1 (C-4), 144.0 (C-4'), 134.8 (C-1), 132.3 (C-1'), 121.2 (C-6'), 118.8 (C-6), 114.2 (C-5), 111.2 (C-2'), 108.3 (C-2), 82.8 (C-7), 72.9 (C-9'), 61.0 (C-9), 56.0 (3-OCH3), 55.9 (3'-OCH3), 52.6 (C-8), 42.4 (C-8'), 33.4 (C-7')。以上数据与文献[10, 11]报道一致, 鉴定为落叶松树脂醇。
| [1] | Huang LC, Dong Z, Chang YP, et al. Brief Introduction of Tibetan drugs "Five root"[J]. Chin J Ethnomed Ethno-pharm (中国民族民间医药杂志), 1994, 2: 14. |
| [2] | He L, Chen SN, Chen YZ, et al. Chemical study on the roots of Mirabilis himalaica[J]. Chin Wild Plant Resour (中国野生植物资源), 1996, 15: 38–39. |
| [3] | Yang PP, Fan HX, Yang LH, et al. Study on the chemical constituents of Mirabilis himalaica roots[J]. J Anhui Agric Sci(安徽农业科学), 2012, 18: 9641–9643. |
| [4] | Zhou SY, Wang GW, Zou YL, et al. A new diphenyl ether derivative from Mirabilis himalaica[J]. Nat Prod Res, 2017, 31: 1034–1041. DOI:10.1080/14786419.2016.1266351 |
| [5] | Yin SZ. A novel flavanone glycoside from Glycyrrhiza uralensis Fisch[J]. J China Pharm Univ (中国药科大学学报), 1999, 30: 19–20. |
| [6] | Ning YC. Structural Identification of Organic Compounds and Organic Spectroscopy (有机化合物结构鉴定与有机波谱学)[M]. 2nd ed. Beijing: Science Press, 2000. |
| [7] | Gaffield WJ. Circular dichroism, optical rotator dispersion and absolute configuration of flavanones, 3-hydroxyflavanones and their glycosides[J]. Tetrahedron, 1970, 26: 4093–4108. DOI:10.1016/S0040-4020(01)93050-9 |
| [8] | Niu XM, Li SH, Peng LY, et al. Constituents from Limonia crenulata[J]. J Asian Nat Prod Res, 2001, 3: 299–311. DOI:10.1080/10286020108040370 |
| [9] | Song WW, Li B, Liu JK. A new lignan from Elaeagnus lanceolata (Elaeagnaceae)[J]. Acta Bot Yunnan (云南植物研究), 2010, 32: 455–462. |
| [10] | Park TW, Lee C, Jin WL, et al. Chemical constituents from Buddleja officinalis and their inhibitory effects on nitric oxide production[J]. Nat Prod Sci, 2016, 22: 129–133. DOI:10.20307/nps.2016.22.2.129 |
| [11] | Cui YL, Mu Q, Hu CQ. Studies on the phenylpropanoids from Caragana rosea[J]. Nat Prod Res Dev (天然产物研究与开发), 2003, 27: 38–40. |
 2018, Vol. 53
2018, Vol. 53


