2. 扬子江药业集团南京海陵药业有限公司, 江苏 南京 210000
2. Yangtze River Pharmaceutical Group Nanjing Hailing Pharmaceutical Co., Ltd, Nanjing 210000, China
奥硝唑是继甲硝唑和替硝唑后的第三代抗厌氧菌感染药物, 由于其疗效肯定, 不良反应小, 已在临床上得到广泛认同[1, 2]。左旋奥硝唑作为有效成分发挥抗厌氧菌和微生物的作用, 其在药效和不良反应方面均优于奥硝唑[3-6], 体内代谢途径与奥硝唑一致[7, 8]。磷酸左奥硝唑酯二钠是经CFDA批准进入药物临床试验的新型化合物, 药品注册分类为1.1类[9, 10]。它为奥硝唑左旋异构体磷酸酯衍生物的钠盐, 是已上市左旋奥硝唑的前药, 它提高了左旋奥硝唑的水溶性, 从而可以进一步减少注射部位的不良反应率。前期大鼠实验结果显示, 磷酸左奥硝唑酯二钠在体内可快速转化为左旋奥硝唑发挥药效, 但其转化效率和转化为左旋奥硝唑后的机体暴露量是否与直接给予等摩尔量的左旋奥硝唑一致尚未进行评价。如果磷酸左奥硝唑酯二钠在体内可快速、彻底地转化为左旋奥硝唑, 则可以证明磷酸左奥硝唑酯二钠进入机体后就是左旋奥硝唑。因而, 两者之间的安全性、药效以及药代动力学均是等同的。若能通过早期的临床试验证明这一点, 则有可能免除大规模临床验证性试验所需要的时间和花费。
若想证明磷酸左奥硝唑酯二钠与左旋奥硝唑之间的一致性, 通常有两种主要方法: ①采用国际上通用的生物等效性验证的研究方案和标准。其优点是方法简便、成熟。也是国际上对判断两个药物之间是否具有一致性的最常用方法[11]。但其缺点是:由于两种药物进行临床试验时所具有的复杂性(如个体内变异、药物间差异、周期间差异、给药顺序等), 比较本研究中的这两种化合物结构并不相同的药物可能存在说服力不强的弱点。②采用稳定同位素标记药物的比较药代动力学/生物等效性的方法。本研究采用非放射性同位素(稳定核素)定位标记磷酸左奥硝唑酯二钠, 并通过与参比药物(左旋奥硝唑)同时给药、分别测定的方法, 参考生物等效的判断原则来进行研究。该方法的优点是可以避免个体内变异、给药周期差异、给药顺序差异对结果的影响, 能直观、灵敏地比较这两种药物在体内代谢的异同。缺点是技术复杂, 需要合成稳定同位素标记药物。使用稳定同位素标记药物进行比较药代动力学/生物等效性研究, 国外已有不少成功实例[12-15], 尤其是个体内变异大、受给药周期影响明显的药物。但是, 至今国内鲜见报道相关的研究案例。
本文首次在食蟹猴体内评价了磷酸左奥硝唑酯二钠的药代动力学特征, 并与左旋奥硝唑进行了比较。同时, 也探讨和验证了采用稳定同位素标记药物的比较药代动力学/生物等效性的评价方法, 为随后在人体内进行的类似研究奠定了基础。
材料与方法药品与试剂 磷酸左奥硝唑酯二钠五水合物和15N-磷酸左奥硝唑酯二钠五水合物、左奥硝唑和15N-左奥硝唑、内标(替硝唑)对照品均由扬子江药业集团南京海陵药业有限公司提供, 纯度分别为97.4% (批号12041401-S2)和97.1% (批号13041921)、99.1% (批号110901)和100.4% (批号20140414)、99.8% (批号100336-200703)。
甲醇为色谱纯, 购自美国Burdick & Jackson公司; 乙酸和乙酸铵为分析纯, 购自国药集团化学试剂有限公司。左旋奥硝唑氯化钠注射液(A药), 规格为每支0.5 g/100 mL (批号201406121);注射用15N-磷酸左奥硝唑酯二钠(B药), 规格为0.25 g/支(批号14042711);注射用磷酸左奥硝唑酯二钠(C药)规格为0.25 g/支(批号14041811)。以上药品均由扬子江药业集团南京海陵药业有限公司提供。6个不同食蟹猴个体的空白血浆样品由北京昭衍新药研究中心股份有限公司提供。
仪器 API-4000型三重串联四级杆质谱仪:美国Applied Biosystems公司, 配备电喷雾离子源(Electrospray Ionization, ESI)以及Analyte 1.5.1数据处理软件; DGU-20A型高效液相色谱仪:日本岛津公司, 包括LC-20AD型二元泵、SIL-20AC型自动进样器; CTO-20A型柱温箱和SCL-10Avp型控制器; 本研究所用其他设备还有Mettler AX-150型十万分之一分析天平、Heraeus Pico型台式离心机和Millipore Q型纯水机等。
动物 实验Ⅰa:食蟹猴, 6只, 雌雄各半, 2~5岁, 体重(3.39±0.29) kg; 实验Ⅰb:食蟹猴, 2只, 雌雄各半, 2~5岁, 体重(3.11±0.04) kg; 实验Ⅱ:食蟹猴, 4只, 雌雄各半, 2~5岁, 体重(3.23±0.32) kg。以上动物均购于广西南宁市富泽野生动物养殖有限公司, 动物许可证编号: SYXK (京) 2009-0024。
实验设计 为了考察食蟹猴静脉注射磷酸左奥硝唑酯二钠后, 其在体内是否可以迅速分解为左旋奥硝唑, 以及其分解为左奥硝唑的量与给予等摩尔左奥硝唑后体内左奥硝唑的量是否相当, 本研究共设计了两项实验。实验Ⅰ:同时给予动物等摩尔量的左旋奥硝唑(A药)和15N-磷酸左奥硝唑酯二钠(B药), 比较两药的药代动力学特征(Ia); 并考察了输注时间对15N-磷酸左奥硝唑酯二钠(B药)药代动力学特征的影响(Ib)。实验Ⅱ:同时给予动物等摩尔量的15N-磷酸左奥硝唑酯二钠(B药)与磷酸左奥硝唑酯二钠(C药), 验证15N标记并不影响磷酸左奥硝唑酯二钠的药代动力学特征。
给药方法与血样采集 实验Ⅰa:周期1—食蟹猴静脉输注(5 min)低剂量混合药(A药0.175 mmol/B药0.175 mmol); 周期2—静脉输注(5 min)高剂量混合药(A药0.35 mmol/B药0.35 mmol), 分别采集两个周期给药前至给药后24 h内的血样。两周期间隔3天的清洗期。实验Ⅰb:重复实验Ⅰa高剂量组的实验操作, 仅静脉输注时间由5 min改为30 min。实验Ⅱ:食蟹猴静脉输注(5 min)高剂量混合药(B药0.35 mmol/C药0.35 mmol)。
以上实验过程中, 动物无需禁食, 清醒状态下给药, 给药后正常进食。实验Ⅰa和实验Ⅱ采集每次给药前和给药后2、5、6、7、10、15、20、30、45、60、120、240、480、720和1 440 min的血样0.5 mL (共16个点); 实验Ⅰb采集给药前和给药后5、10、20、28、30、32、35、40、45、60、120、240、480、720和1 440 min的血样0.5 mL (共16个点)。取血后快速转至肝素处理的试管中(内含NaF 200 mmol·L-1, 以避免磷酸左奥硝唑酯二钠在检测前转化为左旋奥硝唑), 迅速于4 ℃、1 500 r·min-1离心10 min, 立即取出血浆50 μL, 加入到含有150 μL甲醇(含内标)的试管内, 即刻混匀沉淀蛋白后-20 ℃条件下冷冻保存。
血浆药物浓度测定 采用经过方法学考察合格的液相色谱-串联质谱法(LC-MS/MS)定量测定血浆中磷酸左奥硝唑酯二钠和15N-磷酸左奥硝唑酯二钠、左旋奥硝唑和15N-左旋奥硝唑的浓度。使用蛋白沉淀法进行样本前处理, 以替硝唑为内标进行定量测定。血浆中磷酸左奥硝唑酯二钠标准曲线的定量范围是1~230 nmol·mL-1, 质控样本浓度设置为3、18和184 nmol·mL-1; 左旋奥硝唑标准曲线的定量范围是0.2~45 nmol·mL-1, 质控样本浓度设置为0.6、4和36 nmol·mL-1。血样测定过程中, 随行标准曲线和质控样本的准确度及精密度均满足CFDA相关指导原则的要求。
药代动力学分析 采用WinNonlin 6.3软件(Pharsight公司)按照标准非房室模型方法对血药浓度数据进行分析, Cmax和tmax为实测值; 使用线性-对数梯形法则计算AUC0-t; AUC0-∞由AUC0-t+Ct/ke计算; t1/2由ln(2)/ke计算。使用Excel 2010软件对药代动力学参数进行描述性统计。选择左旋奥硝唑作为参比制剂, AUC和Cmax经对数转换后进行生物等效性评价。
结果 1 血药浓度-时间曲线 1.1 实验Ⅰa (药物A和药物B的比较)6只食蟹猴单次静脉输注(5 min) A药0.175 mmol/B药0.175 mmol和A药0.35 mmol/B药0.35 mmol后, 15N-左奥硝唑酯二钠、15N-左奥硝唑和左旋奥硝唑的平均药时曲线见图 1。由图可见, 15N-磷酸左奥硝唑酯二钠给药后可迅速转化为15N-左旋奥硝唑。在给药15 min内, 由15N-磷酸左奥硝唑酯二钠转化生成的15N-左奥硝唑的浓度明显高于等摩尔量给药的左奥硝唑。

|
Figure 1 Mean plasma concentration of 15N-levornidazole disodium phosphate, 15N-levornidazole and levornidazole over time after intravenous infusion (i.f.) single-dose of levornidazole (Drug A) and 15N-levornidazole disodium phosphate (Drug B) simultaneously in 6 monkeys. A: Drug A 0.175 mmol and Drug B 0.175 mmol, 0-24 h; B: Drug A 0.35 mmol and Drug B 0.35 mmol, 0-24 h; C: Drug A 0.175 mmol and Drug B 0.175 mmol, 0-0.5 h; D: Drug A 0.35 mmol and Drug B 0.35 mmol, 0-0.5 h |
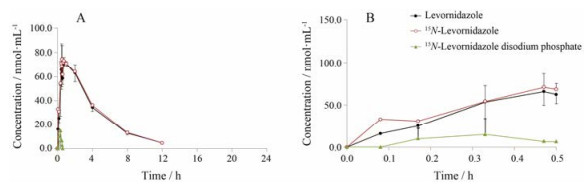
2只食蟹猴单次静脉输注(30 min) 15N-磷酸左奥硝唑酯二钠0.35 mmol/左奥硝唑0.35 mmol后, 15N-左奥硝唑酯二钠、15N-左奥硝唑和左奥硝唑的平均药时曲线见图 2。延长静脉输注时间后, 由15N-磷酸左奥硝唑酯二钠转化生成的15N-左奥硝唑的浓度与等摩尔量给药的左奥硝唑相近, 说明延长给药时间可以减小实验Ⅰa中看到的浓度差异。
|
Figure 2 Mean plasma concentration of 15N-levornidazole disodium phosphate, 15N-levornidazole and levornidazole over time after i.f. single-dose of levornidazole 0.35 mmol (Drug A) and 15N-levornidazole disodium phosphate 0.35 mmol (Drug B) simultaneously in 2 monkeys. A: 0-24 h after dosing; B: 0-0.5 h after dosing |
4只食蟹猴单次静脉输注(5 min) 15N-磷酸左奥硝唑酯二钠0.35 mmol/磷酸左奥硝唑酯二钠0.35 mmol后, 15N-磷酸左奥硝唑酯二钠、磷酸左奥硝唑酯二钠、15N-左旋奥硝唑和左旋奥硝唑的平均血药浓度-时间曲线见图 3。由图可见, 两药的药时曲线吻合, 证明了15N的标记并不影响磷酸左奥硝唑酯二钠的药代动力学行为。

|
Figure 3 Mean plasma concentration of 15N-levornidazole disodium phosphate, levornidazole disodium phosphate, 15N-levornidazole and levornidazole over time after i.f. single-dose of 15N-levornidazole disodium phosphate 0.35 mmol (Drug B) and levornidazole disodium phosphate 0.35 mmol (Drug C) simultaneously in 4 monkeys. A: 0-24 h after dosing; B: 0-0.5 h after dosing |
A药/B药、B药/C药等摩尔量给药后15N-左旋奥硝唑和左旋奥硝唑的药代动力学参数见表 1, 2 (实验Ⅰ)和表 3 (实验Ⅱ)。
| Table 1 Summary of levornidazole disodium phosphate pharmacokinetic parameters in monkey of experiment Ⅰ (x± s) |
| Table 2 Summary of levornidazole pharmacokinetic parameters in monkey of experiment Ⅰ (x± s) |
| Table 3 Summary of levornidazole disodium phosphate and levornidazole pharmacokinetic parameters in monkey of experiment Ⅱ (i.f. 5 min, high dose level, n = 4, x± s) |
对15N-磷酸左奥硝唑酯二钠的主要代谢产物15N-左奥硝唑和左旋奥硝唑(参比药物)进行了生物等效性评价。AUC和Cmax经对数转换后进行方差分析及生物等效性评价, 结果见表 4。实验Ⅰ:低剂量和高剂量5 min给药组AUC具有生物等效性, 但Cmax比值的90%置信区间或点估计值超出等效范围80%~125%的上限, 15N-左奥硝唑的峰浓度高于左奥硝唑的峰浓度, 两药物未显示生物等效性; 高剂量30 min给药组AUC和Cmax比值的90%置信区间均在80%~125%之内, 两药物显示出生物等效性。实验Ⅱ:两药物具有生物等效性。
| Table 4 Bioequivalence summary of levornidazole in monkey |
磷酸左奥硝唑酯二钠在体内迅速代谢为左旋奥硝唑, 静脉输注给药5 min, 其血药浓度在停药10 min后已低于定量下限; 静脉输注给药30 min, 其血药浓度在停药2 min后已低于定量下限。因此, 消除相没有足够的可检测浓度点来计算t1/2、ke、CL、Vz和MRT等药代动力学参数。15N-磷酸左奥硝唑酯二钠的主要代谢产物15N-左奥硝唑的药代动力学特征与等摩尔给药的左奥硝唑基本一致, 机体暴露均随着给药剂量的增加而成比例地增加。15N-磷酸左奥硝唑酯二钠静脉输注给药5 min, 15N-左奥硝唑的AUC与左奥硝唑等效, 但是前者的Cmax明显高于后者, 这种浓度差别主要发生在给药后15 min内, 其原因可能与15N-磷酸左奥硝唑酯二钠在体内的代谢转化、组织分布等有关, 延长静脉输注给药时间可以减小这种差别, 但由于实验动物数量有限, 尚不能得出明确的结论。
由于磷酸左奥硝唑酯二钠(C药)为左奥硝唑(A药)的前体药物, 其在体内能够迅速分解为左旋奥硝唑。15N-磷酸左奥硝唑酯二钠(B药)为磷酸左奥硝唑酯二钠(C药)的稳定同位素标记药物, 动物实验显示其体内代谢方式与后者一致。因此, 上述3种药物在体内均以左奥硝唑的形式存在, 并发生进一步的代谢。
由于B药和C药具有相同的化学结构、相同的制剂学标准。唯一不同的是B药结构中的氮元素由天然元素14N替换为15N。由于14N和15N只相差一个质量数, 通常认为不会导致生物学特性的差别, 因此, B药在机体内的行踪就代表了C药的生物学行为。A药和B药比对实验的目的是为了观察左奥硝唑与磷酸左奥硝唑酯二钠在机体内代谢的差异; B药和C药比对实验的目的只是为了进一步证明14N-磷酸左奥硝唑酯二钠与15N-磷酸左奥硝唑酯二钠是相同的化合物。
如果证明A药和B药等摩尔量同时给药后, A药在人体内的暴露量与B药具有生物等效性, 则说明A药=B药; 如果证明B药和C药等摩尔量给药后, B药在人体内的暴露量与C药具有生物等效性, 则说明B药=C药。从而证明A药和C药的相似性。
本研究所用的生物等效性研究方法不同于传统的两周期交叉设计, 可避免给药周期、个体内变异、给药顺序等因素对生物等效性结果的影响。本研究证明了磷酸左奥硝唑酯二钠具有左旋奥硝唑的前药特征, 结果已成功支持了该药物在人体中使用同样思路进行研究, 从而豁免了部分临床研究, 节约新药研发经费和时间。
由于动物给予稳定同位素标记的磷酸左奥硝唑酯二钠后, 不仅需要测定给药后的血浆浓度, 而且还要测定由其代谢产生的稳定同位素标记的左旋奥硝唑的浓度。故稳定同位素的标记位置不能参与该代谢过程。因此, 本研究把稳定同位素标记的位置设计在咪唑环上。且考虑到合成过程的易于操作性, 最终, 标记位置确定为咪唑环上的硝基氮。
为防止15N-待测物和14N-待测物检测时相互干扰, 在建立检测方法时进行了充分验证, 主要包括: ①使用定量上限浓度样品评价15N-药物对14N-药物检测通道的影响。② 15N-待测物的检测:由于自然界中存在天然丰度的15N, 14N-待测物中会存在一定比例的15N-待测物。当14N-待测物与15N-待测物等摩尔比混合时, 其峰面积比值也不等于1, 而是略高于1。如果采用传统方法建立15N-待测物的标准曲线来定量15N-待测物的浓度, 则会将一部分的14N-药物误认为是15N-待测物。因此, 在实验过程中使用摩尔曲线校正的方法来对15N-药物进行定量。以15N-左旋奥硝唑为例:配制一系列不同摩尔浓度比的左旋奥硝唑及15N-左旋奥硝唑混合血浆样品作为摩尔标准曲线样品, 以左旋奥硝唑与15N-左旋奥硝唑的摩尔比作为X轴, 左旋奥硝唑与15N-左旋奥硝唑的实测峰面积比为Y轴得到一条摩尔标准曲线, 以此来校正左旋奥硝唑对15N-左旋奥硝唑的相互影响。计算经摩尔曲线校正后的15N-左旋奥硝唑浓度。
| [1] | Wang J, Wang ZS, Zhu GH, et al. Clinical application and adverse reactions of ornidazole[J]. Her Med (医药导报), 2006, 25: 711–712. |
| [2] | Tian HP, Wang MN. Pharmacological effect and clinical application of ornidazole[J]. Chin Pharm (中国药房), 2003, 14: 50–51. |
| [3] | Yu P, Guo X, Liu XL, et al. Studies on chiral inversion and pharmacokinetics of laevo-ornidazole in human[J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 847–850. |
| [4] | Su JH, Wang ZQ, Gu XL, et al. Comparative study of ornidazole enantiomers on the toxic and side effects to central nervous system in mice[J]. J China Pharm Univ (中国药科大学学报), 2008, 39: 343–347. |
| [5] | Chen K, Sun JH, Wang ZQ, et al. Inhibition effects and mechanism of ornidazole enantiomers on central nervous system in mice[J]. J China Pharm Univ (中国药科大学学报), 2012, 43: 271–274. |
| [6] | Wei TT, Sun JH, Han LW, et al. Effects of the ornidazole enantiomers on the central nervous system:involvement of the GABAA receptor[J]. Chem Biol Interact, 2015, 242: 163–169. DOI:10.1016/j.cbi.2015.09.019 |
| [7] | Du JB, Deng P, Chen XY, et al. Characterization of ornidazole metabolites in human bile after intraveneous doses by ultraperformance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Acta Pharm Sin B, 2012, 2: 159–167. DOI:10.1016/j.apsb.2012.01.002 |
| [8] | Schwartz DE, Jordan JC, Vetter W, et al. Metabolic studies of ornidazole in the rat, in the dog and in man[J]. Xenobiotica, 1979, 9: 571–581. DOI:10.3109/00498257909042323 |
| [9] | Cao J, Mei HK, Jiang XW, et al. Phase Ⅰ tolerance clinical trial of intravenous injection of levornidazole in Chinese healthy volunteers[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2015, 31: 2311–2313. |
| [10] | Cao J, Chen Q, Mei HK, et al. Phase Ⅰ clinical trial on safety and tolerability of levornidazole disodium phosphate for injection in Chinese healthy volunteers[J]. Chin J Pharmacovigil (中国药物警戒), 2016, 13: 260–274. |
| [11] | CFDA. Guidelines for the study of human bioequivalence of chemical generic drugs using pharmacokinetic parameters as end points[S/OL]. 2015-11-27[2017-10-12]. http://www.cde.org.cn/zdyz.do?method=largePage&id=227. |
| [12] | Eichelbaum M, Somogyi A. Inter-and intra-subject variation in the first-pass elimination of highly cleared drugs during chronic dosing. Studies with deuterated verapamil[J]. Eur J Clin Pharmacol, 1984, 26: 47–53. DOI:10.1007/BF00546708 |
| [13] | Heck HA, Buttrill SE Jr, Flynn NW, et al. Bioavailability of imipramine tablets relative to a stable isotope-labeled internal standard:increasing the power of bioavailability tests[J]. J Pharmacokinet Biopharm, 1979, 7: 233–248. DOI:10.1007/BF01060015 |
| [14] | Eichelbaum M, Dengler HJ, Somogyi A, et al. Superiority of stable isotope techniques in the assessment of the bioavailability of drugs undergoing extensive first pass elimination. Studies of the relative bioavailability of verapamil tablets[J]. Eur J Clin Pharmacol, 1981, 19: 127–131. DOI:10.1007/BF00568399 |
| [15] | Bode H, Brendel E, Ahr G, et al. Investigation of nifedipine absorption in different regions of the human gastrointestinal (GI) tract after simultaneous administration of 13C-and 12C-nifedipine[J]. Eur J Clin Pharmacol, 1996, 50: 195–201. DOI:10.1007/s002280050092 |
 2018, Vol. 53
2018, Vol. 53


