2. 江苏省中医药研究院, 国家中医药管理局中药释药系统重点研究室, 江苏 南京 210028;
3. 解放军93318部队医院, 辽宁 开原 112300
2. Key Laboratory of New Drug Delivery System of Chinese Materia Medica of State Administration of Traditional Chinese Medicine, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China;
3. The Liberation Army 93318 Army Hospital, Kaiyuan 112300, China
壮骨中药肝毒性受到关注, 仙灵骨葆口服制剂引起的肝损伤风险于2016年12月药品不良反应信息通报发布, 该制剂处方中重用君药淫羊藿(占整个组方的70%), 其潜在肝毒性风险逐渐显现, 为临床应用带来巨大挑战[1, 2]。
药物的毒性产生与其在体内的代谢转化密切相关, 但现有体内、外模型难以进行毒性与代谢的实时、动态同步观察, 是制约中药毒性物质发现的难点、瓶颈:体内毒性实验周期较长、成本高、化合物用量大, 不适于高效的毒性筛选及代谢动态检测; 体外实验不能体现在体代谢的综合效果, 无法进行毒/代同步分析。
斑马鱼(zebrafish)是近年来进行药物在体高通量筛选、毒性和代谢研究等热门模式生物[3-5]。斑马鱼发育速度快, 在1周内形成主要的脏器及代谢酶系, 幼鱼体小透明, 实验可在微板中进行并实时动态观察[6]。课题组前期建立了斑马鱼代谢模型, 实现微量(微克至毫克级)成分的在体、高效代谢研究[7, 8], 斑马鱼毒性评价法已在国内、外广泛用于药物的安全性评价[9, 10]。与哺乳动物类似, 药物经斑马鱼作用后发生代谢转化, 产生药效或毒性, 故采用斑马鱼进行毒性动态评价的同时可同步分析代谢物, 即实现斑马鱼毒/代(毒性/代谢)同步进程分析。
中药淫羊藿为小檗科植物淫羊藿(Epimedium brevicornum Maxim.)、箭叶淫羊藿[Epimedium sagittatum (Sieb.et Zucc.) Maxim.]、柔毛淫羊藿(Epimedium pubescens Maxim.)或朝鲜淫羊藿(Epimedium koreanum Nakai)的干燥地上部分。具补肾阳, 强筋骨, 祛风湿之功效[11], 虽然淫羊藿的潜在毒性引起重视, 国家药品不良反应监测中心通报“警惕壮骨关节丸引起的肝损害”中公开: “淫羊藿给药3天, 小鼠即出现呕吐、纳少、活动减少, 给药15天处死, 可见肝脏脂肪变性”[12], 但受评价模型及化合物数据等制约, 淫羊藿毒性相关研究相对薄弱且进展缓慢, 何种物质有毒(是原形成分还是代谢物?)亟待明晰。淫羊藿成分复杂, 主含黄酮类、多糖、有机酸及生物碱等成分, 其中淫羊藿黄酮成分是抗骨质疏松的主要活性成分, 其安全性对淫羊藿临床合理应用至关重要。虽然已有淫羊藿总黄酮大鼠长期毒性和急性毒性研究报道未发现明显毒性[13, 14], 但本课题组用斑马鱼毒性评价发现, 淫羊藿提取物和黄酮组分在一定剂量时会致斑马鱼中毒, 出现活动减少, 脏器变形等现象, 且配伍巴戟天后毒性减弱。何种黄酮成分是致毒关键?配伍巴戟天如何减毒?对阐明淫羊藿的毒性之迷及其配伍减毒合理应用具有意义。
本研究拟采用斑马鱼毒/代(毒性/代谢)同步进程分析法分析淫羊藿提取物、黄酮组分、代表黄酮成分及分别配伍巴戟天后的毒性及主要黄酮成分的同步动态变化, 以期发现淫羊藿致毒关键黄酮成分及配伍巴戟天的减毒作用。
材料与方法实验动物 斑马鱼成鱼(南京大学模式动物研究所), 来自德国Tuebingen品系。
试剂与仪器 培养基母液: 2.9‰ NaCl、0.125 8‰ KCl、0.485 1‰ CaCl2·2H2O、0.811 8‰ MgSO4·7H2O; 巴戟天药材(产地广东, 亳州中药饮片厂, 批号: 1404018038);淫羊藿药材(产地陕西, 南通三越中药饮片有限公司, 批号: 161203);淫羊藿总黄酮/黄酮组分(YTF, 自制[15], 含朝藿定A/B/C和淫羊藿苷(icariin)的含量分别为3.0%、7.1%、9.9%和29.0%); 朝藿定A (epimedin A, EA, 纯度98%, 批号: JZ16042502)、朝藿定B (epimedin B, EB, 纯度98%, 批号: JZ15110905)、箭藿苷C (sagittatoside C, SC, 又名2"-鼠李糖基淫羊藿次苷Ⅱ, 2"-O-rhamnosylicariside Ⅱ, 纯度98%, 批号: JZ16071606)、朝藿定C (epimedin C, EC, 纯度98%, 批号JZ16042503)、宝藿苷Ⅰ (baohuoside I, BI, 纯度98%, 批号JZ15070602)购自南京景竹生物科技有限公司; 淫羊藿苷(纯度98%, 批号: 110737-200415)购自中国食品药品检定研究院。Nikon Aphaphot-2 YS2显微镜(日本Nikon尼康公司); 生化培养箱SPX-80 (宁波海曙赛褔实验仪器厂), Olypus stylus TG-4相机(日本Olypus公司); Agilent 1200型系列高效液相色谱仪(美国Agilent公司); Organomation N-EVAP TM 112氮吹仪(美国Origanomation Associates公司); KQ3200B超声波清洗器(昆山市超声仪器有限公司); METTLER TOLEDO AB135-S分析天平(瑞士METTLER TOLEDO公司)。
高效液相色谱分析 液相条件1:色谱柱为Agilent Zorbax C18色谱柱(5 µm, 150 mm × 4.6 mm)和C18预柱(4.6 mm × 12.5 mm ID, 5 µm); 流动相, A为0.1%甲酸水; B为乙腈; A + B = 100%, 采用梯度洗脱: 10% B (0~5) min; 10%~25% B (5~15 min); 25%~90% B (15~40 min); 90% B (40~45 min)。柱温: 30 ℃; 流速: 1 mL·min-1。
液相条件2:色谱柱为Agilent Zorbax C18色谱柱(5 µm, 250 mm × 4.6 mm)和C18预柱(4.6 mm × 12.5 mm ID, 5 µm); 流动相, A为0.1%甲酸水; B为乙腈; A + B = 100%, 采用梯度洗脱B相比例随时间的变化: 10%~23% (0~10 min); 23%~26% (10~35 min); 26%~48% (35~65 min); 48%~80% (65~80 min); 80%~100% (80~85 min); 100%~100% (85~90 min)。柱温: 25 ℃; 流速1.0 mL·min-1; 检测波长270、272、325和353 nm; 运行时间: 90 min。进样量: 20 μL。
采用上述液相条件, 分析淫羊藿水煎液(YYH)、YTF、EC、淫羊藿苷及分别配伍巴戟天水煎液(BJT)经斑马鱼作用前后的6个代表黄酮成分, 分别为EA、EB、EC、淫羊藿苷、SC及BI。YYH及BJT提取方法:取淫羊藿或巴戟天药材, 适当粉碎, 称取10 g, 加水200 mL浸泡半小时, 煎煮2次, 每次30 min, 滤过, 合并滤液, 分别加纯水适量定容, 即得YYH (10 mg·mL-1)或BJT (20 mg·mL-1)贮备液(YYH和BJT的含量均以生药量计)。
斑马鱼毒/代同步进程法分析YYH、YTF、EC和淫羊苷及其配伍BJT的安全性及代谢物 将收集到的受精卵移入培养基中, 28.5 ℃培养箱中继续培养24 h待用。将1 dpf的健康胚胎置于24孔板中给药, 每孔8个胚胎, 每个实验组16个胚胎。包括0.4% DMSO培养基组、YYH及其配伍BJT (1 μg·mL-1 YYH: 1 μg·mL-1 BJT)[16] (200、500、1 000、1 500和2 000 μg·mL-1, 以YYH计); BJT (200、500、1 000、2 000和3 000 μg·mL-1)、YTF及其配伍BJT (1 μg·mL-1 YTF: 10 μg·mL-1 BJT) (10、25、50、100和200 μg·mL-1, 以YTF计)、代表黄酮成分淫羊藿苷、EC及分别配伍BJT (1 μmol·L-1淫羊藿苷或EC: 20 μg·mL-1 BJT) (10、25、50、100和200 μmol·L-1, 以淫羊藿苷或EC计), 具体给药浓度见表 1。每孔给药液2 mL, 将24孔板放入28.5 ℃恒温培养箱中培养, 培养至6 dpf。并于3 dpf在显微镜下观察各实验组斑马鱼的主要脏器形态, 观察并记录2~6 dpf斑马鱼的死亡数。
| Table 1 Concentration of different groups for zebrafish toxicity experiment. The concentration of YYH and BJT was calculated by the amount of the crude drug in the full text. YYH:BJT: 1 μg·mL-1 YYH: 1 μg·mL-1 BJT; YTF:BJT: 1 μg·mL-1 YTF: 10 μg·mL-1 BJT; Icariin:BJT: 1 μmol·L-1 icariin: 20 μg·mL-1 BJT; EC:BJT: 1 μmol·L-1 EC: 20 μg·mL-1 BJT. YYH: Water decoction of Folium Epimedium; BJT: Water decoction of Radix Morindae Officinalis; YTF: Total flavonoids of Folium Epimedium; EC: Epimedin C |
上述斑马鱼1~6 dpf毒性观察同步, 各组分别选取代表浓度(表 2), 增加幼鱼数量供代谢取样(增设6~12孔, 每孔8个胚胎): YYH及其配伍BJT (500 μg·mL-1)、YTF及其配伍BJT (50 μg·mL-1)、代表黄酮成分淫羊藿苷、EC及分别配伍BJT (25 μmol·L-1)。分别于斑马鱼暴露溶液后0、1、2、3、4及5天时吸取药液适量(表 2), 于-20 ℃冰箱放置。
| Table 2 Concentration of different groups for zebrafish metabolic experiment |
斑马鱼代谢样品处理 将上述各组1~6 dpf (给药后0~5天)代谢药液分别于室温空气吹干, 加80%甲醇适量溶解, 同时将各组斑马鱼鱼体(给药后第5天, 即6 dpf)吸干药液, 用生理盐水洗涤3次, 鱼体加入80%甲醇0.5 mL匀浆, YYH及其配伍BJT (3 000 μg·mL-1)、YTF及其配伍BJT (50 μg·mL-1)、代表黄酮成分淫羊藿苷、EC及分别配伍BJT (25 μmol·L-1), 15 000 r·min-1离心10 min, 上清进样20 μL进行HPLC分析。
数据分析 利用数据统计软件SPSS16.0计算各供试液对斑马鱼半数致死浓度(LC50)。
结果 1 淫羊藿黄酮成分经斑马鱼作用前后的高效液相色谱动态分析YYH、YTF、EC、淫羊藿苷及分别配伍BJT经斑马鱼作用1~6 dpf的高效液相色谱见图 1, 经与文献[17, 18]和用对照品对照, 色谱峰1、2、3、4、5和6为淫羊藿6个主要黄酮成分, 分别为EA、EB、EC、淫羊藿苷、SC和BI。
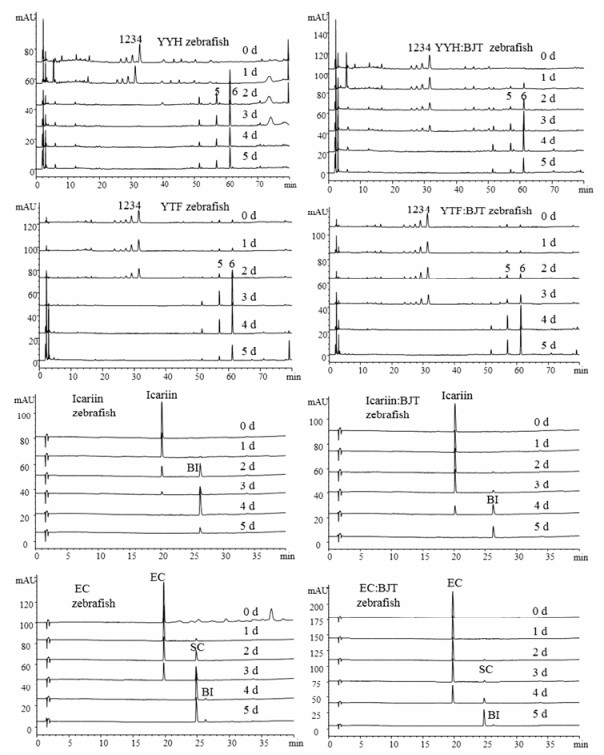
|
Figure 1 HPLC chromatogram for YYH, YTF, EC, icariin and their combination with BJT after exposing to zebrafish from 1-6 dpf (0-5 day after dose). Peak 1: Epimedin A, EA; Peak 2: Epimedin B, EB; Peak 3: Epimedin C, EC; Peak 4: Icariin; Peak 5: Sagittatoside C, SC; Peak 6: Baohuoside I, BI |
以外标法计算上述6个主要淫羊藿黄酮成分含量, 并以每个成分占6个黄酮含量和的百分比计为相对百分含量(图 2), 可见YYH和YTF中以EA、EB、EC和淫羊藿苷为主, 约占6个黄酮成分的93.7%~100%, 经斑马鱼代谢脱糖基后, 全部动态转化为SC和BI。斑马鱼代谢研究表明, EA、EB和淫羊藿苷均转化为共同代谢物BI[19], 而EC则产生SC。
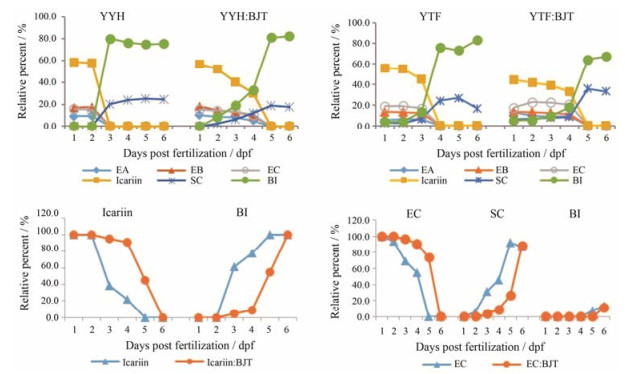
|
Figure 2 Relative percent of EA, EB, EC, icariin, SC or BI for YYH, YTF, EC, icariin and their combination with BJT after exposing to zebrafish from 1-6 dpf |
YYH单独给予1 dpf斑马鱼2天后(3 dpf), EA、EB、EC和淫羊藿苷全部代谢, 伴随代谢物SC和BI相对含量显著升高至19.8%和80.2%;但是, 配伍BJT后, EA、EB、EC和淫羊藿苷的代谢速度减慢, 于给药4天后(5 dpf)代谢完全, SC和BI相对含量动态上升至最高值, 分别为24.1%和75.9%。
YTF单独给予斑马鱼3天后(4 dpf), EA、EB、EC和淫羊藿苷全部代谢, SC和BI含量显著升高至24.0%和76.0%;但在给药5天后(6 dpf), SC含量下降至16.8%, BI含量上升至83.2%, 系SC脱鼠李糖基转变为BI所致。与YYH相似, YTF配伍巴戟天后, EA、EB、EC和淫羊藿苷的代谢速度减慢, 于给药4天后(5 dpf)代谢完全。
淫羊藿代表黄酮成分淫羊藿苷和EC分别单独给予斑马鱼后1天内(2 dpf)均相对稳定, 未见相应代谢物BI和SC; 给药后2~4天(3~5 dpf), 淫羊藿苷和EC均动态代谢完全, 淫羊藿苷的代谢物BI相对含量上升至100%; EC的主要代谢物为SC (相对含量为92.3%), 另一次要代谢物为BI (相对百分含量为7.7%)。淫羊藿苷和EC分别配伍BJT给予斑马鱼后, 代谢速度均减慢, 给药后3天内(4 dpf), 淫羊藿苷和EC相对百分含量均未明显改变, 相应代谢物BI和SC未见明显产生; 直至给药后4天(5 dpf), 淫羊藿苷和EC量分别开始显著降至44.9%和73.2%, 相应代谢物BI和SC量分别显著上升至55.1%和26.8%;至6 dpf, 淫羊藿苷和EC均全部代谢, 淫羊藿苷的代谢物BI含量上升至100%; EC的主要代谢物SC含量显著上升至88.7%, 并开始产生次要代谢物BI (11.3%)。
YYH、YTF、EC、淫羊藿苷及分别配伍BJT经斑马鱼作用5天(6 dpf)后的斑马鱼体内吸收高效液相色谱见图 3, 与0.4% DMSO空白组比较, 除了YTF配伍BJT斑马鱼组可检测到代谢物BI及SC, 但信噪比较小, SC和BI的信噪比分别为1.2和4.8;其他各组斑马鱼色谱峰均未见与空白组明显差异。结果提示, 淫羊藿黄酮成分或其代谢物可吸收入斑马幼鱼体内, 但含量很低, 有时难以检测到。
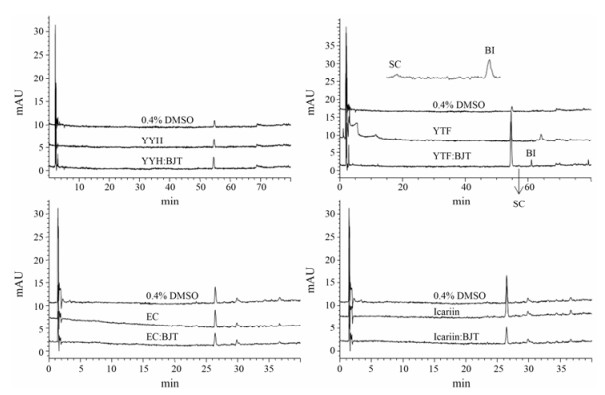
|
Figure 3 HPLC chromatogram for zebrafish (5 day after dose) of YYH, YTF, EC, icariin and their combination with BJT after exposing to zebrafish |
以光学显微镜检视斑马鱼脏器形态和死亡率为主要指标考查毒性。在显微镜下观察结果:斑马鱼受精3 dpf后孵化成幼鱼, 各脏器发育基本完全, 鱼体透明, 在载薄片上易侧卧, 显微镜下检视脏器形态清楚、直观。0.4% DMSO培养基组为空白对照组, 在给药期间未见死亡, 亦未见致鱼脏器产生毒性。各供试液均与培养基组比, 3 dpf斑马鱼显微检视结果见图 4。

|
Figure 4 Pictures of zebrafish embryo exposed to solutions of water decoction of YYH, YTF, EC, icariin and their combination with BJT and control group at 3 dpf, which show different intoxicating phenomenon of different concentration. Magnification, ×100. A: Pericardium; B: Intestine |
YYH在500 μg·mL-1及以下浓度对斑马幼鱼(3 dpf)脏器未见明显改变, 鱼存活最大浓度1 000 μg·mL-1致斑马幼鱼肠道[20, 21]略肿大; BJT在2 000 μg·mL-1及以下浓度对斑马幼鱼(3 dpf)脏器未见明显改变, 在3 000 μg·mL-1时致斑马鱼肠道略肿大、围心囊肿大, 脑部和眼部变小, 眼部色素变浅; YYH配伍BJT后, 在2 000 μg·mL-1时致斑马鱼肠道肿大、围心囊肿大, 脑部和眼部变小, 眼部色素变浅。
与培养基组比, YTF在200 μg·mL-1致斑马幼鱼围心囊水肿、肠道肿大, 脑部和眼部变小, 眼部色素变浅, 但配伍巴戟天后, 相同浓度组幼鱼(3 dpf)脏器均未见明显改变; 淫羊藿苷及其配伍BJT各浓度组斑马幼鱼(3 dpf)脏器均未见明显改变; EC在200 μmol·L-1时致斑马幼鱼(3 dpf)全部死亡, 配伍巴戟天后则全部存活, 但见斑马幼鱼围心囊水肿、肠道肿大, 脑部和眼部变小, 眼部色素变浅。
YYH、YTF、EC、淫羊藿苷及各自配伍BJT对斑马鱼的死亡率与给药浓度和时间基本呈依赖性, 其时间-给药剂量-毒性关系见图 5。

|
Figure 5 Effect on zebrafish mortality (2-6 dpf) of YYH, YTF, EC, icariin and their combination with BJT. Unit for YYH and BJT, YTF, EC and icariin is μg·mL-1, μg·mL-1, and μmol·L-1, respectively |
YYH给药后24 h, 1 500和2 000 μg·mL-1组鱼全部死亡; 1 000 μg·mL-1浓度组鱼死亡37.5%, 在给药后48 h, 死亡率上升至56.25%, 并至6 dpf保持不变; 200和500 μg·mL-1组给药期间鱼的死亡率小于6.25%。巴戟天各浓度组鱼在给药期间无死亡。淫羊藿配伍巴戟天后, 给药后24 h, 1 500和2 000 μg·mL-1鱼死亡率分别降低至31.3%和50%, 并至6 dpf保持不变; 其他各浓度组鱼给药期间未见死亡。
YTF给药后48 h, 仅见200 μg·mL-1浓度组斑马幼鱼(3 dpf)死亡31.25%;给药后72 h, 100和200 μg·mL-1浓度组斑马幼鱼均全部死亡; 配伍巴戟天给药后72 h, 200 μg·mL-1浓度组斑马幼鱼全部死亡, 100 μg·mL-1浓度组斑马幼鱼仅死亡18.75%, 给药后96 h, 100 μg·mL-1组斑马幼鱼死亡率达43.75% (5 dpf), 并至6 dpf保持不变; YTF及其配伍巴戟天, 低于50 μg·mL-1浓度组鱼给药期间不死亡或少量死亡(小于20%)。
淫羊藿苷及其配伍巴戟天各浓度组鱼在给药期间均无死亡。
200和100 μmol·L-1EC致斑马幼鱼全部死亡的时间分别是给药后48 h和72 h, EC配伍巴戟天后, 均推迟至给药后96 h全部死亡。其他低浓度EC及其配伍巴戟天对鱼毒性相当(部分死亡或不死亡)。
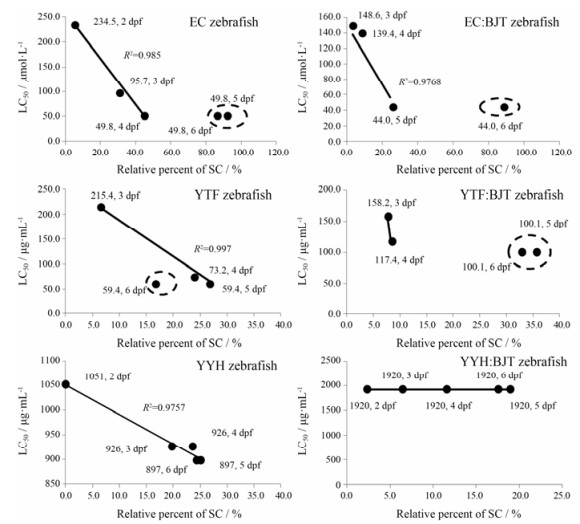
3 代谢物SC的动态变化与斑马鱼动态毒性(LC50)的相关分析淫羊藿黄酮成分按代谢特征主要分为两类, 一类是EA、EB和淫羊藿苷, 其共同主要代谢物为含一个鼠李糖基的BI; 另一类是EC, 其主要代谢物为含两个鼠李糖基的SC。EA、EB、EC和淫羊藿苷是淫羊藿中主要黄酮成分。EA、EB和淫羊藿苷对斑马鱼的毒性小, 本实验以淫羊藿苷为代表, 发现其给予斑马鱼后动态转化为BI, 但未见斑马鱼产生毒性, 提示代谢转化不会增加淫羊藿苷毒性。而EC给予斑马鱼后, 发现动态转化为SC后毒性增加, 提示代谢转化增加EC毒性。本实验发现, YYH、YTF和EC及各自配伍巴戟天的斑马鱼代谢物SC主要来源于EC, 二者的相对含量呈明显的负相关(R2 > 0.9) (图 6)。
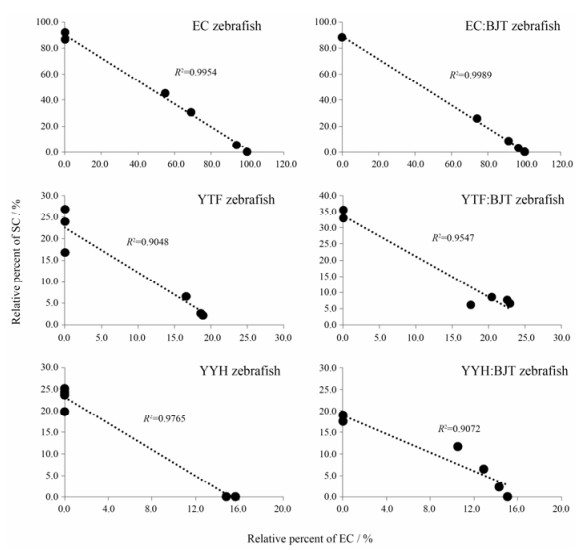
|
Figure 6 Correlation analysis of dynamic changes of relative content between EC and its metabolite SC |
SPSS16.0计算各样品给药后的动态斑马鱼半数致死浓度LC50 (2 dpf或3~6 dpf), 并与SC的相对含量动态变化进行相关分析(图 7)。发现斑马鱼产生毒性(死亡)至毒性达到高峰稳定期间, LC50值的降低(即毒性增加)与SC的增加密切相关(R2 > 0.9), 提示淫羊藿中黄酮的毒性主要来自EC的代谢物SC。YYH、YTF和EC配伍BJT后, 代谢物SC的产生速度减慢, 相应致鱼的毒性也减缓, 特别是YYH与BJT配伍后, 给药期间未见斑马鱼畸形。
|
Figure 7 Correlation analysis of dynamic changes between relative content of SC and zebrafish LC50 from 2 or 3 dpf to 4, 5 or 6 dpf. Data with circle of EC and YTF and their combination with BJT is excluded, the reason is that LC50 at 5 dpf and/or 6 dpfdidn't decrease anymore (that is toxicity increase became stable) |
本实验提出并采用斑马鱼毒/代(毒性/代谢)同步进程分析法, 即用斑马鱼评价毒性的过程中同步动态分析代谢物的变化, 用于分析YYH、YTF、EC、淫羊藿苷及其配伍巴戟天经斑马鱼作用后的毒性与代谢动态变化, 发现淫羊藿致毒关键黄酮成分及配伍巴戟天后的减毒作用。
采用1 dpf斑马鱼胚胎实验, 于3 dpf时孵化成幼鱼, 至5 dpf各种脏器基本发育完全, 鱼体小且透明, 实验可在微板中进行, 在显微镜下检视脏器形态。以鱼的脏器形态变化和死亡率为指标评价毒性, 具有可视、动态、实时等优势。斑马幼鱼即具有较完善的代谢酶系和肠道菌群, 也是进行药物代谢研究的理想模式动物。可见, 本实验选择1~6 dpf斑马鱼可实现药物毒性与代谢的同步动态分析。
近年来淫羊藿的潜在毒性风险受到重视, 其抗骨质疏松主要活性成分黄酮[22, 23]的安全性至关重要, 此外寻找配伍减毒药, 对临床安全有效使用淫羊藿具有意义。故本研究以YYH、TFY、代表黄酮成分(淫羊藿苷和EC)及其配伍BJT为研究对象, 用斑马鱼评价毒性同时分析淫羊藿黄酮类成分的代谢变化, 一方面揭示淫羊藿致毒相关物质及其与代谢转化的关系, 另一方面探讨BJT配伍YYH的减毒作用。
斑马鱼毒性评价发现, 淫羊藿苷各浓度(10~200 μmol·L-1)及其配伍BJT给药期间(1~6 dpf)均未致斑马鱼脏器变形, 也未致斑马鱼死亡, 且不受淫羊藿苷动态转化为主要代谢物BI的影响, 提示代谢转化及配伍BJT均不会影响淫羊藿苷的安全性。YYH (1 000 μg·mL-1及以上浓度)、YTF (50 μg·mL-1及以上浓度)和EC (50 μmol·L-1及以上浓度)致斑马鱼中毒(斑马鱼畸形或死亡), 毒性与给药浓度和时间相关, 配伍BJT后, 毒性均减弱, 主要表现为致鱼中毒浓度提高、鱼出现死亡时间延迟、死亡率降低等。
经斑马鱼作用后同步分析黄酮成分动态变化发现, YYH和YTF中主要黄酮成分EA、EB、EC和淫羊藿苷分别于斑马鱼3和4 dpf全部代谢转化为SC和BI; EC于3~5 dpf逐步转化为SC, 各组斑马鱼死亡率也相应随代谢物的增加而增加, 提示代谢物是潜在致毒因素, 其中EA、EB和淫羊藿苷的共同代谢物为BI, 安全性相对较好, 推测EC的代谢物SC可能是致毒的关键成分。并用斑马鱼毒性评价验证了SC有毒而BI相对安全(另文发表)。
YYH、YTF、EC及各自配伍BJT组经斑马鱼作用后, EC和代谢物SC的相对含量动态变化呈明显负相关(R2 > 0.90), 提示SC主要来源于EC。进一步对SC的动态变化与斑马鱼动态半数致死浓度LC50进行相关分析, 发现SC动态增加至稳定过程中, 斑马鱼LC50也相应动态线性降低(R2 > 0.97), 提示鱼毒性随着SC的增加而增加。BJT配伍YYH、YTF和EC后, SC产生时间延迟, 对斑马鱼的毒性也相应减弱, 提示BJT可能通过减慢EC代谢而减毒。
斑马鱼毒/代同步进程分析法突破了现有体内、外模型无法同步进行毒性与代谢动态分析的技术瓶颈, 具有样品用量小、劳动强度小、高效率、高实验在体化、微板化等优点, 为高效辩识中药毒性物质及发现配伍减毒作用提供思路与方法。
| [1] | National Center for ADR Monitoring. Be vigilant against liver injury caused by oral preparations of Xianlinggubao[EB/OL]. China Food and Drug Administration, 2016[2016-12-08]. http://www.sda.gov.cn/WS01/CL0078/167184.html. |
| [2] | Wang JB, Xiao XH, Du XX, et al. Identification and early diagnosis for traditional Chinese medicine-induced liver injury based on translational toxicology[J]. Chin J Chin Mater Med (中国中药杂志), 2014, 39: 5–9. |
| [3] | Krupp E. Screening of developmental toxicity-validation and productivity of the zebrafish embryotoxicity assay (ZETA) and strategies to optimize de-risking developmental toxicity of drug candidates[J]. Toxicol Lett, 2016, 258: S39. |
| [4] | Sarvaiya VN, Sadariya KA, Rana MP, et al. Zebrafish as model organism for drug discovery and toxicity testing[J]. Veter Clin Sci, 2014, 2: 31–38. |
| [5] | Ying HJ, Yatinesh K, Farooq SM, et al. Zebrafish:a versatile animal model for fertility research[J]. Biomed Res Int, 2016, 2016: 1–20. |
| [6] | Sun HY, Qin XL, Mei CY, et al. Metabolism study of the gallic acid and protocatechuic acid of effective fractions of Polygonum capitatum by model organism zebrafish[J]. Chin Pharmacol Bull (中国药理学通报), 2017, 33: 388–393. |
| [7] | Mei CY, Xiang WY, Hua Y, et al. Metabolism of three components of effective fractions of Polygonum capitatum in zebrafish[J]. Chin New Drugs J (中国新药杂志), 2016, 25: 2007–2013. |
| [8] | Zhao Q, Wang XJ, Ma J. Application of zebrafish in non-clinical drug toxicokinetics research[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2015, 29: 621–625. |
| [9] | Shen ZH, Yang LQ, Wu DS, et al. Method of chemical toxicity assessment based on zebrafish embryos[J]. Chin Tropical Med (中国热带医学), 2016, 16: 1159–1162. |
| [10] | Lantz-Mcpeak S, Guo X, Cuevas E, et al. Developmental toxicity assay using high content screening of zebrafish em-bryos[J]. J Appl Toxicol, 2015, 35: 261–272. DOI:10.1002/jat.v35.3 |
| [11] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic 2015(I) (中华人民共和国药典, 2015年版, 一部)[S]. Beijing: China Medical Science Press, 2015: 327-328. |
| [12] | National Center for ADR Monitoring. Be vigilant against liver injury caused by oral preparations of Zhuangguguanjie Pill[EB/OL]. China Food and Drug Administration, 2008[2008-08-09]. http://www.sda.gov.cn/WS01/CL0078/32614.html. |
| [13] | Li DM, Yin XF, Liu JH, et al. Experimental study on long-term toxicity with total flavonoids of epimedium in mice[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2008, 14: 60–62. |
| [14] | Li DM, Yin XF, Cai DW. Experimental study on acute toxicity with total flavonoids of epimedium in mice[J]. China Pharm (中国药师), 2007, 10: 1011–1012. |
| [15] | Jiang YR, Zhang ZH, Sun E, et al. Preparation of baohuoside I by enzymolysis of Epimedium flavonoids with β-glucosidase[J]. Chin Hosp Pharm J (中国医院药学杂志), 2013, 4: 260–263. |
| [16] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic 2015(I) (中华人民共和国药典, 2015年版, 一部)[S]. Beijing:China Medical Science Press, 2015:81-82. |
| [17] | Wang LJ, Sheng MY. The cytology, isozyme, HPLC finger-print, and interspecific hybridization studies of genus epimedium (berberidaceae)[J]. ISRN Pharm, 2013, 2013: 271578. |
| [18] | Huang MN, Zhou YN, Liu Q, et al. HPLC in simultaneous determination of seven main flavonoids in Epimedium of different places of origin[J]. Acad J Second Mil Med Univ (第二军医大学学报), 2015, 36: 1352–1355. DOI:10.3724/SP.J.1008.2015.01352 |
| [19] | Wei YJ, Li P, Fan HW, et al. Metabolite profiling of four major flavonoids of herba epimdii in zebrafish[J]. Molecules, 2012, 17: 420–432. DOI:10.3390/molecules17010420 |
| [20] | Mcrath P. Zafish:Mthods for Assessing Drug Safety and Toxicity[M]. Hoboken: John Wiley & Sons, 2011: 22. |
| [21] | Xu BJ, Zhang LJ, Li QC, et al. Model validation and evaluation of developmental toxicity do five drugs using zebrafish embryos[J]. Chin Pharmacol Bull (中国药理学通报), 2016, 1: 74–79. |
| [22] | Xu SJ, Zhu YL, Yu JQ, et al. Simultaneous determination of 4 prenylflavonoids of Chuankezhi injection in rat plasma by RRLC-MS/MS[J]. Acta Pharm Sin (药学学报), 2016, 51: 637–641. |
| [23] | Feng QR, Yu JQ, Zhan JJ, et al. In vivo metabolism study of Chuankezhi injection in rat[J]. Acta Pharm Sin (药学学报), 2017, 52: 449–455. |
 2018, Vol. 53
2018, Vol. 53


