2. 河南中医药大学 呼吸疾病诊疗与新药研发河南省协同创新中心, 河南 郑州 450046
2. Collaborative Innovation Center for Respiratory Disease Diagnosis and Treatment and Chinese Medicine Development of Henan Province, Henan University of Chinese Medicine, Zhengzhou 450046, China
随着年龄的增长, 卵巢功能衰竭和体内雌激素水平下降, 月经开始紊乱甚至闭经, 妇女逐渐进入围绝经期, 并伴随着一系列症状的发生, 如月经紊乱、情绪不稳定、潮红潮热、骨质疏松、老年痴呆和心血管疾病等[1]。起初, 通常选择补充人工合成雌激素来缓解由于雌激素水平降低而引起的症状, 但长期使用人工合成雌激素会诱发子宫内膜癌和乳腺癌等一系列疾病[2]。植物雌激素存在于天然植物中, 具有雌激素样作用, 因此植物雌激素便成为了研究热点, 雌激素替代疗法(estrogen replacement therapy, ERT)在治疗围绝经期症状方面也起到一定的作用[3]。植物雌激素不仅可以缓解由于雌激素水平下降而引起的各种症状, 同时还不具有长期使用人工合成雌激素所带来的不良反应。而小鼠子宫增重实验是检验物质雌激素样作用的“金标准”; 且人乳腺癌细胞(MCF-7)细胞是雌激素受体(ER)阳性的人乳腺癌细胞株, 能特异地受雌激素或雌激素样活性物质调节而增殖, 被广泛应用于体外大量并快速筛选植物雌激素。
本实验室前期研究发现, 山药水提物可以显著性增加小鼠子宫指数及促MCF-7细胞增殖, 具有雌激素样作用, 且山药(Dioscorea opposita Thunb.)是我国重要的药食兼用、高产、高效经济作物[4], 为滋补上品药材, 有健脾、补肺、固肾、益精之功效[5]。同时, 实验室从山药中能够分离得到含量较多的尿囊素。尿囊素是尿酸的衍生物, 实验和临床研究表明它具有角质松解、水合、麻醉镇痛、抗刺激物、促进上皮生长、抑菌等作用。尿囊素已用于手足皴裂、鱼鳞病、银屑病和多种角化性皮肤病[6], 且广泛应用于化妆品中[7]。但目前未见到关于尿囊素的雌激素样作用研究报道, 故本实验对尿囊素的雌激素样作用进行研究, 以期找到山药发挥雌激素样作用的物质基础。
材料与方法药品 尿囊素购自Sigma公司(25 g)。山药, 采自河南焦作温县, 经河南中医药大学陈随清教授和董诚明教授鉴定为薯蓣科植物薯蓣(Dioscorea opposita Thunb.)。新鲜山药去泥洗净, 切成薄片, 40 ℃烘干, 取干燥山药片100 g, 10倍水100 ℃煎煮1 h, 共3次, 合并3次滤液, 减压浓缩干燥得到山药水提物粉末16.3 g, 提取率为16.3%。本实验室前期从山药中分离得到尿囊素、熊果苷、烟酰胺、L-色氨酸、香草醇、对苯二酚和苯丙氨酸等化合物[8, 9], 其中尿囊素的含量较大, 约0.2%。
动物与细胞株 清洁级昆明种小鼠, 雌性, 出生21天(刚断乳), 体重9~12 g, 购于北京维通利华实验动物技术有限公司[许可证号: SCXK (京) 2016-0011]。MCF-7细胞购自中国医学科学院基础医学研究所细胞资源中心。
试剂与仪器 DMEM高糖培养基(Gibco Invitrogen公司); 去雌激素胎牛血清(广州四季青公司); 无酚红DMEM高糖培养基、葡聚糖-活性炭去激素胎牛血清(Hyclone公司); 17β-雌二醇(17β-E2, 细胞实验阳性药)、氨苄青霉素、Tris碱(Sigma公司); 戊酸雌二醇片(拜耳医药, Ev, 动物实验阳性药); EDTA、MTT及DMSO (Amresco公司); 雌二醇(E2)、黄体生成素(LH)、卵泡刺激素(FSH) ELISA试剂盒(R & D公司); ICI182, 780、MPP、THC、G15 (Tocris公司)。倒置显微镜(NIKON ECLIPSE TS100);二氧化碳培养箱(STIK公司); SORVALL ST16R Centrifuge高速低温冷冻离心机(Thermo Fisher Scientific公司); 酶标仪(BIO-RAD 680)、半干转膜仪(BIO-RAD公司); 超净工作台(江苏苏净集团); 电泳仪(北京六一公司); 化学发光仪(Beckman Coulter公司)。
小鼠子宫增重实验 将小鼠随机分组, 给药7天。正常组每日蒸馏水0.02 mL·g-1灌胃; 阳性对照组隔日戊酸雌二醇(0.33 mg·kg-1·d-1)灌胃; 山药水提物按药典规定人用药量的20倍量×提取率, 配成混悬液, 每日0.02 mL·g-1灌胃; 尿囊素按照0.5、1 mg·(10 g)-1, 配成混悬液, 每日0.02 mL·g-1灌胃。末次给药24 h后, 摘眼球取血, 脱颈椎处死小鼠, 立即摘取子宫称重, 子宫指数=子宫湿重/体重×100%, 实验平行重复3次。
ELISA法检测血清E2、LH、FSH 小鼠摘眼球取血, 血液室温静置1 h后, 3 000 r·min-1离心10 min, 取上清。按照ELISA试剂盒说明书仔细操作。
细胞增殖实验 MCF-7细胞经含10%去雌激素胎牛血清的无酚红DMEM培养基培养1周后, 取对数生长期细胞, 以每毫升2×104个细胞接种于96孔板内, 每孔体积200 µL。培养24 h后, 换为含药培养液继续培养。37 ℃、5% CO2培养48 h后, 每孔加入MTT溶液(5 mg·mL-1) 20 µL, 继续培养4 h, 小心吸净培养液, 每孔加入DMSO 150 µL, 震荡10 min, 酶标仪490 nm下测定各孔吸光度值(A), 计算平均A值和细胞活力。实验平行重复3次。细胞活力=各组A值/正常组A值。
细胞增殖拮抗实验 CF-7细胞经含10%去雌激素胎牛血清的无酚红DMEM培养基培养1周后, 取对数生长期细胞, 以每毫升2×104个细胞接种于96孔板内, 每孔体积200 µL。培养24 h后, 加药干预48 h, 其中拮抗组在给药前2 h加雌激素受体阻断剂ICI182, 780 (1 μmol·L-1)、雌激素受体α阻断剂MPP(1 μmol·L-1)、雌激素受体β阻断剂THC (1 μmol·L-1)、膜受体GPR30阻断剂G15 (1 μmol·L-1)。同“细胞增殖实验”检测细胞活力。
Western bolt法检测ERα、ERβ和GPR30的表达 称取冻存于液氮中的子宫组织, 按照总蛋白提取试剂盒操作步骤提取各组子宫总蛋白, BCA蛋白定量试剂盒测定蛋白浓度, 经SDS-PAGE电泳分离后转移至PVDF膜上, 用5%脱脂奶粉封闭2 h, 加入一抗ERα (1: 1 000)、ERβ (1: 1 000)、GPR30 (1: 1 000)、β-actin (1: 1 000)。4 ℃孵育过夜, 加入二抗山羊抗兔(1: 2 000), 于37 ℃孵育1 h, ECL化学发光试剂盒显色, 采用化学发光仪采集蛋白条带, 并用Quantity One软件对蛋白条带进行分析。
统计学方法 实验数据以x±s表示, 用SPSS 20.0统计软件处理数据, 采用单因素方差分析(one-way ANOVA)进行组间差异的比较, 以P < 0.05为差异有显著性意义, 以P < 0.01为差异有极显著性意义。
结果 1 尿囊素对性未成熟雌性小鼠子宫指数的影响与正常组相比, 尿囊素低剂量及高剂量能显著诱导性未成熟雌性小鼠子宫指数的增加(34.11%、36.75%, P < 0.05)。同时, 作为阳性对照组的Ev及山药水提物显著诱导性未成熟雌性小鼠子宫指数的增加, 山药水提物还显著增加小鼠的体重增长率(P < 0.05或P < 0.01), 见表 1。
| Table 1 Effect on weight gain rate and uterus index of allantoin after 7 days oral administration on water extract of Dioscorea opposita Thunb. (Wd) and allantoin. n = 10, x±s. *P < 0.05, **P < 0.01 vs Con. Con: Control; La: Low dose of allantoin; Ha: High dose of allantoin; Ev: Estradiol valerate |
与正常组相比, 尿囊素能显著增加小鼠血清E2、FSH的水平(P < 0.05), 但基本不影响血清LH的水平。阳性对照组Ev及山药水提物显著增加E2和FSH的水平, 且Ev显著增加了小鼠血清LH水平(P < 0.01), 见表 2。
| Table 2 Effect on E2, FSH and LH of after 7 days oral administration on Wd and allantoin. n = 10, x±s. *P < 0.05, **P < 0.01 vs Con |
Western blot结果显示, 尿囊素可以显著增加子宫ERα和GPR30的表达, 却对ERβ的表达影响较小。阳性对照组Ev及山药水提物则显著增加子宫ERα、ERβ和GPR30表达(P < 0.01), 如图 1。
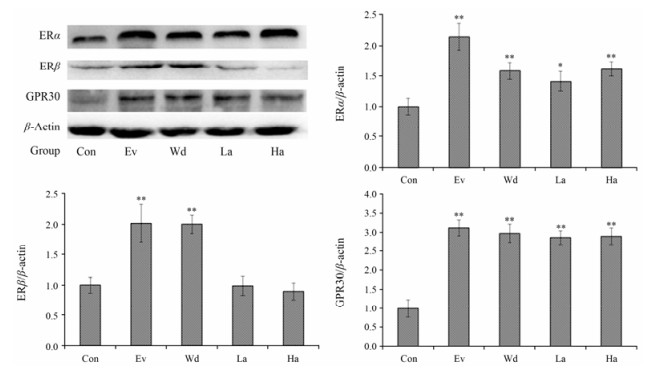
|
Figure 1 Effect on the expression of ERα、ERβ and GPR30 in uterus after 7 days oral administration on Wd and allantoin. n = 3, x±s. *P < 0.05, **P < 0.01 vs Con |
各浓度尿囊素组与正常组比较, 对MCF-7细胞有显著的促增殖作用(P < 0.05)。阳性对照组17β-E2及山药水提物对MCF-7细胞也具有明显的促增殖作用(P < 0.05或P < 0.01), 见表 3。
| Table 3 Effect on MCF-7 cell proliferation culturing with Wd and allantoin for 24 h. n = 4, x±s. *P < 0.05, **P < 0.01 vs Con |
与对照组相比, 5 μmol·L-1尿囊素可以显著促进MCF-7细胞增殖, 且可被雌激素受体阻断剂ICI182, 780 (1 μmol·L-1)、雌激素受体α阻断剂MPP(1 μmol·L-1)、膜受体阻断剂G15 (1 μmol·L-1)所拮抗, 但不被雌激素受体β阻断剂THC (1 μmol·L-1)拮抗。阳性对照组17β-E2及山药水提物对MCF-7细胞的促增殖作用可被以上4种阻断剂拮抗(图 2)。
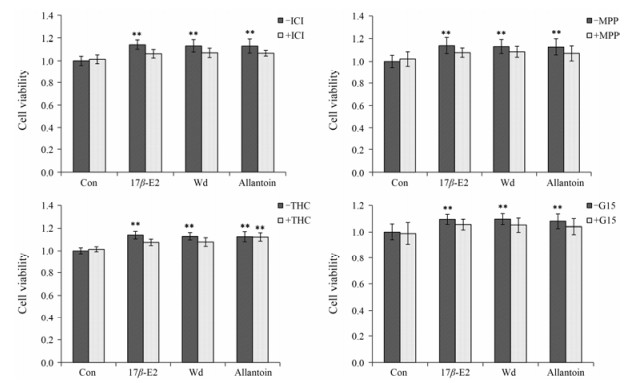
|
Figure 2 Effect of ICI182, 780 (ICI), MPP, THC and G15 on MCF-7 cell proliferation. n = 4, x±s. **P < 0.01 vs Con |
围绝经期综合症是妇女绝经前后的常见病, 严重影响患者的身心健康及日常生活。其症状出现的主要原因是雌激素的降低和缺乏, 而ERT可缓解或改善围绝经期综合症症状。但ERT可导致乳腺癌、子宫内膜癌、心血管疾病的风险增加, 因此寻找有效、不良反应小的治疗药物是妇科用药的努力方向。植物雌激素是指某些能结合并激活哺乳类动物及人类的雌激素受体, 从而具有雌激素样或抗雌激素样活性的植物成分[10]。由于其作用具有靶向性, 目前研究者将其称之为选择性雌激素受体调节剂(selective estrogen receptor modulators, SERMs)[11]。根据其作用特点, 植物雌激素有望成为治疗围绝经期综合症的潜在药物[12, 13]。
课题组前期研究发现, 山药水提物具有雌激素样作用, 但其发挥雌激素样作用的物质基础尚不明确。本实验室对山药进行了系统的化学成分分离, 获取了大量化合物, 其中, 尿囊素是其含量较大的成分, 但其是否为山药发挥雌激素样作用的物质基础尚未可知, 故本实验对尿囊素的雌激素样活性进行研究。
小鼠子宫增重实验[14, 15]是最早建立的检测雌激素活性的经典方法, 主要通过测定外来雌激素对实验小鼠是否具有促进子宫生长的作用来评价雌激素样活性。实验结果显示:与正常组相比, 山药水提物及尿囊素低、高剂量, 均能显著诱导性未成熟小鼠子宫指数的增加, 且尿囊素高剂量对子宫指数的诱导作用最为明显, 提示尿囊素在体内具有雌激素样作用且呈现一定的剂量依赖关系。同时, 山药水提物和尿囊素可以显著性增加未成熟雌性小鼠的血清E2和FSH水平。E2是体内主要由卵巢成熟滤泡分泌的一种天然雌激素, 可以调节女性性器官及副性征发育; FSH是垂体前叶嗜碱性细胞分泌的一种激素, 主要作用为促进卵泡成熟, 促进整个卵巢长大。故推测山药水提物和尿囊素增加小鼠子宫指数发挥雌激素样活性可能与其增加体内E2及FSH的水平有关[16, 17]。
MCF-7细胞是ER阳性的人乳腺癌细胞株, 能特异地受雌激素或雌激素样活性物质调节而增殖, 被广泛应用于体外大量并快速筛选和评价环境雌激素和植物雌激素[18-20]。本研究采用MCF-7细胞增殖实验, 观察了山药水提物及尿囊素对细胞增殖的影响, 评价其体外雌激素样活性。实验结果显示, 山药水提物(10-2mg·mL-1)及尿囊素(2、4、6、8、10 μmol·L-1)均能明显促进MCF-7细胞增殖, 提示山药水提物及尿囊素在体外具有雌激素样作用。但尿囊素促MCF-7细胞增殖在1~10 μmol·L-1内未呈现良好的量效关系, 可能与尿囊素浓度梯度较小有关。
雌激素发挥作用的重要途径是与ER结合, ER则包括经典的核受体与膜受体。其中, 雌激素核受体主要有2种亚型(ERα和ERβ), 核受体会与雌激素或具有雌激素样活性的物质结合, 发生二聚化, ER二聚体与雌激素效应基因上调节区的雌激素应答元件(estrogen response element, ERE)结合, 启动转录起始位点进行转录[21, 22]。同时, 近年来对雌激素膜受体GPR30进行了深入研究, 雌激素可以通过GPR30快速激活细胞内的第二信号系统[23], 间接调节一系列基因转录, 在多种细胞类型中发挥生物学效应。
为了确定山药水提物及尿囊素究竟是通过何种雌激素受体发挥作用的, 本课题组做了相关的拮抗实验及Western blot。雌激素受体通过其独特的信号转导方式调控细胞中基因与蛋白的表达, 影响细胞生长发育, 但当其作用被相应的雌激素受体阻断剂拮抗时, 具有雌激素样作用的药物对细胞的增殖作用即减弱。其中, MPP、THC和G15分别是特异性的ERα[24]、ERβ[25]和GPR30[26]阻断剂, 尿囊素与其共同作用时, 发现ICI182, 780、MPP及G15可以显著抑制MCF-7细胞的增殖, THC却不能抑制MCF-7细胞的增殖; Western blot结果显示尿囊素显著增加小鼠子宫ERα和GPR30的表达, 但对ERβ的表达影响较小, 以上结果提示尿囊素发挥雌激素样作用是由雌激素受体ERα、GPR30介导的。尿囊素增加小鼠子宫重量可能与其增加ERα、GPR30的表达有关; 然而, 阳性药Ev及山药水提物也增加ERα、ERβ、GPR30的表达, 但Ev使小鼠子宫增重的幅度远大于山药水提物和尿囊素, 且Ev组小鼠子宫出现了明显的水肿, 推测阳性药与山药和尿囊素的作用机制不同。查阅文献发现Ev显著增加小鼠子宫重量可能还与其促进小鼠子宫中血管内皮生长因子表达, 诱导血管生成及抑制细胞凋亡有关[27]。
综上所述, 尿囊素显著诱导性未成熟小鼠子宫指数的增加, 促进子宫ERα和GPR30的表达, 升高小鼠血清E2及FSH水平, 促进MCF-7细胞增殖, 且增殖作用能被ICI182, 780、MPP和G15拮抗, 表明尿囊素具有雌激素样活性, 且由ERα和GPR30介导。实验室前期研究发现山药具有雌激素样作用, 本实验证明尿囊素也具有雌激素样作用, 且尿囊素为山药中含量较大的成分之一, 故推测尿囊素是山药发挥雌激素样作用的物质基础之一。植物雌激素由于其作用特点, 是治疗围绝经期综合症的潜在药物。尿囊素具有雌激素样活性, 且不具有人工合成雌激素的不良反应, 有望用于临床, 但仍需要大量的前瞻性、随机、对照的临床研究。
| [1] | Zhang ZH, Li J. Treatment of perimenopausal syndrome[J]. Prog Mod Biomed (现代生物医学进展), 2011, 11: 3580–3582. |
| [2] | Zhang QY. Explore health education on clinic patients with perimenopausal syndrome quality of life[J]. Nei Mongol J Tradit Chin Med (内蒙古中医药), 2010, 29: 116–117. |
| [3] | Xu Y. Treatment of perimenopausal syndrome with estro-gen replacement therapy[J]. Med Inform (医学信息), 2011, 24: 4323–4324. |
| [4] | Xiao J, Zhu MJ. Analysis of different cultivars of Chinese yam by Raman spectroscopy[J]. Her Med (医药导报), 2003, 32: 1641–1645. |
| [5] | Sun XS, Xie B. Advances in pharmacological effects of yam[J]. Tradit Chin Drug Res Clin Pharm (中药新药与临床药理), 2011, 22: 353–355. |
| [6] | Gu WZ, Qin WZ. The role of allantoin and its clinical application[J]. Chin J New Drugs Clin Remedies (新药与临床), 1990, 12: 232–234. |
| [7] | Peng DZ, Wu XG. Development and clinical efficacy of allantoin lipositis[J]. Northwest Pharm J (西北药学杂志), 2003, 14: 265–266. |
| [8] | Feng WS, Li F, Guo MH. Studies on chemical constituents of yam[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2017, 19: 658–662. |
| [9] | Feng WS, Li F, Guo MH. A new pyrazine derivative from Dioscorea opposite Thunb[J]. Acta Pharma Sin (药学学报), 2017, 52: 1299–1301. |
| [10] | Zhu DN, Wang L, Wang ST, et al. Advances in studies on phytoestrogens[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 1422–1429. |
| [11] | Shi SF, Yu CQ. Advances in research on plant estrogens and their targets[J]. J Integ Med (中西医结合学报), 2005, 7: 78–80. |
| [12] | Wang H, Yang HX. Research progress of phytoestrogen therapy for perimenopausal syndrome[J]. Hebei J Tradit Chin Med (河北中医), 2012, 34: 940–942. |
| [13] | Ni JP, Sun HY. Research progress on the role of plant estrogens in perimenopausal women's health care[J]. Chin Gen Pract (中国全科医学), 2008, 6: 360–362. |
| [14] | Hao QX, Wang JF, Niu JZ, et al. Study the compatibility of estrogen-like effects in Siwu Tang plants by mouse uterine weight gain experiment[J]. Beijing J Tradit Chin Med (北京中医药大学学报), 2009, 28: 383–386. |
| [15] | Shelby MD, Newbold RR, Tully DB, et al. Assessing environmental chemicals for estrogenicity using a combination of in vitro and in vivo assays[J]. Environ Health Perspect, 1996, 104: 1296–1300. DOI:10.1289/ehp.961041296 |
| [16] | Deng R, Cai MS, Li YJ. Relationship between serum luteinizing hormone, estradiol and follicle-stimulating hor-mone levels and polycystic ovary syndrome[J]. Clin Med Engin (临床医学工程), 2016, 23: 1521–1522. |
| [17] | Gao LT, Zhou LT, Wang JL. Research progress of long-acting follicle stimulating hormone[J]. Chin J New Drugs (中国新药杂志), 2014, 23: 2418–2423. |
| [18] | Soto AM, Sonnenschein C, Chung KL, et al. The E-SCREEN assay as a tool to identify estrogens:an update on estrogenic environmental pollutants[J]. Environ Health Perspect, 1995, 103: 113–116. DOI:10.1289/ehp.95103s7113 |
| [19] | Saarinen NM, Bingham C, Lorenzetti S, et al. Tools to evaluate estrogenic potency of dietary phytoestrogens:a consensus paper from the EU Thematic Network 'Phytohealth'[J]. Genes Nutr, 2006, 12: 143–158. |
| [20] | Maras M, Vanparys C, Muylle F, et al. Estrogen-like properties of fluorotelomer alcohols as revealed by MCF-7 breast cancer cell proliferation[J]. Environ Health Perspect, 2006, 114: 100–105. DOI:10.1289/ehp.8149 |
| [21] | Erin K, Shanle, Xu W. Endocrine disrupting chemicals targeting estrogen receptor signaling:identification and mechanisms of action[J]. Chem Res Toxicol, 2011, 24: 619–621. |
| [22] | Leclercq G, Cremoux PD, This P, et al. Lack of sufficient information on the specificity and selectivity of commercial phytoestrogens preparations for therapeutic purposes[J]. Maturitas, 2011, 68: 56–64. DOI:10.1016/j.maturitas.2010.10.003 |
| [23] | Chetana M, Revankar, Daniel F, et al. A transmembrane intracellular estrogen receptor mediates rapid cell signaling[J]. Science, 2005, 307: 1625–1630. DOI:10.1126/science.1106943 |
| [24] | David S, Jean T. Estrogen regulation and ion dependence of taurine uptake by MCF-7 human breast cancer cells[J]. Cell Mol Biol Lett, 2007, 12: 2177–2183. |
| [25] | Watanabe K, Motoya E, Matsuzawa N. Marijuana extracts possess the effects like the endocrine disrupting chemicals[J]. Toxicology, 2004, 206: 471–478. |
| [26] | Chen Y, Duan HY, Wang J. Baicalein, unlike 4-hydroxyta-moxifen but similar to G15, suppresses17β-estradiol-induced cell invasion, and matrix metalloproteinase-9 expressionand activation in MCF-7 human breast cancer cells[J]. Oncol Lett, 2017, 14: 1823–1830. DOI:10.3892/ol.2017.6298 |
| [27] | Gui YT, Yu J, Cai ZM. Homone regulation of the expression of vascular endothelial growth factor and its receptors in mouse uterus[J]. J Peking Univ (Health Sci) (北京大学学报医学版), 2005, 37: 501–503. |
 2018, Vol. 53
2018, Vol. 53


