2. 中国药科大学 药学院, 江苏 南京 211198
2. School of Pharmacy, China Pharmaceutical University, Nanjing 211198, China
紫杉烷类药物是新一代抗肿瘤药物, 主要包括紫杉醇和多烯紫杉醇(图 1)。目前上市制剂均为注射剂, 主要有泰索(Taxol)、泰索帝(Taxotere)和Abraxane (表 1)等, 临床广泛用于卵巢癌、乳腺癌、非小细胞肺癌及头颈癌等恶性肿瘤的治疗[1, 2]。尽管上市制剂具有理想的抗肿瘤效果, 但泰索和泰索帝均采用50%表面活性剂和50%无水乙醇增溶药物, 注射后会产生严重的过敏反应、体液潴留及周围神经病变等不良反应[3-5]。Abraxane制剂虽然不含表面活性剂和无水乙醇, 避免了二者带来的不良反应。但是, Abraxane制剂的制备工艺复杂、技术要求高和价格昂贵, 不利于推广, 且注射给药后会产生严重超敏反应[6]。此外, 对于需要长期治疗的癌症患者, 频繁注射给药增加了治疗的不方便性。因此, 避免注射给药, 开发高效、低毒的口服制剂不失为一个理想的制剂开发方案。由于紫杉烷类药物较差的水溶性和渗透性, 开发成口服制剂存在较大困难。因此, 本文结合近几年的相关文献研究及课题组对该方向的研究成果与思考, 从改善水溶性和渗透性角度出发, 为紫杉烷类药物口服固体制剂开发提供针对性的策略。
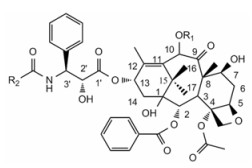
|
Paclitaxel: R1= CH3CO; R2=Ph Docetaxel: R1=H; R2=OC(CH3)3 Figure 1 Structures of paclitaxel and docetaxel |
| Table 1 Marketed products of taxanes |
紫杉烷类药物目前研究及应用最多的主要有紫杉醇和多烯紫杉醇两种。其中, 紫杉醇最初是从植物太平洋红豆杉(Taxus brevifolia)树皮中提取得到[7], 外观为白色或类白色粉末, 分子式为C47H51NO14, 油水分配系数(oil-water partition coefficient, log P)大约为4.0, 脂溶性高[8]。多烯紫杉醇则是欧洲红豆杉(Taxus baccata)针叶中提取的紫杉醇的半合成产物[9], 外观为白色粉末, 分子式为C43H53NO14, log P大约为3.06, 脂溶性高[10]。该类药物具有广谱抗癌活性, 目前已成为治疗卵巢癌、乳腺癌和非小细胞肺癌等恶性肿瘤的一线药物, 其独特的抗肿瘤机制为:通过促进微管蛋白聚合, 稳定微管结构, 使微管细胞在有丝分裂时不能形成正常的有丝分裂纺锤体, 抑制细胞的分裂和增殖, 从而使微管的解聚过程受阻, 最终发挥抗肿瘤作用[11]。
1.2 低水溶性紫杉醇和多烯紫杉醇分子结构中含有较多的疏水基团, 在水中的溶解度仅为0.25和6.5 μg·mL-1, 难以制备成口服制剂, 即便制备成注射剂等液体制剂, 也需要加入大量表面活性剂或有机溶剂进行增溶, 其较低的成药性不能满足临床用药需求[12, 13]。药物在体内的吸收主要包括两个过程:首先, 药物必须从制剂释放到消化液中, 即药物的溶解和溶出过程; 其次, 溶出的药物透过胃肠道上皮细胞进入血液循环的过程, 即渗透过程。成功的口服制剂, 必须具备理想的药物溶出与释药特性。所以, 通过一定手段改善紫杉烷类药物的水溶性是将该类药物开发成口服固体制剂的必要前提。
1.3 低渗透性药物渗透性反映了药物透过胃肠上皮细胞的能力, 对药物的体内吸收有着显著的影响。一般来说, 具有较大log P值的药物往往具有较强的脂溶性, 从而具有较好的胃肠渗透性。紫杉醇和多烯紫杉醇的log P > 3, 理论上应具有较好的脂溶性和胃肠渗透性。然而, 紫杉醇和多烯紫杉醇被报道渗透性较差[人结肠腺癌细胞(human colon adenocarcinoma cells, Caco-2细胞)模型测定渗透性系数值分别约为0.17×10-6和0.7×10-6 cm·s-1][14], 在生物药剂学分类系统(biopharmaceutical classification system, BCS)中属于Ⅳ类[15]。研究发现, 紫杉醇和多烯紫杉醇均是P-糖蛋白(P-glycoprotein, P-gp)的底物, 进入细胞后会被P-gp识别并排回管腔[16, 17]。在疾病的治疗过程中, 胃肠上皮细胞内P-gp的过度表达可以显著减少细胞内紫杉烷类药物的蓄积, 被认为是紫杉烷类药物渗透性差的主要原因[18]。因此, 采用一定手段抑制P-gp的过度表达可以改善紫杉烷类药物的胃肠渗透性。
综上, 紫杉烷类药物来源广泛, 具有广谱抗癌活性, 临床上表现出了良好的治疗效果。与目前注射给药相比, 开发成口服制剂有助于提高患者用药的顺应性并降低治疗成本。然而, 作为BCS Ⅳ类药物, 低水溶性和低渗透性是影响其体内吸收的主要因素[15], 限制了口服制剂的开发。
2 低水溶性改善策略 2.1 化学手段 2.1.1 制备衍生物药物的化学结构修饰是基于药物原有的基本化学结构, 仅对其中某些官能团进行化学修饰, 从而改变原有药物的理化性质。根据紫杉醇结构特点, 将C10位和C13位酯侧链的CH3CO-基团和C6H5-分别替换为H-和(CH3)3CO-基团, 从而得到多烯紫杉醇是目前最成功的衍生物制备方法[19], 溶解度由紫杉醇的0.25 μg·mL-1显著提高至6.5 μg·mL-1。然而, 即便如此, 多烯紫杉醇仍然属于难溶性药物的范畴, 难以满足口服制剂的开发需求, 临床注射剂中依然需要加入50% Tween 80和50%无水乙醇进行增溶。针对多烯紫杉醇目前尚无理想的衍生物制备策略以进一步改善其水溶性。
2.1.2 制备前体药物前体药物是活性药物与其他化合物通过化学交联所形成的无活性共轭物, 在体内经酶解或水解后解离出原药物以发挥药效。对于难溶性药物, 可通过引入亲水基团的方式制备成前体药物, 从而提高溶解度。紫杉烷类药物化学结构中的C2'活性基团因空间位阻小、酯化后在体内易水解等优点而成为引入亲水基团的首选位点[20, 21]。前体药物的亲水性载体材料主要有两种:第一种是以亲水性小分子为载体, 包括磷酸盐类、磺酸盐、羧酸盐类、氨基酸轭合物及糖基衍生物等。Ma等[22]将具有不同取代基的4-二甲基氨基吡啶结合到多烯紫杉醇的C2'位点形成前体药物LK-193~LK-196。溶解度结果表明, 各种前体药物中多烯紫杉醇的水溶性均显著提高, 其中LK-196中多烯紫杉醇的溶解度高达12.4 mg·mL-1, 且对小鼠体内肿瘤的生长具有显著抑制作用。第二种是以亲水性高分子聚合物为载体, 包括透明质酸、聚乙二醇类、聚L-谷氨酸等。Louage等[23]通过药物接枝方法将2-(丁基硫代)丙酸连接到紫杉醇(paclitaxel, PTX)的C2'位, 然后将该聚合物与亲水性聚合物N, N-二甲基丙烯酰胺的聚合物(polyDMA30)组装成PTX-polyDMA30前体药物。该前体药物中的紫杉醇不仅具有良好的水溶性(约0.63 mg·mL-1), 而且具有较高的载药量(21%)和稳定性。此外, Louage等[23]还考察了该前体药物在人卵巢癌细胞中的活性, 结果表明, PTX-polyDMA30的半抑制浓度(half maximal inhibitory concentration, IC50)与Abraxane的IC50无显著差异, 说明该前体药物中聚合物对紫杉醇结构中C2'位上羟基的活性无影响。这种通过引入亲水性聚合物来增加紫杉烷类药物水溶性的方法, 可避免在制剂中使用表面活性剂(Tween 80、聚氧乙烯蓖麻油)和无水乙醇, 从而减少不良反应的发生。但是, 较低的载药量及较高的制备成本依然限制了以聚合物为载体的前体药物的广泛应用。
2.2 制剂手段 2.2.1 常规制剂手段目前, 改善紫杉烷类药物水溶性的制剂手段通常是将药物包裹于辅料分子的结构中, 借助辅料分子的亲水特性而达到增溶目的, 如β-环糊精包合物[24]、微球[25]、脂质体[26]和胶束[27]等。
环糊精及其衍生物具有“内腔疏水、外壁亲水”的特殊结构, 可以很好地将紫杉烷类药物包裹起来, 使药物分子呈现高度分散性, 并提高药物的水溶性。该方法避免了表面活性剂的使用, 具有重要的研究价值。Shah等[24]采用改良的共溶剂冻干法将紫杉醇包裹在多种β-环糊精衍生物中, 制备成分子包合物。结果表明, 包合物中紫杉醇在水中的溶解度提高至0.2 mg·mL-1。然而, β-环糊精增加药物溶解度的作用通常具有一定的用量范围, 当制剂处方添加了其他药用辅料时, 为达到相同的增溶效果, β-环糊精的用量需重新优化[28]。Pooja等[29]将紫杉醇、多烯紫杉醇分别载于D-α-生育酚聚乙二醇琥珀酸酯(D-α-tocopherol polyethylene glycol succinate, TPGS)中, 溶解度结果表明, 胶束中紫杉醇和多烯紫杉醇的溶解度分别提高了约20倍和34倍。然而, 胶束、脂质体、包合物等剂型通常为液体, 在长时间放置后可能存在粒子聚集和沉淀等问题。
2.2.2 制剂晶体学策略 2.2.2.1 无定形技术与晶体药物相比, 无定形药物(amorphous drug)具有长程无序、短程有序的内部结构, 及较大的单位表面自由能。无定形药物粒子表面易水化, 水化膜的反絮凝作用使药物更易分散, 增大药物粒子与溶剂的接触面积进而改善难溶性药物的水分散性或溶出速率, 最终提高其口服生物利用度。但无定形处于热力学高能态, 在制备、储存和给药等过程中极易发生转晶, 存在较为严重的稳定性问题。将难溶性药物均匀分散于无定形聚合物中制备成无定形固体分散体, 利用载体材料的抑晶作用和较高的玻璃化转变温度(glass transition temperature, Tg), 可使无定形药物稳定存在。无定形固体分散体在接触胃肠液后迅速溶出, 能显著改善药物的溶解特性。Lim等[30]采用冷冻干燥技术将多烯紫杉醇与聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物按照重量比1: 10制备成无定形固体分散体, 并考察了多烯紫杉醇晶体、无定形和无定形固体分散体的溶解度。结果表明, 在pH 6.8磷酸盐缓冲液中, 多烯紫杉醇无定形(3.6 μg·mL-1)与其晶体(3.9 μg·mL-1)具有相近的溶解度, 而无定形固体分散体中多烯紫杉醇的溶解度(362.9 μg·mL-1)是其晶体的93倍。此外, 无定形固体分散体的制备工艺亦会对其稳定性有较大影响, 如冷冻干燥法过程缓慢, 水分子进入无定形固体分散体内部, 可能打破活性药物与辅料之间的分散性或氢键等相互作用, 从而降低无定形态的稳定性。Sawicki等[31]研究发现采用冷冻干燥法将多烯紫杉醇晶体与聚乙烯咯吡烷酮、十二烷基磺酸钠制备而得的无定形固体分散体在放置13个月后存在转晶现象, 而采用喷雾干燥法将上述物料制备成的无定形固体分散体具有良好的物理稳定性(24个月内未出现转晶现象)。目前, 制备成无定形固体分散体可以改善药物溶出速率, 是提高无定形药物稳定性的有效手段。然而, 该技术具有明显缺陷, 突出表现在无定形固体分散体的制备通常需要10倍以上药物量的无定形聚合物, 这将显著降低制剂载药量、增加制剂的体积和重量。
2.2.2.2 共晶和共无定形技术药物共晶(pharmaceutical cocrystal)是活性药物成分(active pharmaceutical ingredient, API)与配体(coformer)在氢键或其他非共价键作用下, 以固定化学计量比结合而成的晶体, 如图 2A。共晶作为药物的一种固体形态, 可以在不改变药物化学结构的前提下显著改善药物的物理性质, 如:溶解度、分散速率和稳定性等。目前, 通过制备药物共晶以改善原药物溶解度和溶出速率的研究已成为制剂晶体学研究热点[32-34]。Goud等[35]通过加液研磨法成功制备出呋塞米-胞嘧啶、呋塞米-腺嘌呤以及呋塞米-咖啡因共晶, 结果表明, 3种共晶在水中的溶解度均显著高于呋塞米晶体, 溶出速率大约是呋塞米晶体的2倍。

|
Figure 2 Single-phase system of active pharmaceutical ingredient (API) molecule with coformer in a certain stoichiometric ratio: cocrystal (A) and coamorphous (B) |
与共晶相似, 药物共无定形(pharmaceutical coamorphous)也是由活性药物成分与配体在氢键或其他非共价键作用下, 以固定化学计量比结合而成, 如图 2B。共无定形药物存在以下优势: ①共无定形的形成原理与共晶相似, 克服了药物成盐的局限性; ②共无定形本质上为无定形态, 因而具有无定形显著增加难溶性药物的溶解度和溶出速度的优势; ③共无定形中活性药物和配体可能存在相互作用力, 克服了无定形易转晶的缺点, 增加了无定形态的稳定性; ④参与形成共无定形的配体往往是小分子药物或辅料, 克服了无定形固体分散体中使用大量聚合物而导致载药量低和制剂服用难的应用局限。目前已有较多研究证实了利用该技术制备的药物共无定形显著提高药物的溶解度和溶出速率[36-38], 是一种极具发展前景的制剂新技术。Yamamoto等[39]通过机械研磨法和溶液冷却法分别制备出伊曲康唑-富马酸共无定形和伊曲康唑-富马酸共晶, 并考察了二者在水性介质中的溶解度。结果表明, 共无定形和共晶中伊曲康唑的溶解度均得到显著提高, 且共无定形中伊曲康唑的溶解度是共晶的5倍。此外, 伊曲康唑-富马酸共无定形与其共晶同样具有良好的物理化学稳定性。
理论上, 紫杉醇与多烯紫杉醇等紫衫烷类药物具备制备成共晶或共无定形的分子结构特点。如图 1所示, 紫杉醇和多烯紫杉醇的分子结构中存在多个氢受体(C=O)和氢供体(-NH和-OH)基团。一般来说, 药物分子间形成氢键等作用力有助于形成共晶或共无定形以及提高该体系的稳定性。根据氢键形成经验规则[40], 分子中存在的氢供体和氢受体具有较强的形成氢键的趋势并优先参与氢键的形成。所以, 紫杉烷类药物既可以和氢供体化合物, 也可以和氢受体化合物形成氢键, 具有广泛的配体选择范围, 通过合适的制备技术能最终形成共晶或共无定形。
基于上述思路, 作者所在课题组采用减压旋转蒸发法成功制备了多烯紫杉醇-杨梅素共无定形[41]和多烯紫杉醇-烟酰胺共无定形, 热分析技术和X射线衍射技术证实所得产物为单相无定形二元体系, 傅里叶红外光谱技术和固态核磁共振技术表明两种共无定形的内在结构含有分子间氢键, 如图 3。溶解度结果表明, 在0.01 mol·L-1盐酸溶液中, 两种共无定形中多烯紫杉醇的溶解度较其晶体均得到显著提高, 分别提高了3.4倍和3.8倍。此外, 特性溶出实验结果表明, 两种共无定形中多烯紫杉醇的特性溶出速率也得到了显著提高, 由多烯紫杉醇晶体的0.005 1 mg·cm-2·min-1分别提高至0.019 3和0.023 2 mg·cm-2·min-1, 且60 min内未发生转晶, 在水性介质中具有较好的物理稳定性。一般来说, 较高的溶解度和较快的溶出速率可使药物在服用后更快地发挥治疗作用。因此, 共晶和共无定形作为药物的固体形态之一, 在紫杉烷类药物固体制剂的开发中具有显著的优势。
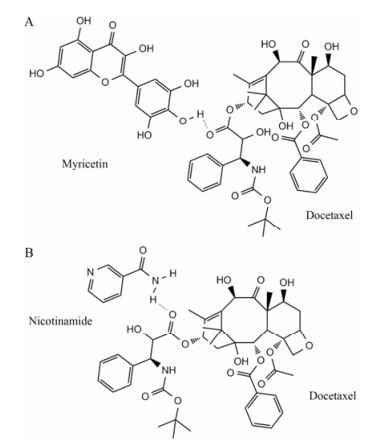
|
Figure 3 The inter-molecular hydrogen bond in the structure of coamorphous docetaxel-myricetin (A) and coamorphous docetaxel-nicotinamide (B) |
以化学修饰方法对紫杉烷类药物进行有目的的结构修饰, 不仅可以改善其水溶性, 还可以改善其在胃肠上皮细胞的渗透性。Louage等[23]通过药物接枝方法制备的前体药物PTX-polyDMA30不仅具有良好的水溶性, 而且其透过细胞膜的方式由膜渗透性转变为细胞的内吞作用, 这种透过细胞膜方式的改变可能会避免细胞膜上P-gp对紫杉烷类药物的外排, 延长药物在细胞内的停留时间。Teow等[42]以渗透促进剂月桂基链修饰的第三代聚酰胺(G3-PAMAM)为载体, 将戊二酸酐与紫杉醇连接成共轭物L6-G3-glu-pac。以Caco-2细胞和原代培养的猪脑内皮细胞为模型, 考察了L6-G3-glu-pac的细胞渗透性和细胞毒性。转运体实验结果表明:与紫杉醇相比, L6-G3-glu-pac在两种细胞中的渗透性均得到显著性提高(约12倍)。
3.2 联合P-gp抑制剂作为P-gp转运体的底物, 紫杉烷类药物具有较低的胃肠渗透性。为解决这一问题, 各种抑制剂相继被用于改善紫杉烷类药物的渗透性。近几年来, 被广泛研究的P-gp抑制剂主要包括辅料抑制剂、具有强抑制能力的新型合成抑制剂以及从植物中提取的天然产物抑制剂。
辅料抑制剂往往具有较低或不具有药理活性, 临床使用具有较高的安全性, 被广泛用于紫杉烷类药物的制剂开发。主要包括非离子型表面活性剂[43, 44]、聚乙二醇类[45]和壳聚糖衍生物[46]等。Varma等[47]考察了TPGS对紫杉醇渗透性和生物利用度的影响。结果发现0.002 mg·mL-1 TPGS可使紫杉醇在大鼠离体回肠的渗透性提高约4.7倍。
常用的新型抑制剂通常是早期所合成抑制剂的衍生物, 具有更强的抑制P-gp能力、更高的P-gp特异性以及更低的药理活性。主要有zosuquidar (LY335979)、elacridar (GF120918)、tariquidar (XR9576)[48]和HM30181[49]等。其中, HM30181较环孢素A、tariquidar (XR9576)、elacridar (GF120918)具有更强的P-gp抑制作用和P-gp特异性, 可以显著提高紫杉醇的体内吸收[50, 51]。然而, HM30181可能产生的胃肠道疾病也不能被忽视[52]。部分新型抑制剂与紫杉烷类药物联合应用已进入临床研究阶段, 这种组合的临床疗效有待在临床中进一步确定。
长久以来, 中药一直被用于肿瘤疾病的治疗, 具有低成本、低毒性和高安全性等诸多优点[53]。许多中药及其提取物具有较强的抑制P-gp的作用和P-gp特异性, 如人参皂苷[54]、雷公藤甲素[55]、姜黄素[56]、黄酮化合物[57, 58]及生物碱[59, 60]等。Yan等[61]考察了给予不同剂量的姜黄素对大鼠口服多烯紫杉醇后生物利用度的影响。结果表明, 姜黄素剂量在25~150 mg·kg-1内, 多烯紫杉醇的口服生物利用度得到显著性提高(高达3.8倍)。此外, 作者所在课题组以大鼠为模型, 考察了不同黄酮化合物(柚皮素、黄芩素、芹菜素、槲皮素、杨梅素)对多烯紫杉醇在体肠吸收和口服生物利用度的影响。结果表明, 不同黄酮化合物对多烯紫杉醇在体肠渗透系数和口服生物利用度有着不同程度的提高, 以杨梅素提高程度最为明显(分别提高了3.5倍和2.4倍)[62]。
3.3 制剂晶体学策略共晶或共无定形因具有显著提高药物溶解度的优点而被广泛研究, 同样该技术还可用于改善药物的渗透性, 这关键取决于对配体的选择, 早期研究多采用糖精[63]、烟酰胺[64]、异烟酰胺[65]和氨基酸[66]等化合物作为配体制备的共晶或共无定形仅能提高药物的溶解和溶出, 对药物的渗透性无任何帮助。
作者认为, 采用共晶或共无定形等制剂晶体学前沿技术改善药物渗透性可以通过选择具有P-gp抑制作用的相关配体加以实现, 如作者在前期工作中发现, 杨梅素可以通过抑制P-gp活性提高多烯紫杉醇的肠吸收和口服生物利用度, 且具备与多烯紫杉醇制备成共无定形的分子结构条件。在此基础上, 采用减压旋转蒸发技术, 成功将多烯紫杉醇与杨梅素制备成共无定形(专利申请号: 201710554273.4)。溶解度、溶出度及生物利用度研究表明, 所制备共无定形中多烯紫杉醇和杨梅素的溶解度和溶出速度分别提高了3.4倍和3.8倍。与大鼠口服多烯紫杉醇和杨梅素的物理混合物相比, 大鼠口服共无定形后多烯紫杉醇的最大血药浓度和口服生物利用度分别提高了3.9倍和3.3倍。此外, 共无定形中杨梅素的血药浓度也得到了显著提高(1.9倍)。以天然产物抑制剂作为配体与紫杉烷类药物制备成共晶或共无定形解决紫杉烷类药物的渗透性问题具备以下特点: ①天然产物来源广泛, 如黄酮类化合物结构中广泛含有氢供体和氢受体, 具备与紫杉烷类药物形成共晶或共无定形的分子结构特点, 数量众多, 筛选范围广; ②天然产物抑制剂更加安全、绿色环保, 符合当前“绿色化学”、“绿色制剂”理念; ③除改善渗透性外, 所形成的共晶或共无定形, 可以同时提高溶解度, 从改善溶出和渗透性两方面提高多烯紫杉醇的体内吸收; ④除具备P-gp抑制作用外, 如上所述的天然产物抑制剂还普遍具有抗肿瘤和抗炎等药理活性, 可以发挥与紫杉烷类药物的协同抗肿瘤作用; ⑤共晶和共无定形均为固态粉末, 有利于后续研究中口服固体制剂的开发。然而, 共晶和共无定形技术作为新兴技术还存在一些问题亟待解决, 如实现共晶及共无定形制备的产业化等问题还有待于进一步研究。
4 结语由于紫杉烷类药物具有较差的水溶性和胃肠渗透性, 如何将该类药物开发成口服制剂是目前面临的较大难题, 因此使得该类药物口服制剂的开发受到严重限制。本文从改善水溶性及渗透性角度探讨了可采用的相应技术策略, 为高水溶性、高渗透性、低不良反应及具有抗肿瘤协同作用的紫杉烷类药物的新型制剂带来希望, 如所探讨的利用天然产物P-gp抑制剂与紫杉烷类药物制备成共晶或共无定形的制剂晶体学策略不仅可以提高药物的水溶性和渗透性, 而且具有潜在的抗肿瘤药效协同作用, 为制剂学前沿技术, 具有广阔的开发前景。
| [1] | Clarke SJ, Rivory LP. Clinical pharmacokinetics of docetaxel[J]. Clin Pharmacokinet, 1999, 36: 99–114. |
| [2] | Rowinsky EK, Donehower RC. The clinical pharmacology of paclitaxel (Taxol)[J]. Semin Oncol, 1993, 20: 16–25. |
| [3] | ten Bokkel Huinink WW, Prove AM, Piccart M, et al. A phase Ⅱ trial with docetaxel (TaxotereTM) in second line treatment with chemotherapy for advanced breast cancer:a study of the EORTC Early Clinical Trials Group[J]. Ann Oncol, 1994, 5: 527–532. |
| [4] | Rowinsky EK, Cazenave LA, Donehower RC. Taxol:a novel investigational antimicrotubule agent[J]. J Natl Cancer Inst, 1990, 82: 1247–1259. |
| [5] | Fjällskog ML, Frii L, Bergh J. Is Cremophor EL, solvent for paclitaxel, cytotoxic?[J]. Lancet, 1993, 342: 873. |
| [6] | Fader AN, Rose PG. Abraxane for the treatment of gynecologic cancer patients with severe hypersensitivity reactions to paclitaxel[J]. Int J Gynecol Cancer, 2009, 19: 1281–1283. |
| [7] | Wani MC, Taylor HL, Wall ME, et al. Plant antitumour agents Ⅵ. The isolation and structure of Taxol, a novel antileukemic and antitumour agent from Taxus brevifolia[J]. J Am Chem Soc, 1971, 93: 2325–2327. |
| [8] | Surapaneni MS, Das SK, Das NG. Designing paclitaxel drug delivery systems aimed at improved patient outcomes:current status and challenges[J]. ISRN Pharmacol, 2012. DOI:10.5402/2012/623139 |
| [9] | Lavelle F, Bissery MC, Combeau C, et al. Preclinical evaluation of docetaxel (Taxotere)[J]. Semin Oncol, 1995, 22: 3–16. |
| [10] | Chen J. Preparation and Evaluation In Vitro of Docetaxel Oral Delivery System (多烯紫杉醇口服给药系统的制备及其体外评价)[D]. Hangzhou: Zhejiang University, 2007. |
| [11] | Schiff PB, Fant J, Horwitz SB. Promotion of microtubule assembly in vitro by taxol[J]. Nature, 1979, 277: 665–667. |
| [12] | Feng X, Yuan YJ, Wu JC. Synthesis and evaluation of water-soluble paclitaxel prodrugs[J]. Bioorgan Med Chem Lett, 2002, 12: 3301–3303. |
| [13] | Du W, Hong L, Yao T, et al. Synthesis and evaluation of water-soluble docetaxel prodrugs-docetaxel esters of malic acid[J]. Bioorg Med Chem, 2007, 15: 6323–6330. |
| [14] | Roger E, Kalscheuer S, Kirtane A, et al. Folic acid functionalized nanoparticles for enhanced oral drug delivery[J]. Mol Pharm, 2012, 9: 2103–2110. |
| [15] | Amidon GL, Lennernäs H, Shah VP, et al. A theoretical basis for a biopharmaceutic drug classification:the correlation of in vitro drug product dissolution and in vivo bioavailability[J]. Pharm Res, 1995, 12: 413–420. |
| [16] | Gallo JM, Li S, Guo P, et al. The effect of P-glycoprotein on paclitaxel brain and brain tumor distribution in mice[J]. Cancer Res, 2003, 63: 5114–5117. |
| [17] | Van Zuylen L, Verweij J, Nooter K, et al. Role of intestinal P-glycoprotein in the plasma and fecal disposition of docetaxel in humans[J]. Clin Cancer Res, 2000, 6: 2598–2603. |
| [18] | Brooks TA, Minderman H, O'Loughlin KL, et al. Taxane-based reversal agents modulate drug resistance mediated by P-glycoprotein, multidrug resistance protein, and breast cancer resistance protein[J]. Mol Cancer Ther, 2003, 2: 1195–1205. |
| [19] | Gueritte-Voegelein F, Guenard D, Lavelle F, et al. Relation-ships between the structure of taxol analogs and their antimitotic activity[J]. J Med Chem, 1991, 34: 992–998. |
| [20] | Mathew AE, Mejillano MR, Nath JP, et al. Synthesis and evaluation of some water-soluble prodrugs and derivatives of taxol with antitumor activity[J]. J Med Chem, 1992, 35: 145–151. |
| [21] | Nicolaou KC, Riemer C, Kerr MA, et al. Design, synthesis and biological activity of protaxols[J]. Nature, 1993, 364: 464–466. |
| [22] | Ma H, Chen G, Wang T, et al. Design, synthesis and biological evaluation of a novel water-soluble prodrug of docetaxel with amino acid as a linker[J]. Chem Biol Drug Des, 2016, 88: 363–369. |
| [23] | Louage B, Nuhn L, Risseeuw MDP, et al. Well-defined polymer-paclitaxel prodrugs by a grafting-from-drug approach[J]. Angew Chem Int Edit, 2016, 55: 11791–11796. |
| [24] | Shah M, Shah V, Ghosh A, et al. Molecular inclusion complexes of β-cyclodextrin derivatives enhance aqueous solubility and cellular internalization of paclitaxel:preformulation and in vitro assessments[J]. J Pharm Pharmacol, 2015, 2: 8. |
| [25] | Fan R, Wang Y, Han B, et al. Docetaxel load biodegradable porous microspheres for the treatment of colorectal peritoneal carcinomatosis[J]. Int J Biol Macromol, 2014, 69: 100–107. |
| [26] | Pereira S, Egbu R, Jannati G, et al. Docetaxel-loaded lipo-somes:the effect of lipid composition and purification on drug encapsulation and in vitro toxicity[J]. Int J Pharm, 2016, 514: 150–159. |
| [27] | Heredia V, Alasino RV, Leonhard V, et al. Sialoganglioside micelles for enhanced paclitaxel solubility:in vitro characterization[J]. J Pharm Sci, 2016, 105: 268–275. |
| [28] | Kurkov SV, Loftsson T. Cyclodextrins[J]. Int J Pharm, 2013, 453: 167–180. |
| [29] | Pooja D, Kulhari H, Singh MK, et al. Dendrimer-TPGS mixed micelles for enhanced solubility and cellular toxicity of taxanes[J]. Colloid Surf B Biointerfaces, 2014, 121: 461–468. |
| [30] | Lim SM, Pang ZW, Tan HY, et al. Enhancement of docetaxel solubility using binary and ternary solid dispersion systems[J]. Drug Dev Ind Pharm, 2015, 41: 1847–1855. |
| [31] | Sawicki E, Beijnen JH, Schellens JH, et al. Pharmaceutical development of an oral tablet formulation containing a spray dried amorphous solid dispersion of docetaxel or paclitaxel[J]. Int J Pharm, 2016, 511: 765–773. |
| [32] | Thakuria R, Delori A, Jones W, et al. Pharmaceutical cocrystals and poorly soluble drugs[J]. Int J Pharm, 2013, 453: 101–125. |
| [33] | Lu J, Rohani S. Preparation and characterization of theo-phylline-nicotinamide cocrystal[J]. Org Process Res Dev, 2009, 13: 1269–1275. |
| [34] | Alhalaweh A, Sokolowski A, Rodríguez-Hornedo N, et al. Solubility behavior and solution chemistry of indomethacin cocrystals in organic solvents[J]. Cryst Growth Des, 2015, 11: 3923–3929. |
| [35] | Goud NR, Gangavaram S, Suresh K, et al. Novel furosemide cocrystals and selection of high solubility drug forms[J]. J Pharm Sci, 2012, 101: 664–680. |
| [36] | Löbmann K, Grohganz H, Laitinen R, et al. Amino acids as co-amorphous stabilizers for poorly water soluble drugs-Part 1:preparation, stability and dissolution enhancement[J]. Eur J Pharm Biopharm, 2013, 85: 873–881. |
| [37] | Qian S, Li Z, Heng WL, et al. Charge-assisted intermolecular hydrogen bond formed in coamorphous system is important to relieve the pH-dependent solubility behavior of lurasidone hydrochloride[J]. Rsc Adv, 2016, 6: 106396–106412. |
| [38] | Gao Y, Liao J, Qi X, et al. Coamorphous repaglinide-saccharin with enhanced dissolution[J]. Int J Pharm, 2013, 450: 290–295. |
| [39] | Yamamoto K, Kojima T, Karashima M, et al. Physicochemical evaluation and developability assessment of co-amorphouses of low soluble drugs and comparison to the co-crystals[J]. Chem Pharm Bull, 2016, 64: 1739–1746. |
| [40] | Etter MC. Encoding and decoding hydrogen-bond patterns of organic compounds[J]. Acc Chem Res, 1990, 23: 120–126. |
| [41] | Hao TY. Studies of Flavonoids-Docetaxel Coamorphous (黄酮化合物-多烯紫杉醇共无定形的研究)[D]. Nanjing: China Pharmceutical University, 2017. |
| [42] | Teow HM, Zhou Z, Najlah M, et al. Delivery of paclitaxel across cellular barriers using a dendrimer-based nanocarrier[J]. Int J Pharm, 2013, 441: 701–711. |
| [43] | Dintaman JM, Silverman JA. Inhibition of P-glycoprotein by D-α-tocopheryl polyethylene glycol 1000 succinate (TPGS)[J]. Pharm Res, 1999, 16: 1550–1556. |
| [44] | Zhang HJ, Yao M, Morrison RA, et al. Commonly used surfactant, Tween 80, improves absorption of P-glycoprotein substrate, digoxin, in rats[J]. Arch Pharm Res, 2003, 26: 768–772. |
| [45] | Sarisozen C, Vural I, Levchenko T, et al. PEG-PE-based micelles co-loaded with paclitaxel and cyclosporine A or loaded with paclitaxel and targeted by anticancer antibody overcome drug resistance in cancer cells[J]. Drug Deliv, 2012, 19: 169–176. |
| [46] | Dünnhaupt S, Barthelmes J, Rahmat D, et al. S-Protected thiolated chitosan for oral delivery of hydrophilic macromolecules:evaluation of permeation enhancing and efflux pump inhibitory properties[J]. Mol Pharm, 2012, 9: 1331–1341. |
| [47] | Varma MV, Panchagnula R. Enhanced oral paclitaxel absorption with vitamin E-TPGS:effect on solubility and permeability in vitro, in situ and in vivo[J]. Eur J Pharm Sci, 2005, 25: 445–453. |
| [48] | Fox E, Bates SE. Tariquidar (XR9576):a P-glycoprotein drug efflux pump inhibitor[J]. Expert Rev Anticancer Ther, 2007, 7: 447–459. |
| [49] | Abdallah HM, Alabd AM, Eldine RS, et al. P-glycoprotein inhibitors of natural origin as potential tumor chemo-sensitizers:a review[J]. J Adv Res, 2015, 6: 45–62. |
| [50] | Kwak JO, Lee SH, Lee GS, et al. Selective inhibition of MDR1(ABCB1) by HM30181 increases oral bioavailability and therapeutic efficacy of paclitaxel[J]. Eur J Pharmacol, 2010, 627: 92–98. |
| [51] | Lee HJ, Heo DS, Cho JY, et al. A phase I study of oral paclitaxel with a novel P-glycoprotein inhibitor, HM30181A, in patients with advanced solid cancer[J]. Cancer Res Treat, 2014, 46: 234–242. |
| [52] | Kim TE, Gu N, Yoon SH, et al. Tolerability and pharma-cokinetics of a new P-glycoprotein inhibitor, HM30181, in healthy Korean male volunteers:single-and multiple-dose randomized, placebo-controlled studies[J]. Clin Ther, 2012, 34: 482–494. |
| [53] | Bansal T, Jaggi M, Khar RK, et al. Emerging significance of flavonoids as P-glycoprotein inhibitors in cancer che-motherapy[J]. J Pharm Pharm Sci, 2009, 12: 46–78. |
| [54] | Yang LQ, Wang B, Gan H, et al. Enhanced oral bioavailability and anti-tumour effect of paclitaxel by 20(s)-ginsenoside Rg3in vivo[J]. Biopharm Drug Dispos, 2012, 33: 425–436. |
| [55] | Zhang H, Ya G, Rui H. Inhibitory effects of triptolide on human liver cytochrome P450 enzymes and P-glycoprotein[J]. Eur J Drug Metab Pharmacokinet, 2017, 42: 89–98. |
| [56] | Sahu BP, Hazarika H, Bharadwaj R, et al. Curcumin-docetaxel co-loaded nanosuspension for enhanced anti-breast cancer activity[J]. Expert Opin Drug Del, 2016, 13: 1065–1074. |
| [57] | Conseil G, Baubichon-Cortay H, Dayan G, et al. Flavonoids:a class of modulators with bifunctional interac-tions at vicinal ATP-and steroid-binding sites on mouse P-glycoprotein[J]. Proc Natl Acad Sci U S A, 1998, 95: 9831–9836. |
| [58] | Mohana S, Ganesan M, Agilan B, et al. Screening dietary flavonoids for the reversal of P-glycoprotein-mediated mul-tidrug resistance in cancer[J]. Mol Biosyst, 2016, 12: 2458–2470. |
| [59] | Yu J, Zhou P, Asenso J, et al. Advances in plant-based inhibitors of P-glycoprotein[J]. J Enzym Inhib Med Chem, 2016, 31: 867–881. |
| [60] | Chen LH, Lu XP, Liang XL, et al. Mechanistic studies of the transport of peimine in the Caco-2 cell model[J]. Acta Pharm Sin B, 2016, 6: 125–131. |
| [61] | Yan YD, Marasini N, Choi YK, et al. Effect of dose and dosage interval on the oral bioavailability of docetaxel in combination with a curcumin self-emulsifying drug delivery system (SEDDS)[J]. Eur J Drug Metab Pharmacokinet, 2012, 37: 217–224. |
| [62] | Hao TY, Ling YN, Wu MJ, et al. Enhanced oral bioavailability of docetaxel in rats combined with myricetin:in situ and in vivo evidences[J]. Eur J Pharm Sci, 2017, 101: 71–79. |
| [63] | Qian S, Heng WL, Wei YF, et al. Coamorphous lurasidone hydrochloride-saccharin with charge-assisted hydrogen bonding interaction shows improved physical stability and enhanced dissolution with pH-independent solubility behavior[J]. Cryst Growth Des, 2015, 15: 2920–2928. |
| [64] | Utami D, Nugrahani I, Ibrahim S. Formation and characterization of mefenamic acid-nicotinamide cocrystal during co-milling based on X-ray powder diffraction analysis[J]. J Appl Pharm Sci, 2016, 6: 75–81. |
| [65] | Liang SJ, Zhou SY, Yang ST, et al. Thermodynamic studies of naringenin-isonicotinamide cocrystals[J]. Acta Pharm Sin (药学学报), 2017, 52: 625–633. |
| [66] | Jensen KT, Larsen FH, Cornett C, et al. Formation mecha-nism of coamorphous drug-amino acid mixtures[J]. Mol Pharm, 2015, 12: 2484–2492. |
 2018, Vol. 53
2018, Vol. 53


