药物分子的手性与药物的药理活性、毒性及药代动力学性质有着密切关系。自“反应停”事件以来, 世界各国纷纷加强了对手性药物的监管力度, 凡是具有手性的药物, 均应评价一对对映体在药效及药代性质的差异。与手性药物的外消旋体相比, 单一光学活性的手性药物的治疗靶点明确, 疗效和安全性更高, 不良反应更低。例如, 埃索美拉唑为奥美拉唑的S构型立体异构体, 其抑制胃酸的作用更强、不良反应更低, 上市后很快成为医药市场的“重磅炸弹”, 累积销售额达几百亿美元。2016年至2017年8月31日, 美国FDA批准的53个新药中, 新分子实体药物有34个, 其中22个为单一光学活性的手性药物[1]。
目前, 获得手性化合物的方法主要有以下三种:手性源合成、手性催化、手性拆分。其中, 手性拆分经济易行、操作简便、易于实现工业化生产。本文将介绍手性拆分的最新研究进展, 拆分底物以化学药物及其合成中间体为主。色谱拆分方法已有综述[2-4], 在此不再赘述。
1 结晶拆分结晶法具有操作简单、产品纯度高、易于实现工业化生产的优点, 缺点是适用于结晶拆分的化合物较少。过去认为, 适合于结晶拆分的化合物应为外消旋混合物(conglomerate), 而外消旋混合物在所有晶体外消旋体中仅占5%~10%。但优先富集现象的发现, 打破了这一传统观念[5]。结晶拆分不依靠外来手性源, 通过外消旋体自发结晶实现拆分, 包括机械拆分外消旋混合物、优先结晶、优先富集、结晶诱导的去外消旋化和消磨诱导的去外消旋化等。其中结晶与手性位点外消旋化的结合, 利于提升拆分效率、节约生产成本, 相信会有巨大的应用前景。
1.1 优先结晶优先结晶(即为晶种法)是向外消旋混合物的过饱和溶液中加入单一对映体的晶种, 诱导该对映体优先结晶析出, 实现拆分。该方法的优点是不需要加入外源手性拆分剂, 易于实现规模化生产。优先结晶拆分的前提条件是底物具备外消旋混合物的性质, 即同手性作用大于异手性作用。因此, 若要选择优先结晶拆分方法, 应首先研究底物的理化性质(熔点、溶解度、晶型等), 判断是否属于外消旋混合物。
一般认为外消旋混合物只占所有外消旋晶体的5%~10%, 但Otero-de-la-Roza等[6]通过对晶体数据库中的大量外消旋晶体进行理论计算后, 发现热力学稳定的同手性晶体占总测试样品的19%。这预示着外消旋混合物在所有外消旋晶体中的实际比例可能更高。
Bredikhina等[7]发现心血管药物贝凡洛尔盐酸盐(1, 图 1)属于外消旋混合物, 进而对其进行了优先结晶拆分。Sanfilippo等[8]对抗抑郁药米那普仑衍生物(2)进行了优先结晶拆分。外消旋谷氨酸在水中重结晶形成外消旋化合物, 无法进行优先结晶。然而, Zhou等[9]采用超声辅助的方法, 促使外消旋谷氨酸在超声的空化作用下, 形成外消旋混合物, 实现其在晶种诱导下的优先结晶拆分。该方法对一些具有外消旋化合物性质的外消旋体进行优先结晶拆分提供了可能。

|
Figure 1 Chemical structures of compounds resolved by crystallization |
与传统的间歇式优先结晶法相比, 连续优先结晶技术克服了传统的间歇式优先结晶法操作繁琐的缺点, 更易于实现工业化生产。Hein等[10]利用串联循环优先结晶的方法拆分奥美拉唑, 利用两个容器的温度差, 实现S异构体的高效富集, ee可达到98%。
1.2 优先富集优先富集是具有外消旋化合物性质的非外消旋体在过饱和溶液中动力学析晶, 形成亚稳态晶体, 在向热力学稳定的晶型转化的过程中, 部分位于不规则排列区域的晶体溶于母液, 使母液具有较高的ee值。优先富集应满足以下要求[5]: ①单一立体异构体的溶解度远大于外消旋体的溶解度; ②结晶过程中发生固-固多晶型转化; ③多晶型转化前后具有不同的晶体结构; ④在晶型转化过程中产生不规则晶体; ⑤热力学稳定的非外消旋晶体能够保留结晶过程中发生的对称性破缺的痕迹。
Gonnade等[11]利用优先富集的方法拆分了非甾体类消炎药酮洛芬(rac-3)。将(S)-3过量2.0%的非外消旋体制成过饱和溶液, 同手性异构体在溶液中聚集形成一维长链, 在动力学驱动下结晶得到亚稳态晶体, 经过固相转化为热力学稳定的单一晶型。在此过程中, 位于晶体不规则排列区域的(S)-3发生破缺溶解, 实现了(S)-3在母液中的富集。发生晶体破缺的原因是对映体过量区域的晶体分子间的相互作用较弱, 稳定性下降而溶解于母液中。Manoj等[12]将外消旋的亮氨酸与草酸等比例结合得到的晶体进行优先富集, 实现了对亮氨酸的手性拆分。
Iwama等[5]通过对晶体结构进行基于氢键基元的图集分析, 解释了优先富集的发生过程。Takahashi等[13]利用温控视频显微镜和时间分辨原位X射线粉末衍射结合的方法, 直接观察了优先富集过程中的结晶生长和多晶型转化。目前, 虽然能够解释优先富集的现象, 但其内在的机制仍不明确。Uchida等[14]通过理论分析探讨了优先富集的机制, 认为其是外消旋体系中固有的手性波动性质引起的自发的手性放大现象, 并因此推测优先富集可能参与生物体中的手性物质(如氨基酸)专一性的形成。
1.3 结晶诱导的去外消旋化结晶诱导的去外消旋化是手性中心外消旋化与优先结晶过程的结合, 由于外消旋化速度大于优先结晶速度, 在形成稳定的同手性晶体的驱动下得到单一立体异构体。
(3R, 6R)-3-羟甲基-6-甲基四氢哌啶是食素受体拮抗剂MK-6096的合成片段, 可通过化合物4还原得到。Chung等[15]将4与2-甲氧基乙胺成盐得到化合物5, 有机碱2-甲氧基乙胺促使C3手性碳原子发生外消旋化, 通过加入微量(3R, 6R)-5的晶种诱导结晶, 拆分得到单一的(3R, 6R)-5。
1.4 Viedma熟化Viedma熟化是手性中心外消旋化与固相Ostwald熟化过程的结合[16]。当外消旋体系中对映体等量的平衡被轻微打破后, 对映体微过量的一方在研磨条件下产生更多晶种, 并在Ostwald熟化作用的驱动下向该种对映体高效富集。Viedma熟化可在环境的外消旋化作用下将手性的微弱差异无限放大, 可能与自然界中氨基酸等单一手性的形成有关。
Wilmink等[17]将抗血小板药物普拉格雷的合成原料6制成席夫碱7, 在液相有机碱1, 8-二氮杂二环十一碳-7-烯(DBU)的外消旋化与固相Ostwald熟化的协同作用下, 加入微量(R)-7晶种打破对映体平衡, 实现(R)-7在固相的富集。该方法还可用于氨基酸及其类似物的不对称转化。
2 化学拆分化学拆分是利用手性拆分剂将外消旋体拆分为单一光学异构体的拆分方法。手性拆分剂可通过与外消旋体形成盐键得到非对映异构盐, 根据溶解度等理化性质的差异, 采用结晶方法实现拆分。当外消旋体无可离子化的基团时, 手性拆分剂可通过氢键与外消旋体形成非对映异构共晶, 再根据理化性质差异实现拆分; 或仅与某一对映体形成单一的共晶而实现拆分。包结拆分则是利用手性拆分剂(主体)形成具有手性空穴的笼状结构, 主要通过氢键作用选择性包结某一对映体(客体)。Dutch拆分和溶剂诱导的手性开关拆分则是对非对映异构体盐结晶和共晶拆分方法的完善和发展。化学拆分扩大了通过结晶方式拆分的底物范围, 使该方法的应用范围更广。本文将主要介绍通过形成结晶拆分外消旋体的方法。
2.1 非对映异构盐结晶拆分非对映异构体盐结晶拆分是外消旋有机酸(或碱)与手性有机碱(或酸)按一定比例形成非对映异构体盐, 根据在溶液中溶解度的差异, 某一非对映异构体盐通过形成结晶或沉淀而实现拆分。该方法具有简单易行且易于实现规模化生产的优点, 在药物合成工业中得到广泛应用。
常见的酸性拆分剂有酒石酸(TA)及其衍生物, 如:二苯甲酰酒石酸(DBTA)、二对甲苯甲酰酒石酸(DTTA)、扁桃酸、苹果酸等。Zhu等[18]利用L-酒石酸(L-TA)拆分了减肥药罗卡西林的合成中间体rac-8 (图 2), Kodama等[19]用(D)-DBTA拆分了药物中间体rac-9, Liu等[20]用(D)-DTTA拆分rac-10得到丙型肝炎治疗药特拉匹韦的合成中间体(1S, 3R, 6S)-10。常用的手性有机碱拆分剂包括辛可宁、辛可尼丁、苯乙胺等。Báthori等[21]采用辛可尼丁拆分了外消旋苹果酸(rac-MA), Jiménez等[22]利用辛可宁拆分rac-11得到(S, S)-11。
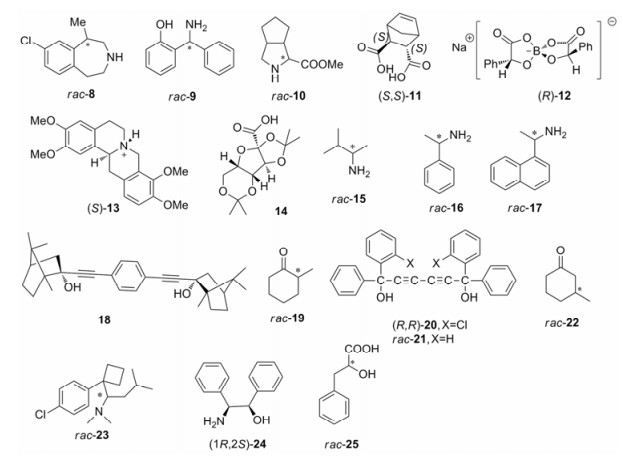
|
Figure 2 Chemical structures of compounds resolved by chemical resolution |
近年来还出现了一些新型结构的拆分剂。Wong等[23]用螺环硼酸酯盐(R)-12拆分延胡索乙素外消旋体(rac-13)得到多巴胺拮抗剂(S)-13。Báthori等[24]采用酮古洛糖酸衍生物14拆分了伯胺化合物rac-15、16、17。
目前, 对于拆分剂的选择一般需通过大量的尝试才能得到理想的拆分剂。Szeleczky等[25]则从现有的大量非对映异构体盐结晶拆分中发现:当拆分剂与底物的分子长度相差3~6个原子时, 具有较好的拆分效果。这或许可以成为指导非对映异构体盐结晶拆分的一种经验规则。
2.2 共晶拆分共晶拆分是拆分剂通过氢键与某一对映体形成共晶而实现拆分, 或与外消旋体形成一对非对映异构共晶, 再根据理化性质差异实现拆分。共晶拆分适用于拆分不具备离子化基团的外消旋体。共晶拆分中, 拆分剂与底物的主要作用力是氢键, 与盐键相比, 氢键的作用力较弱且具有方向性。在溶液中进行共晶拆分一般只得到拆分剂与某一对映体组成的单一共晶[26]。
由于拆分剂与底物之间的作用力较弱且具有方向性, 在溶液体系中寻找适合共晶拆分的拆分剂和拆分条件通常需要大量的尝试。Springuel等[27]绘制了抗癫痫药左乙拉西坦及其对映体与(S)-扁桃酸组成的共晶拆分体系的四元相图, 根据相图寻找和优化拆分条件, 高效获得了光学纯的左乙拉西坦。Sánchez-Guadarrama等[28]利用液体辅助的研磨技术得到了L-苹果酸(L-MA)与抗血吸虫药吡喹酮(rac-PZQ)的一对非对映异构共晶, 重结晶得到(R)-PZQ:L-MA共晶, 水洗除去L-MA后得到ee值高达99.3%的(R)-PZQ, 为实现吡喹酮的手性拆分提供了新方法。液体辅助的研磨技术避免了在溶液体系中因拆分剂与底物溶解度的差异而无法得到热力学稳定的共晶, 从而提高了寻找适合形成共晶的拆分剂的效率。
2.3 包结拆分包结拆分是手性拆分剂(主体)形成的手性空穴通过氢键和分子间次级相互作用对映选择性地包合外消旋客体中的某一对映体形成包结物, 而另一对映体则留在母液中。Batisai等[29]采用哑铃型冰片衍生物18作为主体对客体rac-19进行选择性包合。
2.4 Dutch拆分Dutch拆分是在主体拆分剂的基础上加入一种或多种辅助试剂, 提高拆分的立体选择性和效率。辅助试剂一般是手性拆分剂的类似物, 不参与形成结晶, 只是通过改变结晶过程来促进结晶。Nassimbeni等[30]单独使用(R, R)-20拆分rac-22时得到ee为40%的(R)-22, 而加入等比例的21后, 则可实现(R)-22的完全拆分。化合物21与主体拆分剂结构类似但不具有手性, 其作为辅助试剂改变了结晶过程, 促进了(R, R)-20与(R)-22的非对映异构体晶体的形成, 从而提高拆分效率。
Hu等[31]依据Dutch拆分思路, 采用3种酒石酸衍生物(R, R)-DTTA、(R, R)-DBTA、(R, R)-二对甲氧基苯甲酰酒石酸[(R, R)-DMTA]考察了拆分剂侧链取代基对拆分西布曲明(rac-23)效率的影响。其中, (R, R)-DMTA的拆分效率最高。X-单晶衍射结果显示, (S)-23×(R, R)-DMTA形成平行的带状超分子结构, 溶解度较差; 而(R)-23×(R, R)-DMTA形成螺旋形网状堆积结构, 更易于在拆分溶剂中溶解。拆分剂的侧链取代基显著影响了手性结构匹配和空间形状互补, 从而产生了不同的拆分剂主体-客体超分子结构。这表明Dutch拆分方法不但能够提高拆分的立体选择性和拆分效率, 还能发现高效拆分剂的作用。
2.5 溶剂诱导的手性开关溶剂诱导的手性开关是在手性拆分剂构型不变的条件下, 通过改变结晶溶剂, 改变非对映异构体盐在结晶溶剂中的溶解度和稳定性, 进而控制拆分产物的构型。
Kodama等[32]报道了采用(1R, 2S)-24对rac-25的拆分, 当拆分溶剂为水时, 得到(R)-25, 在异丙醇中则拆分得到(S)-25。溶剂诱导的手性开关拆分方法的优点在于, 当一种构型的拆分剂不易获得或价格昂贵而另一种构型的拆分剂易得且价格便宜时, 可通过选用合适的拆分溶剂使用经济易得的拆分剂进行拆分。
3 动力学拆分动力学拆分(kinetic resolution, KR)是由于外消旋体中一对对映体与手性催化剂反应速率存在差异, 导致一种对映体能够更快地生成产物, 实现手性拆分。动力学拆分的拆分效率取决于转化率(C, 0 < C < 1)和两个对映体反应的速率常数之比, 后者又称为立体选择性因子s (s = kR/kS)。s越大, 动力学拆分效果越好。当s > 10时, 拆分效果明显; 若s较低, 需进行多次拆分。手性催化剂为生物酶时, 采用生物化学立体选择性因子E描述酶动力学拆分效果, E > 100时, 拆分效果显著。动态动力学拆分(dynamic kinetic resolution, DKR)是动力学拆分与手性位点外消旋化过程的结合, 具有高对映选择性和高产率的特点, 其理论产率可达100%。手性位点外消旋化可采用过渡金属催化、酸碱催化等方法实现。动态动力学拆分需满足以下要求: ①外消旋化的速率应大于手性催化的速率; ②外消旋化试剂与手性催化剂具有化学相容性, 即同时发挥作用而不抑制对方活性; ③具有较高的转化率和对映选择性。
3.1 酶催化的动力学拆分酶催化的动力学拆分是通过酶对底物中某一对映体的立体选择性催化, 使得一种对映体能够更快地生成产物, 实现手性拆分。常用于动力学拆分的酶包括:脂肪酶、转氨酶等。其中, 脂肪酶因其易得、底物范围广、耐受性高等特点, 在酶催化的动力学拆分中应用最广泛。
在自然环境中脂肪酶的主要作用是水解脂肪, 而在非水溶剂中, 部分脂肪酶具有很强的对映选择性酯交换作用。脂肪酶能够对底物进行对映选择性水解、氨解、酯基转移、酰胺化等催化反应, 底物包括外消旋的伯醇、仲醇、叔醇、伯胺、酯等, 并成功运用到(-)-帕罗西汀盐酸盐、盐酸地儿硫卓、维生素D3衍生物等手性药物的合成[33]。José等[34]总结了采用来源于褶皱念球菌、米赫根毛霉的脂肪酶和南极假丝酵母脂肪酶B等生物酶拆分外消旋布洛芬的方法。Li等[35]利用脂肪酶AK高效拆分了外消旋α-丙二烯醇(rac-26, 图 3), 并实现了克级拆分。Mathew等[36]采用洋葱伯克霍尔德菌ω-转氨酶成功拆分了rac-27, 得到β-氨基酸(R)-27。
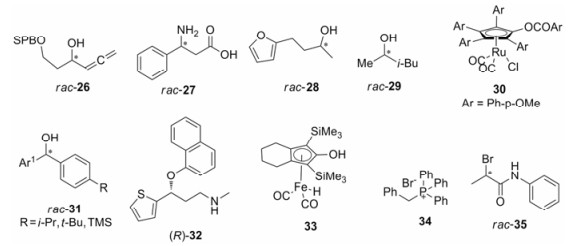
|
Figure 3 Chemical structures of compounds involved in enzymatic kinetic resolution and enzymatic dynamic kinetic resolution |
生物酶作为动力学拆分的催化剂具有微量、高效、反应条件温和及绿色环保等特点, 但也有易失活、不易回收的缺点。固定化酶的应用则克服了其不足, 能够保持甚至提高酶的活性, 延长使用寿命, 并且易于回收, 可重复使用。固定化酶结合连续流动反应体系, 进一步促进了酶催化的动力学拆分的实际应用[37, 38]。Cimporescu等[38]用溶胶-凝胶固定的洋葱伯克霍尔德菌脂肪酶拆分了1, 5-二羟基-1, 2, 3, 4-四氢化萘, 并将固定化酶应用到连续流动体系中。该固定化酶经过连续4天的实验仍保持很高的活性, E值达到200。
Ferreira等[39]利用固定化南极假丝酵母脂肪酶B在正己烷溶液中选择性酰化一系列含呋喃和噻吩结构的外消旋二级醇。对rac-28的选择性酰化仅需10分钟且反应条件温和, 高效地获得了合成活性天然产物citreofuran和pyrenophorine的中间体(S)-28 (99% ee), E超过200。Bandeira等[40]利用固定化酶LipG9, 通过选择性酰化动力学拆分抗老年痴呆药物中间体烷基仲醇的研究, 对rac-29的拆分效率最高(E = 63)。
3.2 酶催化的动态动力学拆分酶催化的动态动力学拆分法是酶动力学拆分与手性位点外消旋化过程的结合, 有高产率、高对映选择性、反应条件温和的优点。外消旋化催化剂包括钯、钌、铱等过渡金属配合物以及有机酸、碱等有机小分子, 生物酶包括荧光假单孢菌脂肪酶、南极假丝酵母脂肪酶B、洋葱伯克霍尔德菌脂肪酶等, 拆分底物多为外消旋二级醇和胺类化合物[41]。
Lee等[42]采用来自伯克氏菌的脂肪酶和钌配合物30对药物(如:抗组胺药、抗心律失常药、抗胆碱能药等)合成前体对二芳基甲醇(rac-31)进行DKR, 得到71%~96%产率和90%~99% ee的产物。抗抑郁药(S)-度洛西汀是5-羟色胺和去甲肾上腺素再摄取抑制剂, 而其对映体(R)-度洛西汀((R)-32)对人体5-羟色胺转运体有更高的抑制活性。El-Sepelgy等[43]首次使用铁配合物33作为外消旋催化剂对外消旋二级醇进行DKR, 得到81%产率和99% ee的产物。铁配合物33通过催化脱氢-氢化过程对手性底物进行外消旋化, 反应条件较温和且与脂肪酶具有很好的兼容性。与钌、钯等贵重金属外消旋催化剂相比, 铁配合物具有廉价易得、绿色环保等优点, 在DKR领域中具有很高的研究价值和应用潜力。
含α-羟基酰胺结构的化合物具有多种生物活性, 如维生素B5、抗生素阿米卡星、降胆固醇药乌苯美司等, 还可用于α-氨基酸、非天然肽、α-羟基β-内酰胺抗生素等的合成。Westerbeek等[44]首次报道了利用卤代烷脱卤素酶和溴化鏻盐34对α-溴代酰胺rac-35进行DKR得到S构型的α-羟基酰胺。由于溴化鏻盐会抑制脱卤素酶的活性, 作者采用半透膜将这两种催化剂隔开, 从而避免了鏻盐对酶的抑制作用。非金属外消旋催化剂更加环保, 并且易于制备、价格低廉, 为DKR反应提供了绿色化学思路。
3.3 非酶催化的动力学拆分非酶催化的动力学拆分催化剂包括有机金属配合物和有机小分子。有机金属配合物是配位金属与手性配体形成的配合物, 对映选择性地催化某一种对映体而实现拆分。配位金属一般为钛、钌、铑、钯等过渡金属。
Yang等[45]用手性铱配合物(R)-36 (图 4)对映选择性氢化脂肪醇rac-37的酯基, 得到S构型的δ-烷基-δ-羟基酯和R构型的1, 5-二醇, 二者分别经过多步反应得到名贵香料(+)-Civet ((+)-38)和Ⅰ型糖尿病治疗药物(R)-lisofylline [(R)-39]。该方法催化剂用量少, 立体选择性因子s达120, 得到的两种产物均得到了有效应用, 符合绿色化学理念。

|
Figure 4 Chemical structures of compounds and transition states involved in non-enzymatic kinetic resolution |
不对称C-H键活化通常依赖于手性催化剂对非手性化合物C-H键的选择性催化实现, 这限制了底物的多样性。Xiao等[46]利用二价钯配合物和MPPA首次对α-羟基及α-氨基苯乙酸进行选择性C-H烯基化。
手性有机小分子催化剂可通过氢键、位阻等作用, 对映选择性与某一对映体反应。Mittal等[47]利用手性催化剂40和非手性助剂41对苄胺类化合物rac-42进行选择性酰化。非手性助剂41的作用是通过与40形成手性离子对43, 提高对映选择性酰基化的效率。α-亚甲基-β-羟基酸酯是天然产物合成的手性砌块, 也可作为重要医药中间体。Jiang等[48]利用酰基转移催化剂An-PIQ (44)选择性水解α-亚甲基-β-羟基酸酯(rac-45), 实现了g级外消旋体的拆分。(S)-45与酰基化的44可能通过π-阳离子、π-π相互作用立体选择性地形成过渡态46, 而非过渡态47, 实现了高效动力学拆分。
3.4 非酶催化的动态动力学拆分非酶动态动力学拆分是手性位点外消旋化与非酶催化动力学拆分过程的结合。外消旋化试剂包括金属配合物和有机酸、碱等, 动力学拆分催化剂包括手性有机金属配合物和手性小分子有机催化剂两类。Pellissier[49]综述了近期手性有机小分子催化DKR的研究进展。
手性P, N-配体QUINAP可用于多种不对称催化, 一般获得QUINAP的方法是手性拆分试剂拆分, 但所使用的拆分试剂价格昂贵。Bhat等[50]利用钯催化剂和手性助剂二茂铁(R, SFc)-48 (图 5), 通过动态动力学拆分的方法, 以86%的产率得到(S)-49, 产物经重结晶后ee值高达99.55%。零价钯与rac-49发生氧化加成, 二价钯通过元结效应与芳环的氢原子形成平面环状过渡态, 使底物外消旋化速率提高4 600倍以上。在手性助剂(R, SFc)-48的作用下, (S)-50高效富集, 随后反应得到(S)-49。
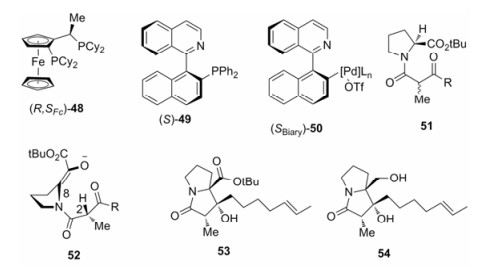
|
Figure 5 Chemical structures of compounds and transition states involved in non-enzymatic kinetic dynamic kinetic resolution |
Kim等[51]以脯氨酸衍生物51为底物, 在碱的作用下发生分子内的Aldol反应, 利用C8处的位阻因素对C2位手性中心外消旋化进行动态动力学拆分。轴手性烯醇过渡态52的结构中, C8位烯醇化后由于手性记忆对酮羰基选择性加成生成53, 进一步还原得到双吡咯烷类生物碱(-)-penibruguieramine A (54)。
4 其他 4.1 手性萃取手性萃取的提取相中含有手性拆分剂, 与一对对映体的亲和力不同, 其中亲和力更强的对映体富集于提取相, 从而实现拆分。Ren等[52]利用L-酒石酸酯在有机相癸醇中萃取得到(R)-布洛芬。基于密度泛函理论的量化计算结果显示, L-酒石酸二己酯与(R)-布洛芬复合物的能量为-64.32 kJ·mol-1, 而与(S)-布洛芬复合物的能量为-39.74 kJ·mol-1, 表明L-酒石酸二己酯与(R)-布洛芬的亲和力更强。
4.2 膜拆分膜拆分包括为手性膜拆分和非手性膜拆分。手性膜具有对映选择性透过功能, 仅依靠手性膜即可实现手性拆分。非手性膜拆分是非手性膜的半透膜特性与手性拆分剂的对映选择性功能的结合, 应用较为广泛的是支撑液膜拆分。将支撑材料浸泡在含有手性载体的有机相膜液中, 在表面张力的作用下, 膜液填充于膜支撑材料中得到支撑液膜。支撑液膜为原料相和反萃相提供对映选择性分界面, 根据对映体与手性载体之间的作用力差异使某一对映体在反萃相被优先萃取。
Zhang等[53]利用溶解L-酒石酸二戊酯的正辛烷溶液作为膜液, 聚偏二氟乙烯中空纤维(PVDF)作为膜支撑材料, 组成支撑液膜, 对布洛芬进行拆分, 分离因子最高达1.38。(R)-布洛芬与L-酒石酸二戊酯的结合力较强, 形成的复合物因体积较大无法穿过PVDF膜而保留在液膜相, (S)-布洛芬与L-酒石酸二戊酯的结合力较弱, 易于进入反萃相。经过连续分离与富集, 可实现布洛芬的拆分。El-Sepelgy等[43]设计的酶膜反应器与外消旋化装置相结合的动态动力学拆分外消旋布洛芬酯, 显示了膜拆分在实现规模化、连续化生产中的应用价值。
4.3 手性吸附手性吸附剂利用其手性空腔对一对对映体吸附能力的差异, 在一定的溶液中或流动相中实现手性拆分。Navarro-Sanchez等[54]采用基于三肽Gly-L-His-Gly的二价铜金属有机框架材料(MOF)分离外消旋麻黄碱和脱氧麻黄碱。这种MOF的空腔体积占整体体积的60%, 空腔孔径约为2 nm, 可允许麻黄碱和脱氧麻黄碱等小分子药物通过, 在手性环境下实现对外消旋体底物的对映选择性吸附。
4.4 纳米粒拆分纳米微粒作为手性拆分剂扩大了拆分剂的种类和应用范围, Fu等[55]将牛血清白蛋白固定于磁性四氧化三铁纳米粒形成手性拆分剂, 通过静电吸附作用对映选择性地吸附外消旋布洛芬和氧氟沙星。虽然产物的ee值不高, 但作为一种新的磁分离方法, 具有较高的研究价值。近年来发展的手性聚合物作为手性拆分剂被用于结晶拆分外消旋体。Preiss等[56]采用由单一构型氨基酸衍生物制成的手性聚合纳米粒, 对映选择性地与D或L-构型的天门冬酰胺结晶实现拆分。
5 展望目前, 手性拆分的方法呈现多样化, 除了传统的化学方法和色谱法外, 出现了与生物、材料等学科交叉的拆分方法, 如酶膜反应器、固定化酶技术, 以及一些新颖的拆分方法, 如优先富集、Viedma熟化。这些扩充了拆分的适用范围, 推进了手性拆分领域的研究进展。相信随着科技的发展, 生物、化学、物理、材料等学科之间的交叉互补, 高效、简便、实用的拆分方法将不断涌现。
| [1] | U. S. Food & Drug Administration. Novel Drug Approvals for 2017[EB/OL]. 2017[2017-09-04]. https://www.fda.gov/Drugs/DevelopmentApprovalProcess/DrugInnovation/ucm537040.htm. |
| [2] | Declerck S, Vander Heyden Y, Mangelings D. Enantioseparations of pharmaceuticals with capillary electrochromatography:a review[J]. J Pharm Biomed, 2016, 130: 81–99. DOI:10.1016/j.jpba.2016.04.024 |
| [3] | Du JB, Chen XY, Zhong DF. Research progress of protein-based chiral stationary phases and their application to chiral drug resolution[J]. Chin J Pharm (中国医药工业杂志), 2015, 46: 1122–1130. |
| [4] | Pan CJ, Wang WF, Chen XG. Recent developments of chiral separation by capillary electrophoresis[J]. Chin J Chromatogr (色谱), 2016, 34: 16–20. DOI:10.3724/SP.J.1123.2015.09002 |
| [5] | Iwama S, Takahashi H, Tsue H, et al. Case study on the interpretation of crystal structures inducing preferential enrichment based on the graph set analysis of hydrogen bond motifs[J]. Cryst Growth Des, 2015, 15: 3052–3062. DOI:10.1021/acs.cgd.5b00499 |
| [6] | Otero-de-la-Roza A, Hein JE, Johnson ER. Reevaluating the stability and prevalence of conglomerates:implications for preferential crystallization[J]. Cryst Growth Des, 2016, 16: :6055–6059. DOI:10.1021/acs.cgd.6b01088 |
| [7] | Bredikhina ZA, Antonovich OA, Zakharychev DV, et al. The effective direct resolution procedure for the chiral drug bevantolol hydrochloride[J]. Tetrahedron-Asymmetr, 2016, 27: 397–403. DOI:10.1016/j.tetasy.2016.03.012 |
| [8] | Sanfilippo C, Forni A, Patti A. Characterization of a conglomerate-forming derivative of (±)-milnacipran and its enantiomeric resolution by preferential crystallization[J]. RSC Adv, 2016, 6: 49876–49882. DOI:10.1039/C6RA07745E |
| [9] | Zhou XH, Wang HS, Zeng Q. Chiral separation of DL-glutamic acid by ultrasonic field[J]. CrystEngComm, 2017, 19: 762–766. DOI:10.1039/C6CE02027E |
| [10] | Hein JE, Cao BH, van der Meijden MW, et al. Resolution of omeprazole using coupled preferential crystallization:efficient separation of a nonracemizable conglomerate salt under near-equilibrium conditions[J]. Org Process Res Dev, 2013, 17: 946–950. DOI:10.1021/op400081c |
| [11] | Gonnade RG, Iwama S, Sugiwake R, et al. Occurrence of spontaneous resolution of ketoprofen with a racemic crystal structure by simple crystallization under nonequilibrium preferential enrichment conditions[J]. Chem Commun, 2012, 48: 2791–2793. DOI:10.1039/c2cc18132k |
| [12] | Manoj K, Takahashi H, Morita Y, et al. Preferential enrich-ment of DL-leucine using cocrystal formation with oxalic acid under nonequilibrium crystallization conditions[J]. Chirality, 2015, 27: 405–410. DOI:10.1002/chir.22431 |
| [13] | Takahashi H, Iwama S, Clevers S, et al. In situ observation of polymorphic transition during crystallization of organic compounds showing preferential enrichment by means of temperature-controlled video-microscopy and time-resolved X-ray powder diffraction[J]. Cryst Growth Des, 2017, 17: 671–676. DOI:10.1021/acs.cgd.6b01516 |
| [14] | Uchida Y, Iwama S, Coquerel G, et al. A kinetic/thermody-namic origin of regular chiral fluctuation or symmetry breaking unique to preferential enrichment[J]. Chem Eur J, 2016, 22: 11660–11666. DOI:10.1002/chem.201601550 |
| [15] | Chung JYL, Marcune B, Strotman HR, et al. Synthesis of ((3R, 6R)-6-methyl piperidin-3-yl) methanol via biocatalytic transamination and crystallization-induced dynamic resolution[J]. Org Process Res Dev, 2015, 19: 1418–1423. DOI:10.1021/acs.oprd.5b00259 |
| [16] | Sögütoglu LC, Steendam RRE, Meekes H, et al. Viedma ripening:a reliable crystallisation method to reach single chirality[J]. Chem Soc Rev, 2015, 44: 6723–6732. DOI:10.1039/C5CS00196J |
| [17] | Wilmink P, Rougeot C, Wurst K, et al. Attrition induced deracemisation of 2-fluorophenylglycine[J]. Org Process Res Dev, 2015, 19: 302–308. DOI:10.1021/op500352m |
| [18] | Zhu Q, Wang J, Bian X, et al. Novel synthesis of antiobesity drug lorcaserin hydrochloride[J]. Org Process Res Dev, 2015, 19: 1263–1267. DOI:10.1021/acs.oprd.5b00144 |
| [19] | Kodama K, Hayashi N, Yoshida Y, et al. Direct enantioseparation of diarylmethylamines with an ortho-hydroxy group via diastereomeric salt formation and their application to the enantioselective addition reaction of diethylzinc[J]. Tetrahedron, 2016, 72: 1387–1394. DOI:10.1016/j.tet.2016.01.034 |
| [20] | Liu LW, Wang FY, Tian F, et al. An improved and enantioselective preparation of the telaprevir bicyclic[3.3.0] praline intermediate and reuse of unwanted enantiomer[J]. Org Process Res Dev, 2016, 20: 320–324. DOI:10.1021/acs.oprd.5b00345 |
| [21] | Báthori NB, Jacobs A, Mei M, et al. Resolution of malic acid by (+)-cinchonine and (-)-cinchonidine[J]. Can J Chem, 2015, 93: 858–863. DOI:10.1139/cjc-2014-0579 |
| [22] | Jiménez L, González T, Briceño A, et al. Resolution of (±)-bicycle[2.2.1] hept-5-ene-trans-2, 3-dicarboxylic acid:crystal structure of its cinchoninium salt[J]. J Chem Crystallogr, 2016, 46: 203–207. DOI:10.1007/s10870-016-0640-4 |
| [23] | Wong LWY, Kan JWH, Nguyen T, et al. Bis(mandelato) borate:an effective, inexpensive spiroborate anion for chiral resolution[J]. Chem Commun, 2015, 51: 15760–15763. DOI:10.1039/C5CC04977F |
| [24] | Báthori NB, Nassimbeni LR, van de Streek J. One hydrogen bond does not a separation make, or does it? Resolution of amines by diacetoneketogulonic acid[J]. Chem Commun, 2015, 51: 5664–5667. DOI:10.1039/C5CC00440C |
| [25] | Szeleczky Z, Semsey S, Bagi P, et al. An aspect of selecting resolving agents:the role of differences in molecule length in diastereomeric salt resolutions[J]. Sep Sci Technol, 2016, 51: 727–732. DOI:10.1080/01496395.2015.1117105 |
| [26] | Springuel G, Robeyns K, Norberg B, et al. Cocrystal formation between chiral compounds:how cocrystals differ from salts[J]. Cryst Growth Des, 2014, 14: 3996–4004. DOI:10.1021/cg500588t |
| [27] | Springuel G, Collard L, Leyssens T. Ternary and quaternary phase diagrams:key tools for chiral resolution through solution cocrystallization[J]. CrystEngComm, 2013, 15: 7951–7958. DOI:10.1039/c3ce41141a |
| [28] | Sánchez-Guadarrama O, Mendoza-Navarro F, Cedillo-Cruz A, et al. Chiral resolution of RS-praziquantel via di-astereomeric co-crystal pair formation with L-malic acid[J]. Cryst Growth Des, 2015, 16: 307–314. |
| [29] | Batisai E, Nassimbeni LR, Weber E. Inclusion compounds of a borneol dumb-bell host with methylcyclohexanones and 2-butanols:structures and resolutions[J]. CrystEngComm, 2015, 17: 4205–4209. DOI:10.1039/C5CE00600G |
| [30] | Nassimbeni LR, Su H, Curtin TL. Enhanced enantioselectivity of 3-methylcyclohexanone by mixed diol host compounds[J]. Chem Commun, 2012, 48: 8526–8528. DOI:10.1039/c2cc34118b |
| [31] | Hu Y, Yuan J, Sun X, et al. Resolutions of sibutramine with enantiopure tartaric acid derivatives:chiral discrimination mechanism[J]. Tetrahedron-Asymmetr, 2015, 26: 791–796. DOI:10.1016/j.tetasy.2015.04.007 |
| [32] | Kodama K, Nagata J, Kurozumi N, et al. Solvent-induced chirality switching in the enantioseperation of regioisomeric hydroxyphenylpropionic acids via diastereomeric salt formation with (1R, 2S)-2-amino-1, 2-diphenylethanol[J]. Tetrahedron-Asymmetr, 2017, 28: 460–466. DOI:10.1016/j.tetasy.2017.02.011 |
| [33] | Angajala G, Pavan P, Subashini R. Lipases:an overview of its current challenges and prospectives in the revolution of biocatalysis[J]. Biocatal Biotransfor, 2016, 7: 257–270. |
| [34] | José C, Toledo MV, Briand LE. Enzymatic kinetic resolution of racemic ibuprofen:past, present and future[J]. Crit Rev Biotechnol, 2016, 36: 891–903. |
| [35] | Li W, Lin Z, Chen L, et al. Highly stereoselective kinetic resolution of α-allenic alcohols:an enzymatic approach[J]. Tetrahedron Lett, 2016, 57: 603–606. DOI:10.1016/j.tetlet.2015.12.098 |
| [36] | Mathew S, Bea H, Nadarajan SP, et al. Production of chiral β-amino acids using ω-transaminase from Burkholderia graminis[J]. J Biotechnol, 2015, 196: 1–8. |
| [37] | Abaházi E, Lestál D, Boros Z, et al. Tailoring the spacer arm for covalent immobilization of Candida antarctica lipase B-thermal stabilization by bisepoxide-activated aminoalkyl resins in continuous-flow reactors[J]. Molecules, 2016, 21: 767. DOI:10.3390/molecules21060767 |
| [38] | Cimporescu A, Todea A, Badea V, et al. Efficient kinetic resolution of 1, 5-dihydroxy-1, 2, 3, 4-tetrahydronaphthalene catalyzed by immobilized Burkholderia cepacia lipase in batch and continuous-flow system[J]. Process Biochem, 2016, 51: 2076–2083. DOI:10.1016/j.procbio.2016.09.023 |
| [39] | Ferreira DSP, Ferreira JG, Everaldo Filho FS, et al. Tuning lipase-catalysed kinetic resolution of 2-substituted thiophenes and furans:a scalable chemoenzymatic route to masked γ-bis-oxo-alcohols[J]. J Mol Catal B-Enzym, 2016, 126: 37–45. DOI:10.1016/j.molcatb.2016.01.014 |
| [40] | Bandeira PT, Alnoch RC, de Oliveira ARM, et al. Enzymatic kinetic resolution of aliphatic sec-alcohols by LipG9, a metagenomic lipase[J]. J Mol Catal B-Enzym, 2016, 125: 58–63. DOI:10.1016/j.molcatb.2015.12.010 |
| [41] | Verho O, Bäckvall JE. Chemoenzymatic dynamic kinetic resolution:a powerful tool for the preparation of enantiomerically pure alcohols and amines[J]. J Am Chem Soc, 2015, 137: 3996–4009. DOI:10.1021/jacs.5b01031 |
| [42] | Lee J, Oh Y, Choi YK, et al. Dynamic kinetic resolution of diarylmethanols with an activated lipoprotein lipase[J]. ACS Catal, 2014, 5: 683–689. |
| [43] | El-Sepelgy O, Alandini N, Rueping M. Merging iron catalysis and biocatalysis-iron carbonyl complexes as efficient hydrogen autotransfer catalysts in dynamic kinetic resolutions[J]. Angew Chem Int Edit, 2016, 55: 13602–13605. DOI:10.1002/anie.201606197 |
| [44] | Westerbeek A, Szymanski W, Feringa BL, et al. Dynamic kinetic resolution process employing haloalkane dehalogenase[J]. ACS Catal, 2011, 1: 1654–1660. DOI:10.1021/cs2003565 |
| [45] | Yang XH, Wang K, Zhu SF, et al. Remote ester group leads to efficient kinetic resolution of racemic aliphatic alcohols via asymmetric hydrogenation[J]. J Am Chem Soc, 2014, 136: 17426–17429. DOI:10.1021/ja510990v |
| [46] | Xiao KJ, Chu L, Yu JQ. Enantioselective C-H olefination of α-hydroxy and α-amino phenylacetic acids by kinetic resolution[J]. Angew Chem Int Edit, 2016, 55: 2856–2860. DOI:10.1002/anie.201510808 |
| [47] | Mittal N, Sun DX, Seidel D. Kinetic resolution of amines via dual catalysis:remarkable dependence of selectivity on the achiral cocatalyst[J]. Org Lett, 2012, 14: 3084–3087. DOI:10.1021/ol301155b |
| [48] | Jiang SS, Xu QC, Zhu MY, et al. Kinetic resolution of α-methylene-β-hydroxy esters catalyzed by acyl transfer cata-lyst An-PIQ[J]. J Org Chem, 2015, 80: 3159–3169. DOI:10.1021/acs.joc.5b00073 |
| [49] | Pellissier H. Recent developments in organocatalytic dy-namic kinetic resolution[J]. Tetrahedron, 2016, 72: 3133–3150. DOI:10.1016/j.tet.2016.04.053 |
| [50] | Bhat V, Wang S, Stoltz BM, et al. Asymmetric synthesis of QUINAP via dynamic kinetic resolution[J]. J Am Chem Soc, 2013, 135: 16829–16832. DOI:10.1021/ja409383f |
| [51] | Kim JH, Lee S, Kim S. Biomimetic total synthesis of (-)-penibruguieramine A using memory of chirality and dynamic kinetic resolution[J]. Angew Chem Int Edit, 2015, 54: 10875–10878. DOI:10.1002/anie.201504954 |
| [52] | Ren Z, Zeng Y, Hua Y, et al. Enantioselective liquid-liquid extraction of racemic ibuprofen by L-tartaric acid derivatives[J]. J Chem Eng Data, 2014, 59: 2517–2522. DOI:10.1021/je500292c |
| [53] | Zhang F, He L, Sun W, et al. Chiral liquid membrane for enantioselective separation of racemic ibuprofen by L-tartaric acid derivatives[J]. RSC Adv, 2015, 5: 41729–41735. DOI:10.1039/C5RA04764A |
| [54] | Navarro-Sanchez J, Argente-García AI, Moliner-Martínez Y, et al. Peptide metal-organic frameworks for enantioselective separation of chiral drugs[J]. J Am Chem Soc, 2017, 139: 4294–4297. DOI:10.1021/jacs.7b00280 |
| [55] | Fu Y, Huang T, Chen B, et al. Enantioselective resolution of chiral drugs using BSA functionalized magnetic nanoparticles[J]. Sep Purif Technol, 2013, 107: 11–18. DOI:10.1016/j.seppur.2013.01.007 |
| [56] | Preiss LC, Werber L, Fischer V, et al. Amino-acid-based chiral nanoparticles for enantioselective crystallization[J]. Adv Mater, 2015, 27: 2728–2732. DOI:10.1002/adma.v27.17 |
 2018, Vol. 53
2018, Vol. 53


