2. 中国中医科学院中药研究所, 北京 100700
2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
白木香Aquilaria sinensis (Lour.) Gilg是我国生产名贵药材沉香的唯一植物来源, 已经被列为国家二级濒危保护植物[1]。沉香是我国传统名贵中药, 具有行气止痛、温中止呕、纳气平喘等功效, 多用于治疗胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急[2]。药理研究结果表明, 沉香具有消化系统和中枢神经系统的保护作用。另外, 沉香是一种名贵香料, 具有龙涎香与檀香混合物的香味, 至今仍旧无法复制这种香味[3]。健康的白木香在自然条件下并不能产生沉香, 在受到雷劈、虫咬、真菌侵染等伤害时才能够产生沉香, 但是沉香形成的分子机制一直没有揭示, 严重制约高效人工结香技术的建立[4]。化学成分分析结果表明, 决定沉香品质的主要成分是倍半萜类物质和苯乙基色酮类物质[5]。茉莉酸甲酯能够诱导白木香及白木香愈伤组织和悬浮细胞产生倍半萜类物质[5, 6], 而盐胁迫能够诱导白木香悬浮细胞及愈伤组织中苯乙基色酮物质的产生[7], 因此沉香结香机制与茉莉酸途径及植物防御反应密切相关。
茉莉酸(jasmonic acid, JA)及其甲酯衍生物茉莉酸甲酯(methyl jasmonate, MeJA)是植物重要的生长调节剂, 在植物生长过程中起到调控作用。一方面茉莉酸可以调节植物的生长发育, 如种子的萌发与生长、器官的生长发育及植物的衰老与凋亡等[8-10], 另外一方面茉莉酸还参与植物的生物胁迫和非生物胁迫的防御反应[11-13]。JA的生物合成途径也称为类十八烷生物合成途径:亚麻酸经脂氧合酶(lipoxy genase, LOX)催化合成13(S)-氢过氧化亚麻酸(13-hydroperoxylinolenic, 13-HPOT), 13-HPOT在丙二烯氧化物合成酶(AOS)、丙二烯氧化物环化酶(allene oxide cyclase, AOC)等酶类的催化下生成10, 11-二氢-12-氧植物二烯酸(12-oxo-phytodienoic acid, OPDA)[10, 14]。OPDA再经过三次β氧化后生成JA[15], 因此, AOS是植物体内茉莉酸合成途径的关键酶。AOS属于P450超基因家族中的一员, 普遍存在于植物组织中, 通过调控JA的生物合成而参与调节植物的许多生理过程[16-18]。在水稻中的研究表明水稻虫害能够诱导AOS基因的表达, 而水稻中AOS2基因的过量表达能够提高水稻内源JA含量, 诱导病程相关PR基因表达及增强对稻瘟病的抗性[19-21]; 伤害胁迫能够诱导番茄叶片中AOS基因的表达[22]。因此AOS基因表达对提高植物对物理环境的适应和种间竞争力, 增强植物防御反应具有重要作用。目前在许多种植物中克隆了AOS基因并进行了相关功能的研究, 在白木香中也克隆得到了AsAOS1基因的序列, 并且研究表明其作为关键酶参与茉莉酸甲酯诱导的沉香特征性成分倍半萜类化合物的生物合成[5]; 但是目前关于AsAOS1蛋白的原核表达及AsAOS1基因在其他非生物胁迫和激素处理下的表达分析等方面均无报道。而研究AOS的原核表达及在非生物胁迫和激素处理下的表达方式有利于研究AOS的生物合成功能及在植物防御反应中的重要作用, 同时有利于阐明白木香结香机制。因此, 本研究根据NCBI中的已知白木香AsAOS1基因序列, 通过RT-PCR获得序列全长, 对其序列特征进行生物信息学分析, 并进行原核表达及纯化, 通过实时荧光定量PCR技术分析其在不同组织中的表达差异, 并研究其在受到盐、干旱、冷及重金属胁迫和外源茉莉酸甲酯、水杨酸、脱落酸和赤霉素处理不同时间愈伤组织中的表达及积累情况, 为研究沉香结香机制及植物的防御反应机制奠定基础。
材料与方法材料 白木香种苗从广州移植, 现种植于北京中医药大学中药现代研究中心3年, 采集6月份的白木香的根、茎及叶提取总RNA, 检测AsAOS1基因在不同器官中的特异性表达。利用白木香叶片和茎尖诱导的愈伤组织, 选取长势相同的白木香愈伤组织, 分别经NaCl (150 mmol·L-1)、低温(4 ℃)、CdCl2 (500 μmol·L-1)、甘露醇(750 mmol·L-1) 4种非生物胁迫及脱落酸(ABA) (150 μmol·L-1)、茉莉酸甲酯(150 μmol·L-1)、赤霉素(GA3) (150 μmol·L-1)、水杨酸(SA) (150 μmol·L-1) 4种外源激素处理, 在处理后12、24、36、48 h提取RNA作为样品检测AsAOS1基因在各种处理下的表达差异。所用菌种为大肠杆菌(Escherichia coli) DH5α、BL21(DE3), 购自天根生物科技有限公司; pET28a (Novagen)由本实验室保存。
白木香组织及愈伤组织中总RNA的提取和cDNA的合成 按照EASYspin Plus植物RNA快速提取试剂盒(Aidlab, 中国)实验操作步骤进行植物总RNA提取, 利用NanoDrop 2000C检测RNA浓度, 同时利用1.2%琼脂糖凝胶电泳检测RNA的完整性和质量。利用Sigma公司的反转录酶M-MLV将白木香的总RNA反转录为第一链(cDNA), 反转录的条件按照说明书进行。
AsAOS1基因序列全长克隆 根据从NCBI数据库中获得的AsAOS1基因序列全长, 设计合成特异性引物, 引物序列为AOS1: ATGGCATCTTCAGCTGT GTCTTTCTGC, AOS2: TCAAAAGCTAGCTCTCTTC AACGAC。以白木香总RNA的反转录产物为模板, 按照下列体系对白木香中AsAOS1基因进行扩增: cDNA 1 μL, LA-Taq (2.5 U·μL-1) 0.5 μL, 10×LA-Taq buffer 5 μL, dNTP Mix (2.5 mmol·L-1) 4 μL, 10 μmol引物各1 μL, 终体积为50 μL。反应: 94 ℃预变性5 min; 然后进行30个循环, 94 ℃ 40 s, 59 ℃ 30 s, 72 ℃ 2 min 30 s, 程序循环结束后72 ℃延伸反应10 min, 4 ℃保存。1%琼脂糖凝胶电泳检测PCR产物, 利用Biomega胶回收试剂盒回收PCR产物。将回收后的PCR产物与pMD19-T连接, 转化到DH5α菌株, 在氨苄抗性的平板上进行筛选, 并经过菌落PCR检测后送上海英潍捷基公司测序。
白木香AsAOS1的序列分析 利用NCBI中ORF Finder确定AsAOS1开放阅读框, 在NCBI数据库中进行同源性检索(http://www.ncbi.nlm.nih.gov/), 用DNAMAN对序列进行多重比对, 并在MEGA6中构建系统进化树。
AsAOS1原核表达载体的构建及异源表达 利用引物AOS-1B (序列为: CGCGGATCCATGGCATC TTCAGCTGTGTCTTTCTGC)和AOS-2E (序列为: CCGGAATTCTCAAAAGCTAGCTCTCTTCAACGAC)扩增AsAOS1基因的序列全长, 用BamH Ⅰ和EcoR Ⅰ双酶切包含有目的基因AsAOS1的PCR产物, 将其构建到表达载体pET28a上, 转入大肠杆菌DH5α感受态细胞, 挑取经扩增筛选、测序鉴定正确的单克隆; 提取质粒pET28a-AsAOS1转入大肠杆菌BL21(DE3)感受态细胞。挑取单菌落接种于含有50 μg·mL-1卡那霉素的LB液体培养基中, 37 ℃活化过夜; 活化菌液按1:100比例加入到适量新鲜含有50 μg·mL-1卡那霉素的LB液体培养基中, 37 ℃振荡培养至OD600达0.6左右, 加异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度0.8 mmol·L-1。先180 r·min-1、37 ℃振荡培养至OD600达0.4~0.6, 调节温度至25 ℃振荡培养16 h诱导AsAOS1过度表达; 4 ℃、12 000 r·min-1离心收集大肠杆菌菌体之后, 悬浮于40 mmol·L-1 KPB缓冲液(pH 7.9, 含有100 mmol·L-1 NaCl、5 mmol·L-1咪唑)中。将菌体置于冰上, 用超声破碎仪(Colo Parmer)来破碎细胞, 破碎液高速离心30 min以上。取上清液, 利用镍离子亲和色谱柱纯化AsAOS1蛋白, 先以20 mmol·L-1 KPB缓冲液(pH 7.9, 含有500 mmol·L-1 NaCl和40 mmol·L-1咪唑)洗脱以去除杂蛋白, 再以15 mmol·L-1 KPB缓冲液(pH 7.5, 含10%甘油和500 mmol·L-1咪唑)洗脱目的蛋白, 洗脱液用Millipore滤膜(30 kDa, Millipore)浓缩至约2 mL, 最终目的蛋白保存在20 mmol·L-1 KPB缓冲液(pH 7.5, 含10%甘油和1 mmol·L-1 EDTA)中。利用SDS-PAGE和Western blot检测重组蛋白表达。
白木香AsAOS1基因在不同组织和不同的胁迫/激素处理时间的表达分析 利用实时荧光定量PCR (quantitative real-time PCR, qRT-PCR)的方法检测白木香不同组织中AsAOS1基因表达情况和不同胁迫处理和激素处理时间的表达情况。分析使用SYBR Green Ⅰ荧光染料法, 在qRT-PCR仪上进行。选取白木香GAPDH基因作为目标基因定量表达的内参基因, 引物序列见表 1。每个样品, 重复3次。反应体系中含有10 μL STBR Premix Ex Taq酶、上下游引物(10 μmol·L-1)各0.4 μL、模板0.5 μL, 总体系为20 μL。反应程序是: 95 ℃预变性3 min, 95 ℃变性30 s, 60 ℃退火/延伸30 s (每次循环后采集荧光), 40个循环后, 95 ℃变性10 s, 65~95 ℃做熔解曲线分析, 每个温度以每步0.5 ℃上升, 每个温度停留5 s。根据熔解曲线判断RT-PCR产物的特异性, 相对定量分析采用2-ΔΔCt方法进行分析。
| Table 1 Primers sequence |
通过分析NCBI数据库中数据和文献数据, 以白木香愈伤组织cDNA为模板, 进行PCR扩增, PCR产物约为1 600 bp, 与预期大小相符, 电泳结果如图 1所示, 将PCR产物连接到pMD19-T载体上, 测序后获得的基因序列与NCBI数据库中序列一致, 序列长度为1 575 bp, 包含AsAOS1基因的完整ORF框, 编码524个氨基酸。
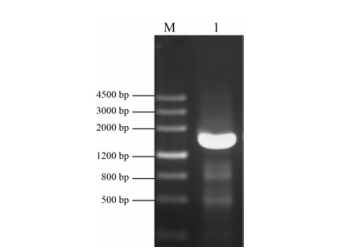
|
Figure 1 PCR amplification of AsAOS1 gene. M: DNA marker; 1: PCR product of AsAOS1 gene |
通过NCBI数据库中Blast结果显示(图 2), 该序列与其他植物物种中的AOS具有较高的同源性, 与野茶树(Camellia sinensis)、川桑(Morus notabilis)、枣(Ziziphus jujuba)、可可(Theobroma cacao)、胡杨(Populus euphratica)、烟草(Nicotiana tabacum)分别有73%、71%、72%、74%、71%、69%相似; 通过多序列比对结果显示, AsAOS1蛋白具有P450家族的特征序列: ①高度保守的I-helix region, 该结构的作用是在血红素表面形成氧结合袋, 序列式GXXXT, 其中G和T的作用是结构氧分子, 但是在白木香中的序列转变为GXXXI, 而植物中P450酶不需要结合氧原子, 因此在白木香中结合氧原子的T转变为I。② C末端具有高度保守血红素结合结构域, P450家族的保守结构序列为FXXGXXXCXG, C为血红素结合位点, 而CYP74A酶类的保守区序列演变为P-V-NKQCAG, 白木香中的序列为P-L-NKQCAG。③具有CYP74A酶类高度保守的ETLR结构域。白木香中序列演变为EALR。为了进一步了解白木香AsAOS1蛋白可能的功能和在植物AOS家族中的进化位置, 从NCBI blastp的比对结果中选取来源于其他植物的21条AOS蛋白序列, 包括乔木类植物甜橙、橡胶等, 模式植物拟南芥、玉米、烟草等, 以及其他植物如茄、苜蓿等利用MEGA6.0构建了系统进化树(图 3)。从图 3可以看出, 白木香AsAOS1与甜橙(Citrus sinensis) AOS蛋白亲缘关系比较接近。

|
Figure 2 Multiple sequence alignment of AsAOS1and AOS from other plant species. The CYP74 conserved sequences are under the red line. The highly conserved I-helix region, heme-binding domain (the heme-binding C is marked by arrowhead) and the highly conserved ETLR motifs of the CYP74A enzymes are boxed. As: Aquilaria sinensis; Cs: Camellia sinensis; Mn: Morus notabili; Zj: Ziziphus jujub; Tc: Theobroma cacao; Pe: Populus euphratica; Nt: Nicotiana tabacum |
|
Figure 3 Phylogenetic analysis of AOS proteins from plants |
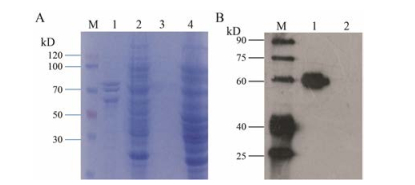
将原核表达载体pET28a-AsAOS1质粒转化大肠杆菌BL21(DE3)后, 通过预实验探索及SDS-PAGE电泳检测蛋白是否可溶并确定最佳诱导条件, 使用终浓度为0.8 mmol·L-1 IPTG于25 ℃下诱导16 h达到最佳效果。由于AsAOS1在其氨基酸序列的N端带有一个6个His (组氨酸)的标签, 用镍离子亲和色谱柱纯化AsAOS1蛋白, 用Millipore滤膜浓缩蛋白, 最终目的蛋白保存在20 mmol·L-1 KPB缓冲液。利用SDS-PAGE检测发现在60 kDa以上出现3条蛋白条带, 利用Western blot检测目的条带, 位于60 kDa左右的条带是AsAOS1蛋白纯化的条带(图 4)。

|
Figure 4 SDS-PAGE and Western blot analysis of recombinant AsAOS1 protein. A: SDS-PAGE analysis of recombinant AsAOS1 protein. M: Marker; 1: Purified recombinant AsAOS1 protein; 2: The total protein of E. coli containing pET28a-AsAOS1 plasmid after induction; 3: Purified empty vector control; 4: The total protein of E. coli containing pET28a plasmid after induction. B: Western blot analysis of recombinant AsAOS1 protein. M: Marker; 1: Recombinant AsAOS1 protein sample; 2: Empty vector control |
利用荧光定量PCR检测AsAOS1基因的组织特异性表达, 结果显示AsAOS1基因在白木香所有组织中均有表达, 在茎中表达最高, 根次之, 在叶中表达最低, 说明AsAOS1基因表达具有器官特异性(图 5)。
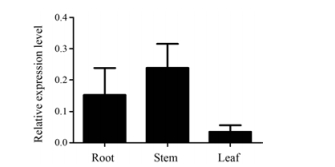
|
Figure 5 Relative expression level of AsAOS1 gene in different tissues. Note: Repeat 3 samples, each for 3 times |
茉莉酸是植物重要的激素, 当植物受到外界环境胁迫时, 体内的茉莉酸及其衍生物的含量显著增加, 启动抗逆基因的表达, 从而导致代谢途径的变化, 使植物产生各种化学防御物质, 而白木香中产生的具有药用价值的次生代谢产物, 倍半萜类和苯乙基色酮类化合物是沉香的主要特征性成分, 也是参与植物防御反应的重要物质。白木香在自然条件下结香时间比较长, 因此不利于结香机制研究的进行, 本实验室利用白木香的茎和叶构建了愈伤组织体系, 通过茉莉酸甲酯和盐胁迫能够诱导产生与自然条件下结香形成的沉香倍半萜类和苯乙基色酮类物质, 而且以前的实验结果表明愈伤组织细胞具有全能性, 利用愈伤组织研究植物基因的功能在很多文献中都有报道。因此在本研究中, 对白木香的愈伤组织分别进行盐、干旱、低温及重金属处理, 以相同生长情况下未进行任何处理的愈伤组织做对照, 不同时间点取样提取RNA后进行实时荧光定量PCR分析, 检测茉莉酸甲酯途径的关键基因AsAOS1的表达水平, 结果显示盐、低温和重金属胁迫都诱导AsAOS1基因的表达, 3种胁迫诱导都是在12 h诱导AsAOS1表达量最高, 分别是对照的5、6、12倍, 之后48 h内的表达量逐渐降低, 说明重金属胁迫对AsAOS1基因影响最大(图 6)。而利用甘露醇模拟干旱条件, 发现AsAOS1基因的表达与对照相比, 略有降低, 说明干旱胁迫对白木香中AsAOS1基因的表达影响微弱(图 6)。
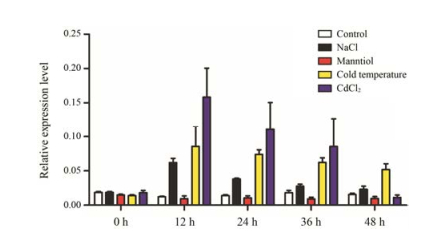
|
Figure 6 Relative expression level of AsAOS1 gene under different abiotic stress in Aquilaria sinensis calli. Note: Repeat 3 samples, each for 3 times |
已经报道的大麦、拟南芥、青蒿及长春花的AOS基因能够被茉莉酸甲酯、水杨酸诱导, 说明植物激素的调控可能是交叉作用的。本研究中对白木香的愈伤组织进行茉莉酸甲酯、水杨酸、脱落酸和赤霉素处理, 实验结果表明, 茉莉酸甲酯诱导AsAOS1基因的表达, 在12 h达到最高, AsAOS1基因的表达量是对照的6.2倍, 之后逐渐下降(图 7)。水杨酸和脱落酸处理后使AsAOS1基因表达量上升, 在24 h表达量到达最高点, 之后逐渐降低, 48 h降低到正常水平, 而赤霉素对AsAOS1的表达没有明显的影响(图 7)。
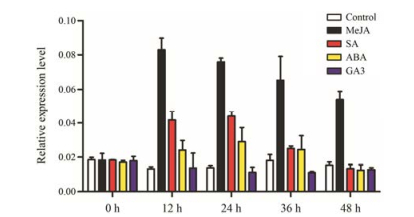
|
Figure 7 Relative expression level of AsAOS1 gene under different hormone treatment in Aquilaria sinensis Calli. MeJA: Methyl jasmonate; SA: Salicylic acid; ABA: Abscisic acid; GA3: Gibberellin. Note: Repeat 3 samples, each for 3 times |
近年来药用植物的次生代谢一直是研究的热点, 而且次生代谢产物常具有较高的药理活性和药用价值, 因此致力于提高植物体内次生代谢产物的研究也不断被发现。AOS是茉莉酸生物合成的关键酶, 而茉莉酸能够调控白木香中决定沉香品质的倍半萜类物质的生物合成[6], 同时研究表明在盐胁迫条件下能够诱导产生苯乙基色酮的生物合成[7], 因此研究白木香的AsAOS1基因的原核表达和在不同非生物胁迫和激素处理下的表达分析, 有利于研究AsAOS1基因体外的生物合成功能和在植物防御反应中的作用, 为进一步研究AsAOS1基因在白木香的结香过程中的作用奠定基础。
目前已经从多种植物中分离得到AOS基因, 本研究根据NCBI的序列, 通过qRT-PCR的方法从白木香的愈伤组织中分离得到该序列, 白木香AsAOS1与其他物种中的AOS具有较高的同源性, 具有P450家族应有的保守序列。本研究首次在大肠杆菌中表达了白木香的AsAOS1蛋白, 希望能够在蛋白水平研究白木香中AsAOS1蛋白的生物学功能和体外研究AsAOS1蛋白的生物合成功能。P450家族蛋白在大肠杆菌中表达时则大部分以包涵体形式存在, 溶解度比较低[23, 24], 本研究通过构建原核表达载体pET-28-AsAOS1在BL21(DE3)菌株中诱导表达了白木香AsAOS1蛋白, 而且重组蛋白AsAOS1在表达菌中能够以可溶性蛋白存在, 因此为进一步研究AsAOS1的功能奠定基础。
研究表明, AOS基因表达具有组织特异性, 在水稻中AOS基因主要在根中表达[20, 21]。长春花中, AOS在根中表达量最高, 在老叶中表达较高, 但是在幼花中表达最低[25]。本研究表明, 白木香的AsAOS基因具有器官特异性, 在茎中表达量最高, 根次之, 叶中的表达量最少。茉莉酸作为植物体内广泛存在的植物激素, 能够作为信号分子参与植物的抗逆反应。以前的研究表明病虫害、机械伤害、低温、干旱等能够诱导AOS基因的表达[11-13, 26]。而盐、干旱、低温和重金属是植物生长过程中最常见的非生物胁迫, 本研究表明, 盐、低温和重金属胁迫能够促进白木香AsAOS1基因的表达, 而且重金属铬对AsAOS1基因的表达水平影响最大。实验结果表明AsAOS1基因参与植物的防御反应, AsAOS1基因也可能与盐胁迫诱导的沉香特征性成分苯乙基色酮的生物合成相关。
AOS基因的表达能够受到外源的茉莉酸、水杨酸等诱导, 长春花AOS表达受到外源茉莉酸甲酯的诱导[27], 拟南芥、大麦中的AOS基因受到水杨酸的诱导[27, 28]。茉莉酸、水杨酸、脱落酸和赤霉素在植物防御反应中起到重要作用, 因此本研究中利用外源的茉莉酸、水杨酸、脱落酸和赤霉素处理白木香的愈伤组织, 白木香中AsAOS1基因能够被外源的茉莉酸甲酯、水杨酸和脱落酸诱导, 但是赤霉素对其表达影响不大, 本研究首次表明除了茉莉酸甲酯和水杨酸外, 脱落酸影响白木香中AsAOS1基因的表达, 以前的文献报道水杨酸也能够诱导沉香特征性成分的产生[29], 本实验结果预示沉香特征性成分的生物合成可能受到多种激素交叉调控, AsAOS1基因在沉香特征性成分生物合成过程中起重要作用。AsAOS1基因的蛋白表达及非生物胁迫和激素处理下的表达分析, 为进一步研究白木香结香的分子调控机制奠定基础, 同时有利于丰富植物的防御反应的研究。
| [1] | State Environmental Protection Administration of China. Institute of Botany, the Chinese Academy of Sciences. List of Rare and Endangered Plants in China (Vol 1) (中国珍稀濒危保护植物名录:第一册)[M]. Beijing: Science Press, 1987. |
| [2] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典:一部)[S]. Beijing:Chemical Industry Press, 2000. |
| [3] | Li G, Duan LS, Yang CY, et al. Advances in studies on technology of agarwood formation in Aquilaria sinensis[J]. J Anhui Agric Sci (安徽农业科学), 2009, 37: 12012–12013. |
| [4] | Zhang Z, Yang Y, Wei JH, et al. Advances in studies on mechanism of agarwood formation in Aquilaria sinensis and its hypothesis of agarwood formation induced by defense response[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 156–159. |
| [5] | Xu YH, Liao YC, Zhang Z, et al. Jasmonic acid is a crucial signal transducer in heat shock induced sesquiterpene formation in Aquilaria sinensis[J]. Sci Rep, 2016, 23: 21843. |
| [6] | Xu Y, Zhang Z, Wang M, et al. Identification of genes related to agarwood formation:transcriptome analysis of healthy and wounded tissues of Aquilaria sinensis[J]. BMC Genomics, 2013, 14: 227–243. DOI:10.1186/1471-2164-14-227 |
| [7] | Wang XH, Gao BW, Liu X, et al. Salinity stress induces the production of 2-(2-phenylethyl)chromones and regulates novel classes of responsive genes involved in signal transduction in Aquilaria sinensis Calli[J]. BMC Plant Biol, 2016, 16: 119. DOI:10.1186/s12870-016-0803-7 |
| [8] | Ranjan R, Miersch O, Sembdner G, et al. Presence and role of jasmonate in apple embryos[J]. Physiol Plant, 2010, 90: 548–552. |
| [9] | Creelman RA, Mullet JE. Biosynthesis and action of jasmonate in plants[J]. Annu Rev Plant Mol Biol, 1997, 48: 355–381. DOI:10.1146/annurev.arplant.48.1.355 |
| [10] | Turner JG, Ellis C, Devoto A. The jasmonate signal pathway[J]. Plant Cell, 2002, 14: 153–164. DOI:10.1105/tpc.000679 |
| [11] | Onkokesung N, Gális I, von Dahl CC, et al. Jasmonic acid and ethylene modulate local responses to wounding and simulated herbivory in Nicotiana attenuata leaves[J]. Plant Signal Behav, 2010, 153: 785–798. |
| [12] | Shang J, Xi DH, Xu F, et al. A broad-spectrum efficient and nontransgenic approach to control plant viruses by application of salicylic acid and jasmonic acid[J]. Planta, 2011, 233: 299–308. DOI:10.1007/s00425-010-1308-5 |
| [13] | Diniz I, Figueiredo A, Loureiro A, et al. A first insight into the involvement of phytohormones pathways in coffee resistance and susceptibility to Colletotrichum kahawae[J]. PLoS One, 2017, 12: e0178159. DOI:10.1371/journal.pone.0178159 |
| [14] | Wasternack C, Miersch O, Kramell R, et al. Jasmonic acid biosynthesis signal transduction gene expression[J]. Fett Lipid, 1998, 100: 139–146. DOI:10.1002/(ISSN)1521-4133 |
| [15] | Vick BA, Zimmerman DC. Biosynthesis of jasmonic acid by several plant species[J]. Plant Physiol, 1984, 75: 458–461. DOI:10.1104/pp.75.2.458 |
| [16] | Brash AR, Baertschi SW, Ingram CD, et al. Isolation and characterization of natural allene oxides:unstable intermediates in tire metabolism of lipid hydroperoxides[J]. Proc Natl Acad Sci U S A, 1988, 85: 3382–3386. DOI:10.1073/pnas.85.10.3382 |
| [17] | Laudert D, Pfarmschmidt U, Lottspeich F, et al. Cloning molecular and functional characterization of Arabidopsis thaliana allene oxide synthase (CYP74), the first enzyme of the octadecanoid pathway to jasmonates[J]. Plant Mol Biol, 1996, 31: 323–335. DOI:10.1007/BF00021793 |
| [18] | Laudert D, Weiler EW. Allene oxide synthase:a major control point in Arabidopsis thaliana octadecanoid signaling[J]. Plant J, 1998, 15: 675–684. DOI:10.1046/j.1365-313x.1998.00245.x |
| [19] | Agrawal GK, Tamogami S, Han O, et al. Rice octadecanoid pathway[J]. Biochem Biophys Res Commun, 2004, 317: 1–15. DOI:10.1016/j.bbrc.2004.03.020 |
| [20] | Mei CS, Qi M, Sheng GY, et al. Inducible overexpression of a rice allene oxide synthase gene increases the endogenous jasmonic acid levels, PR gene expression, and host resistance to fungal infection[J]. Mol Plant Microbe Interact, 2006, 19: 1127–1137. DOI:10.1094/MPMI-19-1127 |
| [21] | Haga K, Iino M. Phytochrome-mediated transcriptional up-regulation of allene oxide synthase in rice seedlings[J]. Plant Cell Physiol, 2004, 45: 119–128. DOI:10.1093/pcp/pch025 |
| [22] | Sivasankar S, Sheldrick B, Rothstein SJ. Expression of allene oxide synthase determines defense gene activation in tomato[J]. Plant Physiol, 2000, 122: 1335–1342. DOI:10.1104/pp.122.4.1335 |
| [23] | Zhang TT, Wang CL, Han RL, et al. Construction of pET32a prokaryotic expression vector of C4H gene in Salvia miltiorrhiza[J]. J Northwest Agric Forest Univ (Nat Sci) (西北农林科技大学学报自然科学版), 2011, 39: 158–162. |
| [24] | Zeng XL, Zheng RR, Luo J, et al. Cloning and characterization of cinnamate 4-hydroxylase (C4H) genes from Osmanthus fragrans[J]. Acta Hort Sin (园艺学报), 2016, 43: 525–537. |
| [25] | Wang MX, Lu Ping, Xu Fei, et al. Expression analysis of allene oxide synthase gene from Herba Catharanthi rosei[J]. Acta Bot Boreal-Occid Sin (西北植物学报), 2012, 32: 2365–2373. |
| [26] | Choi DW, Jung J, Ha YI, et al. Analysis of transcripts in methyl jasmonate-treated ginseng hairy roots to identify genes involved in the biosynthesis of ginsenosides and other seconddary metabolites[J]. Plant Cell Rep, 2005, 23: 557–566. DOI:10.1007/s00299-004-0845-4 |
| [27] | Choi B, Ghosh R, Gururani MA, et al. Positive regulatory role of sound vibration treatment in Arabidopsis thaliana against Botrytis cinerea infection[J]. Sci Rep, 2017, 7: 2527. DOI:10.1038/s41598-017-02556-9 |
| [28] | Maucher H, Hause B, Feussner I, et al. Allene oxide synthases of barley (Hordeum vulgare cv[J]. Plant J, 2000(21): 199–213. |
| [29] | Okudera Y, Ito M. Production of agarwood fragrant constituents in Aquilaria calli and cell suspension cultures[J]. Plant Biotechnol, 2009, 26: 307–315. DOI:10.5511/plantbiotechnology.26.307 |
 2017, Vol. 52
2017, Vol. 52


