当温度上升至43 ℃时, 热能会使细胞受损。光热治疗(photo-thermal therapy, PT)作为一种治疗恶性肿瘤的新方法, 即利用光热转换效率高的光热剂, 在外部光源(一般是近红外光)的照射下将光能转化为热能, 进而杀死肿瘤细胞, 一般光照时间短, 材料无毒无害, 具有很大的发展潜力[1]。吲哚菁绿(indocyanine green, ICG)是一种合成的三羧花菁系的小分子光热剂, 能高效地将光能转化成热能, 是目前唯一被美国食品药品管理局批准用于临床的成像试剂, 其光热转换能力使其在肿瘤光热疗法中运用广泛[2]。大量研究表明, 光热疗法和化疗的联用能协同诱导肿瘤细胞的凋亡和坏死, 近年来越来越受到研究者的关注。Tang等[3]发现游离的ICG与多柔比星(doxorubicin, DOX)联用后对肿瘤细胞的杀伤作用最强。但ICG血浆半衰期极短, 只有2~4 min, 进入血液循环后98% ICG会迅速结合血浆蛋白, 被肝脏代谢[4]。为了延长游离药物的体内循环时间, 增加其肿瘤蓄积浓度, 可以设计合适的纳米递药系统通过增强的渗透和滞留效应(enhanced permeability and retention effect, EPR)提高药物在肿瘤部位的蓄积, 减少毒副作用。因此, 构建生物相容性良好的负载ICG的载体, 具有十分重要的意义。
相较于人工合成材料, 一些天然多糖如透明质酸、壳聚糖和肝素等由于其无免疫原性和无毒性被越来越多地用于制备纳米粒[5]。肝素作为内源聚阴离子, 具有良好的生物相容性, 可降解性以及亲水性。大量文献报道, 肝素及其衍生物不仅具有抗凝血功能, 还具有抑制新生血管和抗肿瘤转移等作用[6]。但普通未分级肝素容易引起出血和血小板减少的症状, 临床应用受到了一定限制。与之相比, 低分子量肝素(low molecular weight heparin, LH)由普通肝素经降解处理, 分子量更小, 安全性大大提高, 同时具有与普通肝素相似的抗肿瘤转移活性[7]。另外, 临床研究表明, 低分子量肝素通过抑制肿瘤细胞的迁移和黏附, 能明显延长癌症患者生存期[8]。
聚合物胶束作为一种有效的抗肿瘤药物载体, 能够装载疏水性抗肿瘤药物并靶向递送至肿瘤部位, 减少在其他部位蓄积, 并保护药物在生物介质中不被降解, 进而提高治疗效果[9]。在本实验室的前期研究中, 曾将LH与DOX通过pH敏感酰胺键相连, 得到具有抗肿瘤及抗转移功能的LH-DOX聚合物胶束[10]。基于此, 本课题将光热剂ICG物理包载于聚合物胶束LH-DOX中, 得到LH-DOX/ICG胶束, 该胶束在激光照射下, 光热剂ICG产生高热效应, 使肿瘤细胞凋亡, 从而发挥光热治疗和化学治疗的协同作用。本文构建并表征了LH-DOX/ICG胶束, 初步评价了其对黑色素瘤细胞的抗肿瘤及抗转移活性。
材料与方法材料 低分子量肝素(LH)、多柔比星(DOX) (大连美仑生物技术有限公司); 吲哚菁绿(ICG, 日本Tokyo Chemical Industry公司); 6-氨基乙酸、氯化亚砜(北京百灵威科技有限公司); 1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS) (成都贝斯特试剂有限公司); B16F10鼠源性黑色素瘤细胞(中国科学院上海细胞生物学研究所); DMEM培养基、胰蛋白酶(美国Gibco公司); 胎牛血清(FBS, 美国Hyclone公司); 青霉素-链霉素溶液、3-(4, 5-二甲基噻唑基)-2, 5-二苯基四氮唑溴盐(MTT) (碧云天生物技术有限公司); Calcein-AM/PI活细胞/死细胞双染试剂盒(上海翊圣生物科技有限公司); Annexin V-FITC/PI凋亡检测试剂盒(南京凯基生物科技发展有限公司); 其他试剂均为市售分析纯。
仪器 电子分析天平(BT 25S, 德国Sartorius公司); NanoSZ900激光纳米粒度及电位分析仪(Nano ZS90, 英国Malvern公司); 透射电子显微镜(JEM-100SX, 日本JEOL公司); 化学发光仪(Varioskan Flash instrument, 美国Thermo Scientific公司); 红外二极管激光器(MDL-Ⅲ-808, 长春新产业光电技术有限公司); 二氧化碳培养箱(Forma 311, 美国Thermo Fisher公司); 恒温空气摇床(ZHWY-100H, 上海智城分析仪器制造有限公司); 冷冻离心机(Centrifuge 5415R, 德国Eppendorf公司); 倒置显微镜(40CFL Axiovert 40, 德国Carl Zeiss公司); 激光扫描共聚焦显微镜(FV 1000, 日本Olympus公司); 流式细胞仪(CytomicsTM FC500, 美国Beckman Coulter公司)。
pH敏感胶束材料LH-DOX的合成 LH-DOX胶束的合成参考本实验前期的研究[10]。氨基己酸乙酯(linker)的合成:三口瓶中加入无水乙醇50 mL, 冰浴下滴加重蒸的SOCl2 5 mL。逐步加入氨基己酸13.1 g, 升温至75 ℃左右, 回流反应7 h, 减压蒸出过量的SOCl2和乙醇, 残余物固化, 重结晶后得白色固体。
Linker酰肼的合成 精密称取氨基己酸乙酯414.5 mg, 溶于10 mL无水乙醇中, 加入80%水合肼80 μL, 70 ℃避光反应6 h, 得粗品。过硅胶柱分离得纯品。
Linker-DOX片段的合成 精密称取DOX 15.0 mg, 溶于5 mL甲醇中, 充分溶解后加入linker酰肼, 缓慢滴加三氟醋酸20 μL, 室温避光反应24 h, 减压蒸出过量的甲醇, 得粗品, 过柱分离得纯品。
低分子量肝素-多柔比星(LH-DOX)的合成 低分子量肝素于甲酰胺中溶解, 加适量EDC, NHS避光反应6 h, 加入疏水片段linker-DOX, 避光反应48 h, 最终合成腙键连接的两亲性聚合物。
载吲哚菁绿胶束(LH-DOX/ICG)的制备 将ICG的DMSO溶液(1 mg·mL-1)滴加到LH-DOX的DMSO溶液(5 mg·mL-1)中, 滴加完毕后搅拌2 h保证与胶束充分作用, 透析12 h后冻干。
粒径、电位及形态学观察 取上述条件下制备的LH-DOX/ICG 100 μL, 用纯水稀释至1 mL, 采用激光纳米粒度及电位分析仪测定其粒径和zeta电位。另取适量LH-DOX/ICG样品, 滴在覆有支持膜的铜网上, 用2%磷钨酸负染干燥后置于透射电镜下拍照。
载药量和包封率的测定 配制质量浓度为0.05、0.20、0.25、0.5、1.0、2.5和5.0 μg·mL-1 DOX溶液, 于化学发光仪(Ex = 470 nm, Em = 590 nm)测量其荧光强度, 并绘制标准曲线。配制质量浓度为1.25、2.5、5.0、7.5、10.0、15.0和20.0 μg·mL-1 ICG, 于紫外分光光度计(779 nm)测量其吸光度值, 并绘制标准曲线。取适量LH-DOX/ICG样品, 加入一定量的纯水稀释后, 分别测定DOX的荧光强度和ICG的吸光度, 并用上述实验所得标准曲线计算ICG和DOX的浓度、载药量及包封率。载药量=载体中ICG或DOX的质量/总质量× 100%;包封率=载体中ICG的质量/ ICG总量× 100%。
血清稳定性考察 将各组胶束分别与等体积的FBS混合均匀, 并置于37 ℃恒温空气摇床中缓慢振摇, 分别于0、2、4、6、8、12、24和48 h取样, 经化学发光仪测定样品在750 nm波长处的透光率。
体外释放实验[11] DOX释放的考察:取已知浓度的LH-DOX/ICG胶束0.4 mL, 置于透析袋(分子质量8~14 kDa)中, 用夹子夹闭透析袋, 并将其置于装有40 mL、pH分别为5.0、6.5和7.4磷酸盐缓冲液(PBS)的离心管中, 将离心管置于空气摇床中, 在37 ℃、60 r·min-1条件下振摇。在0.5、1、2、4、6、8、12、24和48 h取出0.1 mL介质留样检测, 同时补充等温等体积介质。所得样品稀释同等倍数后, 所得样品用化学发光仪测定荧光强度(Ex = 470 nm, Em = 590 nm), 并计算DOX的浓度, 绘制释放曲线。
ICG释放的考察:将已知浓度的LH-DOX/ICG胶束分成若干等份后, 分别放入透析袋中, 并置于10%胎牛血清(FBS)和PBS (pH 7.4)的释放介质中避光震荡, 于特定时间点取出一个透析袋, 将胶束溶液加入适量甲醇破坏, 游离出所负载的ICG。用紫外分光光度计测定吸光度(779 nm), 并计算ICG的浓度, 绘制释放曲线。ICG的释放率= (M0 -Msample) / M0 × 100%, 其中Msample和M0分别代表特定时间测出的LH-DOX/ICG胶束中残余ICG的量和加入已知浓度的LH-DOX/ICG胶束中ICG量。
溶血性考察[12] 取健康BALB/c小鼠全血, 3 000 r·min-1离心5 min, 弃去上清液, 细胞沉淀用PBS (pH 7.4)洗涤3次, 直至上清液不再显红色。用PBS将其配制成2%红细胞悬液备用。用PBS将LH-DOX和LHDOX/ICG胶束分别稀释成浓度为1 500、750、375、187.5、93.75和46.875 nmol·mL-1溶液, 并取以上两组不同浓度的胶束溶液0.5 mL, 与等体积2%红细胞悬液充分混匀作为实验组。另取2%红细胞悬液0.5 mL, 分别加入等体积的PBS和超纯水, 作为阴性对照组和阳性对照组。每组平行3份, 在37 ℃摇床中孵育1 h后, 取出离心(3 000 r·min-1, 10 min), 沉淀的红细胞用PBS分散后, 于显微镜下观察其形态。将上清液加入96孔板中, 每孔200 μL, 于化学发光仪测定吸光度(540 nm), 按以下公式计算:溶血率= (Asample -A(-)control) / (A(+)control -A(-)control)。其中, Asample、A(-)control和A(+)control分别表示样品、阴性对照组和阳性对照组在540 nm处的吸光度值。
体外光热效应的考察 分别配制ICG、LH-DOX和LH-DOX/ICG样品溶液(ICG浓度为2 μg·mL-1), 在外部近红外光源(808 nm、2W·cm-2)照射300 s, 同时采用电子温度计测量溶液温度。自0 s开始, 每间隔25 s读取并记录各样品温度。
划痕愈合实验 采用细胞划痕愈合法评价LH-DOX/ICG胶束对细胞迁移运动与修复能力的影响。B16F10细胞以3×105个/孔接种于6孔板内, 24 h后, 在6孔板的单层贴壁细胞上, 用200 μL的枪头在细胞生长的中央区域划线, 去除中央部分的细胞, 用PBS清洗3次, 将含有LH-DOX (4 μg·mL-1 DOX)、LH-DOX/ICG (4 μg·mL-1 DOX、2 μg·mL-1 ICG)和LH-DOX与ICG的混合溶液(4 μg·mL-1 DOX、2 μg·mL-1 ICG)的培养基分别加入各孔内。孵育6 h后, 对激光照射组进行激光处理(808 nm、2 W·cm-2, 300 s), 随后继续孵育; 无激光照射组不处理。当孵育总时间达到12 h时, 取出6孔板, 在显微镜下观察划痕边界并拍照记录, 用Image J测量各组划线之间的距离并计算迁移率。迁移率计算公式如下:迁移率= (D0 h -D12 h) / D0 h × 100%, 其中D0 h、D12 h分别为0、12 h的各组划痕之间的距离。
细胞毒性实验 用DMEM培养基分别配制DOX质量浓度为0.1、0.8、4和20 μg·mL-1游离DOX、LH-DOX、LH-DOX/ICG溶液及LH-DOX与ICG的混合溶液备用。将B16F10细胞以2×103个/孔接种于96孔板中, 培养24 h后, 移除培养基后加入上述系列浓度的含有DOX溶液。其中LH-DOX+ ICG+laser与LH-DOX/ICG+laser组给予808 nm、2 W·cm-2激光辐射300 s。24 h时, 移除培养基, 用冷PBS洗涤, 每孔加入无血清DMEM培养基150 μL和5 mg·mL-1 MTT溶液20 μL。37 ℃孵育4 h后, 移除培养基, 每孔加入DMSO 200 μL, 在37 ℃、70 r·min-1摇床中孵育30 min。用化学发光仪在490 nm处测定各孔的吸光度(A实验), 以DMSO溶液的孔作为空白(A空白), 以给药的孔作为对照组(A对照), 测量并计算每孔的细胞存活率。公式如下:存活率= (A实验 -A空白) / (A对照 -A空白) × 100%。
细胞凋亡实验 采用Annexin V-FITC/PI双染细胞凋亡检测试剂盒和Calcein-AM/PI双染试剂盒考察各组胶束诱导B16F10细胞凋亡的能力。将B16F10细胞以3×105个/孔接种于6孔板内, 培养24 h后, 将含有LH-DOX (4 μg·mL-1 DOX)、LH-DOX/ICG (4 μg·mL-1 DOX、2 μg·mL-1 ICG)的培养基分别加入各孔内, 每组分别设置3个复孔。孵育6 h后, 对激光照射组进行激光处理(808 nm、2 W·cm-2, 300 s), 随后继续孵育。当孵育总时间达到12 h时, 将两组的细胞分别消化, 用冷PBS洗涤, 加入100 μL binding buffer重悬细胞, 并依次加入Annexin V-FITC 5 μL和PI 5 μL, 混合均匀后室温避光染色15 min, 通过流式细胞仪检测细胞的凋亡情况。
B16F10细胞以3×105个/孔接种于铺有盖玻片的6孔板内。孵育24 h后, 将含有LH-DOX (4 μg·mL-1 DOX)、LH-DOX/ICG (4 μg·mL-1 DOX、2 μg·mL-1 ICG)和LH-DOX与ICG的混合溶液(4 μg·mL-1 DOX、2 μg·mL-1 ICG)的培养基分别加入各孔内, 每组分别设置3个复孔。孵育6 h后, 对激光照射组进行激光处理(808 nm、2 W·cm-2, 300 s), 随后继续孵育。当孵育总时间达到12 h时, 用PBS洗涤3次后, 每孔加入400 μL Calcein-AM/PI工作液染色15 min, 在激光共聚焦显微镜下拍摄记录各组的凋亡情况。
统计学分析 采用SPSS 17.0统计软件进行统计学分析, 数据用x±s表示, 组间比较采用单因素方差分析(one-way ANOVA), 以P < 0.05为差异有统计学意义。
结果 1 粒径、电位及形态学观察所制备的LH-DOX/ICG胶束表征如图 1所示, 胶束的粒径为(148.7 ± 2.1) nm, zeta电位为(-30.7 ± 1.1) mV, 呈负电性。在透射电镜(TEM)下可见, 胶束大小均一, 形状规则, 大多呈类球形。
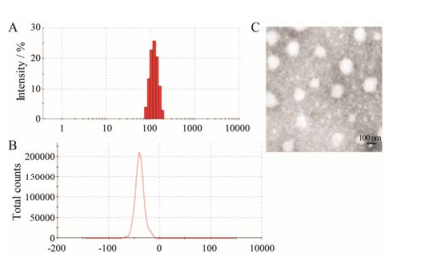
|
Figure 1 Dynamic light scattering (DLS) analysis (A, B). The transmission electron microscopy (TEM) image of heparin-doxorubicin/ indocyanine green (LH-DOX/ICG) micelles (C) |
分别用化学发光仪和紫外分光光度计测量并绘制DOX和ICG的标准曲线, 如图 2所示。DOX的标准曲线为y = 5.887 3 x + 0.698 8, R2 = 0.999 2, 表明在0.05~5.00 μg·mL-1内DOX线性关系良好; ICG的标准曲线y = 0.088 3 x + 0.021 8, R2 = 0.999 6, 表明在1.25~20.00 μg·mL-1内ICG线性关系良好。分别测定LH-DOX/ICG胶束中DOX和ICG的荧光强度和吸光度值, 计算得到DOX的载药量为(11.82 ± 1.30) %, ICG的载药量和包封率分别为(5.59 ± 0.91) %和(85.63 ± 3.62) %。

|
Figure 2 The standard curves of DOX (A). The standard curves of ICG (B). n = 3, x±s |
通过浊度法评价胶束在血清中的稳定性。如图 3所示, LH-DOX、LH-DOX/ICG胶束与50% FBS共孵育后, 48 h内均无明显聚集或沉淀形成, 透光率均在90%以上, 表明两种胶束均具有良好的血清稳定性。
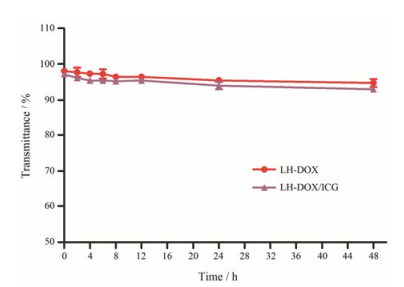
|
Figure 3 The variations of transmittance of different micelles in 50% FBS phosphate buffer. n = 3, x±s |
采用透析袋法对LH-DOX/ICG胶束的体外释放行为进行考察[13]。当pH为7.4时, DOX很难从胶束中释放, 48 h时释放度仅为(24.6 ± 3.60) %; 当pH为6.5和5.0时, 释放明显增加, 分别达到(68.3 ± 4.43) %和(75.6 ± 6.03) % (图 4A)。结果表明, 该胶束在pH 5.0~6.5偏酸性条件下, LH-DOX/ICG胶束中的DOX更容易释放。为了模拟体内环境, 本课题使用含10% FBS的PBS作为释放介质(图 4B), 48 h时, ICG在10% FBS中的释放率小于35%, 在PBS中的释放率小于20%, 表明LH-DOX/ICG胶束对ICG较好的保护作用。

|
Figure 4 The release profiles of LH-DOX/ICG in vitro. A: The DOX release profiles of LH-DOX/ICG at different pH; B: The ICG release profiles of LH-DOX/ICG at different medium. n = 3, x±s |
在显微镜下可见, 红细胞与不同浓度LH-DOX和LH-DOX/ICG胶束溶液孵育后, 形态仍保持正常, 与PBS组并无明显差异(图 5A); 由左至右两种胶束的浓度从高到低, 各浓度下的胶束均未引起红细胞破裂(图 5B); LH-DOX和LH-DOX/ICG胶束的溶血率均小于5% (图 5C)。以上结果显示浓度范围在46.875~1 500 nmol·mL-1 LH-DOX和LH-DOX/ICG胶束均不会引起红细胞溶血, 表明胶束具有良好的生物相容性。

|
Figure 5 The safety evaluation of different micelles. A: Microscopic images of red blood cells exposed to different micelles; B: Photo images of tubes containing supernatant from red blood cells exposed to LH-DOX and LH-DOX/ICG at varying concentrations. PBS and UP water were used as negative and positive controls, respectively. C: Graphical representation of percent hemolysis by different micelles. n = 3, x±s |
据文献[14, 15]报道, ICG质量浓度大于2 μg·mL-1时, 能够触发高热效应, 43 ℃以上的高温即会对肿瘤细胞的细胞骨架和细胞膜产生不可逆损伤。如图 6结果显示, LH-DOX/ICG胶束组与游离ICG组均能在激光照射下发生光热转换, 触发高热效应, 在照射时间达到300 s时, 溶液温度升高至45 ℃, 两组之间无明显差异, 表明物理包载过程对ICG的光热性能并无影响。而LH-DOX组由于不含ICG, 不能引起光热转换使溶液温度升高。

|
Figure 6 The photo-thermal effect of different formulations. n = 3, x±s |
细胞迁移运动在肿瘤转移中扮演重要角色, 因此采用划痕愈合实验考察LH-DOX/ICG胶束对B16F10细胞迁移运动与修复能力的影响[16]。对照组在划痕后12 h, B16F10细胞通过迁移填满划痕区域; 当加入LH-DOX、LH-DOX+ICG和LH-DOX/ICG后, 划痕区域的愈合情况明显受到抑制而减慢; 由图 7可见, 在给予激光照射后, LH-DOX+ICG和LH-DOX/ICG组的迁移率显著地低于LH-DOX组, 表明在激光照射后ICG能够发挥抑制肿瘤迁移的作用。LH-DOX+ICG和LH-DOX/ICG组的迁移率分别为(35.92 ± 3.67) %和(13.23 ± 2.42) %, 两者间有显著性差异, 导致这一现象的原因: LH-DOX+ICG组中的ICG为游离状态, 稳定性较差, 在进入细胞的过程中部分被破坏; 而LH-DOX/ICG组中, 胶束将ICG包载于内核, 起到保护作用, 故LH-DOX/ICG能在激光照射下更好地发挥抑制肿瘤细胞迁移运动与修复能力。

|
Figure 7 Effect of B16F10 cells scratch metastasis by different formulations. A: The macroscopic scratch healing images of different formulations; B: The migration rate of different formulations. n = 3, x±s. **P < 0.01, ***P < 0.001 vs LH-DOX/ICG group with laser irradiation |
采用MTT法考察胶束对B16F10细胞的毒性。图 8A所示, 游离DOX和LH-DOX胶束对B16F10细胞都有一定程度的毒性, 并且杀伤作用与DOX呈剂量依赖关系; 在相同的DOX浓度下, LH-DOX胶束的毒性要低于游离的DOX。图 8B所示, 在无激光照射时, LH-DOX、LH-DOX+ICG和LH-DOX/ICG对B16F10细胞都有一定程度的毒性, 并且杀伤作用与DOX呈剂量依赖关系, 但三者之间并没有显著性差异。当给予激光照射后, LH-DOX+ICG和LH-DOX/ ICG组的细胞存活率进一步降低, 但LH-DOX/ICG组的存活率仍低于LH-DOX+ICG组, 且有显著性差异, 原因是游离的ICG不稳定, 而LH-DOX/ICG胶束将ICG包载于疏水核心, 保护ICG不被降解, 故LH-DOX/ICG能在激光照射下更好地抑制肿瘤细胞生长。

|
Figure 8 In vitro cytotoxicity assay of different DOX formulations on B16F10 cells. A: The cytotoxicity study of free DOX and LH-DOX micelles; B: The cytotoxicity study of LH-DOX, LH-DOX+ICG and LH-DOX/ICG with or without laser irradiated. n = 5, x±s. *P < 0.05 vs DOX group; △P < 0.05, △△△P < 0.001 vs LH-DOX+ICG+laser group; ▲P < 0.05, ▲▲P < 0.01 vs LH-DOX/ ICG+laser group |
采用Annexin V-FITC/PI双染细胞凋亡检测试剂盒和Calcein-AM/PI双染试剂盒考察各组胶束诱导B16F10细胞凋亡的能力[17]。正常细胞Annexin V-FITC和PI染色均为阴性, 早期凋亡阶段的细胞Annexin V-FITC阳性而PI阴性, 晚期凋亡阶段和坏死的细胞Annexin V-FITC和PI均为阳性。由图 9A可见, 配合激光照射的LH-DOX/ICG组诱导细胞凋亡和坏死的数量显著高于LH-DOX组和未给予激光照射的LH-DOX/ICG组; Calcein-AM标记活细胞, PI标记死细胞, 图 9B显示出与图 9A相同的结果, 应注意到的是, 在激光照射下, LH-DOX/ICG组的凋亡细胞数量高于LH-DOX+ICG组, 其原因与ICG的稳定性有关, LH-DOX/ICG组中的ICG由于被胶束包载保护, 其稳定性高于LH-DOX+ICG组中游离的ICG, 故在激光照射下LH-DOX/ICG胶束能够更好地对B16F10细胞进行有效的化疗及光热协同治疗。
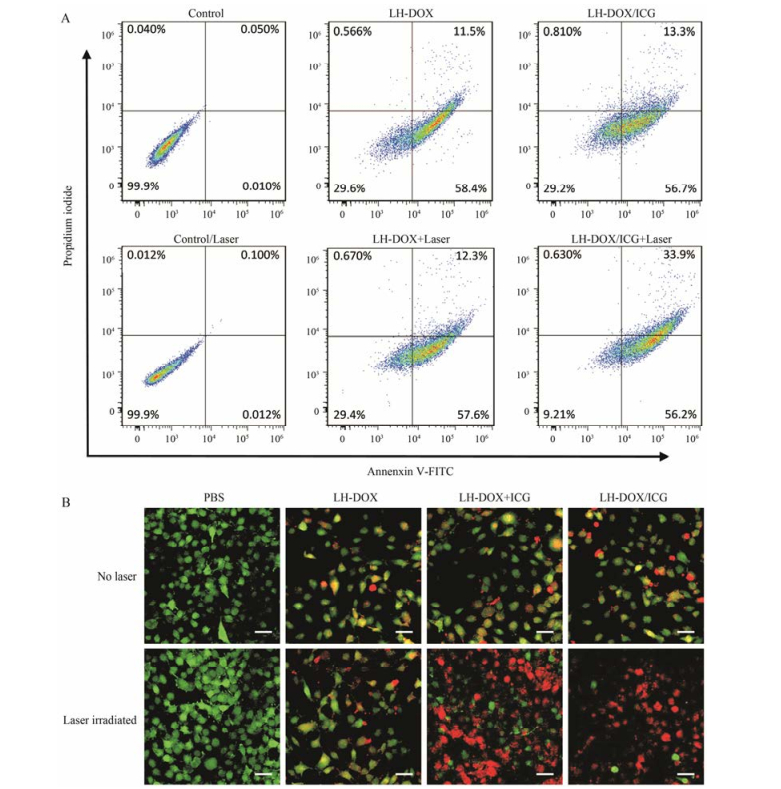
|
Figure 9 Cell survivals of B16F10 cells after chemo-photothermal treatment. A: Flow cytometry analysis of B16F10 cells after chemo-photothermal treatment. B: Confocal images of B16F10 cells after chemo-photothermal treatment. Viable cells were stained green with calcein-AM, and dead/later apoptosis cells were stained red with PI (scale bar, 35 μm) |
本课题构建的两亲性聚合物胶束LH-DOX/ICG, 在生理等渗缓冲液中自组装形成大小均一, 形态规则的类球形纳米级别胶束。研究表明, 粒径在100~200 nm内的纳米粒能通过实体瘤的高通透性和EPR效应被动靶向到肿瘤部位[18]。本课题构建的LH-DOX/ ICG粒径为(148.7 ± 2.1) nm, 呈负电荷, 满足了被动靶向的基本条件。
为了验证该聚合物胶束的pH响应性, 考察了不同pH下LH-DOX/ICG中DOX的释放行为。结果表明, 当缓冲介质的pH从7.4下降至6.5时, 在相同孵育时间下DOX的释放明显增加。这说明该胶束中连接两亲性片段的腙键在环境pH下降后, 能成功断裂并释放DOX。此外, 还考察了ICG的释放行为, 其在pH 7.4的磷酸盐缓冲液中释放缓慢, 无突释情况出现; 在模拟体内循环环境的10% FBS介质中, ICG的释放稍快。
热疗对细胞的杀伤作用存在临界温度, 通常肿瘤细胞的临界温度在42.5~43 ℃, 极少数细胞可达44 ℃[19]。ICG作为一种光热剂, 一般以游离形式给药。将ICG包载在胶束中, 对其光热效应进行了考察。结果表明, 胶束具有优异的光热转化能力, ICG在以物理包载的方式载入LH-DOX/ICG胶束后并不影响其光热转化能力。
据文献[10]报道, 疏水片段LH具有抗转移功能。划痕愈合实验表明, LH-DOX/ICG胶束在配合激光照射下, 迁移率最低, 表明化疗-光热治疗发挥协同作用, 提高抗迁移效果。
为了验证LH-DOX/ICG胶束对肿瘤细胞的杀伤作用, 考察了LH-DOX/ICG胶束对B16F10细胞的细胞毒性。当给予LH-DOX/ICG组激光照射后, 发现B16F10细胞存活率明显下降, 与未照射组和LH-DOX+ICG组相比呈显著性差异, 达到联合化疗和光热治疗作用, 提高了抗肿瘤的效果。而这一效果在对B16F10细胞的凋亡诱导实验中也得到了证实。当LH-DOX/ICG组配合激光照射后, 可以发现B16F10细胞凋亡和坏死数量明显上升, 与LH-DOX+ICG组相比呈显著性差异, 这是因为LH-DOX/ICG组的ICG包载于胶束疏水内核, 较好地保护了ICG不被降解, 故LH-DOX/ICG胶束能更好地发挥光热转化作用。由此可见, LH-DOX/ICG胶束对细胞的化疗-光热治疗具有协同作用, 可增强细胞杀伤能力, 提高疗效。
本课题制备了共载化疗药物DOX和光热剂ICG的LH-DOX/ICG胶束, 联合化疗和光热治疗, 发挥了对黑色素瘤细胞的抗肿瘤和抗转移作用。后续工作将进一步探索该制剂在动物体内的药效学以及药代动力学, 为临床研究提供更多的理论依据。
| [1] | Chen YW, Su YL, Hu SH, et al. Functionalized graphene nanocomposites for enhancing photothermal therapy in tumor treatment[J]. Adv Drug Deliver Rev, 2016, 105: 190–204. DOI:10.1016/j.addr.2016.05.022 |
| [2] | Zheng M, Yue C, Ma Y, et al. Single-step assembly of DOX/ICG loaded lipid-polymer nanoparticles for highly effective chemo-photothermal combination therapy[J]. ACS Nano, 2013, 7: 2056–2067. DOI:10.1021/nn400334y |
| [3] | Tang Y, McGoron AJ. Combined effects of laser-ICG photothermotherapy and doxorubicin chemotherapy on ovarian cancer cells[J]. J Photochem Photobiol B, 2009, 97: 138–144. DOI:10.1016/j.jphotobiol.2009.09.001 |
| [4] | Zhao P, Zheng M, Yue C, et al. Improving drug accumulation and photothermal efficacy in tumor depending on size of ICG loaded lipid-polymer nanoparticles[J]. Biomaterials, 2014, 35: 6037–6046. DOI:10.1016/j.biomaterials.2014.04.019 |
| [5] | Li JZ, Yuan ZQ, Yan M, et al. pH-Sensitive micelles loaded paclitaxel using carboxymethyl chitosan-palmitic acid mediated by cRGD[J]. Acta Pharm Sin (药学学报), 2016, 51: 642–649. |
| [6] | Chalkiadaki G, Nikitovic D, Katonis P, et al. Low molecular weight heparin inhibits melanoma cell adhesion and migration through a PKCa/JNK signaling pathway inducing actin cytoskeleton changes[J]. Cancer Lett, 2011, 312: 235–244. DOI:10.1016/j.canlet.2011.08.016 |
| [7] | Young E, Venner T, Ribau J, et al. The binding of unfractionated heparin and low molecular weight heparin to thrombin-activated human endothelial cells[J]. Thromb Res, 1999, 96: 373–381. DOI:10.1016/S0049-3848(99)00125-5 |
| [8] | Norrby K. Low-molecular-weight heparins and angiogenesis[J]. APMIS, 2006, 114: 79–102. DOI:10.1111/apm.2006.114.issue-2 |
| [9] | Yin XL, Zhang B, Liu YJ, et al. Advances in polymer-drug conjugated micelles in the delivery of anticancer drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 710–716. |
| [10] | Mei L, Liu Y, Xia C, et al. Polymer-drug nanoparticles combine doxorubicin carrier and heparin bioactivity functionalities for primary and metastatic cancer treatment[J]. Mol Pharm, 2017, 14: 513–522. DOI:10.1021/acs.molpharmaceut.6b00979 |
| [11] | Zhang HW. Co-delivery of Indocyanine Green and Doxorubicin from Chitosan-based Micelle System and Their Use in Near-infrared Photothermal-Chemotherapy (壳聚糖基复合胶束体系用于共负载吲哚菁绿与阿霉素的肿瘤光热化疗的研究)[D]. Hangzhou:Zhejiang University, 2012. http://d.wanfangdata.com.cn/Thesis/Y2262684 |
| [12] | Patel PM, Patel R, Wadia D, et al. Dendritic macromolecules as nano-scale drug carriers:phase solubility, in vitro drug release, hemolysis and cytotoxicity study[J]. Asian J Pharm Sci, 2015, 10: 306–313. DOI:10.1016/j.ajps.2015.04.002 |
| [13] | Manchun S, Dass CR, Sriamornsak P. Stability of freeze-dried pH-responsive dextrin nanogels containing doxorubicin[J]. Asian J Pharm Sci, 2016, 11: 648–654. DOI:10.1016/j.ajps.2015.09.006 |
| [14] | Wust P, Hildebrandt B, Sreenivasa G, et al. Hyperthermia in combined treatment of cancer[J]. Lancet Oncol, 2002, 3: 487–497. DOI:10.1016/S1470-2045(02)00818-5 |
| [15] | Hung CC, Huang WC, Lin YW, et al. Active tumor permeation and uptake of surface charge-switchable theranostic nanoparticles for imaging-guided photothermal/chemo combinatorial therapy[J]. Theranostics, 2016, 6: 302. DOI:10.7150/thno.13686 |
| [16] | Veiseh O, Kievit FM, Ellenbogen RG, et al. Cancer cell invasion:treatment and monitoring opportunities in nanomedicine[J]. Adv Drug Deliver Rev, 2011, 63: 582–596. DOI:10.1016/j.addr.2011.01.010 |
| [17] | Chen Y, Li H, Deng Y, et al. Near-infrared light triggered drug delivery system for higher efficacy of combined chemo-photothermal treatment[J]. Acta Biomaterial, 2017, 51: 374–392. DOI:10.1016/j.actbio.2016.12.004 |
| [18] | Maeda H, Nakamura H, Fang J. The EPR effect for macromolecular drug delivery to solid tumors:improvement of tumor uptake, lowering of systemic toxicity, and distinct tumor imaging in vivo[J]. Adv Drug Deliver Rev, 2013, 65: 71–79. DOI:10.1016/j.addr.2012.10.002 |
| [19] | Frazier N, Robinson R, Ray A, et al. Effects of heating temperature and duration by gold nanorod mediated plasmonic photothermal therapy on copolymer accumulation in tumor tissue[J]. Mol Pharm, 2015, 12: 1605–1614. DOI:10.1021/acs.molpharmaceut.5b00019 |
 2017, Vol. 52
2017, Vol. 52


