2. 中国医学科学院、北京协和医学院药物研究所 药物晶型研究中心, 晶型药物研究北京市重点实验室, 北京 100050
2. Research Centre of Polymorphic Drugs, Beijing Key Laboratory of Polymorphic Drugs, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
尼莫地平(nimodipine)是第二代二氢吡啶类钙离子拮抗剂(图 1), 可通过血脑屏障, 选择性作用于脑血管平滑肌, 扩张脑血管, 增加脑血流量, 拮抗脑血管痉挛, 能有效防止或逆转蛛网膜下腔出血所引起的缺血性损伤, 不良反应小[1]。作为常用药物, 有报道不同厂家不同批次间药品质量存在差异[2, 3], 且在最新仿制药一致性评价任务目录中也含尼莫地平片[4], 这提示控制尼莫地平的质量有着重要意义。多晶型现象是固体有机化合物普遍存在的现象, 晶型差异可能影响药物疗效[5]。而通过对药物晶型差异的研究, 可以提高药品质量、保证治疗效果[6]。尼莫地平作为经典药物, 有报道指出其具有多晶型现象[7, 8], 也有报道不同晶型尼莫地平在家兔代谢中虽有一定差异, 但有生物等效性[9]。
|
Figure 1 Structure of nimodipine |
尼莫地平不同晶型在恒河猴等大动物体内代谢差异研究鲜见报道, 且大动物实验结果与人体内代谢结果更接近。本文通过建立测定恒河猴血浆中尼莫地平含量的LC-MS方法[10, 11], 观察尼莫地平不同晶型片剂口服给药后药代动力学性质[12], 以期为尼莫地平不同晶型片剂的临床应用及提升产品质量提供实验依据。
材料与方法仪器设备 Rigaku D/max-2550粉末X射线衍射仪; TDTF-RC8MD溶出实验仪; TU-1901双光束紫外可见光分光光度计; Agilent 1200高效液相色谱仪; Agilent 6110单四极杆质谱仪。
化学试剂 尼莫地平晶型片剂(每片20 mg, 批号160601)、尼莫地平晶型对照品, 尼群地平对照品由中国医学科学院药物研究所晶型中心吕扬教授提供。尼莫地平参比片剂(批号: 1406178)购自山东新华制药股份有限公司。甲醇为LC-MS级(J.T. Baker, USA), 甲酸(HPLC级)购自TEDIA (Fairfield, USA), 实验用水制备于Milli-Q Reagent water system纯水机(Millipore, MA, USA), 其他化学试剂均为分析纯。
实验动物 恒河猴12只, 雌雄各半, 体重为4.0~4.5 kg (北京协尔鑫生物资源研究所, 许可证号SCXK2015-0011, 动物福利和实验过程遵循中国医学科学院动物伦理委员会的规定)。
X射线粉末衍射 样品处理:取样品100 mg研磨过100目筛, 称取50 mg, 对过筛样品进行X射线粉末衍射实验。检测条件: CuKα辐射, 石墨单色器, 管压40 kV, 管流150 mA, 2θ扫描范围3~80, 扫描速度8°/分, 步长0.02°。狭缝条件:发散狭缝为1°, 限高狭缝为10 mm, 防散射狭缝为1°, 接收狭缝为0.30 mm。
溶出度 根据中国药典2015版第二法要求, 以醋酸-醋酸钠(pH 4.5)缓冲液为介质, 每篮900 mL溶出介质, 37 ℃, 75 r·min-1, 30 min后取出溶液, 过滤出10 mL, 20 mL量瓶定容。精密称定标准品10 mg, 置于100 mL量瓶中, 加10 mL乙醇溶解, 用溶出介质定容至100 mL。后取出5 mL, 定容至50 mL。将样品与标准品分别测定238 nm吸光度, 每片溶出量不少于85%[13]。
LC-MS条件 实验采用Agilent 1200 HPLC系统, 色谱柱为Agilent Zorbax SB-C18 (3.5 μm, 2.1 mm × 100 mm), 柱温为30 ℃。流动相为甲醇-水(含0.05%甲酸), 以0.3 mL·min-1的速度进行洗脱。高效液相色谱仪通过ESI源连接到Agilent 6110单四极杆质谱仪上。质谱检测为正离子监测模式。干燥气流为10.0 L·min-1, 干燥气温度为350 ℃, 喷雾器压力为35.0 psi (1 psi ≈ 6.9 kPa), 毛细管电压为3 000 V。质谱检测器以选择性离子监测模式(SIM)运行, 尼莫地平和内标的m/z分别为441.1和383.1, 碎裂电压分别为50和150 V。
尼莫地平溶液的配制 精密称取尼莫地平的标准品适量, 用甲醇配制成1 mg·mL-1溶液作为储备液备用。使用前精密吸取尼莫地平的储备液用以流动相稀释成以下浓度的标准溶液: 5、2.5、1 μg·mL-1及500、250、100、50和10 ng·mL-1。
内标溶液的配制 精密称取尼群地平适量, 用甲醇配制成1 mg·mL-1尼群地平内标储备液。使用前用甲醇稀释储备液为5 μg·mL-1内标工作溶液。
尼莫地平的血浆样品制备与处理 取尼莫地平系列浓度工作溶液各15 μL、猴空白血浆135 μL、内标工作液(5 μg·L-1) 10 μL、乙酸乙酯1 mL于1.5 mL离心管中混合萃取, 涡旋3 min, 13 400 r·min-1离心10 min, 取上层溶液950 μL于1.5 mL离心管中, 氮吹仪吹干, 加入流动相75 μL复溶, 涡旋2 min, 离心10 min, 取上清进样10 μL进行LC-MS分析, 得到标准曲线的测定结果。标准曲线的浓度在0.002~1.000 mg·L-1内。
质控样品制备 方法同标准曲线, 低、中和高浓度分别为0.005、0.100和0.800 mg·L-1。取质控样品工作液15 μL、空白血浆135 μL于1.5 mL离心管中, 加入内标工作液(5 μg·L-1) 10 μL、乙酸乙酯1 mL混合萃取, 涡旋3 min, 13 400 r·min-1离心10 min, 取上层溶液950 μL于1.5 mL离心管中, 氮吹仪吹干, 加入流动相75 μL复溶, 涡旋2 min, 离心10 min, 取上清进样10 μL进行LC-MS分析。
方法特异性 考察空白血浆样品色谱图、空白血浆样品单独加入加尼莫地平和内标(IS)的色谱图及共同加入尼莫地平与内标的色谱图, 评估空白血浆中的物质对于尼莫地平的测定是否存在干扰[14]。
方法线性、准确度和精密度 该方法的线性是通过对尼莫地平与内标的峰面积比值和浓度进行加权最小二乘回归得到。精密度的变异系数要求小于20% (RSD %)。日内准确度和精密度通过在同一天内测定3个浓度的质控样品5次来确定。日间准确度和精密度是通过连续测定3天3个浓度的质控样品, 每天5次重复来确定。准确度和精密度分别由RE和RSD来表示。
方法回收率和基质效应 取空白血浆150 μL于1.5 mL离心管中, 加入内标工作液(5 μg·L-1) 10 μL、乙酸乙酯1 mL混合萃取, 涡旋3 min, 13 400 r·min-1离心10 min, 取上层溶液950 μL于1.5 mL离心管中, 氮吹仪吹干, 加入流动相75 μL复溶, 涡旋2 min, 离心10 min, 取上清液60 μL, 分别加入低、中、高浓度质控工作液15 μL, 涡旋2 min, 离心10 min, 取上清液10 μL, 进行LC-MS分析, 反复测定5次。所测结果即为尼莫地平直接溶解在空白血浆制备的上清液的峰面积值。回收率是指质控样品中尼莫地平峰面积值与尼莫地平直接溶解在空白血浆制备的上清液的峰面积值之比。基质效应是指空白血浆上清液溶解的尼莫地平的峰面积值与用流动相溶解的尼莫地平的峰面积值之比。
稳定性 处理前室温放置4 h、长期放置(-80 ℃放置30天)、反复冻融3次稳定性是将质控样品低、中、高浓度分别按对应说明的方式处理后, 按质控样品测定方法测定峰面积, 并与制备后直接进样的对应质控样品测定峰面积相比。处理后进样盘放置24 h稳定性是将制备好但未进样的样品在液相进样盘内放置24 h后再进样测定峰面积, 与处理后直接进样的质控样品对应浓度峰面积相比。
药代动力学研究 恒河猴随机分成2组, 每组6只, 雌雄各半, 分别口服给药2.5 mg·kg-1。给药前以及给药后的0.25、0.5、0.75、1、2、4、6、8、10、12、24、36和48 h于猴注射对侧前肢采血约0.5 mL置于含肝素钠离心管中, 4 ℃、4 000 r·min-1离心10 min, 取上层血浆存于-80 ℃备用, 测定时采用测定尼莫地平血浆样品的处理方法进行处理。药代动力学参数由DAS 2.0软件采用二房室模型计算获得。拟合相关药代参数用Graphpad 6.0法进行t检验。
结果 1 不同晶型制剂制备与表征尼莫地平晶A型、晶B型在熔点和X射线粉末衍射图谱上均有一定差异, 将不同晶型按照常用片剂处方进行制备, 以晶型片剂(晶A)与参比片剂(晶B)分别作为代表。
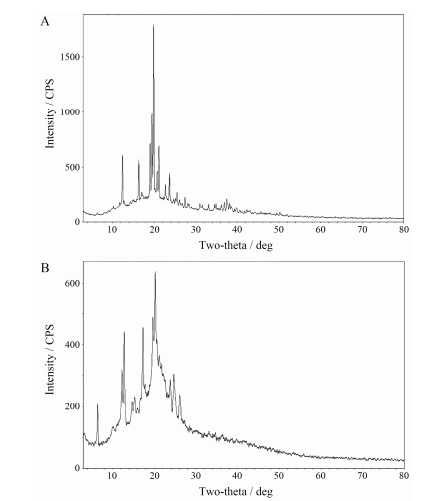
1.1 片剂表征-粉末X射线衍射分析(PXRD)从图谱(图 2)结果来看, 两种晶型片剂特征峰位置与峰强有一定差别, 两种制剂一定程度上保留了不同晶型的差异。
|
Figure 2 PXRD patterns of different crystal forms of nimodipine of batch No. 160601 (A) and 1406178 (B) |
晶型片剂与参比片剂溶出度分别为89.94%和91.13%, RSD分别为16.47%和16.84%, 均符合要求, 且比较二者溶出能力, 参比片剂比晶型片剂高1.3%, 且二者均符合药典规定的高于85%溶出度。
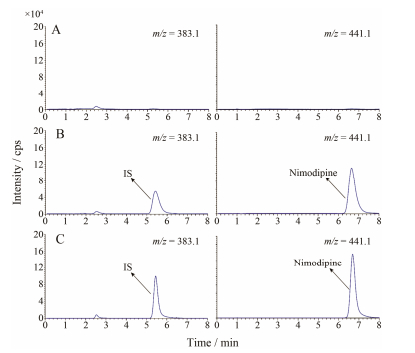
2 猴血浆尼莫地平测定方法学考察 2.1 特异性结果(图 3)表明, 尼莫地平和内标的保留时间分别为5.4和6.7 min。在保留时间范围内均没有内源性物质或其他物质的干扰, 基线噪音较小, 可满足定量测定要求。
|
Figure 3 HPLC chromatograms of biological samples with nimodipine. A: Blank plasma; B: Standard solution; C: Sample in 4 h. IS: Internal standard |
该方法标准曲线的浓度范围为0.002~1.000 mg·L-1, y = 0.049 3 x -0.075 2 (R2 = 0.999 4), 最低定量限为0.002 μg·L-1。日内与日间准确度偏差在-12.0%~6.75%之间, 日内与日间精密度在4.47%~7.91%之间。
2.3 回收率与基质效应尼莫地平在3个浓度条件下的回收率分别为(124.53 ± 0.62) %、(106.82 ± 7.53) %和(84.40 ± 0.96) %, 其RSD分别为0.50%、7.05%和1.13%。同时, 基质效应分别为(101.34 ± 0.64) %、(116.42 ± 9.06) %和(98.40 ± 2.20) %, 其RSD分别为0.62%、9.06%和2.23%。
2.4 方法稳定性尼莫地平在不同的稳定性考察条件下的RE介于-13.03%~18.7%之间, RSD在0.71%~18.99%之间。表明尼莫地平在上述样品处理及放置过程中均稳定, 能够满足恒河猴血浆中尼莫地平的测定要求。
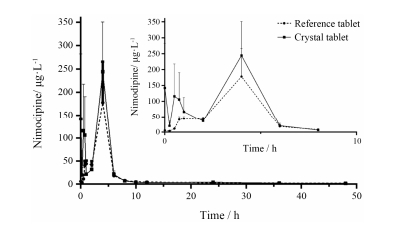
3 尼莫地平在猴体内的药代动力学 3.1 两种片剂药时曲线对比由图 4可见两种片剂达峰时间相同, 晶型片剂峰浓度相比参比片剂高了37.3%, 曲线下面积增加29.8%。图 4小图可见在给药后1~8 h段, 晶型片剂血药浓度均高于参比片剂, 说明晶型片剂在1~8 h的血药浓度上具有一定优势。
|
Figure 4 Comparison of blood concentration-time curves of nimodipine different crystal forms tablets after oral administration. n = 6, x±s |
二房室模型拟合后, 两种片剂的主要药代参数如表 1, 结果发现, 尼莫地平晶型片剂与参比片剂相比, 峰浓度更高, 同时曲线下面积也更大, 增加了31.96%, 平均滞留时间与半衰期则分别减少27%与0.96%, 清除率减少20.31%, 表观分布容积减少10.92%。两种片剂参数经t检验后可见, 虽有不同, 但均无统计学差异。
| Table 1 Main pharmacokinetic parameters of nimodipine different tablets in rhesus after orally administration |
本文建立的HPLC-MS方法检测恒河猴体内尼莫地平浓度的方法, 分析时间短、峰形好、准确度高、灵敏度高、稳定性好, 可快速检测猴血液样品中的尼莫地平浓度。目前虽有大鼠、家兔等相关动物关于尼莫地平不同晶型代谢差异的相关报道, 但未见恒河猴相关研究结果, 本研究则可以弥补相关缺失。
比较两种不同晶型尼莫地平片的药代动力学参数, 可以看出, 晶型药物片剂相比已上市药物片剂在恒河猴体内的血药峰浓度更高, 曲线下面积更大。溶出度结果显示, 上市药物比晶型片剂高1.3%, 但在动物体内的峰浓度、曲线下面积却相反, 晶型片剂比上市药物增加了31.96%, 提示动物体内的吸收与片剂的溶出度相关性较差, 不能反映片剂的体内过程。
药物不同晶型的疗效差异, 主要在吸收过程中起主要作用。但人体作为一个复杂的系统, 从吸收出现差异开始, 对应的分布、代谢、排泄都会受到一定影响, 进而表现出不同的效果。而两种片剂在排除物理溶出的影响后, 曲线下面积仍有不同, 说明吸收过程可能存在一定的差异, 而其他药代动参数结果统计上无差异, 提示两种片剂的这种吸收差异对药物在体内的整体代谢过程中影响可能不足以表现出参数上的区别。
本研究通过表征不同晶型制剂中活性组分的晶型状态, 以及体外溶出度实验证明了不同晶型尼莫地平片剂在恒河猴体内药代动力学结果存在一定不同, 提示尼莫地平制剂的临床疗效或与其晶型有密切关系。不过, 本研究没有设置标准的原研或参比制剂, 未能获得最佳的临床应用的优势晶型制剂, 后续仍需要进行深入细致的研究工作。
近年来仿制药一致性评价任务是CFDA的重要工作之一[15], 尼莫地平片作为评价目录中成员, 其质量与疗效稳定性及一致性也是重要工作组成部分。而本文结果提示, 不同晶型制剂间药代动力学结果存在一定差异, 但这种未能引起药代动力学参数水平显著差异的微小不同对不同制剂的影响程度如何, 这还有待深入研究。相信通过这些研究结果, 合理控制生产过程中尼莫地平的不同晶型的比例, 可能会得到疗效更佳更稳定的临床应用制剂。
| [1] | Zhang JT. New 1, 4 double dihydropyridine second generation of calcium channel antagonist-nimodipine[J]. Chin Pharmacol Bull (中国药理学通报), 1987, 3: 235–241. |
| [2] | Riekes MK, Pereira RN, Rauber GS, et al. Polymorphism in nimodipine raw materials:development and validation of a quantitative method through differential scanning calorimetry[J]. J Pharm Biomed Anal, 2012, 70: 188–193. DOI:10.1016/j.jpba.2012.06.029 |
| [3] | Xing C, Sun JL, Yang SY, et al. Study on the crystalline status of domestic nimodipine solid[C]//Proceeding of the Third China Crystalline Pharmaceutical Research and Development Technology Symposium (第三届中国晶型药物研发技术研讨会论文集). Tengzhou:China Pharmacological Society, 2011:7. |
| [4] | Qiang GF, Lü Y, Du GH. The present situation and development direction of the research for polymorphic drugs in China[J]. Chin J New Drug (中国新药杂志), 2009, 18: 1196–1200. |
| [5] | Du GH, Lü Y. Advantages of solid chemical drugs[J]. Chin Pharm J (中国药学杂志), 2010, 45: 5–10. |
| [6] | Huang ZL, Du GH. A survey of absorption and bioavailability of crystalline drugs[C]//Proceeding of the Third China Crystalline Pharmaceutical Research and Development Technology Symposium (第三届中国晶型药物研发技术研讨会论文集). Tengzhou:China Pharmacological Society, 2011:6. |
| [7] | Jiao LT, Zhang L, Yang DZ, et al. A variety of methods for characterization of two crystal forms of nimodipine[C]//Proceeding of the 6th National Symposium on Crystal Drug R & D Technology (第六届全国晶型药物研发技术学术研讨会论文集). Guangzhou:Chinese Crystallographic Society, 2016:1. |
| [8] | Siddiqui A, Rahman Z, Sayeed VA, et al. Chemometric evaluation of near infrared, Fourier transform infrared, and Raman spectroscopic models for the prediction of nimodipine polymorphs[J]. J Pharm Sci, 2013, 102: 4024–4035. DOI:10.1002/jps.23712 |
| [9] | Wang J, Zhang RH, Sun SY. Studies on the polymorphism of nimodipine[J]. Acta Pharm Sin (药学学报), 1995, 30: 443–448. |
| [10] | Yuan HJ, Chen DW, Liu YL, et al. Study on pharmacokinetics of nimodipine polymorphs in rabbits[J]. Chin Pharm J (中国药学杂志), 2005, 40: 609–612. |
| [11] | Qin ZZ, Chen QX, Song JK, et al. Pharmacokinetic comparison of two ozagrel polymorph forms in SD rats[J]. Acta Pharm Sin (药学学报), 2015, 50: 218–221. |
| [12] | Song JK, Zhang W, Zhang WK, et al. Pharmacokinetics of salvianolic acid A after single intravenous administration in Rhesus monkey[J]. Acta Pharm Sin (药学学报), 2015, 50: 1142–1147. |
| [13] | National Pharmacopoeia Committee. Pharmacopoeia of People's Republic Of China (中华人民共和国药典)[M]. Part 2. Beijing: China Medical Science Press, 2015: 309. |
| [14] | Xie T, Du GH. Absorption of puerarin polymorphs administrated orally in macaque[C]//Proceeding of Metabonomics of Traditional Chinese Medicine and Modern Research Forum (代谢组学与中医药现代研究学术论坛论文集). Taiyuan:China Pharmacological Society, 2013:4. |
| [15] | China Food and Drug Administration. Standardization of consistency evaluation of substance quality and consistency[EB/OL].[2017-07-10]. http://www.sda.gov.cn/WS01/CL1756/173642.html. |
 2017, Vol. 52
2017, Vol. 52


