2. 大连医科大学药学院临床药理学室, 辽宁 大连 116000
2. Department of Clinical Pharmacology, College of Pharmacy, Dalian Medical University, Dalian 116000, China
失眠症是一种常见的睡眠障碍, 即睡眠的质或量不能满足个体生理需要, 从而影响人们日常工作和生活的一种主观体验[1]。失眠患者多伴有注意力不集中、精神减退和记忆力障碍等症状[2, 3]。目前药物仍是治疗失眠的重要手段。以安定和唑吡坦为代表的第二、第三代镇静催眠药物主要针对γ-氨基丁酸(GABA)信号系统发挥睡眠调节作用, 虽然药效肯定, 但在用药过程可能会产生宿醉、肌松、耐受或反跳性失眠等症状[4, 5]。因此, 寻找具有作用机制新颖、不良反应更小的新型睡眠调节剂仍是热点。
腺苷是重要的内源性物质, 在睡眠诱导、持续和深度调节中发挥重要作用。腺苷A1和A2A受体与腺苷亲和力高且在脑组织高表达。以往研究表明, 腺苷主要通过激活A1受体抑制促觉醒神经元, 兴奋A2A受体激活睡眠神经元发出抑制信号, 抑制组胺和单胺类觉醒系统而诱导睡眠[6, 7]。因此, 激动腺苷A1和A2A受体的腺苷类似物具有促进睡眠的潜在作用, 可望开发成为新型镇静催眠药物。
天麻是具有“镇静安神”作用的传统中药。从天麻中分离得到的N6-对羟苄基-腺苷(NHBA)可显著降低小鼠自主活动, 具有明显镇静作用[8]。YZG-331是以NHBA为先导化合物进行结构改造优选出的N6-取代-腺苷衍生物。前期药理研究表明, 小鼠口服YZG-331后肌松作用轻、降压作用弱, 连续4周给药未发现明显成瘾性, 明显优于安定和唑吡坦, 现已申请国家发明专利和国际PCT[9]。
尽管YZG-331药理活性研究已见相关报道, 但其药代动力学特征尚不清楚。本研究拟应用LC-MS/MS分析方法, 研究不同性别小/大鼠口服和静脉注射不同剂量YZG-331后的血浆药代动力学特征及在主要脏器及组织的分布; 考察YZG-331与不同种属动物及人的血浆蛋白结合率和体外代谢稳定性, 为了解YZG-331体内动态变化规律、种属/性别差异以及后续临床药代动力学研究提供参考依据。
材料与方法药品和试剂 YZG-331及内标YZG-441 (图 1, 纯度 > 99%)由中国医学科学院药物研究所植化室提供。比格犬、食蟹猴和人肝微粒体购自BD公司, SD大鼠和ICR小鼠肝微粒体由本实验室自制。甲醇和乙腈为色谱纯(Fisher, 美国), 其他试剂均为分析纯。超纯水经Milli-Q纯水仪制备(Millipore, MA, 美国)。

|
Figure 1 Chemical structures of YZG-331 and YZG-441 |
实验动物 雌/雄ICR小鼠(30~32 g)和雌/雄SD大鼠(220~250 g)购自北京维通利华实验动物技术有限公司[许可证号: SCXK (京) 2013-0001], 动物福利和实验过程遵循中国医学科学院动物伦理委员会的规定。
实验仪器 API 4000型-液质联用仪(AB公司, 美国); Agilent 1260系统:四元梯度泵、在线脱气机、自动进样器、柱温箱(Agilent公司)及用于数据采集和分析的软件Xcalibur 1.4.2。GL-88B漩涡混合器(江苏海门麒麟医用仪器厂), Biofuge Primo R低温离心机(Thermo, 美国), TGL-16B型离心机(上海安亭科学仪器厂)。
色谱条件 色谱柱: Zorbax C18柱(2.1 mm × 100 mm, 3.5 μm), 流动相:甲醇-水(60:40, 0.1%甲酸), 流速: 0.2 mL·min-1; 柱温: 25 ℃; 进样量: 5 μL; 进样池温度: 4 ℃。
质谱条件 电喷雾离子源(ESI), 喷雾电压为5.5 kV。阳离子方式检测, 扫描方式为选择反应离子监测(SRM), YZG-331用于定量分析的选择性反应离子分别为: m/z 386.2→254.2 (CE: 25 eV)。一次进样的分析时间为7.5 min。
小鼠口服YZG-331后的血浆药代动力学 雌雄ICR小鼠各20只, 分为4组, 每组5只, 实验前禁食12 h, 自由饮水。YZG-331以0.5% CMC配制成质量浓度为1、2、4和8 mg·mL-1悬液。小鼠分别口服YZG-331 (10、20、40和80 mg·kg-1)后2、5、15、30 min、1、2、3、4、6、8、12和24 h (40、80 mg·kg-1剂量组增加36、48和72 h)用肝素化的玻璃毛细管于眼眶静脉丛取血30 μL, 5 000 r·min-1离心10 min, 分离血浆并储存在-20 ℃备用。
小鼠静脉注射YZG-331的血浆药代动力学及生物利用度 雌雄ICR小鼠各5只, 自由饮水和饮食。YZG-331用乙醇100 μL溶解后用生理盐水配制成0.1 mg·mL-1溶液。小鼠尾静脉注射YZG-331 (1 mg·kg-1)后2、5、10、20、30 min、1、2、3、4、6和8 h用肝素化的玻璃毛细管于眼眶静脉丛取血约30 μL, 分离血浆储存在-20 ℃备用。生物利用度计算公式: F(%) = D静脉×AUC口服 / D口服 ×AUC静脉 ×100%。
小鼠口服YZG-331后在体内主要脏器及脑组织的分布 雄雌ICR小鼠各15只, 分为3组, 每组5只, 实验前禁食12 h, 自由饮水。根据雄雌小鼠口服给药后的血浆药时曲线, 选择YZG-331 (10 mg·kg-1)口服后5 min、30 min、2 h断头处死动物, 收集血液, 5 000 r·min-1离心10 min, 制备血浆储存在-20 ℃备用。另收集全部或部分心、肝、脾、肺、肾、肾上腺、脑、睾丸(卵巢)、附睾(子宫)、胃、小肠、肌肉、脂肪组织和器官样品, 称重后, 按照1:3 (w/v)体积加入生理盐水研磨, 制备成组织匀浆并储存在-20 ℃备用。
雌雄小鼠各5只, 实验前禁食12 h, 自由饮水。口服给予YZG-331 (10 mg·kg-1)后30 min断头处死动物, 取下丘脑、海马、纹状体、皮层等部位称重后, 按照1:3 (w/v)体积加入生理盐水制备匀浆, 储存在-20 ℃备用。
大鼠口服和静脉注射YZG-331的体内药代动力学 雄雌SD大鼠各20只, 分为4组, 每组5只。实验前禁食12 h, 自由饮水。大鼠分别口服YZG-331 (25、50、100和200 mg·kg-1)后5、15、30 min、1、2、4、6、8、12和24 h (100、200 mg·kg-1剂量组增加36、48和72 h)用肝素化的玻璃毛细管于眼眶静脉丛取血, 分离血浆储存在-20 ℃备用。
雄雌SD大鼠各5只, 自由饮水和饮食。大鼠尾静脉注射YZG-331 (5 mg·kg-1)后2、5、10、20、30 min、1、2、3、4、6和8 h于眼眶静脉丛取血肝素抗凝5 000 r·min-1离心10 min, 分离血浆储存在-20 ℃备用。
血浆蛋白结合率测定 以改良超滤法测定YZG-331 (100、1 000和5 000 ng·mL-1)与小鼠、大鼠、猴、犬和人血浆蛋白的结合率。分别配制不同种属含YZG-331 (100、1 000和5 000 ng·mL-1)的血浆样品, 于室温放置平衡1 h后取出部分样品测定药物初始浓度。取血浆样品140 μL加到超滤上层管, 另取超滤管, 于上层管中加入空白血浆样品140 μL作为平行样。10 000 ×g离心15 min后, 翻转上层管, 加药样品和空白样品互换上层管, 在常温700 ×g离心3 min, 测定2个下层管中药物含量分别作为结合药物浓度和游离药物浓度。
YZG-331在动物及人血浆中的稳定性 将YZG-331与大鼠、小鼠、犬、猴和人血浆温孵, 考察YZG-331在动物及人血浆的稳定性。将YZG-331 (终浓度为1 μmol·L-1)分别加到200 μL小鼠、大鼠、猴、犬、人血浆中, 每组设置3个平行样, 37 ℃水浴温孵0、60和120 min。
YZG-331在人工肠液/胃液中的稳定性 配制人工胃液:取盐酸234 mL加水稀释到1 L, 配制成稀盐酸。取稀盐酸16.4 mL加水800 mL, 与胃蛋白酶10 g混匀后, 用水稀释至1 L。配制人工肠液:取磷酸二氢钾6 g溶于500 mL水, 用0.4%氢氧化钠溶液调至pH 6.8, 另取胰蛋白酶10 g用水溶解, 将两液合并, 用水稀释至1 L。将YZG-331 (终浓度为1 μmol·L-1)分别加到人工肠液/胃液200 μL中, 每组设置3个平行样, 37 ℃水浴温孵0、15、30、60和120 min。
YZG-331在动物及人肝微粒体中的稳定性 将YZG-331与大鼠、小鼠、犬、猴和人肝微粒体温孵, 考察YZG-331在动物及人肝微粒体的稳定性。肝微粒体温孵体系包括:肝微粒体蛋白(0.5 mg·mL-1)、NADPH再生系统、Tris-HCl缓冲液(50 mmol·L-1, pH 7.4)、YZG-331 (0.5 μmol·L-1), 反应总体积为200 μL (有机溶剂含量 < 1%)。每组设置2个平行样, 37 ℃温孵30 min。
YZG-331在大鼠肠菌中的稳定性 大鼠断头处死后, 迅速取出盲肠内容物, 以1:30 (w/v)加入厌氧培养液中混匀, 即得肠菌培养液。将YZG-331加到肠菌培养液中, 振荡混匀, 配制成终质量浓度为5 μg·mL-1温孵液(DMSO终浓度为0.5%)。将YZG-331温孵液0.5 mL在37 ℃缺氧条件下温孵0、0.5、0.75、1、2、4和6 h。
样品处理 将含YZG-331血浆、组织匀浆、肠内容物以及缓冲液样品50 μL加入两倍体积的乙腈沉淀和内标溶液(YZG-441, 2 μg·mL-1) 10 μL, 振荡混匀后, 14 000 r·min-1离心5 min, 操作2次, 取上清5 μL进行LC-MS/MS分析, 测定YZG-331含量。
数据处理 所测实验数据应用Phoenix WinNonlin软件(version 6.3, Certara Corporation, St. Louis, MO)计算药代动力学参数。除有特殊说明, 实验结果均用平均值± SD表示。生物利用度计算公式: F(%) = D静脉× AUC口服/D口服×AUC静脉×100%;血浆蛋白结合率计算公式:血浆蛋白结合率(%) = (1 -游离药物浓度/总药物浓度) × 100%。
结果 1 小鼠口服/静脉注射YZG-331后的血浆药代动力学特征参考YZG-331小鼠药效学剂量及预实验结果, 选择雌雄小鼠口服YZG-331剂量为10、20、40、80 mg·kg-1, 进行血浆药代动力学研究。血浆药时曲线及药代动力学参数见图 2和表 1。结果可见, 小鼠单次口服YZG-331后吸收较快, 各剂量组给药后2 min血中即可测到原形药, 给药后12~48 h血药浓度接近检测限。雌雄小鼠的Cmax随给药剂量增加而递增, 但80 mg·kg-1剂量组出现吸收饱和趋势。给药剂量与AUC0-t的线性拟合后, AUC0-t均随剂量增加呈线性递增(R2 = 0.99和0.98)。此外, 高剂量组雌鼠Cmax及AUC0-t明显高于雄鼠, 而t1/2及MRT随剂量增加明显延长, 提示雌性小鼠存在消除饱和, 雌雄小鼠体内动力学特征存在一定性别差异。

|
Figure 2 Mean plasma concentration-time profiles of YZG-331 in male (A) and female (B) mice after an oral administration at 10, 20, 40 or 80 mg·kg-1. n = 5, x±s |
| Table 1 Pharmacokinetic parameters of YZG-331 in male and female mice after oral administration at 10, 20, 40, 80 mg·kg-1 and intravenous injection at 1 mg·kg-1. n = 5, x±s. *P < 0.05, **P < 0.01 vs male |
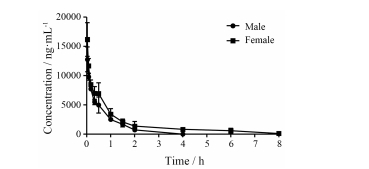
雌雄小鼠尾静脉注射YZG-331 (1 mg·kg-1)血浆药时曲线及药代动力学参数见图 3和表 1。结果可见, 雌鼠t1/2高于雄鼠, 且CL低于雄鼠, 提示YZG-331在雌鼠体内的消除较雄鼠慢。同时, 雌鼠的AUC0-t是雄鼠的1.5倍, 提示其暴露量明显高于雄鼠。根据口服和静脉注射YZG-331后的AUC0-t计算雄鼠口服YZG-331 (10 mg·kg-1)后的生物利用度为51.2%, 雌鼠为27.7%, 雄鼠生物利用度是雌鼠的1.8倍, 存在一定的性别差异。
|
Figure 3 Mean plasma concentration-time profiles of YZG-331 in male and female mice after intravenous injection at 1 mg·kg-1. n = 5, x±s |
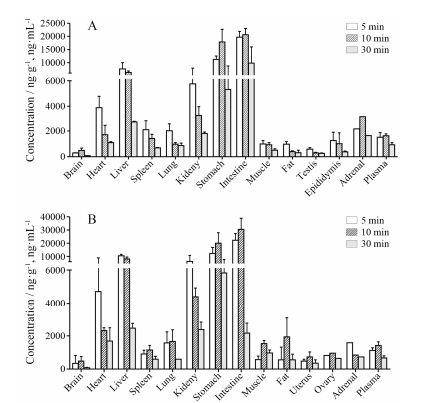
雌雄小鼠口服YZG-331 (10 mg·kg-1)后体内分布广泛(图 4)。雄鼠给药5 min后组织和器官中YZG-331浓度排序为:小肠 > 胃 > 肝 > 肾 > 心脏 > 肾上腺 > 脾 > 肺 > 血浆 > 附睾 > 肌肉 > 脂肪 > 睾丸 > 脑, 给药后30 min和2 h的分布趋势与5 min相似。雌鼠给药5 min后组织和器官中YZG-331浓度排序为:小肠 > 胃 > 肝 > 肾 > 心脏 > 肾上腺 > 肺 > 血浆 > 脾 > 卵巢 > 肌肉 > 脂肪 > 子宫 > 脑, 其他时间点的分布趋势与5 min相似。小鼠口服YZG-331后在胃肠道及血流量丰富组织分布较多, 靶器官脑中也有分布, 但浓度较低, 组织分布未见明显性别差异。
|
Figure 4 Tissue distribution of YZG-331 in male (A) and female (B) mice after a single oral administration at 10 mg·kg-1. n = 5, x±s |
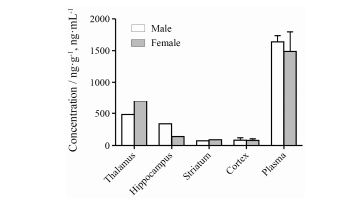
YZG-331 (10 mg·kg-1)口服给药后在脑中多个部位均有分布(图 5)。雄鼠给药后30 min, 各部位药物浓度排序为:血浆 > 丘脑 > 海马 > 皮层 > 纹状体, 雌鼠给药30 min后的药物分布趋势与雄鼠相似。
|
Figure 5 Brain distribution of YZG-331 in male and female mice after a single oral administration at 10 mg·kg-1. n = 5, x±s |
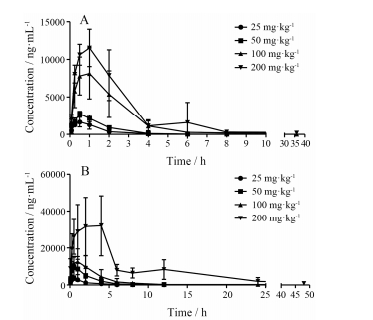
参考YZG-331大鼠药效学剂量及预实验结果, 选择大鼠口服YZG-331剂量为25、50、100和200 mg·kg-1, 进行血浆药代动力学研究, 血浆药时曲线见图 6, 应用WinNonlin程序采用非房室模型计算其药代动力学参数见表 2。
|
Figure 6 Mean plasma concentration-time profiles of YZG-331 in male (A) and female (B) rats after oral administration at 25, 50, 100 and 200 mg·kg-1. n = 5, x±s |
| Table 2 Pharmacokinetic parameters of YZG-331 in male and female rat after oral administration at 25, 50, 100, 200 mg·kg-1 and intravenous injection at 5 mg·kg-1. n = 5, x±s. *P < 0.05, **P < 0.01 vs male |
雄雌大鼠单次口服YZG-331后吸收较快, 各剂量组给药后5 min血中即可测到原形药, 雄鼠给药后8~48 h血药浓度接近检测限, 雌鼠给药后24~72 h血药浓度接近检测限。雄雌大鼠的Cmax均随剂量增加而递增, 但高剂量组出现吸收饱和趋势。给药剂量与AUC0-t作拟合曲线显示雄雌大鼠体内YZG-331的AUC0-t增加与剂量不呈比例(R2 = 0.94和0.92)。同时, MRT0-t随着剂量增加均出现明显延长, 提示存在消除饱和。此外, YZG-331在雌鼠体内Cmax和AUC0-t明显高于雄鼠, 提示存在一定性别差异。
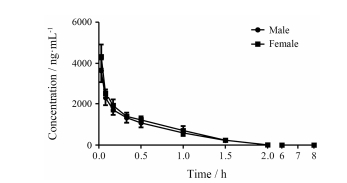
雄雌大鼠尾静脉注射YZG-331 (5 mg·kg-1) 4 h后血浆中原形药含量低于检测限(图 7), 药代动力学参数见表 2。雄雌大鼠静脉注射YZG-331后药代参数未见明显性别差异。根据口服和静脉注射YZG-331后的AUC0-t结果计算雄鼠口服YZG-331 (25 mg·kg-1)后的生物利用度为27.1%, 雌鼠为78.7%, 存在明显性别差异。
|
Figure 7 Mean plasma concentration-time profiles of YZG-331 in male and female rats after intravenous injection at 5 mg·kg-1. n = 5, x±s |
应用超滤法测定YZG-331体外与动物及人血浆蛋白的结合, 结果表明YZG-331 (100、1 000、5 000 ng·mL-1)体外与小鼠、大鼠、猴、犬、人血浆蛋白高度结合, 结合率为93.3%~98.9% (表 3), 无明显浓度依赖性和种属差异。
| Table 3 Protein binding (%) of YZG-331 with mouse, rat, monkey, dog and human plasma in vitro. n = 3, x±s |
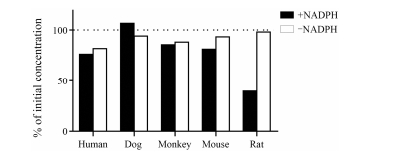
YZG-331与不同种属和人血浆及人工胃液/肠液温孵2 h后原形药含量无明显减少, 提示YZG-331在血浆和人工胃液/肠液中稳定。YZG-331在不同种属肝微粒体中的代谢稳定性见图 8。结果表明, 在无NADPH的条件下, YZG-331含量均无明显降低。在加入NADPH的条件下, 大鼠肝微粒体中的原形药剩余量低于50%, 而其他种属动物和人肝微粒体的含量均无明显降低(< 25%), 提示YZG-331在肝微粒体的代谢具有明显种属差异, 且YZG-331在大鼠肝微粒体中的代谢是NADPH依赖的酶促反应。
|
Figure 8 Stability of YZG-331 in liver microsomes of human, dog, monkey, mouse and rat in vitro |
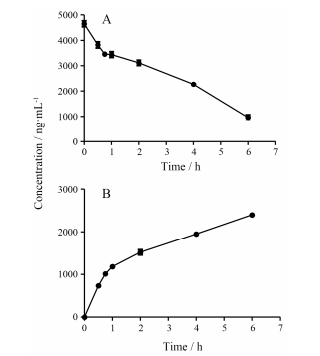
YZG-331与大鼠肠菌温孵结果见图 9。肠菌温孵液中YZG-331含量随温孵时间延长逐渐降低, 温孵6 h后原形药剩余量为21%, 并可检测到代谢产物(m/z 254)生成, 经与对照品比对保留时间、质谱裂解规律, 该代谢产物被鉴定为YZG-331的水解代谢产物M2, 其与原形药减少具有一定消长依赖性。
|
Figure 9 Concentration-time profiles of YZG-331 (A) and M2 (B) in rat intestinal bacteria incubations |
药代动力学研究是通过了解药物在体内的吸收、分布、代谢和排泄过程, 阐明药物的体内动态变化规律, 解释药效、毒理作用的体内物质基础, 对于早期成药性评价、优化给药方案及指导临床合理用药均具有重要意义。
YZG-331的主要药效学研究均选用ICR小鼠完成, 本研究发现小鼠口服YZG-331 (10~80 mg·kg-1)后AUC0-t可随剂量增加而递增, AUC0-t与剂量相关性较好, 但高剂量组雄鼠出现吸收饱和, 雌鼠存在消除饱和。前期研究证实, YZG-331是外排转运体P-gp的底物, 因此YZG-331的吸收与消除饱和是否与P-gp或其他转运体相关有待研究[10]。
雄性小鼠的口服生物利用度是雌鼠的1.8倍, 存在一定性别差异。考虑到雄鼠静脉注射YZG-331 (1 mg·kg-1)后CL是雌鼠的1.5倍, 但口服给药10 mg·kg-1和20 mg·kg-1组雄鼠Cmax均为雌鼠的1.4倍, 推测YZG-331的吸收过程可能是口服生物利用度的性别差异主要原因之一。YZG-331在雌鼠体内清除较慢可能与雌性动物体重和脏器重量相对较轻、体脂含量较高、肾小球滤过率较低有关[11]。另外, 动力学特性的性别差异还可能由CYP450和转运体介导的药物代谢/转运过程的差异引起[12, 13]。
为比较YZG-331的体内动力学是否存在种属差异, 为后期预测人体的药效和药代及毒性评价研究寻找合适的临床前实验动物, 本研究还考察了大鼠口服和静脉注射YZG-331后的血浆药代动力学特征。由于大鼠口服YZG-331最低有效剂量为25 mg·kg-1, 高于小鼠, 因此本研究大鼠所用剂量与大鼠药效保持一致。研究发现YZG-331在大鼠体内存在吸收和消除饱和趋势。YZG-331在雌鼠体内Cmax和AUC0-t均明显高于雄鼠, 生物利用度是雄鼠的2.9倍, 由于静脉给药后YZG-331在雌雄大鼠体内CL、t1/2、AUC0-t无明显差别, 提示大鼠生物利用度性别差异可能与药物吸收有关。
前期药效学研究表明, 雄性小鼠口服YZG-331 (10 mg·kg-1)即可发挥药效, 而雄性大鼠则需要口服25 mg·kg-1才能产生药效。本研究可见雄性小鼠口服YZG-331 (10 mg·kg-1)血药峰浓度(Cmax)及体内暴露量(AUC)均明显高于雄性大鼠25 mg·kg-1剂量组, 提示药代动力学特征可能是导致药效种属差异的原因。另外, 雌性小鼠YZG-331的生物利用度低于雄鼠, 而雌性大鼠的生物利用度却高于雄鼠, 提示生物利用度也存在一定种属差异。雄性小鼠的生物利用度明显高于雌鼠, 但是雄性小鼠体内清除率明显快于雌鼠; 雄性大鼠的生物利用度明显低于雌鼠, 而雄性大鼠体内清除率与雌鼠相近, 因此推测吸收因素可能是小鼠和大鼠口服YZG-331生物利用度种属差异的主要原因。
同时, 对候选物代谢稳定性的评估是早期药物研发的关键。肝脏是药物代谢转化的主要场所, 人肝微粒体已普遍应用于早期代谢稳定性的高通量筛选。本研究发现, YZG-331在不同种属动物和人肝微粒体的代谢稳定性存在明显种属差异, 因此不能采用大鼠肝脏清除率预测其在人体的代谢, 小鼠、大鼠的体内血浆药代动力学差异是否与YZG-331在肝脏代谢的种属差异相关还需要进一步研究。
肠道是口服药物体内吸收、转运及代谢的重要场所, 近年来随着对肠道菌群认识的增加, 肠菌参与药物代谢的重要性越来越引起重视。YZG-331与大鼠肠菌温孵6 h后原形药剩余含量低于20%, 推测大鼠肠道是YZG-331代谢的主要场所。此外, 具有明显种属及性别差异的FMOs参与YZG-331代谢[14], 除在肝脏表达外, FMOs也在小肠表达, 因此影响YZG-331吸收的转运体以及肠道FMOs的首过是否是造成YZG-331生物利用度性别及种属差异的原因值得进一步研究。
结论本文研究了小/大鼠口服和静脉注射YZG-331后的血浆药代动力学、血浆蛋白结合以及体外代谢特征。结果表明, YZG-331在小鼠、大鼠体内的血浆药代动力学存在性别差异和种属差异; 药物在体内分布广泛, 在主要药效部位脑中也有分布; YZG-331与血浆蛋白结合高度结合; 主要经大鼠肝脏微粒体和肠道菌群代谢。YZG-331的小鼠、大鼠体内血浆药代动力学性别及种属差异是否与其肝脏及肠道代谢的差异相关还需要进一步研究。
| [1] | Ohayon MM, Partinen M. Insomnia and global sleep dissatisfaction in Finland[J]. J Sleep Res, 2002, 11: 339–346. DOI:10.1046/j.1365-2869.2002.00317.x |
| [2] | Wafford KA, Ebert B. Emerging anti-insomnia drugs:tackling sleeplessness and the quality of wake time[J]. Nat Rev Drug Discov, 2008, 7: 530–540. DOI:10.1038/nrd2464 |
| [3] | Ramar K, Olson EJ. Management of common sleep disorders[J]. Am Fam Physician, 2013, 88: 231–238. |
| [4] | Griffiths AN, Jones DM, Richens A. Zopiclone produces effects on human performance similar to flurazepam, lormetazepam and triazolam[J]. Br J Clin Pharmacol, 1986, 21: 647–653. DOI:10.1111/bcp.1986.21.issue-6 |
| [5] | Bocca ML, Le Doze F, Etard O, et al. Residual effect of zolpidem 10 mg and zopiclone 7.5 mg versus flunitrazepam 1 mg and placebo on driving performance and ocular saccades[J]. Psychopharmacology (Berl), 143: 373–379. |
| [6] | Sheth S, Brito R, Mukherjea D, et al. Adenosine receptors:expression, function and regulation[J]. Int J Mol Sci, 2014, 15: 2024–2052. DOI:10.3390/ijms15022024 |
| [7] | Scammell TE, Gerashchenko DY, Mochizuki T, et al. An adenosine A2a agonist increases sleep and induces Fos in ventrolateral preoptic neurons[J]. Neuroscience, 2001, 107: 653–663. DOI:10.1016/S0306-4522(01)00383-9 |
| [8] | Zhang Y, Li M, Kang RX, et al. NHBA isolated from Gastrodia elata exerts sedative and hypnotic effects in sodium pentobarbital-treated mice[J]. Pharmacol Biochem Behav, 2012, 102: 450–457. DOI:10.1016/j.pbb.2012.06.002 |
| [9] | Shi J, Zhang J, Yue Z. N6-Substituted adenosine derivatives, N6-substituted adenine derivatives and uses thereof[P]. WO2011069294, 2011-06-26. http://www.freepatentsonline.com/ep2511283.html |
| [10] | Liu Z, Sheng L, Li Y, et al. Effects of P-glycoprotein on the intestine and blood-brain barrier transport of YZG-331, a promising sedative-hypnotic compound[J]. Eur J Pharmacol, 2016, 791: 339–347. DOI:10.1016/j.ejphar.2016.08.039 |
| [11] | Obach RS, Baxter JG, Liston TE, et al. The prediction of human pharmacokinetic parameters from preclinical and in vitro metabolism data[J]. J Pharmacol Exp Ther, 1997, 283: 46–58. |
| [12] | Kim RB, Wandel C, Leake B, et al. Interrelationship between substrates and inhibitors of human CYP3A and P-glycoprotein[J]. Pharm Res, 1999, 16: 408–414. DOI:10.1023/A:1018877803319 |
| [13] | Wolbold R, Klein K, Burk O, et al. Sex is a major determinant of CYP3A4 expression in human liver[J]. Hepatology, 2003, 38: 978–988. DOI:10.1002/(ISSN)1527-3350 |
| [14] | Liu Z, Yang Y, Sheng L, et al. Interspecies variation of in vitro stability and metabolic diversity of YZG-331, a promising sedative-hypnotic compound[J]. Frontiers Pharmacol, 2017. DOI:10.3389/fphar.2017.00527 |
 2017, Vol. 52
2017, Vol. 52


