动脉粥样硬化(atherosclerosis, AS)作为一种慢性炎症性疾病, 是多种心脑血管疾病的共同病理基础, 严重威胁人类的生命健康[1-3]。白细胞介素6 (interleukin-6, IL-6)作为一种前炎症因子, 在斑块形成和发展中起着重要的作用, 被认为是AS发生和发展的主要致病因子之一[1, 4, 5]。IL-6与受体结合后活化细胞膜表面的糖蛋白130 (gp130), 可以诱导下游信号转导和转录激活因子(STAT)活化, 进而引发炎症反应[6]。研究表明STAT在AS病变中可被激活, 活化的STAT在人类AS的炎症区域增多, 提示IL-6/ STAT信号转导通路在AS的发生、发展中的重要作用[7, 8], 通过抑制IL-6/STAT信号通路介导的炎症反应, 可能为寻找新型抗AS候选物提供一种新的思路和策略。
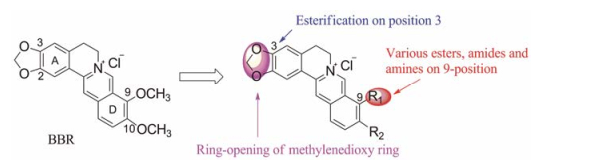
盐酸小檗碱(berberine, BBR, 图 1)作为我国传统中药单体, 安全性良好, 具有抗菌、抗炎、降血脂等广泛的药理活性[9-13]。研究表明, 在150 mg·kg-1剂量下, BBR可以减少ApoE基因敲除小鼠动脉粥样硬化斑块, 显示出中度的抗AS活性[14]。鉴于本课题组长期致力于从我国生物碱天然产物中寻找创新药物[15-18], 本研究以BBR为先导物, 主要在其3-位或/和9-位(图 1)引入不同类型的侧链基团, 包括短链烷基、刚性大基团、杂环和芳香性基团等, 由此设计合成了17个全新的BBR酯类、酰胺以及胺类衍生物。通过并测定其对IL-6诱导的STAT1和STAT3磷酸化的抑制活性, 总结构效关系。并进一步证实此类化合物是通过抑制AMPK磷酸化水平抑制炎症反应。
|
Figure 1 Chemical structure of berberine (BBR), and its structure modification strategy |
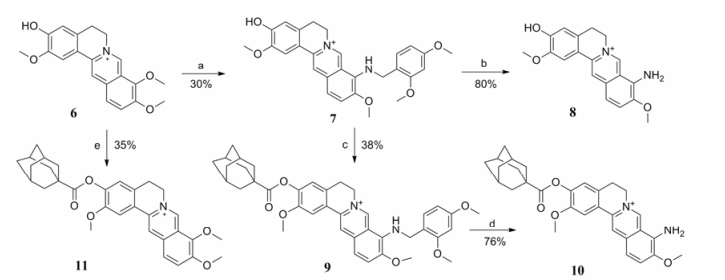
首先, 以市售BBR为原料, 在高温真空条件下, 选择性脱除9-位甲基, 而后在碱性条件下与相应的酰氯反应得到9-位酯类化合物2a~2f (合成路线1)。以BBR为原料, 在高温条件下加入2, 4-二甲氧基苄胺, 获得重要中间体3。强酸条件下裸露出9-氨基后, 以吡啶为缚酸剂, 制得9-位酰胺类衍生物5a~5f。另外, 以市售药根碱(6)为起始原料, 在高温条件下获得9-位取代氨基衍生物7, 酸性条件下裸露出氨基制备出化合物8。在化合物7的3-位进行酯化反应, 得金刚烷甲酯衍生物9, 盐酸脱苄后得氨基化合物10。最后, 以乙腈为溶剂, 在三乙胺催化下转化为对应的3-位酯类目标物11 (合成路线2)。

|
Reagents and conditions: (a) 2, 4-Dimethoxybenzylamine, 120 ℃; (b) HCl, CH3OH; (c) RCOCl, triethylamine, CH3CN, reflux; (d) HCl, CH3OH; (e) RCOCl, triethylamine, CH3CN, reflux. Scheme1 Synthesis of 9-substituted BBR derivatives |
|
Reagents and conditions: (a) 2,4-Dimethoxybenzylamine, 120 ℃; (b) HCl, CH3OH; (c) RCOCl, triethylamine, CH3CN, reflux; (d) HCl, CH3OH; (e) RCOCl, triethylamine, CH3CN, reflux. Scheme2 Synthesis of 3-and 9-substituted jatrorrhizine derivatives (7-11) |
所有目标化合物结构经1H NMR、13C NMR以及HR-MS分析确证。化合物的理化性质及图谱数据见表 1。
| Table 1 Physical properties and spectra data of all newly synthesized compounds |
磷酸化的STAT (p-STAT)是STAT的活化形式, 其中STAT1络氨酸701 (Tyr701)位点和STAT3络氨酸705 (Tyr705)位点的磷酸化分别是两者活化的标志。使用Western blotting的方法, 在人血管内皮细胞(HUVEC)中对新合成的化合物(2a~2f、5a~5f以及7~11)抑制IL-6诱导的p-STAT1 (Tyr701)和p-STAT3 (Tyr705)的磷酸化进行了筛选, 结果如图 2所示。首先, 在6个9-位取代BBR酯型衍生物2a~2f中, 金刚烷甲酯衍生物2b可以明显抑制IL-6/ STAT1和IL-6/STAT3磷酸化; 而脂肪链(化合物2a)、芳香环(化合物2c和2d)以及杂环取代(化合物2e和2f)衍生物的活性则明显下降或完全丧失。随后, 将BBR的9-位氧原子替换为氮原子, 得到了6个与酯类衍生物对应的酰胺类衍生物5a~5f。结果显示, 所有酰胺衍生物的抗炎活性均在不同程度上有所下降, 说明9-位酯键连接刚性片段时有利于活性提高。

|
Figure 2 BBR analogues inhibited IL-6-induced STAT1 and STAT3 phosphorylation. Following pretreatment with BBR analogs 2a-2f, 5a-5f and 7-11 (10 μmol·L-1) for 2 h, HUVEC cells were treated with DMSO, sIL-6Ra (25 ng·mL-1)/IL-6 (5 ng·mL-1) for 30 min. The phosphorylation of STAT1 and STAT3 were measured by Western blotting using corresponding antibodies. D: DMSO. β-Actin served as the loading control. ***P < 0.001 compared with DMSO treated, IL-6-induced p-STAT1 group. ###P < 0.001 compared with DMSO treated, IL-6-induced p-STAT3 group |
据此, 将BBR的A环亚甲二氧基打开, 在3-位引入金刚烷活性片段; 同时在其9-位分别引入氨基或者2, 4-二甲氧基苄胺等基团, 共设计合成了5个全新衍生物。结果显示, 当3-位缺少金刚烷片段(化合物7和8), 或9-位没有芳香体系存在(化合物10和11)时, 所得衍生物的抗炎活性均有不同程度的降低。而当3-位引入金刚烷片段, 同时9-位为2, 4-二甲氧基苄胺取代时, 化合物9对STAT1和STAT3的活化显示出良好的抑制活性, 提示3-位存在刚性片段的同时, 在9-位引入芳香体系有利于抗炎活性的提高。
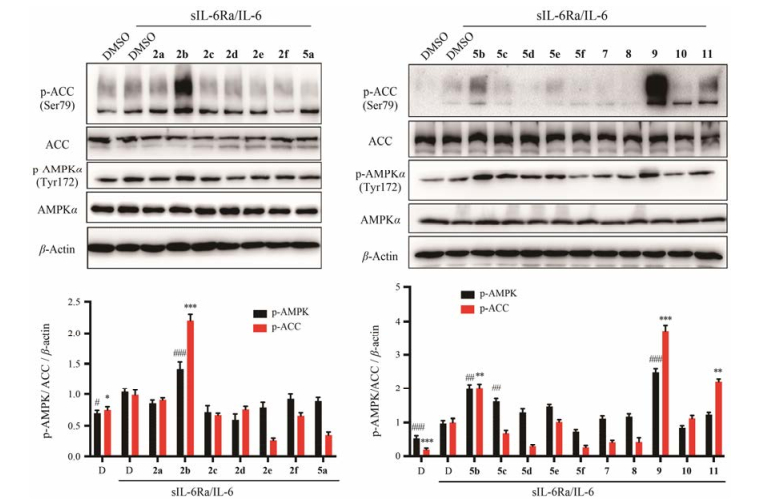
鉴于AMPK激活后可抑制STAT信号途径从而发挥其抑制炎症反应[19, 20], 进一步探讨了此类衍生物抑制STAT通路的初步机制。通过Western blotting方法, 在HUVEC细胞中检测了目标化合物对AMPK磷酸化水平的影响, 结果如图 3所示。结果显示, 代表性化合物2b和9能显著增加AMPK和下游因子ACC磷酸化水平, 表明化合物2b和9可以激活AMPK。此结果与STAT1/3磷酸化的抑制活性相对应, 提示化合物2b和9可以通过激活AMPK从而抑制IL-6诱导的STAT1/3的磷酸化。
|
Figure 3 BBR analogues induced ACC and AMPK phosphorylation. Following pretreatment with BBR analogs 2a-2f, 5a-5f and 7-11 (10 μmol·L-1) for 2 h, HUVEC cells were treated with DMSO, sIL-6Ra (25 ng·mL-1)/IL-6 (5 ng·mL-1) for 30 min. The phosphorylation of ACC and AMPK were measured by Western blotting using corresponding antibodies. D: DMSO. β-Actin served as the loading control. *P < 0.05, **P < 0.01, ***P < 0.001 compared with DMSO treated, IL-6-induced p-ACC group. #P < 0.05, ##P < 0.01, ###P < 0.001 compared with DMSO treated, IL-6-induced p-AMPK group |
本研究以酯键、酰胺键等作为连接臂, 在BBR的9-位或/和3-位引入短链烷基、刚性基团、杂环以及取代芳环等不同类型取代基, 共设计合成了17个全新的BBR酯类、酰胺和胺类衍生物, 并对其抑制由IL-6诱导的STAT1和STAT3磷酸化进行了评价。构效关系显示, 3-位或9-位刚性结构的引入有利于活性的提高。其中, 化合物2b和9表现出最优的抑制活性, 进一步研究提示, 两者可以通过激活AMPK抑制IL-6诱导的STAT1和STAT3磷酸化, 进而抑制IL-6/STAT信号通路介导的炎症反应。研究结果为BBR衍生物发展成为一类新型抗AS候选物提供了良好的构效关系与科学数据。
实验部分熔点用CXM-300型精密熔点仪测定, 温度未校正; 1H NMR和13C NMR用Bruker Avance Ⅲ 500和600核磁共振仪测定(500/600 MHz), 溶剂为DMSO-d6或methanol-d4; HR-MS用Autospec Ultima-TOF质谱测定仪测定; Flash柱分离纯化用Combiflash Rf 200快速制备液相; 荧光检测用ZF-20D暗箱式紫外分析仪; 薄层色谱(TLC)采用E-Merck公司预铺硅胶铝箔卷; 试剂均为分析纯。
Medium 200培养基、低血清生长添加剂(LSGS)和胎牛血清购自美国Gibco公司。丙烯酰胺、甲叉双丙烯酰胺、十二烷基磺酸钠(SDS)、Tris碱、过硫酸铵及Tween-20均购自美国Amresco公司。蛋白酶抑制剂(Cocktail)购自美国Sigma公司。磷酸化STAT3 (p-STAT3 Tyr705)抗体、磷酸化STAT1 (p-STAT1 Tyr701)抗体、磷酸化ACC (p-ACC Ser79)抗体、磷酸化AMPK (p-AMPK Tyr172)抗体、STAT3抗体、STAT1抗体、ACC抗体和AMPK抗体购自美国Cell Signaling公司。β-Actin抗体和羊抗兔或小鼠二抗均购自美国Santa Cruz公司。白介素6刺激因子sIL-6Ra和IL-6均购自美国Invivogen公司。PVDF膜购自美国Millipore公司。ECL Plus超敏免疫印迹检测试剂盒购自美国Bio-RAD公司。其他试剂均为国产分析纯。
1 化学合成 1.1 化合物2a~2f的合成BBR (3.71 g, 10 mmol)在195~210 ℃减压(30~40 mmHg)加热30 min得紫黑色油状物。产物经5%盐酸/甲醇酸化, 减压除去溶剂, 以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得橙红色固体1 (2.85 g, 80%)。
化合物1 (100 mg, 0.28 mmol)溶于5 mL无水乙腈中, 加入三乙胺(175 μL, 1.26 mmol)和相应酰氯(1.1~1.2 eq), 70 ℃反应5~6 h。冷却至固体完全析出, 抽滤, 沉淀以大量二氯甲烷洗, 得目标化合物2a~2f。
1.2 化合物5a~5f的合成BBR (7.4 g, 20 mmol)加于2, 4-二甲氧基苄胺15 mL (78 mmol)中, 120 ℃加热反应6~8 h。冷却至室温, 加入丙酮50 mL, 搅拌, 抽滤, 丙酮2×50 mL洗涤。固体经硅胶柱, 以二氯甲烷/甲醇为流动相分离纯化得红色化合物3 (3.5 g, 37%)。
化合物3 (3 g, 6.4 mmol)溶于甲醇中, 加入浓盐酸3 mL, 室温搅拌5~6 h, 抽滤, 沉淀以80%乙醇洗涤, 得红色化合物4 (1.8 g, 80 %)。
化合物4 (100 mg, 0.28 mmol)于5 mL无水二氯甲烷中, 加入吡啶(100 μL, 1.24 mmol)和相应酰氯(2~3 eq), 回流反应10~12 h。减压除去溶剂, 以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得。目标化合物5a~5f。
1.3 化合物7~10的合成药根碱(6, 2 g, 5.8 mmol)于2, 4-二甲氧基苄胺5 mL (23 mmol)中, 120 ℃加热反应6~8 h。冷却至室温, 加入乙醚20 mL, 抽滤, 以乙醚2×20 mL洗涤, 除去未反应的胺。沉淀以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得红色化合物7 (0.8 g, 30%)。
化合物7 (100 mg, 0.21 mmol), 加入2 mol·L-1盐酸乙醚2 mL, 室温搅拌5~6 h, 抽滤, 沉淀以80%乙醇洗涤, 得红色化合物8 (54 mg, 80%)。
化合物7 (0.5 g, 1.05 mmol)溶于5 mL无水乙腈中, 加入三乙胺(175 μL, 1.26 mmol)、金刚烷甲酰氯(235 mg, 1.2 mmol), 70 ℃反应5~6 h。减压除去溶剂, 加入二氯甲烷50 mL, 以0.5%盐酸20 mL、饱和食盐水2×20 mL洗涤, 无水硫酸钠干燥, 浓缩。产物以二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得红色化合物9 (0.38 g, 38%)。
化合物9 (100 mg, 0.16 mmol), 加入盐酸乙醚2 mL, 室温搅拌5~6 h, 抽滤, 沉淀以80%乙醇洗涤, 得红色化合物10 (58 mg, 76%)。
1.4 化合物11的合成药根碱(100 mg, 0.29 mmol)溶于5 mL无水乙腈中, 加入三乙胺(175 μL, 1.26 mmol)和金刚烷甲酰氯(62 mg, 0.32 mmol), 70 ℃反应5~6 h。冷却至固体完全析出, 抽滤, 沉淀以大量二氯甲烷洗, 得黄色化合物11 (51 mg, 35%)。
2 生物学实验 2.1 细胞培养及化合物处理人血管内皮细胞HUVEC购自美国ATCC。使用含有10%胎牛血清、2% LSGS、100 u·mL-1青霉素、100 μg·mL-1硫酸链霉素的M200完全培养基, 在饱和湿度、37 ℃、5% CO2条件下进行细胞培养。当细胞生长至约80%~90%汇合时, 将细胞按1:3进行传代培养。实验中合成的化合物均溶于DMSO中, IL-6和IL-6Ra溶于PBS缓冲液中。使用10 μmol·L-1的化合物作用细胞2 h后, 再加入sIL-6Ra (25 ng·mL-1)和IL-6 (5 ng·mL-1)处理30 min, 而后收集细胞进行蛋白免疫印迹分析。
2.2 Western blotting将处理后的细胞用细胞刮刀刮下, 1 200×g离心收集细胞。加入适量裂解液(50 mmol·L-1 Tris-HCl pH 7.5, 1% Triton-100, 150 mmol·L-1NaCl, 2 mmol·L-1 EDTA, 1×Cocktail), 冰上放置30 min, 然后14 000×g离心15 min, 收集上清液即为蛋白提取液。用标准Bradford方法测定样品的蛋白浓度。于12% SDS聚丙烯酰胺凝胶电泳分离蛋白, 半干法将蛋白转至PVDF膜。转膜结束后, 将其放入含5%脱脂奶粉的TBS-T (20 mmol·L-1 Tris-HCl、150 mmol·L-1 NaCl、0.1% Tween-20, pH 7.6)中振荡封闭1 h。封闭后的膜装入杂交袋与一抗溶液(1:1 000稀释) 4 ℃孵育过夜, 用TBS-T洗膜3次, 以洗去未结合的一抗。与辣根过氧化物酶标记的二抗溶液(抗兔二抗1:2 000稀释、抗鼠二抗1:5 000稀释)在室温孵育1~2 h后, TBS-T洗膜3次, 按照ECL Plus免疫试剂盒说明书进行显色, 通过Tanon-5100凝胶成像系统(上海天能科技有限公司)捕获并分析图像。
| [1] | van Diepen JA, Berbee JF, Havekes LM, et al. Interactions between inflammation and lipid metabolism:relevance for efficacy of anti-inflammatory drugs in the treatment of atherosclerosis[J]. Atherosclerosis, 2013, 228: 306–315. DOI:10.1016/j.atherosclerosis.2013.02.028 |
| [2] | Taleb S. Inflammation in atherosclerosis[J]. Arch Cardiovasc Dis, 2016, 109: 708–715. DOI:10.1016/j.acvd.2016.04.002 |
| [3] | Viola J, Soehnlein O. Atherosclerosis-a matter of unresolved inflammation[J]. Semin Immunol, 2015, 27: 184–193. DOI:10.1016/j.smim.2015.03.013 |
| [4] | Marciniak A, Nawrocka Rutkowska J, Brodowska A, et al. Cardiovascular system diseases in patients with polycystic ovary syndrome-the role of inflammation process in this pathology and possibility of early diagnosis and prevention[J]. Ann Agric Environ Med, 2016, 23: 537–541. DOI:10.5604/12321966.1226842 |
| [5] | Hartman J, Frishman WH. Inflammation and atherosclerosis:a review of the role of interleukin-6 in the development of atherosclerosis and the potential for targeted drug therapy[J]. Cardiol Rev, 2014, 22: 147–151. DOI:10.1097/CRD.0000000000000021 |
| [6] | Rutherford C, Speirs C, Williams JJ, et al. Phosphorylation of Janus kinase 1(JAK1) by AMP-activated protein kinase (AMPK) links energy sensing to anti-inflammatory signaling[J]. Sci Signal, 2016, 9: ra109. DOI:10.1126/scisignal.aaf8566 |
| [7] | Voloshyna I, Littlefield MJ, Reiss AB. Atherosclerosis and interferon-gamma:new insights and therapeutic targets[J]. Trends Cardiovasc Med, 2014, 24: 45–51. DOI:10.1016/j.tcm.2013.06.003 |
| [8] | Szelag M, Piaszyk-Borychowska A, Plens-Galaska M, et al. Targeted inhibition of STATs and IRFs as a potential treatment strategy in cardiovascular disease[J]. Oncotarget, 2016, 7: 48788–48812. DOI:10.18632/oncotarget.v7i30 |
| [9] | Yao J, Kong W, Jiang JD. Learning from berberine:treating chronic diseases through multiple targets[J]. Sci China Life Sci, 2015, 58: 854–859. DOI:10.1007/s11427-013-4568-z |
| [10] | Heidarian E, Rafieian-Kopaei M, Khoshdel A, et al. Metabolic effects of berberine on liver phosphatidate phosphohydrolase in rats fed on high lipogenic diet:an additional mechanism for the hypolipidemic effects of berberine[J]. Asian Pac J Trop Biomed, 2014, 4: S429–S435. DOI:10.12980/APJTB.4.2014C474 |
| [11] | Bi CW, Zhang CX, Li YB, et al. Synthesis and structure-activity relationship of cycloberberine as anti-cancer agent[J]. Acta Pharm Sin (药学学报), 2013, 48: 1800–1806. |
| [12] | Li YH, liu YX, Wang YX, et al. Synthesis and biological evaluation of new 13-n-nonylprotoberberine derivatives as antitubercular agents[J]. Acta Pharm Sin B, 2013, 3: 38–45. DOI:10.1016/j.apsb.2012.12.004 |
| [13] | Wang YX, Fu HG, Li YH, et al. Synthesis and biological evaluation of 8-substituted berberine derivatives as novel anti-mycobacterial agents[J]. Acta Pharm Sin B, 2012, 2: 581–587. DOI:10.1016/j.apsb.2012.10.008 |
| [14] | Feng M, Zou Z, Zhou X, et al. Comparative effect of berberine and its derivative 8-cetylberberine on attenuating atherosclerosis in ApoE-/- mice[J]. Int Immunopharmacol, 2017, 43: 195–202. DOI:10.1016/j.intimp.2016.12.001 |
| [15] | Wang YX, Kong WJ, Li YH, et al. Synthesis and structure-activity relationship of berberine analogues in LDLR up-regulation and AMPK activation[J]. Bioorg Med Chem, 2012, 20: 6552–6558. DOI:10.1016/j.bmc.2012.09.029 |
| [16] | Ma Y, Ou TM, Tan JH, et al. Quinolino-benzo-[5, 6]-dihydroisoquindolium compounds derived from berberine:a new class of highly selective ligands for G-quadruplex DNA in c-myc oncogene[J]. Eur J Med Chem, 2011, 46: 1906–1913. DOI:10.1016/j.ejmech.2011.02.020 |
| [17] | Li YH, Wang L, Hong B, et al. Synthesis and structure-activity relationship of 13-hexylberberine analogues as CD36 antagonists[J]. Acta Pharm Sin (药学学报), 2010, 45: 1128–1133. |
| [18] | Ren G, Zhang MR, Song DQ, et al. Study on hypoglycemic activity of 9-substituted berberine derivatives in vitro[J]. Acta Pharm Sin (药学学报), 2017, 52: 1282–1286. |
| [19] | Mancini SJ, White AD, Bijland S, et al. Activation of AMP-activated protein kinase rapidly suppresses multiple pro-inflammatory pathways in adipocytes including IL-1 receptor-associated kinase-4 phosphorylation[J]. Mol Cell Endocrinol, 2017, 440: 44–56. DOI:10.1016/j.mce.2016.11.010 |
| [20] | Kelly M, Keller C, Avilucea PR, et al. AMPK activity is diminished in tissues of IL-6 knockout mice:the effect of exercise[J]. Biochem Biophys Res Commun, 2004, 320: 449–454. DOI:10.1016/j.bbrc.2004.05.188 |
 2017, Vol. 52
2017, Vol. 52


