2. 厦门大学附属中山医院, 福建 厦门 361102
2. Zhongshan Hospital, Xiamen University, Xiamen 361102, China
2型糖尿病(type 2 diabetes, T2DM)是一种常见的内分泌代谢紊乱性疾病, 其病因多发并伴有遗传倾向。随着生活水平的不断提高, 糖尿病的发病率也逐年攀升, 成为危害人身体健康的三大杀手之一。噻唑烷二酮类(thiazolidinediones, TZDs)药物作为胰岛素增敏剂应用于临床2型糖尿病治疗, 常配合二甲双胍使用[1], 其主要作用靶点为外周组织过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor γ, PPARγ), PPARγ活性增加可诱导该组织对胰岛素的敏感性增加, 促进血液内葡萄糖的摄取, 从而起到降低血糖的效果[2]。然而, 自噻唑烷二酮类药物应用于临床以来不良反应频发, 目前唯有吡格列酮仍应用于临床, 研究表明其不良反应多与脂肪组织内PPARγ的脂代谢异常相关[3]。研究表示, 区别于其他噻唑烷二酮类药物, 吡格列酮具有部分激动过氧化物酶体增殖物激活受体α (peroxisome proliferator-activated receptor α, PPARα)的作用[4]。PPARα也是临床贝特类降血脂药物的主要靶点[5], 对噻唑烷二酮类药物引发的一些不良反应起到一定的缓解作用。近年来, 关于PPARα/γ双靶点激动剂治疗2型糖尿病的研究也逐渐增多, 如2011年阿格列札(aleglitazar)作为PPARα/γ双靶点激动剂进入Ⅲ期临床试验, 但最终因心衰等不良反应而失败[6]。所以, 寻找一种不良反应少且对2型糖尿病治疗有效的PPARα/γ双靶点激动剂是目前糖尿病研究的重点之一。
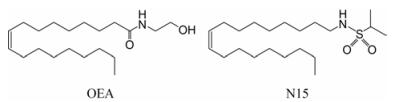
N-(Z)-9-十八烯基-2-丙磺酰胺(N-(Z)-9-octade-cenyl-2-propanesulfonamide, N15), 为油酰乙醇胺(oleoylethanolamide, OEA)类似物, 化学结构如图 1所示, 经过改造后可在增加OEA抗水解能力的同时不降低其生物活性, 即增强了口服吸收效果[7]。OEA是人体内源性化合物大麻素受体配基之一, 为PPARα受体直接激动剂。N15与PPARs受体结合能力实验显示, 经过结构改造后N15可以激动PPARα受体的同时, 对PPARγ受体同样具有激活作用[7], 可判定为一种新型的PPARα/γ双靶点激动剂。此外, 多项研究显示OEA具有明显的减肥、降血脂和调节能量代谢的作用[8]。但对于OEA和N15的糖代谢调节作用并未见报道, 所以本文旨在探索新化合物N15对链脲佐菌素(streptozotocin, STZ)诱导小鼠T2DM胰岛素抵抗的作用效果并对其作用机制进行探索。
|
Figure 1 The structures of oleoylethanolamid (OEA) and N-(Z)-9-octadecenyl-2-propanesulfonamide (N15) |
N15由本实验室自主合成; STZ、柠檬酸和柠檬酸钠购自美国Sigma公司; 吡格列酮购自江苏恒瑞医药股份有限公司; Insulin ELSIA试剂盒购自美国ALPCO公司; 血糖试纸和血糖测试仪购自美国强生公司; p-AMPK、AMPK、p-Akt、Akt和Glut4单抗购自美国Abcam公司。
动物实验70只SPF级雄性KM小鼠(25 g), 购自北京维通利华实验动物技术有限公司, 合格证号为2015000522329。啮齿类动物常规饲料, 自由饮水, 室温20~24 ℃, 12 h明暗循环环境下适应性喂养1周后禁食不禁水12 h。随机选取10只设为正常组, 其余60只腹腔注射60 mg·kg-1 STZ (临用前溶解于0.1 mol·L-1、pH 4.2的柠檬酸-柠檬酸钠缓冲溶液, 现配现用, 置于冰上), 连续注射3天后, 禁食12 h尾尖取血检测小鼠空腹血糖, 血糖浓度≥11.1 mmol·L-1即为造模成功, 选取血糖浓度为11.1~20.0 mmol·L-1为实验组, 正常对照组给予pH 4.2的柠檬酸-柠檬酸钠缓冲溶液腹腔注射。
将所选实验组小鼠随机分成5组, 即模型组、吡格列酮组、N15低、中、高剂量组。正常组和模型组给予生理盐水0.2 mg·kg-1·d-1灌胃处理, 吡格列酮组给予6.0 mg·kg-1·d-1吡格列酮灌胃处理, N15低、中、高剂量组分别给予N15合成产物50、100和200 mg·kg-1·d-1灌胃处理, 每日1次。分别于给药后第7、14、21、28、35和42天检测空腹血糖(fast blood glucose, FBG), 并于第14、28、42天眼眶取血通过ELISA试剂盒检测空腹胰岛素含量(fast blood insulin, FIns), 并计算胰岛素抵抗指数(HOMA-insulin resistance index, HOMA-IR)。HOMA-IR = FBG×FIns/22.5[9]。并于给药第6周进行口服糖耐量实验(oral glucose tolerance test, OGTT)和胰岛素耐量实验(intraperi-toneal insulin tolerance test, IPITT)。
OGTT给药6周后, 实验当天各组小鼠禁食不禁水, 8 h后灌胃给予2.0 g·kg-1葡萄糖负荷。于负荷前(0 min)及负荷后30、60和120 min尾静脉取血, 通过血糖试纸测定血糖值, 并设定各组小鼠负荷前血糖值为100%, 负荷后各点血糖值均与负荷前血糖值进行比较。
IPITT给药6周后, 实验当天各组小鼠禁食不禁水, 8 h后腹腔注射常规胰岛素溶液(0.75 U·kg-1), 于注射前(0 min)和注射后15、30、60和120 min尾静脉取血, 通过血糖试纸测定血糖值, 并设定各组小鼠负荷前血糖值为100%, 负荷后各点血糖值均与负荷前血糖值进行比较。
Western blot法检测选取给药结束后取材保存的肝脏组织, 用含有蛋白酶抑制剂(Roche公司)和磷酸酶抑制剂(Applgen公司)的RIPA裂解缓冲液(Aidlab Biotechnologies公司)提取蛋白。用BCA蛋白质测定试剂盒(PIERCE公司)定量后, 蛋白通过SDS-PAGE电泳并转移到PVDF膜(Millipore公司)。5%胎牛血清(Solarbio公司)的TBST封闭PVDF膜。一抗4 ℃孵育过夜, 将结合的抗体与HRP缀合的山羊抗兔二抗(ZSGB-BIO公司)在室温下孵育1 h。使用Image Station 4000R (Rochester公司)的扫描光密度测定法将蛋白质带可视化和定量。
统计学方法采用Graphpad Prism 5软件进行分析, 实验结果以mean ± SEM表示, 多组间比较采用one way-ANOVA, 以P < 0.05为差异具有统计学意义。
结果 1 模型建立情况KM小鼠腹腔注射60 mg·kg-1·d-1 STZ 3天后进行FBG、空腹胰岛素测试, 结果显示, 2型糖尿病KM小鼠模型成功率为100%, 其中70%达到选取血糖标准, 结果如表 1所示。与正常组比较, 实验组FBG、Fins和HOMA-IR均显著增加。
| Table 1 The fasting blood glucose (FBG), fasting blood insulin (FIns) and homeostasis model assessment-insulin resistance index (HOMA-IR) in model mice were observed. n = 10, mean ± SEM. #P < 0.05, ###P < 0.001 vs normal group |
结果显示, 与模型组相比, 50和100 mg·kg-1·d-1 N15给药组FBG、FIns和HOMA-IR均显著降低(图 2A~C, P < 0.001), FBG、FIns于第7天开始显著降低(图 2A、B, P < 0.001), HOMA-IR于第28天开始显著降低(图 2C, P < 0.001)。除第7及14天外(图 2A, P < 0.05, P < 0.01), 200 mg·kg-1·d-1 N15给药组FBG与模型组相比均无显著差异(图 2A, P > 0.05), 第14、28和42天FIns均显著降低(图 2B, P < 0.001), HOMA-IR于第42天开始显著降低(图 2C, P < 0.001)。根据以上结果判定, N15的最佳治疗剂量为100 mg·kg-1·d-1。与阳性对照药吡格列酮给药组比较, N15给药组FBG、FIns和HOMA-IR均无显著性差异(图 2A~C, P > 0.05)。

|
Figure 2 Effect of N15 (50, 100 and 200 mg·kg-1·d-1) on glycaemic control in KM mice, pioglitazone (6 mg·kg-1·d-1) as the positive group. A: Sequential monitoring of FBG; B: FIns; C: HOMA-IR, after 8 h fasting. n = 10, mean ± SEM. ##P < 0.01, ###P < 0.001 vs normal group; *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
口服糖耐量实验及胰岛素耐量实验结果如图 3A、B所示, 与模型组相比, 100和200 mg·kg-1·d-1 N15均可明显改善2型糖尿病小鼠对葡萄糖和胰岛素的耐受程度(P < 0.05, P < 0.01, P < 0.001); 50 mg·kg-1·d-1 N15并未明显改善2型糖尿病小鼠对葡萄糖和胰岛素的耐受程度(P > 0.05)。

|
Figure 3 N15 ameliorates glucose and insulin tolerance in KM mice. Oral glucose tolerance test (OGTT) (A) and intraperitoneal insulin tolerance test (IPITT) (B) were preformed after 8 h fasting. Plasma glucose and insulin levels were measured from the blood samples that were drawn at baseline (t = 0 min) and indicated time points. n = 10, mean ± SEM. ##P < 0.01, ###P < 0.001 vs normal group; *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
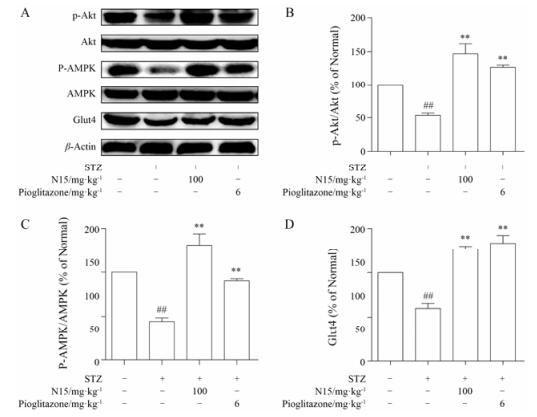
如图 4A所示, STZ建立模型后KM小鼠肝脏中Akt、AMPK蛋白水平表达不变(图 4B、C, P > 0.05), 而其活性形式磷酸化蛋白表达水平显著降低(图 4B、C, P < 0.01), 此外肝内Glut4蛋白表达水平也显著降低(图 4D, P < 0.01);给予N15及吡格列酮治疗6周后, KM小鼠肝脏中p-Akt、p-AMPK及Glut4蛋白表达水平均显著上调(图 4B~D, P < 0.01), Akt和AMPK蛋白水平表达不变(图 4B、C, P > 0.05)。提示N15可在一定程度上调小鼠肝脏内Akt、AMPK和Glut4相关信号通路。
|
Figure 4 Effect of N15 on Akt, AMPK and Glut4 activity in liver. A: Representative Western blot images of p-Akt, Akt, p-AMPK, AMPK and Glut4 protein; B-D: Quantitative analysis of p-Akt/Akt, p-AMPK/AMPK and Glut4. The values are expressed as percen-tages compared with the normal group (set to 100%). n = 10, mean ± SEM. ##P < 0.01 vs normal group; **P < 0.01 vs model group |
N15和OEA均为PPARα内在激动剂。研究显示, PPARα主要在肝脏中表达, 是脂代谢关键的调节因子, 几乎参与脂代谢的所有过程[10], 在脂肪酸摄取、结合与氧化、脂蛋白组合、运输与代谢等过程中均具有重要意义。在2型糖尿病状态下, 脂代谢紊乱可进一步诱发血糖耐受和胰岛素抵抗, 此外脂代谢紊乱可引发肥胖及脏器脂质堆积, 现有临床实例也证实调节脂代谢平衡对治疗糖尿病具有很好的现实意义[11]。PPARγ对糖代谢的调节主要是增加外周组织的胰岛素敏感性, 活化的PPARγ可能通过促进脂肪细胞分化、增强胰岛素信号转导、抑制脂代谢从而改善胰岛素抵抗, 调节糖代谢。在脂代谢方面, 由于游离脂肪酸(free fatty acid, FFA)水平升高可降低胰岛素敏感性, 减少肌肉中葡萄糖的摄取, 而TZDs通过促进PPARγ受体的活化可促进脂肪组织中脂质、脂肪酸的利用, 使肌肉等外周组织对FFA的摄取减少从而增加对胰岛素的敏感性。先前的研究显示, N15在激动PPARα的同时, 具有激动PPARγ的效果, 即为PPARα和PPARγ双靶点激动剂[7], 这些为N15治疗2型糖尿病提供了理论依据, 在本研究中利用STZ小剂量连续注射诱导2型糖尿病模型用于验证N15治疗2型糖尿病小鼠胰岛素抵抗效果, 实验结果显示N15具有明显的控制血糖及血清胰岛素浓度, 改善糖尿病后胰岛素抵抗的作用(图 2)。此外, 葡萄糖耐量和胰岛素耐量实验结果显示, 给予N15后小鼠葡萄糖耐受程度明显增加, 且对胰岛素的敏感性有所增加(图 3)。
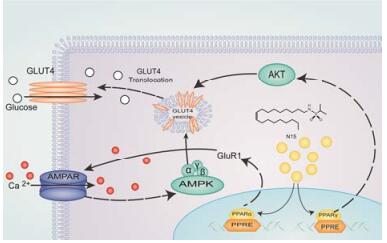
PPARγ对糖代谢的调节主要作用于外周组织对胰岛素的敏感性, 可有效降低胰岛素抵抗, 改善糖耐量。同时PPARγ可与PI3K信号转导途径相作用, 调节亚基与胰岛素受体底物相结合, 促使磷脂酰肌醇3磷酸磷酸化, 激活下游信号分子产生多种生物学效应, 促进葡萄糖转运体转位, 增加外周组织对葡萄糖的吸收和摄取, 从而达到降糖的目的[12, 13]。此外, AMPK被誉为“能量通道”在糖脂代谢中均发挥重要作用, Glut4是葡萄糖转运蛋白, 为转运葡萄糖所必需。研究显示, AMPK和Glut4可作为Akt信号通路的下游蛋白之一[14]。本实验研究同样显示了N15对于PI3K信号通路的激活作用, 且作用效果与吡格列酮相当(无明显统计学差异)。对于下游信号分子探索显示, N15对AMPK和Glut4同样具有激活作用(图 4), 其作用机制如图 5, 因此推测N15可通过激活核内PPARγ受体而发挥调节血糖作用, 而对于其是否发挥直接激动作用及是否通过通路内其他靶点发挥作用还需要进一步探讨。此外, N15的PPARα激动作用对于糖尿病后脂代谢紊乱同样具有调节作用[15], 研究显示PPARα激动剂具有的减肥作用, 可避免临床胰岛素增敏剂(PPARγ激动剂)噻唑烷二酮类药物体重增加的不良反应, 然而N15是否具有抑制体重作用还需要进一步验证。
|
Figure 5 Mechanism of N15 on hepatocyte in type 2 diabetic mellitus |
综上所述, 新型化合物N15具有治疗2型糖尿病胰岛素抵抗的功效, 是一种具有血糖控制效果的化学合成产物, 可将之与其他糖尿病治疗药物联合使用制成各种糖尿病治疗的组合药物及剂型, 具有实际应用价值。
| [1] | Saltiel AR, Olefsky JM. Thiazolidinediones in the treatment of insulin resistance and type Ⅱ diabetes[J]. Diabetes, 1996, 45: 1661–1669. DOI:10.2337/diab.45.12.1661 |
| [2] | Barroso I, Gurnel M, Crowley VE, et al. Dominant negative mutations in human PPAR γ associated with severe insulin resistance, diabetes mellitus and hypertension[J]. Nature, 1999, 402: 880–883. |
| [3] | Yu JG, Javorschi S, Hevener AL, et al. The effect of thiazolidinediones on plasma adiponectin levels in normal, obese, and type 2 diabetic subjects[J]. Diabetes, 2002, 51: 2968–2974. DOI:10.2337/diabetes.51.10.2968 |
| [4] | Ferré P. The biology of peroxisome proliferator-activated receptors:relationship with lipid metabolism and insulin sensitivity[J]. Diabetes, 2004, 53(Suppl 1): S43–S50. |
| [5] | Inoue I, Itoh F, Aoyagi S, et al. Fibrate and statin synergistically increase the transcriptional activities of PPAR α/RXRα and decrease the transactivation of NF-κB[J]. Biochem Biophys Res Commun, 2002, 290: 131–139. DOI:10.1006/bbrc.2001.6141 |
| [6] | Lincoff AM, Tardif JC, Schwartz GG, et al. Effect of aleglitazar on cardiovascular outcomes after acute coronary syndrome in patients with type 2 diabetes mellitus:the AleCardio randomized clinical trial[J]. JAMA, 2014, 311: 1515–1525. DOI:10.1001/jama.2014.3321 |
| [7] | Chen CX, Yang LC, Xu XD, et al. Effect of propane-2-sulfonic acid octadec-9-enyl-amide on the expression of adhesion molecules in human umbilical vein endothelial cells[J]. Eur J Pharmacol, 2015, 756: 15–21. DOI:10.1016/j.ejphar.2015.03.014 |
| [8] | Rodríguez de Fonseca F, Navarro M, Gómez R, et al. An anorexic lipid mediator regulated by feeding[J]. Nature, 2001, 414: 209–212. DOI:10.1038/35102582 |
| [9] | Haffner SM, Kennedy E, Gonzalez C, et al. A prospective analysis of the HOMA model. The Mexico City Diabetes Study[J]. Diabetes Care, 1996, 19: 1138–1141. DOI:10.2337/diacare.19.10.1138 |
| [10] | Vamecq J, Cherkaoui-Malki M, Andreoletti P, et al. The human peroxisome in health and disease:the story of an oddity becoming a vital organelle[J]. Biochimie, 2014, 98: 4–15. DOI:10.1016/j.biochi.2013.09.019 |
| [11] | Parker B, Noakes M, Luscombe N, et al. Effect of a high-protein, high-monounsaturated fat weight loss diet on glycemic control and lipid levels in type 2 diabetes[J]. Diabetes Care, 2002, 25: 425–430. DOI:10.2337/diacare.25.3.425 |
| [12] | Chen R, Peng X, Du W, et al. Curcumin attenuates cardiomyocyte hypertrophy induced by high glucose and insulin via the PPAR γ/Akt/no signaling pathway[J]. Diabetes Res Clin Pract, 2015, 108: 235–242. DOI:10.1016/j.diabres.2015.02.012 |
| [13] | Jay MA, Ren J. Peroxisome proliferator-activated receptor (PPAR) in metabolic syndrome and type 2 diabetes mellitus[J]. Curr Diabetes Rev, 2007, 3: 33–39. DOI:10.2174/157339907779802067 |
| [14] | Horie T, Ono K, Nagao K, et al. Oxidative stress induces Glut4 translocation by activation of PI3-K/Akt and dual AMPK kinase in cardiac myocytes[J]. J Cell Physiol, 2008, 215: 733–742. DOI:10.1002/(ISSN)1097-4652 |
| [15] | Tsuchida A, Yamauchi T, Takekawa S, et al. Peroxisome proliferator-activated receptor (PPAR) α activation increases adiponectin receptors and reduces obesity-related inflammation in adipose tissue:comparison of activation of PPAR α, PPARγ, and their combination[J]. Diabetes, 2005, 54: 3358–3370. DOI:10.2337/diabetes.54.12.3358 |
 2017, Vol. 52
2017, Vol. 52


