至今, 肿瘤依然是严重影响人类健康的重大疾病之一, 目前多数肿瘤治疗的手段依然局限于化学疗法、放射疗法和手术, 而治疗效果也因肿瘤种类不同而存在差异。传统的化疗手段缺乏特异性, 对正常细胞和肿瘤细胞均可造成杀伤作用, 毒副作用不言而喻。放射性疗法与手术对于转移瘤的治疗效果微乎其微, 限制了其应用。近20年来, 随着对肿瘤生物学及肿瘤免疫学的深入研究, 研究者逐渐开始将研究重点集中于能将毒性降至最小的肿瘤特异性免疫治疗, 并取得了极大的进展。
免疫治疗, 顾名思义是指通过调节患者的免疫系统而达到缓解或治愈疾病的目的, 依照治疗的原理不同, 可分为激活免疫系统和抑制免疫系统两种策略, 前者旨在诱导免疫系统杀伤异质细胞的能力, 后者旨在降低免疫系统的抑制信号进而增强免疫系统的清除能力。当肿瘤发生时, 由于肿瘤细胞免疫原性不强, 且一些肿瘤细胞表面受体以及肿瘤微环境中的细胞因子能够协助肿瘤逃过免疫系统的监视, 抑制了自身的抗肿瘤免疫效果, 因而此时免疫治疗的重点应集中于增加免疫系统对肿瘤抗原识别的敏感性, 同时阻断免疫逃逸信号的传递, 由此增强免疫系统清除肿瘤的能力。
1 肿瘤治疗新方向——肿瘤免疫治疗传统治疗方法的种种弊端使研究者们意识到开发高效低毒的治疗策略已经迫在眉睫。肿瘤免疫治疗或肿瘤疫苗均是颇具前景的选择, 其能通过调节患者自身的免疫能力达到识别肿瘤细胞, 杀伤肿瘤细胞的目的[1]。
在肿瘤免疫治疗研究初期, 获得成功的主要是免疫细胞过继治疗手段, 包括自然杀伤性细胞(natural killer cells, NK cells)、CD8+ T淋巴细胞、细胞淋巴因子激活杀伤细胞(lymphokine-activated killer cells, LAK cells)、肿瘤浸润淋巴细胞(activating tumor-infiltrating lymphocytes)及以树突状细胞(dendritic cells, DC)为基础的肿瘤疫苗[1, 2]。
随着对肿瘤相关抗原和肿瘤特异性抗原研究的不断深入, 研究人员尝试了多种抗肿瘤免疫策略:如将肿瘤细胞的全裂解产物作为原始抗原激活免疫反应[3]; 或将抗原与免疫佐剂一同给药, 增加抗原提呈细胞(antigen presenting cells, APCs)对抗原的摄取提呈, 进而增加细胞毒性T细胞(cytotoxic T lym-phocyte, CTL)杀伤肿瘤细胞的强度, 以及增强激活T细胞的共刺激信号和促炎性细胞因子等介导的治疗等。以上策略均是以增强免疫系统针对肿瘤细胞的反应强度和杀伤能力为目的。肿瘤免疫治疗的另一个方向则是降低免疫系统中对CTL杀伤肿瘤细胞具有抑制作用的因素, 如髓源性的抑制细胞(CD4+CD25+调节性T细胞和FOXP3+调节性T细胞[4])、免疫检查点等, 降低这些抑制信号能够在一定程度上增强肿瘤免疫治疗的效果。
实现肿瘤免疫治疗最重要的媒介是肿瘤疫苗, 肿瘤疫苗既具有预防肿瘤发生的作用, 也具有治疗肿瘤的作用。用作预防目的时, 肿瘤疫苗旨在通过提前对机体进行肿瘤相关抗原的接种, 使之产生肿瘤特异性的抗体或记忆性T细胞, 起到预防肿瘤的目的; 用作治疗目的肿瘤疫苗则是在肿瘤发生后, 激活体内的巨噬细胞和DC细胞, 产生能特异性杀伤肿瘤的CD8+ T细胞, 最终限制肿瘤的生长。
DC细胞是实现肿瘤免疫治疗的重要角色, 基于DC细胞的肿瘤免疫治疗方式很多: ①通过体外将肿瘤抗原与DC细胞进行孵育促进其摄取, 继而注射至体内实现肿瘤免疫的效果; ②通过将灭活的肿瘤细胞注射入体内, 待DC细胞识别摄取后进行下一步呈递; ③通过低强度的放疗化疗促进肿瘤相关抗原的释放, 经由DC细胞识别摄取后促进肿瘤免疫反应的产生。以上所有方式均需要DC细胞对肿瘤抗原的识别摄取, 并通过与MHC-Ⅰ分子或MHC-Ⅱ分子结合表达于DC细胞表面, 分别提呈给CD8+或CD4+ T细胞, 最终产生肿瘤特异性免疫反应[5] (图 1)。

|
Figure 1 The antigen presentation process by dendritic cells |
为了进一步优化肿瘤免疫治疗的治疗效果, 将纳米载体应用到肿瘤免疫治疗领域已经成为新兴的研究热点, 研究者尝试利用纳米载体本身特殊的理化性质, 高效地递送抗原, 调节免疫反应强度, 实现对肿瘤生长的抑制。
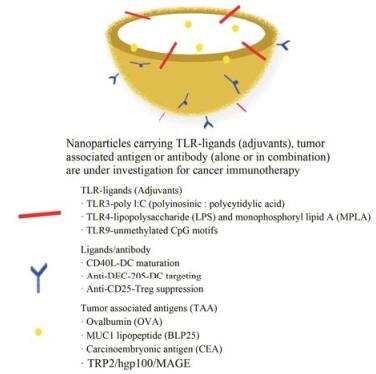
利用纳米载体携载免疫调节物质的研究正在如火如荼地进行着, 不少研究已取得一定成效, 携载物可以是免疫佐剂(如多肽、蛋白、核酸、寡核苷酸)、肿瘤相关抗原和抗体(靶头)等[6] (图 2)。其中, 免疫佐剂与肿瘤相关抗原是最常联用的两种成分, 当二者共载于纳米载体时, 能够借助纳米载体本身独特的理化性质, 传递至淋巴器官(淋巴结或脾脏)或抗原提呈细胞从而达到更佳的免疫治疗效果。可见纳米制剂在肿瘤免疫治疗中可作为多功能的载体系统, 既可以通过修饰靶头促进DC细胞识别, 又可实现肿瘤抗原和免疫佐剂的共传递[7]。除此之外, 纳米载体还可以解决一些游离药物系统注射后的问题, 如溶解性差、生物利用度低和治疗指数低等。
|
Figure 2 Design strategy of nanocarriers in tumor immuno-therapy |
目前, 已有多种纳米载体系统在肿瘤免疫治疗领域得到开发, 包括基于聚合物的纳米粒和胶束, 基于脂质成分的脂质体、纳米乳及无机成分的氧化铁纳米颗粒等。
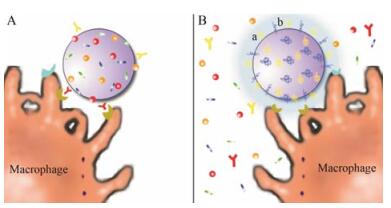
2.1 脂质体脂质体是一种由脂质双分子层形成的类脂纳米囊泡, 中央为亲水性的核心, 粒径通常在90~150 nm[5]。脂质体的水相和脂质双分子层可以包载多种药物, 如亲水性的药物可以包封于亲水性的核心, 疏水性的药物可以包载于脂质膜层中, 两性药物可定位于水相和膜内部的磷脂上, 蛋白质类抗体还可修饰于脂质体表面赋予其靶向性。由此可见, 脂质体是一种性质优良的纳米载体系统[8-10]。脂质体的优势还在于对包载其中的药物具有缓慢持续释放的效果, 并能通过改变药物分布和药代动力学降低药物的毒性等[9, 11]。长循环脂质体则是在普通脂质体的基础上进一步优化的结果, 其通常是指在脂质体表面进行磷脂酰肌醇、聚乙二醇和神经节苷脂等修饰, 使脂质体不易被血液中的调理素识别, 降低网状内皮系统的吞噬, 延长体内循环时间, 使药物作用时间延长[12, 13](图 3)。
|
Figure 3 The stealth liposomes avoid the internalization of RES system. A: Liposomes without pegylation are prone to macrophage internalization; B: Stealth liposomes reduce the internalization of macrophages |
目前已有众多研究将脂质体作为疫苗或抗肿瘤药物的纳米载体[14]。Van Broekhoven等[15]报道了对携载抗原的脂质体表面进行anti-DEC-205抗体修饰, 从而增强脂质体对DC细胞的靶向性。结果显示, 经修饰的脂质体在小鼠模型中展现出的抗肿瘤效果显著高于对照组, 治疗组小鼠的生存期也得到明显延长, 表明靶头修饰增强了脂质体对DC细胞的靶向性和摄取效率, 进而促进抗原特异性杀伤性T细胞的产生。Zhang等[16]采用pH敏感穿膜肽修饰脂质体, 携载免疫佐剂α-半乳糖神经酰胺后, 显著提高了DC细胞的摄取, 并有效激活NK T细胞。U’ren等[17]研究指出携载质粒DNA的阳离子脂质体能够增强抗肿瘤免疫反应, 相较于对照组, 治疗组能诱导大量白细胞介素-12 (IL-12)和干扰素-γ (IFN-γ)的分泌, 并快速激活CD8+ T细胞, 提高肿瘤免疫效率。Yoshikawa等[18]研究了以脂质体携载肿瘤裂解物的体内外免疫作用, 选用脂质作为载体, 通过膜融合的方式传递黑色素瘤细胞裂解产物, 无论是在体外刺激DC细胞还是体内免疫, 其产生的免疫效果均明显高于游离的黑色素瘤细胞裂解成分。此外, Chan等[19]还将脂质体用于淋巴结的多色磁共振成像研究。
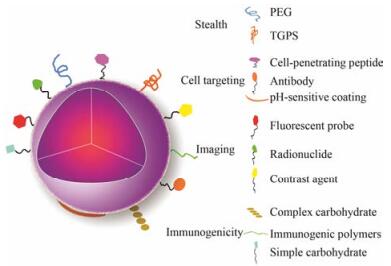
2.2 聚合物纳米粒聚合物纳米粒是一类以天然或合成的高分子材料为载体制成的固态胶体微粒, 粒径一般在10~100 nm, 可用作小分子药物及生物大分子药物的载体[20]。依给药方式不同、聚合物的化学结构、粒径大小、形状、表面电荷和降解性质等均可进行适当的调整, 并且可以在纳米粒的表面进行适当修饰从而得到理想的多功能纳米粒[21] (图 4)。这类纳米粒能够高效稳定地包载亲水性或疏水性药物, 并保护药物在体内外不被降解[22, 23], 不仅如此, 纳米粒还凭借理想的粒径范围, 能轻松通过多种细胞内外屏障, 从而协助包载药物穿过脉管内皮, 进入到目标炎症部位或肿瘤部位[22, 24]。
|
Figure 4 Fabrication of multifunctional nanocarriers |
聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]纳米粒及聚己内脂(polycaprolactone, PCL)纳米粒因其出众的生物降解能力和生物相容性, 成为目前应用最为广泛的纳米载体[25]。除了作为载体以外, 研究发现PLGA纳米粒和PCL纳米粒本身还具有一定免疫佐剂的作用, 因此又被称为颗粒佐剂。采用PLGA纳米粒或PCL纳米粒作为载体制备肿瘤疫苗, 一方面保护了携载蛋白的免疫原性和抗原性; 另一方面其本身还能作为免疫佐剂刺激免疫反应的发生, 使得疫苗产生更显著的免疫效果[26, 27]。
Zhang等[28]曾研究使用PLGA纳米粒将小鼠黑色素瘤抗原与Toll样受体-4激动剂MPLA (mono-phosphoryl lipid A)进行共载, 结果显示共载组能够显著延缓小鼠皮下黑色素瘤的生长, 说明黑色素瘤抗原与免疫佐剂经纳米粒共载后, 能够产生强烈的抗黑色素瘤免疫反应从而抑制皮下黑色素瘤生长。Roy等[29]选择将免疫调节剂脂多糖与化疗药物紫杉醇共载于PLGA纳米粒中, 结果显示共载给药组小鼠的平均肿瘤体积只是单独给药组的40%, 肿瘤部位浸润的抗原提呈细胞和T细胞的数量也明显高于单独给药组, 表明将脂多糖与紫杉醇共载能够促进肿瘤免疫反应, 并与化疗药物协同抑制肿瘤生长。Schlosser等[30]则将卵清蛋白(ovalbumin, OVA)与免疫佐剂CpG ODN共载于PLGA纳米粒中。结果显示, 小鼠在接种表达OVA的黑色素瘤后, 经过单次免疫体内产生的抗原特异性IFN-γ+ CD8+ T细胞是对照组的8倍, 说明将免疫佐剂CpG ODN与肿瘤抗原共载于PLGA纳米粒是提高肿瘤疫苗治疗效果的可行之策。除了常见的PLGA纳米粒, 基于无机材料的纳米粒同样可以用于肿瘤免疫治疗中, Cruz等[31]使用超顺磁氧化铁纳米粒携载荧光标记的抗原, 该纳米粒不仅可用于分析和定量纳米粒被DC细胞的摄取情况, 还能观察抗原被摄取之后在亚细胞结构中的分布情况。
2.3 聚合物胶束聚合物胶束是由两亲性嵌段共聚物在合适的温度和浓度条件下, 在溶剂体系中自发形成的直径小于100 nm的热力学稳定的胶体系统[32]。聚合物胶束具有疏水性的核心, 常用于包载水溶性较差或疏水性药物, 并且能够提高包载药物的生物利用度, 避免药物在体内被快速降解[33]。
在肿瘤免疫治疗中, 聚合物胶束同样具有重要作用。由于其粒径较小, 易于随淋巴管渗透至淋巴结内, 当用作抗肿瘤疫苗的载体时, 无论是对传递肿瘤抗原还是免疫佐剂均非常有利。Kelle等[34]制备出由N-(2-羟丙基)甲基丙烯酰胺/丙基丙烯酰胺/甲基丙烯酸二甲氨基乙酯/甲基丙烯酸丁酯构成的胶束, 显著提高了DC细胞对所包载抗原的摄取效率, 并诱导了CD8+ T细胞应答, 是一种极具潜力的肿瘤疫苗载体。Wilson等[35]制备出由甲基丙烯酸二甲氨基乙酯/吡啶硫甲基丙烯酸乙酯构成的胶束, 共同包载免疫佐剂CpG ODN和肿瘤抗原, 相较于游离药物组, 共载药物组促进抗原的交叉呈递, 显著提高细胞免疫和体液免疫反应。
2.4 树枝状聚合物树枝状聚合物是由中心核、支化单体和可官能化的外周基团形成的超支化球形纳米载体, 其可以通过支化单体的聚合或发散聚合制备, 产生具有亲水性的表面和疏水性的核心[36]。树枝状聚合物的主要理化特征是低黏度、超支化分子拓扑、大分子尺寸和多个可以化学官能化的端基[37]。如今研究最广泛的树枝状聚合物家族是聚酰胺-胺(polyamidoamine, PAMAM), 此外还有聚丙烯亚胺以及肽树枝状聚合物如聚L-谷氨酸树枝状聚合物[38]。
Yoshikawa等[18]报道线性聚谷氨酸是一种能够递送抗原至DC细胞的聚氨基酸聚合物, 同时具有促进DC细胞成熟和促进CTL增殖的佐剂性质。目前已有几种树枝状聚合物进入了临床试验, 用作抗乳腺癌[39]、前列腺癌[40]和小细胞肺癌[41]的疫苗载体, 取得了良好的结果。
2.5 单克隆抗体单克隆抗体(10~15 nm)不是典型的肿瘤免疫治疗的纳米载体, 但因其与病毒样颗粒具有相同的大小范围, 也可被认为属于纳米药物类别。单克隆抗体可以结合在肿瘤细胞表面表达的抗原上, 通过抗体依赖的胞吞作用和补体介导的胞毒作用对肿瘤细胞造成杀伤[42]。曲妥单抗(anti-HER2)和西妥昔单抗(anti-EGFR)是分别被批准用于治疗乳腺癌和结肠癌的两种单克隆抗体[43]。
3 影响纳米载体被免疫系统摄取的因素将肿瘤相关抗原高效地递送给DC细胞, 是纳米载体系统促进肿瘤免疫治疗的一个重要先决条件。微粒疫苗包括全细胞疫苗、灭活病毒体和病毒样颗粒, 或是制备的纳米递送系统如脂质体和纳米粒等, 其粒径、表面电荷及受体配体结合作用等均能影响抗原的递送, 因而理想的理化条件能显著增加DC细胞对抗原的摄取[44]。
3.1 粒径纳米载体的粒径影响着细胞对纳米粒的摄取机制和内吞途径, 决定了纳米粒在细胞中的命运和整个生物学效应。有报道指出, 小粒径(小于100 nm)的纳米载体可以轻易地进入引流淋巴结, 进而被淋巴结中的DC细胞摄取, 这种特性非常有利于肿瘤免疫治疗的开展。粒径稍大的纳米载体(大于200 nm)则可通过被循环单核细胞摄取, 并随细胞迁移至淋巴结[45, 46]。Foged等[47]研究表明, 纳米载体的粒径小于500 nm才能使DC细胞高效摄取, 当纳米载体的粒径大于500 nm时, 则更倾向于被一些特殊的细胞通过巨胞饮或吞噬作用摄取, 如巨噬细胞和皮肤中的郎格罕细胞。Fifis等[48]研究指出, 用于预防和治疗肿瘤的纳米载体的最佳粒径范围应是40~50 nm。Xiang等[45]则指出, 当纳米载体的粒径与病毒大小(100 nm左右)接近时, 通常激活细胞免疫, 刺激CTL和Th1的产生, 诱发病毒样免疫反应; 纳米载体的粒径与细菌大小(0.5~1 μm)接近时, 通常激活体液免疫, 刺激Th2分化和抗体的产生, 产生细菌样免疫反应。病毒样颗粒的Ⅱ期临床试验已显示他们具有诱导产生体液免疫和细胞免疫应答的潜力。载有免疫佐剂CpG ODN和黑色素瘤抗原的病毒样颗粒能诱导巨噬细胞和CTL的活化, 并促进炎性细胞因子如肿瘤坏死因子(TNF-α)、IFN-γ及IL-2的分泌[49]。
3.2 形态除了粒径的影响外, 还有报道指出纳米载体的形状同样会对细胞摄取水平和生物分布产生影响。虽然已有研究者提出非球形的纳米载体因能避免非特异性的细胞吞噬, 延长血液中的循环时间, 但与球形纳米载体相比, 非球形的纳米载体被DC细胞摄取的水平相对较低。而根据Gratton等[50]报道, 杆状的纳米载体展现出最高的细胞摄取水平, 其次是球形, 之后依次是圆柱体和立方体的纳米载体。
3.3 表面电荷纳米载体的表面电荷同样在颗粒内化过程中发挥重要作用, 甚至会影响其诱导产生的免疫应答的性质[45]。由于细胞膜带有负电荷, 带正电荷纳米载体系统对其表现出较高的亲和力, 因此阳离子纳米载体能更快速地被巨噬细胞或DC细胞摄取, 进入细胞后, 带负电或中性纳米载体倾向于定位在溶酶体, 而带正电的纳米粒显示出溶酶体逃逸的能力, 主要定位于细胞核周区域[51, 52]。
4 纳米载体靶向免疫细胞的机制 4.1 被动靶向众所周知, 一定粒径范围的纳米载体(200~500 nm)能通过实体瘤的高渗透性与滞留效应(en-hanced permeability and retention effect, EPR效应)实现在肿瘤部位蓄积, 这是由于肿瘤部位毛细血管内皮完整性缺失, 使得循环系统中纳米载体能顺着浓度梯度渗透至肿瘤间隙, 同时肿瘤部位淋巴管回流的缺失使得渗透进入的纳米载体能长时间地蓄积于肿瘤部位, 从而形成被动靶向至肿瘤部位的现象[53]。
纳米载体对免疫细胞的被动靶向同样存在, 其被动靶向的效率主要决定于上述提到的纳米载体的理化性质:小粒径的纳米载体能轻易随着淋巴管进入淋巴结, 增加淋巴结中DC细胞对纳米载体的摄取, 而大粒径的纳米载体则更易被注射部位或循环系统中的吞噬细胞摄取; 带正电的纳米载体更易被DC细胞摄取, 但其组织中的渗透能力较为受限, 相反带负电或中性的纳米载体在组织中渗透能力较好, 但对DC细胞的亲和力又相对较低; 杆状或球状的纳米载体被DC细胞摄取的能力更强, 圆柱状和立方体状的纳米载体被DC细胞摄取的能力则相对较弱[6]。
4.2 主动靶向主动靶向纳米粒通常是通过在其表面或外周修饰生物活性配体, 该配体能被组织或细胞上过表达的受体识别并结合, 进而促进纳米载体通过受体介导的胞吞作用进入细胞[54, 55]。表面修饰是实现纳米载体主动靶向的重要手段, 在免疫治疗中同样需要这样的修饰来实现纳米载体与免疫细胞的特异性接触[56] (图 5)。

|
Figure 5 Targeted delivery of nanocarriers by modification of antibody, ligand or pathogen-associated molecular patterns (PAMPs) |
DC细胞表面高表达DEC-205, 该细胞具有良好地呈递外源性抗原与MHC-Ⅰ类复合物结合的能力, 进而促进高度特异性的细胞毒性免疫应答。Van Broekhoven等[15]曾通过在脂质体表面修饰单链抗体anti-DEC-205来获得脂质体对DC细胞的特异性靶向, 并使其包载的肿瘤抗原得以高效地提呈, 实现肿瘤特异性的免疫治疗效果。
4.2.2 特异性配体修饰载体实现主动靶向DC细胞表面的甘露糖受体同样也可以通过配体受体结合而促进纳米载体的内化, 增强抗原的进一步加工和呈递, 引起更强烈的抗原特异性免疫应答[57, 58]。还有研究表明, 直接刺激抗原提呈细胞表面的CD40即可激活抗原提呈细胞, 增强肿瘤相关抗原的提呈, 刺激产生杀伤性T细胞, 而不需要依赖于辅助性T细胞表面的CD40受体与之结合产生的共刺激信号, 这也为肿瘤免疫中纳米载体提供表面修饰的新思路[59]。
4.2.3 PAMPs修饰载体实现主动靶向目前免疫细胞靶向研究较多的还有免疫细胞表面的模式识别受体(pattern recognition receptors, PRRs), PRRs可识别环境中的病原体相关分子模式(pathogen-associated molecular patterns, PAMPs), 并参与免疫反应, 从启动、增殖到执行结束的所有阶段[60]。PAMPs可以是不同类型的分子, 统称为“危险信号”, 包括脂质、脂蛋白、蛋白质、碳水化合物和核酸。PRRs和PAMPs的识别后可通过激活多因子信号传导途径而触发免疫应答, 分泌多种细胞因子和趋化因子, 进而诱导炎症反应的产生[60]。经典的PRRs主要有以下几类:如Toll样受体(Toll-like receptor, TLR)、视黄酸诱导型基因样受体[retinoic-acid inducible gene (RIG)-like receptors, RLRs]、核苷酸寡聚化结构域样受体[oli-gomerization domain (NOD)-like receptors, NLRs]、DNA受体(胞浆中的DNA传感器)、清道夫受体和C型凝集素受体(C-type lectin receptors, CLRs)[7, 57, 61]。在哺乳动物中, 研究最广泛的PRRs是TLR类, 其主
要由抗原提呈细胞表达, 尤其是DC细胞, 此外也在适应性免疫系统相关的细胞上有发现, 如αβT细胞、调节性T细胞及NKT细胞等[62]。TLR的刺激对于固有免疫系统及适应性免疫系统均有显著的活化作用, 这个刺激可以是来自于T细胞或B细胞表面TLR的直接作用, 也可以是来自于DC细胞表面TLR的间接作用[7]。CLR属于由抗原提呈细胞表达的另一种PRR, 该受体家族的特征在于存在结合碳水化合物的结构域, CLR作为一种特异性受体主要参加抗原的内化过程, 能促进抗原的摄取及内部加工提呈过程, 影响抗原在胞内的命运, 以及选择与MHC-Ⅰ类复合物或MHC-Ⅱ类复合物结合[63, 64]。
由此可见, 借助PRR, 一方面能够更加精准地实现免疫细胞靶向; 另一方面可以优化纳米载体被免疫细胞摄取的过程, 这种重要作用也为肿瘤免疫相关的靶向纳米载体的设计提供了丰富的思路。此外, 对携载有肿瘤抗原的纳米载体进行PAMPs的修饰, 能够在同一系统中实现抗原成分和“危险信号”的共传递, 显著提高纳米载体的免疫原性, 为后续激活肿瘤相关免疫反应创造了重要的先决条件[7]。
4.3 局部给药除了直接注射的纳米载体外, 目前还有通过将制剂植入皮下实现纳米级药物递送, 其中一些技术已经进入临床试验阶段, Ali等[65, 66]报道了一种三维多孔聚合物支架的研发, 该支架以粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony stimu-lating factor, GM-CSF)作为DC细胞诱导剂, CpG-聚乙烯亚胺纳米粒作为TLR-9激动剂, 黑色素瘤裂解产物为肿瘤抗原来源。该三维支架能够促进DC细胞成熟, 促进摄取了抗原的DC细胞迁移至引流淋巴结, 进一步激活初始T淋巴细胞。这种疫苗策略可提供高达90%预防性和治疗性抗肿瘤保护, 并且已经被美国食品和药物管理局批准作为植入疫苗策略进行临床研究。
5 肿瘤免疫治疗中纳米载体系统的优势相较于传统的肿瘤治疗手段, 肿瘤免疫治疗的优势在于以下几个方面: ①可以精准地识别肿瘤细胞进行特异性杀伤, 而对正常细胞的影响较小; ②肿瘤特异性的免疫反应同样可以对转移瘤产生抑制效果; ③肿瘤免疫具有记忆性, 可以在长时间内对机体进行保护, 防止肿瘤复发。然而肿瘤的各种免疫逃逸途径使得早期肿瘤疫苗的治疗效果不尽人意, 例如肿瘤细胞可通过下调自身MHC分子的表达量, 从而躲避CTL的清除作用[2]。而纳米载体利用其本身的独特的理化性质, 能有效地将免疫佐剂(多肽、蛋白、核酸、寡核苷酸链等)或肿瘤抗原传递至免疫器官(淋巴结或脾脏)或抗原提呈细胞从而达到更佳的免疫治疗效果。
由于病原体表面PAMPs的存在, 其可被机体强大的免疫系统快速识别, 纳米载体由于粒径大小与病原体类似, 因此常常采用模拟病原体的方式进行设计[67], 如在纳米载体表面修饰上PAMPs以提高抗原递送效率[68]。
当目标抗原OVA以游离形式皮下注射给小鼠时, 经过交叉呈递给CD8+ T细胞的量非常低, 而将抗原经由PLGA纳米粒包载后, 能显著提高OVA的抗原提呈, 激活CD8+ T细胞, 其分泌的IL-2是游离抗原组的1 000倍[69]。另有研究证明, 当游离肿瘤抗原被抗原提呈细胞吞噬后, 经由MHC-Ⅰ类途径提呈的量非常少, 而当抗原提呈细胞摄取了纳米载体包载的肿瘤抗原后, 可通过交叉呈递促进抗原经由MHC-Ⅰ类途径进行提呈, 甚至在免疫完成后96 h仍可检测到抗原提呈过程, 进而诱导产生长时间有效的肿瘤特异性CTL反应[70]。
不仅如此, 纳米载体还能保护免疫治疗成分(抗原/免疫佐剂)不会在生物环境中过早降解, 提高抗原在体内的稳定性, 并且具有较高的载药量, 能够持续缓慢地释放抗原, 有助于提高免疫应答的强度, 较长的抗原暴露持续时间同时也能诱导产生有效的免疫记忆应答[71]。
6 总结与展望随着免疫学家和材料科学家积极合作, 一系列新的肿瘤治疗手段正不断被开发出来。纳米载体则为免疫治疗提供了极具吸引力的递送模式, 可以通过在实体瘤或淋巴结中的特异性蓄积来降低免疫治疗分子的全身细胞毒性, 并且通过免疫治疗剂的持续缓慢释放, 诱导效应细胞长期生成并产生有效的记忆性免疫应答。纳米载体可以携带不同种类的免疫调节剂, 例如抗原/抗体/细胞因子/配体(可以单独携载也可共载), 能够在递送过程中保护免疫调节剂不被快速降解并保持其构象。纳米载体还能促进实现组合疗法而达到协同的抗肿瘤作用, 例如化疗免疫疗法, 通过纳米载体将化疗药物与免疫调节剂共载给药, 化疗药物对肿瘤细胞起到直接杀伤作用, 免疫调节剂则可以调节免疫系统对肿瘤细胞实施杀伤, 二者协同使得抗肿瘤效果得到提升。而有些具有固有免疫调节活性的聚合物(PLGA)则可同时作为免疫刺激颗粒及抗原/药物载体。
纳米载体介导的肿瘤免疫治疗在最近几十年已经显示出良好结果, 一些基于纳米载体的肿瘤免疫疗法已成功完成临床研究(Gardasil宫颈癌疫苗), 多个项目正处在临床试验阶段。现有的基于纳米载体的肿瘤免疫治疗的目的主要在于调整包载物(抗原/佐剂等)的释放速率, 实现对肿瘤组织的特异性治疗, 减少游离药物的不良反应, 并最终调节免疫系统, 预防或治疗肿瘤的生长。在开发用于常规药物递送的纳米载体时, 需要考虑如何避免免疫系统的清除, 而肿瘤免疫治疗中则需要设计与免疫系统的各个通路能够产生相互作用的纳米载体系统。因此, 在开发具体的纳米载体时, 需根据其用途不同而进行相应的调整以实现特定的治疗结果。
可以预见, 在未来用于肿瘤免疫治疗的纳米载体系统能够将以下特性有机地结合起来: ①免疫细胞的靶向, 促进不同药物的可控递送从而调节免疫细胞对肿瘤细胞的作用; ②通过包含不同的探针进行追踪, 以提高细胞标记方法和成像方法的安全性、特异性和灵敏度。基于纳米载体免疫治疗手段将可以针对特定患者进行合理计划调整, 产生更好的临床效果, 增强对肿瘤发展的控制, 从而促进其从实验室走向市场。
| [1] | Baronzio G, Parmar G, Shubina I, et al. Update on the challenges and recent advances in cancer immunotherapy[J]. Immunotargets Ther, 2013, 2: 39–49. |
| [2] | Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting[J]. Annu Rev Immunol, 2004, 22: 329–360. DOI:10.1146/annurev.immunol.22.012703.104803 |
| [3] | Goforth R, Salem AK, Zhu X, et al. Immune stimulatory antigen loaded particles combined with depletion of regulatory T-cells induce potent tumor specific immunity in a mouse model of melanoma[J]. Cancer Immunol Immunother, 2009, 58: 517–530. DOI:10.1007/s00262-008-0574-6 |
| [4] | Ahmad F, Mani J, Kumar P, et al. Activation of anti-tumor immune response and reduction of regulatory T cells with Mycobacterium indicus pranii (MIP) therapy in tumor bearing mice[J]. PLoS One, 2011, 6: e25424. DOI:10.1371/journal.pone.0025424 |
| [5] | Conniot J, Silva JM, Fernandes JG, et al. Cancer immunotherapy:nanodelivery approaches for immune cell targeting and tracking[J]. Front Chem, 2014, 2: 105. |
| [6] | Singh MS, Bhaskar S. Nanocarrier-based immunotherapy in cancer management and research[J]. Immunotargets Ther, 2014, 3: 121–134. |
| [7] | Silva JM, Videira M, Gaspar R, et al. Immune system targeting by biodegradable nanoparticles for cancer vaccines[J]. J Control Release, 2013, 168: 179–199. DOI:10.1016/j.jconrel.2013.03.010 |
| [8] | Aslan B, Ozpolat B, Sood AK, et al. Nanotechnology in cancer therapy[J]. J Drug Target, 2013, 21: 904–913. DOI:10.3109/1061186X.2013.837469 |
| [9] | Sharma A, Jain N, Sareen R. Nanocarriers for diagnosis and targeting of breast cancer[J]. BioMed Res Int, 2013, 2013: 960821. |
| [10] | Sahoo SK, Labhasetwar V. Nanotech approaches to drug delivery and imaging[J]. Drug Discov Today, 2003, 8: 1112–1120. DOI:10.1016/S1359-6446(03)02903-9 |
| [11] | Khan DR, Rezler EM, Lauer-Fields J, et al. Effects of drug hydrophobicity on liposomal stability[J]. Chem Bio Drug Des, 2008, 71: 3–7. |
| [12] | Frank MM. The reticuloendothelial system and bloodstream clearance[J]. J Lab Clin Med, 1993, 122: 487–488. |
| [13] | Krishnamachari Y, Geary SM, Lemke CD, et al. Nanoparticle delivery systems in cancer vaccines[J]. Pharm Res, 2011, 28: 215–236. DOI:10.1007/s11095-010-0241-4 |
| [14] | Ewert K, Evans HM, Ahmad A, et al. Lipoplex structures and their distinct cellular pathways[J]. Adv Genet, 2005, 53: 119–155. |
| [15] | van Broekhoven CL, Parish CR, Demangel C, et al. Targeting dendritic cells with antigen-containing liposomes:a highly effective procedure for induction of antitumor immunity and for tumor immunotherapy[J]. Cancer Res, 2004, 64: 4357–4365. DOI:10.1158/0008-5472.CAN-04-0138 |
| [16] | Zhang MM, Yang YT, Yu QW, et al. Preliminary study on immune mechanisms of pH-sensitive transmembrane peptide modified liposome loaded with α -galactosylceramides[J]. Acta Pharm Sin (药学学报), 2017, 56: 634–640. |
| [17] | U'Ren L, Kedl R, Dow S. Vaccination with liposome-DNA complexes elicits enhanced antitumor immunity[J]. Cancer Gene Ther, 2006, 13: 1033–1044. DOI:10.1038/sj.cgt.7700982 |
| [18] | Yoshikawa T, Okada N, Oda A, et al. Nanoparticles built by self-assembly of amphiphilic gamma-PGA can deliver antigens to antigen-presenting cells with high efficiency:a new tumor-vaccine carrier for eliciting effector T cells[J]. Vaccine, 2008, 26: 1303–1313. DOI:10.1016/j.vaccine.2007.12.037 |
| [19] | Chan KWY, Bulte JWM, Mcmahon MT. Diamagnetic chemical exchange saturation transfer (diaCEST) liposomes:physicochemical properties and imaging applications[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2013, 6: 111–124. |
| [20] | Panyam J, Labhasetwar V. Biodegradable nanoparticles for drug and gene delivery to cells and tissue[J]. Adv Drug Deliver Rev, 2003, 55: 329–347. DOI:10.1016/S0169-409X(02)00228-4 |
| [21] | Albertsson AC. Degradable Aliphatic Polyesters[M]. Berlin: Springer, 2002. |
| [22] | Singh R, Lillard JW Jr. Nanoparticle-based targeted drug delivery[J]. Exp Mol Pathol, 2009, 86: 215–223. DOI:10.1016/j.yexmp.2008.12.004 |
| [23] | Gelperina S, Kisich K, Iseman MD, et al. The potential advantages of nanoparticle drug delivery systems in chemotherapy of tuberculosis[J]. Am J Resp Crit Care, 2005, 172: 1487–1490. DOI:10.1164/rccm.200504-613PP |
| [24] | Prokop A, Davidson JM. Nanovehicular intracellular delivery systems[J]. J Pharm Sci, 2008, 97: 3518–3590. DOI:10.1002/jps.21270 |
| [25] | Danhier F, Ansorena E, Silva JM, et al. PLGA-based nanoparticles:an overview of biomedical applications[J]. J Control Release, 2012, 161: 505–522. DOI:10.1016/j.jconrel.2012.01.043 |
| [26] | Chen M, Ouyang H, Zhou S, et al. PLGA-nanoparticle mediated delivery of anti-OX40 monoclonal antibody enhances anti-tumor cytotoxic T cell responses[J]. Cell Immunol, 2014, 287: 91–99. DOI:10.1016/j.cellimm.2014.01.003 |
| [27] | Johansen P, Estevez F, Zurbriggen R, et al. Towards clinical testing of a single-administration tetanus vaccine based on PLA/PLGA microspheres[J]. Vaccine, 2000, 19: 1047–1054. DOI:10.1016/S0264-410X(00)00343-1 |
| [28] | Zhang Z, Tongchusak S, Mizukami Y, et al. Induction of anti-tumor cytotoxic T cell responses through PLGA-nanoparticle mediated antigen delivery[J]. Biomaterials, 2011, 32: 3666–3678. DOI:10.1016/j.biomaterials.2011.01.067 |
| [29] | Roy A, Singh MS, Upadhyay P, et al. Nanoparticle mediated co-delivery of paclitaxel and a TLR-4 agonist results in tumor regression and enhanced immune response in the tumor microenvironment of a mouse model[J]. Int J Pharm, 2013, 445: 171–180. DOI:10.1016/j.ijpharm.2013.01.045 |
| [30] | Schlosser E, Mueller M, Fischer S, et al. TLR ligands and antigen need to be coencapsulated into the same biodegradable microsphere for the generation of potent cytotoxic T lymphocyte responses[J]. Vaccine, 2008, 26: 1626–1637. DOI:10.1016/j.vaccine.2008.01.030 |
| [31] | Cruz LJ, Tacken PJ, Fokkink R, et al. Targeted PLGA nano-but not microparticles specifically deliver antigen to human dendritic cells via DC-SIGN in vitro[J]. J Control Release, 2010, 144: 118–126. DOI:10.1016/j.jconrel.2010.02.013 |
| [32] | Torchilin VP. Structure and design of polymeric surfactant-based drug delivery systems[J]. J Control Release, 2001, 73: 137–172. DOI:10.1016/S0168-3659(01)00299-1 |
| [33] | Jhaveri AM, Torchilin VP. Multifunctional polymeric micelles for delivery of drugs and siRNA[J]. Front Pharmacol, 2014, 5: 77. |
| [34] | Keller S, Wilson JT, Patilea GI, et al. Neutral polymer micelle carriers with pH-responsive, endosome-releasing activity modulate antigen trafficking to enhance CD8+ T cell responses[J]. J Control Release, 2014, 191: 24–33. DOI:10.1016/j.jconrel.2014.03.041 |
| [35] | Wilson JT, Keller S, Manganiello MJ, et al. pH-Responsive nanoparticle vaccines for dual-delivery of antigens and immunostimulatory oligonucleotides[J]. ACS Nano, 2013, 7: 3912–3925. DOI:10.1021/nn305466z |
| [36] | Lee CC, Mackay JA, Fréchet JM, et al. Designing dendrimers for biological applications[J]. Nat Biotechnol, 2005, 23: 1517–1526. DOI:10.1038/nbt1171 |
| [37] | Yang W, Cheng AY, Xu TW, et al. Targeting cancer cells with biotin-dendrimer conjugates[J]. Eur J Med Chem, 2009, 44: 862–868. DOI:10.1016/j.ejmech.2008.04.021 |
| [38] | Nanjwade BK, Bechra HM, Derkar GK, et al. Dendrimers:emerging polymers for drug-delivery systems[J]. Eur J Pharm Sci, 2009, 38: 185–196. DOI:10.1016/j.ejps.2009.07.008 |
| [39] | Gilewski TA, Ragupathi G, Dickler M, et al. Immunization of high-risk breast cancer patients with clustered sTn-KLH conjugate plus the immunologic adjuvant QS-21[J]. Clin Cancer Res, 2007, 13: 2977–2985. DOI:10.1158/1078-0432.CCR-06-2189 |
| [40] | Slovin SF, Ragupathi G, Musselli C, et al. Fully synthetic carbohydrate-based vaccines in biochemically relapsed prostate cancer:clinical trial results with α-N-acetylgalactosamine-O-serine/threonine conjugate vaccine[J]. J Clin Oncol, 2003, 21: 4292–4298. DOI:10.1200/JCO.2003.04.112 |
| [41] | Krug LM, Ragupathi G, Hood C, et al. Vaccination of patients with small-cell lung cancer with synthetic fucosyl GM-1 conjugated to keyhole limpet hemocyanin[J]. Clin Cancer Res, 2004, 10: 6094–6100. DOI:10.1158/1078-0432.CCR-04-0482 |
| [42] | Weiner LM, Murray JC, Shuptrine CW. Antibody-based immunotherapy of cancer[J]. Cell, 2012, 148: 1081–1084. DOI:10.1016/j.cell.2012.02.034 |
| [43] | Mahalingam D, Curiel TJ. Antibodies as cancer immunotherapy[M]//Curiel T, ed. Cancer Immunotherapy. New York:Springer, 2013:335-376. |
| [44] | Bachmann MF, Jennings GT. Vaccine delivery:a matter of size, geometry, kinetics and molecular patterns[J]. Nat Rev Immunol, 2010, 10: 787–796. DOI:10.1038/nri2868 |
| [45] | Xiang SD, Scholzen A, Minigo G, et al. Pathogen recognition and development of particulate vaccines:does size matter?[J]. Methods, 2006, 40: 1–9. DOI:10.1016/j.ymeth.2006.05.016 |
| [46] | Manolova V, Flace A, Bauer M, et al. Nanoparticles target distinct dendritic cell populations according to their size[J]. Eur J Immunol, 2008, 38: 1404–1413. DOI:10.1002/(ISSN)1521-4141 |
| [47] | Foged C, Brodin B, Frokjaer S, et al. Particle size and surface charge affect particle uptake by human dendritic cells in an in vitro model[J]. Int J Pharm, 2005, 298: 315–322. DOI:10.1016/j.ijpharm.2005.03.035 |
| [48] | Fifis T, Gamvrellis A, Crimeen-Irwin B, et al. Size-dependent immunogenicity:therapeutic and protective properties of nano-vaccines against tumors[J]. J Immunol, 2004, 173: 3148–3154. DOI:10.4049/jimmunol.173.5.3148 |
| [49] | Goldinger SM, Dummer R, Baumgaertner P, et al. Nano-particle vaccination combined with TLR-7 and -9 ligands triggers memory and effector CD8+ T-cell responses in melanoma patients[J]. Eur J Immunol, 2012, 42: 3049–3061. DOI:10.1002/eji.201142361 |
| [50] | Gratton SEA, Ropp PA, Pohlhaus PD, et al. The effect of particle design on cellular internalization pathways[J]. Proc Natl Acad Sci U S A, 2008, 105: 11613–11618. DOI:10.1073/pnas.0801763105 |
| [51] | Yue ZG, Wei W, Lv PP, et al. Surface charge affects cellular uptake and intracellular trafficking of chitosan-based nanoparticles[J]. Biomacromolecules, 2011, 12: 2440–2446. DOI:10.1021/bm101482r |
| [52] | Thiele L, Merkle HP, Walter E. Phagocytosis and phagosomal fate of surface-modified microparticles in dendritic cells and macrophages[J]. Pharm Res, 2003, 20: 221–228. DOI:10.1023/A:1022271020390 |
| [53] | Maeda H. The enhanced permeability and retention (EPR) effect in tumor vasculature:the key role of tumor-selective macromolecular drug targeting[J]. Adv Enzyme Regul, 2001, 41: 189–207. DOI:10.1016/S0065-2571(00)00013-3 |
| [54] | Gao H, Xiong Y, Zhang S, et al. RGD and interleukin-13 peptide functionalized nanoparticles for enhanced glioblastoma cells and neovasculature dual targeting delivery and elevated tumor penetration[J]. Mol Pharm, 2014, 11: 1042–1052. DOI:10.1021/mp400751g |
| [55] | Cheng J, Teply BA, Sherifi I, et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery[J]. Biomaterials, 2007, 28: 869–876. DOI:10.1016/j.biomaterials.2006.09.047 |
| [56] | Stephan MT, Moon JJ, Um SH, et al. Therapeutic cell engineering with surface-conjugated synthetic nanoparticles[J]. Nat Med, 2010, 16: 1035–1041. DOI:10.1038/nm.2198 |
| [57] | Carrillo-Conde B, Song EH, Chavez-Santoscoy A, et al. Mannose-functionalized "pathogen-like" polyanhydride nanoparticles target C-type lectin receptors on dendritic cells[J]. Mol Pharm, 2011, 8: 1877–1886. DOI:10.1021/mp200213r |
| [58] | Lu Y, Kawakami S, Yamashita F, et al. Development of an antigen-presenting cell-targeted DNA vaccine against melanoma by mannosylated liposomes[J]. Biomaterials, 2007, 28: 3255–3262. DOI:10.1016/j.biomaterials.2007.03.028 |
| [59] | Vonderheide RH, Bajor DL, Winograd R, et al. CD40 immunotherapy for pancreatic cancer[J]. Cancer Immunol Immun, 2013, 62: 949–954. DOI:10.1007/s00262-013-1427-5 |
| [60] | Kumar H, Kawai T, Akira S. Pathogen recognition in the innate immune response[J]. Biochem J, 2009, 420: 1–16. DOI:10.1042/BJ20090272 |
| [61] | Shen L, Higuchi T, Tubbe I, et al. A trifunctional dextran-based nanovaccine targets and activates murine dendritic cells, and induces potent cellular and humoral immune responses in vivo[J]. PLoS One, 2013, 8: e80904. DOI:10.1371/journal.pone.0080904 |
| [62] | Wesch D, Peters C, Oberg HH, et al. Modulation of γδ T cell responses by TLR ligands[J]. Cell Mol Life Sci, 2011, 68: 2357–2370. DOI:10.1007/s00018-011-0699-1 |
| [63] | Unger WW, Van KY. 'Dressed for success' C-type lectin receptors for the delivery of glyco-vaccines to dendritic cells[J]. Curr Opin Immunol, 2011, 23: 131–137. DOI:10.1016/j.coi.2010.11.011 |
| [64] | van Kooyk Y. C-type lectins on dendritic cells:key modulators for the induction of immune responses[J]. Biochem Soc Trans, 2008, 36: 1478–1481. DOI:10.1042/BST0361478 |
| [65] | Ali OA, Verbeke C, Johnson C, et al. Identification of immune factors regulating antitumor immunity using polymeric vaccines with multiple adjuvants[J]. Cancer Res, 2014, 74: 1670–1681. DOI:10.1158/0008-5472.CAN-13-0777 |
| [66] | Ali OA, Huebsch N, Cao L, et al. Infection-mimicking materials to program dendritic cells in situ[J]. Nat Materials, 2009, 8: 151–158. DOI:10.1038/nmat2357 |
| [67] | Moon JJ, Huang B, Irvine DJ. Engineering nano-and microparticles to tune immunity[J]. Adv Mater, 2012, 24: 3724–3746. DOI:10.1002/adma.v24.28 |
| [68] | Little SR. Reorienting our view of particle-based adjuvants for subunit vaccines[J]. Proc Natl Acad Sci U S A, 2012, 109: 999–1000. DOI:10.1073/pnas.1120993109 |
| [69] | Hong S, Ackerman AL, Virginia C, et al. Enhanced and prolonged cross-presentation following endosomal escape of exogenous antigens encapsulated in biodegradable nanoparticles[J]. Immunology, 2006, 117: 78–88. DOI:10.1111/imm.2006.117.issue-1 |
| [70] | Harding CV, Song R. Phagocytic processing of exogenous particulate antigens by macrophages for presentation by class Ⅰ MHC molecules[J]. J Immunol, 1994, 153: 4925–4933. |
| [71] | Waeckerlemen Y, Allmen EU, Gander B, et al. Encapsulation of proteins and peptides into biodegradable poly(D, L -lactide-co-glycolide) microspheres prolongs and enhances antigen presentation by human dendritic cells[J]. Vaccine, 2006, 24: 1847–1857. DOI:10.1016/j.vaccine.2005.10.032 |
 2017, Vol. 52
2017, Vol. 52


