2. 广东药科大学中药学院, 广东 广州 510006
2. School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China
中药活性成分的辨识及药效物质基础的精准解析和表征是中药新药研究开发、药效作用机制阐明、临床精准用药的重要前提[1-3], 也是中药质量控制的核心内容。与中药功能属性密切相关的化学物质(质量控制指标成分)的高效、精准辨析是现代中药质量研究亟待突破的瓶颈问题[4, 5]。
生物色谱(bio-chromatography)是基于生物大分子的特异性相互作用分离、纯化和测定具有活性的化合物及其生化参数的一种分析技术[6, 7]。细胞膜色谱技术(cell membrane chromatography, CMC)是将含靶标受体的活性组织细胞膜(或受体高表达细胞)作为固定相, 用液相色谱法研究药物与固定相上细胞膜受体相互作用的一种生物色谱分析方法[8]。细胞膜色谱技术为中药复杂物质体系同时、快速、特异和灵敏的定性定量表征提供了新的方法平台。多维多息指纹图谱通过对中药(药物系统)的表征与活性效应之间的组效学特征(组效关系)研究相结合, 系统完整地解决中药药效和质量相关性问题[9]。
本文着重对细胞膜色谱技术在中药有效成分辨识中的应用及方法学研究进展情况进行简要综述, 并结合作者在复杂物质体系成分解析、生物膜色谱和薄层色谱-生物自显影技术用于中药质量研究的一些心得和思考, 探讨将以细胞膜色谱为代表的生物色谱技术(发现)与中药多维多息指纹图谱(整体表征)和多指标成分含量测定(局部刻画)结合, 基于整体观, 以中药活性成分的定性定量表征为指标评价中药质量的策略和思路。
1 细胞膜色谱法及其在中药活性成分辨析中的应用细胞膜色谱法由西安交通大学贺浪冲教授于1996年提出, 是一种研究药物与受体相互作用的亲和色谱方法, 其具有受体亲和与色谱分离双重功能, 可进行药物分离、活性筛选以及药物鉴定, 在中药复杂体系成分分离和筛选研究方面有独特的优势[10]。
1.1 细胞膜色谱的分类根据细胞膜是否固定于色谱载体表面可将细胞膜色谱法分为细胞膜生物亲和色谱法与细胞膜固相色谱法。
细胞膜生物亲和色谱法是将活性细胞膜固定在硅胶等色谱分离载体的表面, 制成细胞膜色谱固定相(cell membrane stationary phase, CMSP), 用液相色谱方法研究药物与固定相上细胞膜之间的亲和作用[11-13]。其最大的特点就是具有色谱分离和细胞膜活性的双重特性, 筛选方法快速、简捷、靶点多样, 适合中药等复杂体系的研究, 可直接通过色谱参数(容量因子)的不同而判断其药理活性[14, 15]。然而, 细胞膜生物亲和色谱柱制备过程繁琐, 缺乏标准的操作规程, 在不同实验人员和不同实验室间重现性较差, 制备的色谱柱有效使用寿命不到72 h, 阻碍其大规模应用和商品化前景。
细胞膜固相色谱法直接用效应器官的细胞膜与中药提取液在适宜培养基中共同孵育, 利用活性细胞膜固相化中药的成分, 使效应成分与细胞膜受体特异性结合, 再通过洗涤、解离等过程将效应成分释放, 利用LC-MS等鉴定解离液中的活性组分。该法以细胞膜为固定相, 保留了细胞膜的完整性、膜受体的立体结构、周围环境和靶点[16]; 经过多次洗涤药物作用后的细胞膜, 可排除大量非特异性成分的干扰, 是研究中药效应成分的有效手段之一。Li等[6]采用生物特异萃取法结合高效液相色谱分离进行中药活性成分的辨识, 即将样品与靶细胞(膜)在缓冲溶液中孵育, 不结合的化合物用相同的缓冲液洗脱掉, 在适当的变性条件下使结合成分与受体解离, 从柱中洗脱下来; 应用HPLC比较结合前后和/或洗脱液中的化学成分, 以辨识准活性成分。与细胞膜生物亲和色谱法相比, 细胞膜固相色谱仅具有细胞膜的生物活性, 而无色谱分离特性, 仅能实现活性成分初步筛选, 后续还需要快速分离系统和高灵敏检测系统对活性组分进行进一步分离和解析。
1.2 细胞膜色谱技术的发展自问世以来, 细胞膜色谱技术经历了从“离线”到“在线”筛选通量不断提高, 由“多靶点”到“特定靶点(受体)”特异性和灵敏性不断增强, 由靶点“未知”到特定受体高表达细胞株靶点和受体作用更加清晰的发展历程; 基于云计算的虚拟对接、分子对接和药物亲和反应靶标稳定技术(DARTS)等技术与分子生物学研究结合应用于细胞膜色谱实现了靶标的有效鉴定和确证。
1.2.1 细胞膜色谱固定相靶细胞种类早期细胞膜色谱法多采用生物组织和一般培养细胞作为靶细胞(表 1[17-44]所示)。细胞膜中存在多种活性蛋白, “目标”受体与“非目标”受体同时存在, “目标”受体表达数量有限且未知不可控, 药物可能与多种酶、受体或通道蛋白结合, 采用液相色谱法测定的容量因子反映的是药物与细胞膜上多种靶标的协同亲和作用, 在此基础上建立的细胞膜色谱法对配体分子识别的特异性、敏感性和选择性均受到不同程度的限制, 对活性组分的靶标鉴定和验证工作存在较大困难。
| Table 1 Applications of the models of cell membrane chromatography (CMC) in screening active components from TCMs |
随着分子生物学技术的发展, 通过外源重组质粒将受体的配基、亚基及靶酶的活性中心等在细胞株或微生物中成功大量表达在一定程度上解决了上述难题, 在此基础上建立的明确靶点受体高表达细胞膜色谱模型, 有效提高了筛选的特异性和准确性[45]。Wang等[46]通过质粒转染得到稳定膜高表达亚型受体细胞株, 构建了受体高表达HEK293α1B细胞膜色谱系统, 再与大鼠肝脏组织匀浆和原代培养的肝细胞制备的细胞膜系统测定的容量因子进行比较分析, 结果显示, 配体在HEK293α1B细胞膜色谱柱的保留时间最长, 在大鼠肝脏组织匀浆细胞膜色谱柱的保留时间最短, 说明应用HEK293α1B细胞膜色谱系统具有更高的精确性和灵敏性, 显著提高了细胞膜色谱的柱效、特异性和专一性。表 2[47-68]对近年来受体高表达细胞膜色谱在中药及中药制剂中的应用进行了整理。
| Table 2 Applications of the models of CMC in screening active components from TCMs |
然而, 基于某种受体稳定高表达的细胞膜色谱模型存在两个问题, 一是所谓的受体高表达是将质粒导入细胞中使某种特定受体表达量提高, 提高中药中该受体特异激动剂或拮抗剂的筛选效率。而由于其他细胞膜固有受体表达量并未受到影响, 中药中活性成分与细胞膜上非目标受体的亲和作用对筛选结果的干扰依然存在, 这种筛选模型依然是一种多靶点的复杂模型。另外一方面, 中药复方具有多组分-多靶点协同作用的特点, 这种针对单一靶点特定受体的模型筛选中药活性组分并不符合中医药整体性和动态性的基本特性, 不适用于多组分靶标的筛选。此外, 这种特定受体高表达模型制备过程繁琐, 价格昂贵, 不适用于推广和商业化。
1.2.2 正常/病理细胞膜色谱技术活性成分与靶细胞膜、细胞内特异性酶或受体结合是中药发挥作用的重要步骤之一。对疾病状态下器官、组织病理生理状态的模拟可在一定程度上避免一些与疾病不相关的特异性或非特异性相互作用对筛选的干扰。然而, 无论是正常组织或传代细胞系的细胞膜碎片还是某种受体高表达细胞株作为细胞膜来源, 都无法完全模拟器官的损伤或病理状态, 导致错误的筛选结果, 并因此耗费了大量时间用于分离、纯化和药效学的确证。Chen等[15, 69, 70]以多柔比星(DOX)诱发心力衰竭模型大鼠心脏左心室作为细胞膜来源, 将正常心脏与多柔比星诱导的衰竭心肌细胞膜色谱行为进行比较分析, 用于筛选附子和四逆汤中与多柔比星诱发心力衰竭相关的活性组分; 利用位置切换阀技术同时载入全二维分析体系, 比较保留组分在细胞膜色谱柱上色谱保留行为(容量因子k)的差异。在心衰细胞膜色谱保留上具有较高亲和力的组分认为是和疾病密切相关的活性组分, 反之, 在正常细胞膜色谱柱上有较好保留而在衰竭的心肌细胞细胞膜色谱柱保留较差, 可认为其是对DOX诱导的心力衰竭的非特异性组分。最终筛选出附子中塔拉乌头胺、异叶乌头素、14-乙酰塔拉乌头胺和14-苯甲酰尼奥宁等这4个成分作为后期重点研究的抗DOX心力衰竭活性先导化合物。该种方法对正常和病理性细胞膜色谱柱之间的潜在活性组分亲和力进行可视化比较, 显著提高了细胞膜色谱筛选得到的组分对于特定疾病的疗效的专属性。
1.2.3 二维液相色谱技术在细胞膜色谱分析中的应用细胞膜色谱在创立之初主要采用“离线收集”的方式, 即通过人工方式收集在细胞膜色谱固定相上保留的中药活性组分, 经一系列样品前处理后再利用LC (GC)/MS分离、鉴定有效组分中的活性成分, 这种离线收集的方式主要存在如下问题:一是“手动”流分收集工作耗时耗力; 二是研究过程容易受到其他因素的影响, 如浓缩过程可能引起收集流分中不稳定的化学成分结构发生变化, 操作过程繁琐引入不必要的污染, 微量成分流失等; 三是后期分离鉴定技术工作量较大。二维液相色谱(two dimensional liquid chromatography, 2D-LC)通过两个不同分离过程或机制对复杂样品进行分离, 能显著提高峰容量, 增加色谱峰定性和定量的灵敏度及可靠性[71]。细胞膜二维液相分析系统将细胞膜色谱作为第一维色谱, 筛选出有效组分流出色谱柱后, 通过切换阀切换到第二维色谱柱进行分离分析, 通常以常规高效液相色谱柱作为第二维色谱。建立基于细胞膜色谱二维在线分析系统的活性成分筛选平台, 可直接在线从复杂体系中“识别”-“分析”-“鉴定”作用于特定受体的活性成分, 提高效率同时有效改善柱效低等限制细胞膜色谱应用的问题。这种全二维细胞膜色谱的搭建使得细胞膜色谱法对中药活性成分的分析更加确切, Chen等[15]建立了基于HepG2细胞膜色谱-整体柱-飞行时间质谱系统的全二维液相分析方法, 快速地筛选鉴定出黄柏中小檗碱和四氢巴马汀, 苦参中的苦参碱和氧化苦参碱是具有抗肝癌活性的成分; Ji等[69]搭建了新型的SMMC-7721细胞-鸦胆子和HepG2细胞-鸦胆子的全二维细胞膜色谱-整体柱色谱的高通量活性成分筛选模型, 筛选出腺苷和鸦胆子苦素B两种潜在的抗肿瘤活性成分。西安交通大学贺浪冲教授研究团队[72]以高表达受体细胞膜色谱技术为核心, 研究了集“识别-分离-鉴定”于一体的细胞膜色谱-HPLC/MS二维分析系统, 在此基础上研制开发了“天然药物中目标物快速‘识别鉴定’二维色谱系统”。他们以酪氨酸激酶受体(TKR)作为抗肿瘤药物筛选的靶点, 构建了EGFR、VEGFR、bFGFR1和bFGFR4等稳定膜高表达亚型TKR受体细胞株, 并利用TKR/CMC二维色谱分析仪, 对红毛七等50多种中药材中的抗肿瘤活性成分进行筛选, 得到了塔斯品碱等抗肿瘤血管生成先导化合物[13]。
1.2.4 表面修饰的共价细胞膜色谱技术具有生物活性的细胞膜在体外“寿命”有限, 膜的脱落和活性衰减导致制备的细胞膜色谱柱柱效仅为3~5天, 且重复性低, 大大限制了该技术的广泛应用。对此, Ding等[73]研究发现, 氨丙基三乙氧基硅烷(APTES)可使硅胶被醛基修饰后与细胞膜上的氨基反应形成共价键, 将细胞膜固定在硅胶表面, 使其不容易脱落, 从而建立APTES修饰的HepG2肿瘤干细胞膜色谱柱。吉非替尼在APTES修饰的细胞膜色谱柱上保留时间为21 min, 而在对照组未经修饰的细胞膜色谱柱上保留时间为10 min, 说明经APTES修饰组的色谱柱相对于非修饰组表现出较高的柱效; 连续12天内每天对两组细胞膜色谱柱注射6次吉非替尼, 结果表明APTES修饰可使柱寿命延长至至少12天, 且将重现性提高到10%以内。这种细胞膜色谱法的改进可显著延长其柱寿命并扩大其应用范围, 非常适合于制备无价的或难以获得的细胞材料例如干细胞的细胞膜色谱柱。表面修饰共价细胞膜色谱技术的发展使细胞膜色谱柱商业化成为可能。
2 细胞膜色谱技术在中药质量分析领域中应用的策略和思考中药质量控制模式与单一成分化学药物存在本质差别, 其质量标准的建立须体现中医用药理论, 全面反映药效物质基础、复方药物君臣佐使的配伍关系及药物的性味等。中药指纹图谱技术通过对中药化学物质基础的整体表征, 可从宏观上反映中药产品的相似性和一致性; 而多指标成分定量通过对中药中关键指标成分含量测定(局部刻画)来表征中药质量的优劣; 二者结合在一定程度上实现了中药质量的全面控制。
2.1 基于指纹图谱技术与药效相关性的中药质量控制研究中药化学指纹图谱已成为一种国内外广泛接受的中药质量评价模式[3]。但现阶段所建立的色谱指纹图谱多仅能反映中药化学特征, 与中药药效关联性不强。生物自显影-薄层色谱技术[74]和高效液相色谱在线活性检测[75]等基于靶标内在活性的中药活性成分筛选技术在一定程度上实现了中药指纹图谱与生物活性关联分析。薄层色谱-生物自显影技术是将靶标反应液作为色谱分离的显色剂, 根据斑点颜色鉴别其是否具有相关活性。如二肽基肽酶Ⅳ (DPP Ⅳ)将底物(Gly-Pro-对硝基苯胺)水解成对硝基苯胺(pNA), 用亚硝酸钠重氮化, 然后与N-(1-萘基)乙二胺二盐酸盐反应形成玫瑰红色染料, 从而在TLC板上显示玫瑰红色背景, DPP Ⅳ抑制剂阻断底物的酶解以产生pNA则在背景上显示白斑, Gu等[76]将这一原理应用于9种药用植物的甲醇提取物DPP Ⅳ抑制剂的筛选, 发现了骆驼蒿中的活性成分骆驼蓬碱。近两年还有利用薄层色谱(TLC)-生物自显影方法从中草药中检测到脂肪酶抑制剂[77]和α-葡萄糖苷酶抑制剂[78], 但该法分离能力较差, 对化合物定性主要依赖于Rf值, 故仅适用于活性成分的初步筛选。高效液相色谱-在线活性检测是通过HPLC分离复杂混合物, 再与靶标在线混合后在反应线圈相互作用, 通过检测酶催化底物产生的产物量的减少说明其对酶的抑制作用。常艳旭等[79-81]构建了高效液相色谱-二极管阵列检测-化学发光法联用仪器系统, 建立丹参注射液-H2O2清除活性指纹图谱, 用于丹参注射液的一致性评价; 进一步模拟阳性药物峰效关系模型, 构建丹参注射液效价指纹图谱; 并利用相似度评价和判别分析与丹参药材活性指纹图谱结合, 评价不同产地、不同品种、不同栽培方式的丹参药材, 从化学信息和活性信息等多个角度确定了栽培丹参和山东产白花丹参可作为野生丹参的替代品。Li等[82]先从500种中药水提和醇提物中寻找到诃子、玫瑰、丁香的果实提取物以及石榴的果壳对α-葡萄糖苷酶具有较高抑制剂作用, 通过HPLC-DAD-MS/MS-BCD快速筛选和表征这4种提取物中的α-葡萄糖苷酶抑制剂; 鉴定出具有α-葡萄糖苷酶抑制作用的化合物鞣料云实素和鞣花酸。此外, 该法还应用于中药中黄嘌呤氧化酶抑制剂[83]的筛选, 但该法成本较高并不能作为普适性筛选技术。
上述两种技术或基于活性成分的化学特性(如自由基清除能力), 或基于与单一特定靶标的亲和作用进行活性成分的辨识, 在一定程度上解决了中药指纹图谱与药效相关性的问题。然而, 基于化学特性的活性成分辨识技术并非针对药物作用的靶标, 特异性较差; 而基于单靶点的活性成分辨识具有效率低、作用单一、使用成本高等问题, 限制了其在中药质量控制中的应用。
2.2 细胞膜色谱技术在中药质量控制中应用的思考中药质量控制指标成分是中药质量控制的核心, 其选择需既能反映中药整体特征, 又与中药功能主治、生物活性及安全性密切相关。刘昌孝院士于2016年提出了“中药质量标志物(Q-marker)”的概念, 指出在中药质量研究中需对与中药功能属性密切相关的化学物质, 即反映中药安全性、有效性的标志性物质进行质量控制[5]。
细胞膜色谱法将配体在体内与细胞膜受体相互作用过程转换为体外的色谱过程, 是一种从中药复杂体系中筛选发现目标成分的技术手段。He等[84]应用建立的不同细胞膜色谱模型筛选已研究了160余种中草药, 从中发现了多个具有抗心肌缺血、抗炎、抗肿瘤、抗高血压及治疗糖尿病等活性的目标组分。近年来, 研究者们探索将细胞膜色谱技术用于中药质量评价, 即通过不同的细胞膜色谱柱筛选中药及方剂中活性成分, 将活性成分与其他相关组分结合, 构建相应的指纹图谱, 可在一定程度上将疗效和质量控制相联系, 从而达获得稳定可靠的质控方法。Wang等[85, 86]利用细胞膜色谱法并结合离体药理实验, 对“四物汤”中各味中药进行拆方分析, 发现川芎醇提后的醋酸乙酯萃取部位是川芎发挥药效的有效部位, 并建立了以川芎有效部位为基础的高效毛细管色谱指纹图谱和高效液相色谱指纹图谱, 用于不同来源川芎药材的质量评价。Li等[87, 88]采用犬心肌、大脑和血管细胞膜受体筛选技术分别发现了丹参脂溶性部位对心肌、三七水溶性部位对大脑、当归挥发油对血管均有较强的选择性作用; 进而根据心康平抗心肌缺血、耐缺氧和增加冠脉血流量等作用, 并根据各指标成分在细胞膜色谱上的保留行为, 选择三七皂苷R1, 人参皂苷Rb1、Re和Rg1作为心康平的定性指标进行薄层鉴别, 以丹参酮IIA和当归中藁本内酯为主要定量指标用于心康平的质量评价。上述研究根据研究对象的药理作用选取相应的细胞膜色谱模型, 筛选与药物功效和活性对应的质量控制指标成分, 并用于产品质量评价, 虽然筛选到的指标成分与常规质量控制指标成分相同, 但为未知药物质量控制指标成分的选择提供了方法借鉴和新思路, 遗憾之处是这些方法未能将指标成分的“量-效”关系体现到质量评价中, 即仅通过细胞膜色谱分析筛选指标成分, 并未考虑指标成分含量与活性及安全性的关系。
中药注射剂是临床上广泛应用的现代中药制剂; 但由于中药物质基础的多样性与复杂性, 以及中药注射剂临床使用存在不规范的现象, 近年来关于中药注射液不良反应的报告逐年升高, 最常见的不良反应就是过敏反应和类过敏反应。目前, 已通过构建过敏源受体高表达的细胞膜色谱模型, 利用高表达受体细胞膜色谱-HPLC/MS二维色谱分析系统进行中药注射剂中潜在致敏组分的在线富集、筛选及结构鉴定, 并结合体外药理实验, 确定中药注射剂及相关药材中可能引起Ⅰ型过敏反应和类过敏反应的致敏组分。Han等[61]采用大鼠IgE受体高表达的RBL-2H3/ CMC模型从双黄连注射液中筛选得到潜在致敏成分黄芩苷, 并通过肥大细胞脱颗粒实验和β-氨基己糖苷酶实验验证了黄芩苷的致敏活性。Guo等[60]构建了高表达H1R (组胺受体高表达)的HEK293细胞系, 通过H1R/CMC-HPLC/MS在线二维色谱系统从鱼腥草注射液中筛选出作用于H1受体的鱼腥草素, 经药理实验验证鱼腥草素为H1受体激动剂, 是潜在的致敏成分。但上述研究缺乏潜在致敏原诱发过敏反应的剂量与其在相应中药注射剂中浓度的相关性研究。同时, 中药注射剂在临床应用发生过敏和类过敏等不良反应因素较为复杂, 仅通过细胞膜色谱难以模拟临床不良反应发生的真实情况, 故采用细胞膜色谱法筛选中药注射剂中潜在致敏原, 但也仅能提供一些参考, 其在中药注射剂安全性评价和质量控制中的具体应用还有待商榷。
2.3 基于细胞膜色谱构建中药多维多息指纹图谱多维多息指纹图谱[3, 9]从多维联用分析技术、药效检测和信息处理三个方面入手开展中药指纹图谱理论和实践研究。多维即采用多种分析仪器联用的模式, 目前最常用的高效液相色谱/二极管阵列检测器/质谱/质谱联用方式所得的色谱峰图(各个成分的保留时间)、二极管阵列检测器所得的在线紫外光谱图(on-line UV图)、一级质谱图(各个成分的相对分子质量)和二级质谱图(某成分的特征碎片)。所谓多息, 即指中药的特征谱应努力做到化学和药效两方面信息的融合[89-91], 经组效关系研究, 获取中药药效组分指纹图谱; 并将化学指纹图谱和中药药效组分指纹图谱用于中药材、提取物和中药复方制剂的质量控制, 以及药物创新等实践中, 解决中药质量评价的科学性等关键科学问题[9]。在此基础上发展定量指纹图谱, 通过中药中各成分含量变化计算相似度, 采用相似系统理论定量评价中药液相色谱指纹图谱的相似度[92]。作者课题组提出在多维多息指纹图谱分析中引入细胞膜色谱技术, 构建“筛选(细胞膜色谱)-整体表征(多维多息指纹图谱)-局部刻画(多指标成分定量)”一体的基于整体观的中药质量评价策略, 具体技术路线见图 1。
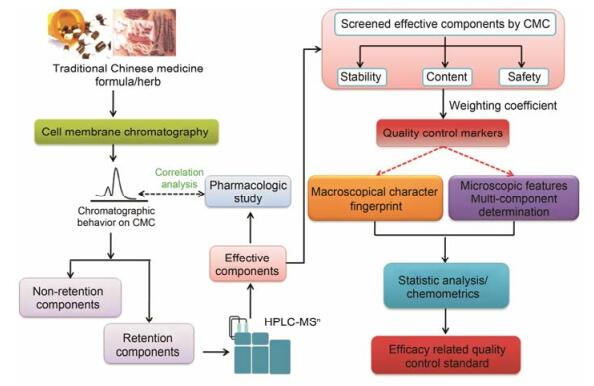
|
Figure 1 Roadmap for quality control of traditional Chinese medicine on the basis of the relationship between fingerprinting and efficacy |
第一步:中药有效组分及关键指标成分的筛选。首先根据研究对象(中药材、提取物及中药复方制剂)的功效和作用选择3~5个与药物疾病治疗作用相关的细胞膜色谱模型, 应用细胞膜色谱模型发现、筛选、富集不同中药中可能与特定细胞膜受体结合的目标组分, 即有效组分; 采用液相-质谱或气相-质谱联用等技术通过离线或在线的方式鉴定有效组分的化学物质基础; 通过经典药理学/毒理研究验证细胞膜色谱筛选结果; 在此基础上选取可用于质量控制的关键指标成分, 用于指纹图谱相似度评价和多指标成分含量测定。关键指标成分须满足以下3个条件: ①在细胞膜色谱上有保留, 且响应超过目标组分在细胞膜色谱的检测限(信噪比3)和/或定量限(信噪比10); ②目标中药的代表性成分; ③具有与药物疾病治疗作用相关的活性。
第二步:局部刻画-多指标成分含量测定。建立关键指标成分的含量测定方法, 确定中药产品中各目标组分(有效组分)和所含关键指标成分的含量间的比例。明确目标组分及关键指标成分与药物疾病治疗作用(药效)的量效关系, 由此可从这些关键指标成分的含量及其比例的变化可推算药物的量效关系, 进而可根据目标组分或指标成分含量变化预测待测产品质量变化可能会引起的药效变化。目标组分在细胞膜色谱上的检测限和/或定量限可作为确定多指标成分含量测定限度的依据。
第三步:整体表征-多维多息指纹图谱的建立。采用液相-质谱或气相-质谱联用等技术建立中药中目标组分的多维指纹图谱(针对不同种类化合物, 可选择不同分析方法)。根据细胞膜色谱筛选结果确定指纹图谱的特征峰用于多维指纹图谱的相似度评价, 确定参比峰, 规定特征峰的相对保留时间及相对峰面积比, 用于不同批次、不同来源的中药质量一致性评价。关键指标成分在细胞膜色谱上的保留行为(容量因子k )与相应药效的经典药理学评价指标等进行相关性分析, 计算关键指标成分种类和含量对生物活性贡献作为质量评价的权重系数, 结合化合物含量、稳定性、安全性(毒性、过敏/类过敏)等不同维度信息经化学计量学处理后, 构建与中药化学成分指纹峰相对应的活性指纹谱, 再经过统计分析, 将不同的化学与生物学指纹信息整合后进行综合质量评价。
这种方式的优点在于可将细胞膜色谱作为“深入研究”的一部分, 由具有研究经验丰富的团队进行前期研究、验证和复核比对; 再“浅出标准”, 将活性信息与化学指纹图谱相关性以数学公式、含量限度等方式收载于标准中, 用于实际质量评价。
2.4 基于血小板细胞膜色谱的活血化瘀中药质量评价策略细胞膜色谱法作为以亲和为基础的药物筛选方法之一, 其成本低、简单、高效且普适于中药复杂体系的活性成分筛选。至今为止, 已建立了多种细胞膜色谱成功地用于中药活性成分筛选体系。本课题组建立了血小板细胞膜色谱模型用于丹参注射液、丹红注射液、血塞通注射液中抗血小板凝集活性筛选, 根据这些活性成分在细胞膜色谱上保留行为和容量因子初步判断活性成分的大小, 同时采用体外抗凝集实验验证细胞膜色谱分析结果, 说明建立的血小板细胞膜色谱法可用于中药及其制剂中抗血小板凝集的活性成分筛选。通过血小板细胞膜色谱模型筛选出丹参提取物中的抗血小板凝集的活性成分丹酚酸B、迷迭香酸、紫草酸, 将其作为质量控制的指标成分; 分别用HPLC和血小板细胞膜色谱对不同批次的丹参提取物进行含量测定; 确定血小板细胞膜色谱的最低检测限; 通过血小板体外抗凝集实验进行活性验证; 将其在血小板细胞膜色谱上的保留行为与体外抗凝集实验结果进行相关性分析; 计算指标成分种类和含量对生物活性贡献作为质量评价的权重系数, 同时对指标成分在提取物中的含量和稳定性等维度进行评价, 最后构建与这3种成分相对应的活性指纹图谱, 从而对丹参提取物进行综合质量评价。基于血小板细胞膜色谱的活血化瘀中药质量评价策略将另文详述。
3 小结与展望随着疾病发病机制的深入研究, 更多的药物作用靶点被人类所发现, 以明确的作用靶点为基础的细胞膜色谱技术使得药物活性成分的筛选更加具体。通过建立靶点明确的细胞膜色谱达到效应成分高通量筛选的目的, 结合靶点的致病原理, 将筛选的成分作为指标成分对其进行质量控制, 可实现基于生物活性的中药质量控制; 正常/病理模型的细胞膜色谱方法在提高色谱柱专属性的同时, 还可解释中药复方药效成分的君臣佐使配伍关系, 将中药活性成分筛选与传统中医理论相结合, 进一步为主要药效成分的质量控制提供理论依据; 另外, IgE等受体高表达的细胞膜色谱模型的建立对于中药注射剂的致敏组分进行高通量筛选, 可用于中药注射剂安全性监控。
细胞膜色谱技术发展至今, 实现了中药活性成分的高通量筛选, 但如何阐明这些潜在活性组分的作用靶点, 成为制约其应用和发展的瓶颈问题。近年来, 靶点筛选和鉴定技术发展迅速, 主要分为两种[93], 一种是基于分子生物学、细胞生物学等“湿法实验”的研究, 例如应用广泛的亲和层析技术和药物亲和反应靶标稳定技术, 传统的亲和层析技术具有仅依靠药物与靶蛋白的结合而不依赖于特异性的细胞和生化参数的优势, 是一种选择性沉降靶蛋白以去除非靶蛋白的正性富集方式, 但对于低亲和力的靶蛋白筛选能力较差; 药物亲和反应靶标稳定技术(DARTS)[94, 95]是先通过药物的结合作用稳定靶蛋白从而抵抗蛋白酶的消化作用, 再消化掉非靶蛋白的负性富集方式, 该技术的优点在于使用原始小分子化合物不需要任何化学修饰可筛选药物的直接作用靶点, 但只能筛选出高丰度的靶点, 且筛选的靶点不能进行富集。虽然“湿法实验”的方法用于靶标筛选最为直接, 但因为靶标与中药活性成分的低亲和能力而限制其发展。另一种是基于计算机模拟和生物信息学技术的“干法实验”, 例如基于“云计算-高通量对接”的虚拟筛选技术和反向分子对接等, “云计算-高通量对接”通过构建病症相关蛋白数据库, 应用筛选多组分的靶标, 并对筛选得到的靶标信息进行进一步匹配和验证, 可在较短的时间内完成大量组分靶标的虚拟筛选研究, 具有高通量和专属性的优势; 反向分子对接是通过计算方法找到特定药物或活性小分子化合物的潜在药物靶标, 能够预测大量的药物-靶点相互作用, 从药物靶点作用网络的角度阐释中药的作用机制。中药种类繁多, 活性成分更是多种多样, 单纯的靠传统的植物化学分离纯化或是单纯的通过生物色谱等方法进行活性成分的分析都是不全面的, 整合细胞膜色谱和靶点鉴定技术可建立一种快速活性成分筛选和靶标鉴定的全新的策略, 这种全新的策略无疑是弥补了中药现代化研究中的缺陷问题, 将大大加快中药现代化的进程。
| [1] | Luo GA, Wang YM, Liang QL, et al. Systems Biology for Traditional Chinese Medicine (中医药系统生物学)[M]. Beijing: Science Press, 2011. |
| [2] | Luo GA, Wang YM, Liang QL, et al. Systems Biology for Traditional Chinese Medicine[M]. Hoboken, New Jersey: John Wiley & Sons, Inc., 2012. |
| [3] | Luo GA, Liang QL, Wang YM. Traditional Chinese Medicine Fingerprint-Quality Evaluation, Quality Control and New Drug R&D (中药指纹图谱——质量评价、质量控制与新药研发)[M]. Beijing: Chemical Industry Press, 2009. |
| [4] | Luo GA, Wang YM, Cao J, et al. Studies on establishment of modern quality standards system of traditional Chinese medicine in China[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中药现代化), 2002, 4: 5–11. |
| [5] | Liu CX, Chen SL, Xiao XH, et al. A new concept on quality marker of Chinese material medica:Quality control for Chinese medicinal products[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1443–1457. |
| [6] | Li SP, Zhao J, Qian ZM, et al. Advanced development of chromatography in screening and identification of effective compounds in Chinese material medica[J]. Sci Sin:Chem (中国科学:化学), 2010, 40: 651–667. |
| [7] | Qiu HX, Huang QD, Chen D, et al. Application progress on the biochromatography in traditional Chinese medicine research[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2010, 28: 144–147. |
| [8] | Wang N, Duan JA, Zhu Q, et al. Method and application of cyto-membrane biochromatography on studying Chinese medicine[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2008, 10: 82–85. |
| [9] | Luo GA, Wang YM, Cao J. The characteristic fingerprint of multi-dimensional and multi-data and its application[J]. Chin Tradit Pat Med (中成药), 2000, 22: 395–397. |
| [10] | He LC, Geng XD. Cell membrane receptor chromatography-A new approach to the study of drugs and receptors[J]. New Dev Biomed Chromatogr (生物医药色谱新进展), 1996, 3: 8. |
| [11] | He LC, Wang SC, Yang GD, et al. Progress in cell membrane chromatography[J]. Drug Discov Ther, 2007, 1: 104–107. |
| [12] | He LC, Yang GD, Geng XD. Enzyme activity and chromatographic properties of cell membrane immobilized on silica surface[J]. Chin Sci Bull (科学通报), 1999, 44: 632–637. DOI:10.1007/BF03182725 |
| [13] | Hou XF, Du H, He SX, et al. Advances in research on the application of cell Membrane chromatography in the study of drug-receptor interactions[J]. Prog Pharm Sci (药学进展), 2015, 39: 882–888. |
| [14] | Chen YY, Guo J. Advances in application of cell membrane chromatography in screening bioactive components of Chinese material medica[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 383–387. |
| [15] | Chen XF. Methodology Study of the Screening of Active Ingredients from Traditional Chinese Medicines by Cell Membrane Chromatography and Identification of Their Binding Targets (中药活性组分的细胞膜色谱筛选和靶标鉴定方法学研究)[D]. Shanghai: The Second Military Medical University, 2014. http://cdmd.cnki.com.cn/article/cdmd-90030-1015518687.htm |
| [16] | Yang GD, He LC, Bian XL, et al. Establishment of β -cell membrane chromatographic model and its biological affinity[J]. Chin Sci Bull (科学通报), 2005, 50: 35–39. |
| [17] | Zhang B, He LC. Analysis of the active components of Cladonia fallax Abbayes with cytotoxic activity by cell membrane chromatography[J]. J Mod Med Health (现代医药卫生), 2006, 22: 2303–2304. |
| [18] | Zhang YJ, He LC. Screening active component inhibiting Hela cell proliferation in Libanotis buethorimensis by using the model of cell membrane chromatography[J]. Chin Pharm J (中国药学杂志), 2005, 40: 463–464. |
| [19] | Li C, He L. Establishment of the model of white blood cell membrane chromatography and screening of antagonizing TLR 4 receptor component from Atractylodes macrocephala Koidz[J]. Sci China C Life Sci, 2006, 49: 182–189. |
| [20] | Liang MJ, He LC. Analysis of the effective part and effective component of Angelica sinensis in Siwutang[J]. Anal Chem (分析化学), 2004, 32: 83–86. |
| [21] | Wang YW, Chang RM, Wang X, et al. Screening effective components from Fructs Citri Sarodactylis by cell membrane chromatography and HPLC/MS[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2013, 20: 66–68. |
| [22] | Li MH. Study on Interaction between the Water-Soluble Components from Polygonum cillinerve (Nakai) Ohwi and Cardiac Cell Membrane by Cell Membrane Chromatography (心肌细胞膜与中药朱砂七水溶性成分作用的色谱法研究)[D]. Xi'an: Shanxi Normal University, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10718-2009045401.htm |
| [23] | He J, Han S, Yang F, et al. Prostate cell membrane chromatography-liquid chromatography-mass spectrometry for screening of active constituents from Uncaria rhynchophylla[J]. J Chromatogr Sci, 2013, 51: 905–909. DOI:10.1093/chromsci/bms188 |
| [24] | Zhang YN, Yue XF, Zhang ZQ. Study on the interactions between four components in Ligusticum chuanxiong rhizome and acceptors on cardiac muscle membrane[J]. China J Chin Mater Med (中国中药杂志), 2004, 29: 660–662. |
| [25] | Chen Y, Zhang N, Ma J, et al. A platelet/CMC coupled with offline UPLC-QTOF-MS/MS for screening antiplatelet activity components from aqueous extract of Danshen[J]. J Pharm Biomed Anal, 2016, 117: 178–183. DOI:10.1016/j.jpba.2015.06.009 |
| [26] | Fan HW, Yu L, Hong M, et al. Establishment of platelet membrane immobilized chromatography and application in the analysis of active components of Radix Salviae Miltiorrhizae[J]. Chin Pharm J (中国药学杂志), 2004, 39: 375–378. |
| [27] | Jia J. Study on Material Basis of Honghua Injection on Antithrombotic Effects (红花注射抗血栓药效物质基础初步研究)[D]. Taiyuan: Shanxi University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10108-2010191015.htm |
| [28] | Wang J, Huang ZG, Cao H, et al. Screening of anti-platelet aggregation agents from Panax notoginseng using human platelet extraction and HPLC-DAD-ESI-MS/MS[J]. J Sep Sci, 2008, 31: 1173–1180. DOI:10.1002/jssc.v31:6/7 |
| [29] | Yu L, Li Y, Fan H, et al. Analysis of marker compounds with anti-platelet aggregation effects in Mailuoning injection using platelet binding assay combined with HPLC-DAD-ESI-MS and solid-phase extraction technique[J]. Phytochem Anal, 2011, 22: 87–93. DOI:10.1002/pca.v22.1 |
| [30] | Zhang X, Qi LW, Yi L, et al. Screening and identification of potential bioactive components in a combined prescription of Danggui Buxue decoction using cell extraction coupled with high performance liquid chromatography[J]. Biomed Chromatogr, 2008, 22: 157–163. DOI:10.1002/(ISSN)1099-0801 |
| [31] | He CY. The Analysis of Active Chemicals in Yinchenhao Decoction with Hepatocyte Membrane Immobilized Chromatography (茵陈蒿汤人肝细胞膜固相色谱研究)[D]. Nanjing: Nanjing University of Chinese Medicine, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10315-2004113967.htm |
| [32] | Hong M, Ma HY, Zhu Q. Establishment of hepatocyte extraction combined with HPLC and application in analysis of active components in the fruits of Gardenis jasminoidex extract[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 450–453. |
| [33] | Yu L, Zhao J, Zhu Q, et al. Macrophage biospecific extraction and high performance liquid chromatography for hypothesis of immunological active components in Cordyceps sinensis[J]. J Pharm Biomed Anal, 2007, 44: 439–443. DOI:10.1016/j.jpba.2007.01.003 |
| [34] | Wang X, Xue H, Yue Y, et al. Targeted screening of active ingredients from Corydlis Decumbentis Rhizoma based on high expression β1 adrenergic receptor/cell membrane chromatography method[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2015, 21: 65–68. |
| [35] | Li Q, Wang J, Liu G, et al. Screening bioactive compounds from Ligusticum chuanxiong by high density immobilized human umbilical vein endothelial cells[J]. Anal Bioanal Chem, 2015, 407: 5783–5792. DOI:10.1007/s00216-015-8764-5 |
| [36] | Dong QQ, Li P, Song Y, et al. Analysis for predicting bioactive compounds of Rhizoma Salviae Miltiorrhizae by target cell extraction and high performance liquid chromatography-electrospray ionization/time of flight-mass spectrometry[J]. Chin J Anal Chem (分析化学), 2007, 35: 648–652. |
| [37] | Liu J, Feng L, Wang R, et al. Components screening from Curcuma longa Linn. and their bioaffinity property on human umbilical vein endothelial cells by cell membrane chromatography[J]. J Liq Chromatogr Relat Technol, 2013, 36: 2142–2155. |
| [38] | Liu J, Yang J, Wang S, et al. Combining human periodontal ligament cell membrane chromatography with online HPLC/MS for screening osteoplastic active compounds from Coptidis Rhizoma[J]. J Chromatogr B, 2012, 904: 115–120. DOI:10.1016/j.jchromb.2012.07.031 |
| [39] | Wang C, He L, Wang N, et al. Screening anti-inflammatory components from Chinese traditional medicines using a peritoneal macrophage/cell membrane chromatography-offline-GC/MS method[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2009, 877: 3019–3024. DOI:10.1016/j.jchromb.2009.07.022 |
| [40] | Li W, Niu X, Zhou P, et al. A Combined peritoneal macrophage/cell membrane chromatography and offline GC-MS method for screening anti-inflammatory components from Chinese traditional medicine Houttuynia cordata Thunb[J]. Chromatographia, 2011, 73: 673–680. DOI:10.1007/s10337-011-1926-5 |
| [41] | Qiu J, Chen X, Zheng X, et al. Target cell extraction coupled with LC-MS/MS analysis for screening potential bioactive components in Ginkgo biloba extract with preventive effect against diabetic nephropathy[J]. Biomed Chromatogr, 2015, 29: 226–232. DOI:10.1002/bmc.v29.2 |
| [42] | Jia D, Chen X, Cao Y, et al. On-line comprehensive two-dimensional HepG2 cell membrane chromatographic analysis system for charactering anti-hepatoma components from rat serum after oral administration of Radix Scutellariae:a strategy for rapid screening active compounds in vivo[J]. J Pharm Biomed Anal, 2016, 118: 27–33. DOI:10.1016/j.jpba.2015.10.013 |
| [43] | Zhang T, Ding Y, An H, et al. Screening anti-tumor compounds from Ligusticum wallichii using cell membrane chromatography combined with high-performance liquid chromatography and mass spectrometry[J]. J Sep Sci, 2015, 38: 3247–3253. DOI:10.1002/jssc.v38.18 |
| [44] | Wang JH, Wu XL, Wan QY, et al. Screening of active components of Cynanchum komarovi Al. Iljinski with analgesic effects using rat cerebral cortex cell membrane chromatography[J]. Nat Prod Res Dev (天然产物研究与开发), 2016, 28: 996–1000, 1028. |
| [45] | Zhu BQ. Some application advances of genetic engineering technology in pharm aceutical industry[J]. Chin J Pharm (中国医药工业杂志), 1997, 28: 56–58. |
| [46] | Wang Y, Deng XL, Yuan BX, et al. A method for improving the accuracy and sensitivity of cell membrane chromatography[J]. J Southern Med Univ (南方医科大学学报), 2009, 29: 2362–2366. |
| [47] | Yu W, Yuan B, Deng X, et al. The preparation of HEK293 α 1A or HEK293 α 1B cell membrane stationary phase and the chromatographic affinity study of ligands of α 1 adrenoceptor[J]. Anal Biochem, 2005, 339: 198–205. DOI:10.1016/j.ab.2005.01.004 |
| [48] | Wang L, Ren J, Sun M, et al. A combined cell membrane chromatography and online HPLC/MS method for screening compounds from Radix Caulophylli acting on the human α1A adrenoceptor[J]. J Pharm Biomed Anal, 2010, 51: 1032–1036. DOI:10.1016/j.jpba.2009.11.007 |
| [49] | Zeng A, Yuan B, Wang C, et al. Frontal analysis of cell-membrane chromatography for determination of drug-α1D adrenergic receptor affinity[J]. J Chromatogr B, 2009, 877: 1833–1837. DOI:10.1016/j.jchromb.2009.05.021 |
| [50] | Hou X, Zhou M, Jiang Q, et al. A vascular smooth muscle/cell membrane chromatography-offline-gas chromatography/mass spectrometry method for recognition, separation and identification of active components from traditional Chinese medicines[J]. J Chromatogr A, 2009, 1216: 7081–7087. DOI:10.1016/j.chroma.2009.08.062 |
| [51] | Yang XX, Chang RM, Yue Y, et al. Cardiac muscle/cell membrane chromatography-offline-liquid chromatography/mass spectrometry method to identify bioactive components from traditional Chinese medicines[J]. Anal Lett, 2013, 46: 1317–1330. DOI:10.1080/00032719.2012.762585 |
| [52] | Li M, Wang S, Zhang Y, et al. An online coupled cell membrane chromatography with LC/MS method for screening compounds from Aconitum carmichaeli Debx. acting on VEGFR-2[J]. J Pharm Biomed Anal, 2010, 53: 1063–1069. DOI:10.1016/j.jpba.2010.07.011 |
| [53] | Hou X, Wang S, Hou J, et al. Establishment of A431 cell membrane chromatography-RPLC method for screening target components from Radix Caulophylli[J]. J Sep Sci, 2011, 34: 508–513. DOI:10.1002/jssc.v34.5 |
| [54] | Sun M, Zhang YM, Zhang J, et al. A high expression EGFR/cell membrane chromatography and online high performance liquid chromatography/mass spectrometry method for screening EGFR antagonists from Rhizoma Polygoni Cuspidati[J]. Acta Pharm Sin B, 2011, 1: 115–120. DOI:10.1016/j.apsb.2011.06.008 |
| [55] | Sun M, Guo Y, Dai B, et al. High-expression EGFR/cell membrane chromatography-online-high-performance liquid chromatography/mass spectrometry:rapid screening of EGFR antagonists from Semen Strychni[J]. Rapid Commun Mass Spectrom, 2012, 26: 2027–2032. DOI:10.1002/rcm.6318 |
| [56] | Wang SC, Sun M, Zhang YM, et al. EGFR/cell membrane chromatography-online-high performance liquid chromatography/mass spectrometry method for screening EGFR antagonists from Radix Angelicae Pubescentis[J]. Sci China Chem, 2010, 53: 2357–2362. DOI:10.1007/s11426-010-4010-3 |
| [57] | He H, Han S, Zhang T, et al. Screening active compounds acting on the epidermal growth factor receptor from Radix Scutellariae via cell membrane chromatography online coupled with HPLC/MS[J]. J Pharm Biomed Anal, 2012, 62: 196–202. DOI:10.1016/j.jpba.2011.12.025 |
| [58] | Chen XF, Cao Y, Lü D, et al. Comprehensive two-dimensional HepG2/cell membrane chromatography/monolithic column/time-of-flight mass spectrometry system for screening anti-tumor components from herbal medicines[J]. J Chromatogr A, 2012, 1242: 67–74. DOI:10.1016/j.chroma.2012.04.034 |
| [59] | Guo Y, Han S, Cao J, et al. Screening of allergic components mediated by H1R in homoharringtonine injection through H1R/CMC-HPLC/MS[J]. Biomed Chromatogr, 2014, 28: 1607–1614. DOI:10.1002/bmc.v28.12 |
| [60] | Guo Y, Han SL, Cao JJ, et al. Histamine H1 receptor cell membrane chromatography online high-performance liquid chromatography with mass spectrometry method reveals houttuyfonate as an activator of the histamine H1 receptor[J]. J Sep Sci, 2014, 37: 3188–3194. DOI:10.1002/jssc.201400678 |
| [61] | Han SL, Zhang T, Huang J, et al. New method of screening allergenic components from Shuanghuanglian injection:withRBL-2H3/CMC model online HPLC/MS system[J]. J Pharm Biomed Anal, 2014, 88: 602–608. DOI:10.1016/j.jpba.2013.10.006 |
| [62] | Lin R, Yang GD, Wang WR, et al. Screening the active components of Salvia miltiorrhiza for atherosclerosis with chromatography of CD40 highly expressed cell membrane[J]. J Chin Med Mater (中药材), 2006, 29: 1315–1317. |
| [63] | Zhang T, Han S, Huang J, et al. Combined fibroblast growth factor receptor 4 cell membrane chromatography online with high performance liquid chromatography/mass spectrometry to screen active compounds in Brassica albla[J]. J Chromatogr B, 2013, 912: 85–92. DOI:10.1016/j.jchromb.2012.10.029 |
| [64] | Du H, Lü N, Huang J, et al. A cell membrane chromatography method for screening 5-HT receptor agonists from drug pair of Chuanxiong Rhizoma and Angelicae Dahuricae Radix[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 490–494. |
| [65] | Xue Y. Screening of Anti-Atherosclerosis Active Components of Polygonum cuspidatum (中药虎杖抗动脉粥样硬化活性成分的初步筛选)[D]. Shanghai: Fudan University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10246-1015416073.htm |
| [66] | Yuan B, Hou J, He L. Evaluation of drug-muscarinic receptor affinities using cell membrane chromatography and radioligand binding assay in guinea pig jejunum membrane[J]. Acta Pharmacol Sin, 2005, 26: 113–116. DOI:10.1111/aphs.2005.26.issue-1 |
| [67] | Hou XF, Yuan XL, Zhang B, et al. Screening active anti-breast cancer compounds from Cortex Magnolia officinalis by 2D LC-MS[J]. J Sep Sci, 2013, 36: 706–712. DOI:10.1002/jssc.v36.4 |
| [68] | Tang C, Liu Z S, Qin N, et al. Novel cell membrane capillary chromatography for screening active compounds from natural products[J]. Chromatographia, 2013, 76: 697–701. DOI:10.1007/s10337-013-2462-2 |
| [69] | Ji SG, Ding X, Cao Y, et al. Screening of potential active anti-cancer components of Brucea javanica by SMMC-7721 and Hep-G2 comprehensive two dimensional CMC-monolith chromatography[J]. J Pharm Pract (药学实践杂志), 2014, 32: 425–427. |
| [70] | Chen XF, Cao Y, Zhang H, et al. Comparative normal/failing rat myocardium cell membrane chromatographic analysis system for screening specific components that counteract doxorubicin-induced heart failure from Acontium carmichaeli[J]. Anal Chem, 2014, 86: 4748–4757. DOI:10.1021/ac500287e |
| [71] | Li Z, Chen K, Guo M, et al. Two-dimensional liquid chromatography and its application in traditional Chinese medicine analysis and metabonomic investigation[J]. J Sep Sci, 2016, 39: 21–37. DOI:10.1002/jssc.201500634 |
| [72] | He LC, Wang SC. The Application of CMC Hyphenated Technique on the Identification of Property Subjects and the Development of Two-Dimensional Chromatograph (CMC联用技术在目标物识别中的应用及二维色谱仪研制)[C]. Xi'an: Proceedings of the 20th National Symposium and Exhibition on Chromatography of China, 2015. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGHY201504003036.htm |
| [73] | Ding X, Cao Y, Yuan Y, et al. Development of APTES-decorated HepG2 cancer stem cell membrane chromatography for screening active components from Salvia miltiorrhiza[J]. Anal Chem, 2016, 88: 12081–12089. DOI:10.1021/acs.analchem.6b02709 |
| [74] | Cheng Z, Wu T. TLC bioautography:high throughput technique for screening of bioactive natural products[J]. Comb Chem High Throughput Screening, 2013, 16: 531–549. DOI:10.2174/1386207311316070004 |
| [75] | Shi SY, Zhang YP, Jiang XY, et al. Coupling HPLC to on-line, post-column (bio) chemical assays for high-resolution screening of bioactive compounds from complex mixtures[J]. TrAC Trends Anal Chem, 2009, 28: 865–877. DOI:10.1016/j.trac.2009.03.009 |
| [76] | Gu LH, Liao LP, Hu HJ, et al. A thin-layer chromatography-bioautographic method for detecting dipeptidyl peptidase Ⅳ inhibitors in plants[J]. J Chromatogr A, 2015, 1411: 116–122. DOI:10.1016/j.chroma.2015.07.123 |
| [77] | Tang J, Zhou J, Tang Q, et al. A new TLC bioautographic assay for qualitative and quantitative estimation of lipase inhibitors[J]. Phytochem Anal, 2016, 27: 5–12. DOI:10.1002/pca.2581 |
| [78] | Yang Y, Gu L, Xiao Y, et al. Rapid identification of α -glucosidase inhibitors from Phlomistuberosa by sepbox chromatography and thin-layer chromatography bioautography[J]. PLoS One, 2015, 10: e0116922. DOI:10.1371/journal.pone.0116922 |
| [79] | Chang YX, Ding XP, Qi J, et al. Determination of phenolic acids in danshen preparations by LC with chemiluminescence detection[J]. Chromatographia, 2009, 69: 319–323. DOI:10.1365/s10337-008-0876-z |
| [80] | Chang Y, Ding X, Qi J, et al. The antioxidant-activity-integrated fingerprint:an advantageous tool for the evaluation of quality of herbal medicines[J]. J Chromatogr A, 2008, 1208: 76–82. DOI:10.1016/j.chroma.2008.08.054 |
| [81] | Chang YX, Yan DM, Chen LL, et al. Potency fingerprint of herbal products Danshen injection for their quality evaluation[J]. Chem Pharm Bull, 2009, 57: 586–590. DOI:10.1248/cpb.57.586 |
| [82] | Li DQ, Zhao J, Xie J, et al. A novel sample preparation and on-line HPLC-DAD-MS/MS-BCD analysis for rapid screening and characterization of specific enzyme inhibitors in herbal extracts:case study of α -glucosidase[J]. J Pharm Biomed Anal, 2014, 88: 130–135. DOI:10.1016/j.jpba.2013.08.029 |
| [83] | Li D, Li S, Zhao J. Screening of xanthine oxidase inhibitors in complex mixtures using online HPLC coupled with postcolumn fluorescence-based biochemical detection[J]. J Sep Sci, 2014, 37: 338–344. DOI:10.1002/jssc.v37.4 |
| [84] | Hou XF, Wang SC, Zhang T, et al. Reflections on the cell membrane chromatography used in quality control of traditional Chinese medicine[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中药现代化), 2014, 16: 526–528. |
| [85] | Wang SC, Zhu LH, He LC. HPLC-fingerprint analysis of the active part of Radix Ligusticum chuanxiong Hort[J]. J Xi'an Jiaotong Univ Med Sci (西安交通大学学报·医学版), 2003, 24: 221–223. |
| [86] | Bian XL, Zhang J, Wang SC, He LC. HPCE-fingerprint analysis of the active part of Radix of Ligusticum chuanxiong Hort[J]. Chin J Pharm Anal (药物分析杂志), 2005, 25: 1520–1523. |
| [87] | Li HL, Yang GD, He LC. Identification and Determination of Xinkangping[J]. Chin J Pharm Anal (药物分析杂志), 2001, 21: 348–351. |
| [88] | Zhao HR, Yang GD, He LC, et al. Screening the effective component of Angelica sinensis by cell membrance chromatography[J]. Chin Pharm J (中国药学杂志), 2000, 35: 13–15. |
| [89] | Luo GA, Wang YM. Study on the total effective components of traditional Chinese medicine and its theory[J]. Chin Tradit Pat Med (中成药), 1997, 19: 43–44. |
| [90] | Luo GA, Wang YM. The chemical research system of traditional Chinese medicine[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中药现代化), 1999, 1: 16–19. |
| [91] | Luo GA, Wang YM. Study on the relationship between material basis and pharmacodynamics of traditional Chinese medicine[J]. World Sci Technol-Mod Tradit Chin Med Mater Med (世界科学技术-中药现代化), 1999, 1: 11–15. |
| [92] | Liu YS, Cao M, Wang YM, et al. Similarity system theory to evaluate the similarity of high performance liquid chromatography fingerprint of traditional Chinese medicine quantitatively[J]. Anal Chem (分析化学), 2006, 34: 333–337. |
| [93] | Wu XX. Characterization of Anti-Leukemia Components from Indigo naturalis Using Cell Membrane Chromatography and Target Identification (青黛抗白血病活性成分的细胞膜色谱筛选及靶标鉴定研究)[D]. Quanzhou: Huaqiao University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10385-1016918730.htm |
| [94] | Lomenick B, Olsen RW, Huang J. Identification of direct protein targets of small molecules[J]. ACS Chem Biol, 2010, 6: 34–46. |
| [95] | Lomenick B, Hao R, Jonai N, et al. Target identification using drug affinity responsive target stability (DARTS)[J]. Proc Natl Acad Sci U S A, 2009, 106: 21984–21989. DOI:10.1073/pnas.0910040106 |
 2017, Vol. 52
2017, Vol. 52


