2. 山西大学 化学化工学院, 山西 太原 030006;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
中药是中医药防病治病最重要的物质手段, 其本身的内在质量直接影响到中医临床疗效和安全用药。中药材中所含化学成分是其发挥药效作用的物质载体, 质量稳定、均一的中药材以及中成药是保证中医临床疗效发挥的基础。与化学合成药物不同, 中药材是由多种化学成分构成的复杂体系, 其特点是化学成分种类繁多、结构多样、含量差异大, 而且化学成分的种类及其组合比例容易受到种质资源、生长环境、栽培与加工方式等多种因素的影响而变化。因此, 与化学合成药物具有高度的稳定均一性不同, 不同来源、批次中药材之间的化学差异性是客观且必然存在的。临床广泛使用的中成药, 由于药材来源、生产工艺的不同, 不同厂家的产品在化学组成上也必然存在一定的差异性, 即使是独家产品, 由于不同批次原料药材之间本身存在差异, 不同批次产品之间也存在差异。而化学差异性的存在必然会导致药效的差异性, 对中医临床疗效产生一定的影响。
现行的中药质量控制模式主要依靠有效(指标)成分含量测定和指纹图谱技术, 有效成分的含量测定只能反映个别成分的含量差异, 不能从整体上反映药材之间的化学差异性。指纹图谱技术在提取共有峰后只能进行相似度评价, 关注的是样本之间的相似性, 而非共有峰恰恰反映的是不同样本之间的化学差异。因此, 现行的指纹图谱技术可以进行相似度评价, 但由于忽略了非共有峰存在所导致的化学差异而无法客观评价不同样本之间的差异性, 迫切需要采用新的方法来客观准确地评价中药的化学差异性。
1.2 化学差异性是否导致生物学差异及两者的相关性是中药差异性研究的关键中药材中广泛存在“一药多源”的现象, 如党参、麻黄、柴胡、黄芪等均有多个法定基源, 这些不同基源的植物虽然存在一定化学差异, 但却具有相同的功效, 几千年的中医药实践证明这些不同基源的药材虽然存在化学差异, 但入药后生物学效应差异不大, 可作为同种药材使用。这说明, 虽然多基源药材之间存在化学差异, 但其体内的生物学效应具有趋同性。在中药材中还存在“一物多药”现象, 如枳壳和枳实均来源于芸香科植物酸橙(Citrus aurantium L.)及其栽培变种, 枳壳为干燥未成熟果实, 而枳实则为干燥幼果, 两者的功效表述存在明显差异:枳实的功效为破气消积、化痰散痞, 用于积滞内停、痞满胀痛、泻痢后重等; 而枳壳的功效为理气宽中、行滞消胀, 用于胸胁气滞、胀满疼痛、食积不化等。现代研究表明枳壳和枳实两者存在显著化学差异[1], “一物多药”现象又说明某些特定化学成分的差异会导致生物效应的明显变化。
综上所述, 由于中药多来源于植物的特殊性以及化学组成的复杂性, 其化学差异是客观且必然存在的。中药差异性研究不仅需要表征化学差异, 更重要的是还需要阐明化学差异对生物学差异的影响规律, 即哪些化学成分的差异与生物学效应的相关性较大, 哪些化学差异与生物学效应的相关性较小。在中药质量标准研究中, 这些对生物学差异有显著影响的化学成分应作为质量控制的指标成分。
2 中药质量差异性评价的思路不同产地或栽培方式的中药材之间存在一定的化学差异, 且不同成分的波动范围不同。某些成分的波动范围可能较大, 而某些成分的波动范围相对较小。存在化学差异的中药对机体的作用上也存在一定差异, 说明中药的差异性研究不仅应包括化学(体外)差异性评价, 而且包括体内生物学效应的差异性评价。因此, 中药差异性研究应阐明: ①如何客观表征中药化学差异性和生物学差异性。②化学差异导致生物学差异性或趋同性的机制。③如何在质量标准中建立具体的指标来评价中药差异性。在课题组前期研究及借鉴中药谱效关系等思路的基础上, 初步提出了中药差异性的研究思路(图 1)。
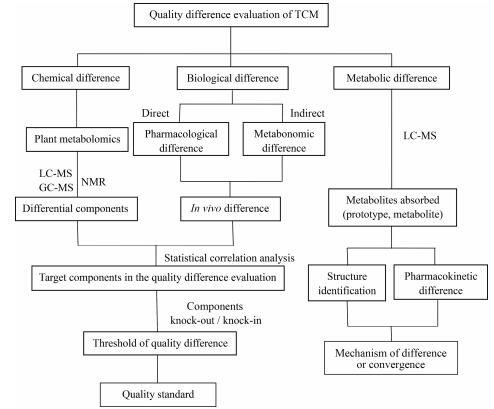
|
Figure 1 The approach of quality difference evaluation of traditional Chinese medicine (TCM) |
不同来源的同种中药(材)化学差异性研究包括以下3个层次: ①整体化学物质组成差异; ②化学差异成分; ③每个差异成分的差异性(波动范围)的客观表征评价。
由于中药具有多成分、多靶点、协同作用的特点, 所以应将中药所含的全部化学成分作为一个整体进行质量评价。中药材代谢产物在时间和空间上具有高度动态性, 种类繁多, 结构迥异, 传统的分析手段难以满足这种高通量分析要求。植物代谢组学技术是一种可对植物提取物中代谢组进行高通量、无偏差全面分析的技术。所以将植物代谢组学技术用于中药可获得其较为全面的化学组成信息, 为这一问题的解决提供了新的方法。植物代谢组学技术不仅可以反映样本的分组聚类信息(即整体差异性), 更重要的是通过统计学手段可以揭示不同组别样本之间的化学差异成分。近年来, 本课题组将植物代谢组学技术应用于多种药材的化学分析, 如黄芪、款冬花、远志、柴胡、当归、地黄、芍药等[2-8], 结果显示植物代谢组学技术在中药化学表征上具有独特的优势, 因此, 提出了基于植物代谢组学技术的中药化学差异性评价思路, 包括以下步骤: ①化学信息表征。对低极性成分可以采用气质联用技术, 对中高极性成分可以采用核磁共振结合液质联用分析, 其中核磁共振是非选择性检测技术, 适合分析在色谱柱上不保留的强极性成分, 可以与液质联用分析形成互补; 此外, 对于一维NMR中重叠严重的信号, 可以测定二维核磁共振指纹, 以使不同的信号有效区分; ②数据预处理。将上述化学信息数据经过预处理后导入多元统计分析软件进行主成分分析, 通过主成分分析(PCA)结合聚类分析判定不同来源药材的分类情况; 采用PLS-DA、OPLS-DA结合特征峰面积的ANOVA分析, 确定不同来源药材的差异性化学成分; ③差异度计算。差异度包括样本差异度和单一化学成分的差异度。根据上述样本在主成分分析和聚类分析结果, 将去除异常值的上述不同批次样本化学指纹数据生成对照指纹, 以对照指纹为参照, 根据每个样本在多维空间中的坐标值计算待测样本和对照样本之间的距离, 通过距离表征每个样本的差异度。化学成分的差异度计算通过HPLC或HPLC-MS含量测定方法对差异成分进行定量分析, 确定该差异成分的变化幅度范围, 对数据进行预处理并选择合适统计学方法, 如去掉10%的最小值和最大值后取平均值和中位数, 然后计算差异度。如何选择合适的统计学方法计算表征整体及具体成分的差异度是中药化学差异性研究的关键。
款冬花又称冬花, 为菊科款冬属植物款冬(Tussilago farfara L.)的干燥花蕾[9], 具有润肺下气、止咳化痰的功效, 中医临床上主要用于新久咳嗽、喘咳痰多、劳嗽咳血等症[10]。款冬花中含有三萜皂苷、倍半萜、黄酮、生物碱、色原酮、绿原酸、挥发油等化学成分[11]。我国款冬花药材资源主要分布于河北、山西、内蒙古、陕西等省, 商品款冬花药材来源有野生和栽培品2种。栽培款冬花目前主要产于甘肃的漳县、陇西、渭源, 河北蔚县, 内蒙古通辽等地; 而野生品主要分布于山西北部、甘肃等地。近年来款冬花药材价格上涨导致野生品被大面积采挖而资源枯竭, 因此, 目前商品款冬花药材主要来源于栽培品。款冬花化学成分复杂, 《中国药典》中规定的款冬酮单一成分无法全面评价款冬花的药材质量。有研究[11]采用NMR代谢组学技术, 对不同来源的21批款冬花药材进行了化学差异性比较。主成分分析显示栽培品与野生品款冬花可以明显区分, 说明两者在化学组成上存在明显差异。然后通过有监督的偏最小二乘法判别分析(PLS-DA)确定两者的成分差异体现在:野生品中咖啡酸、绿原酸、芦丁、款冬酮、甲基丁酸-3, 14-Z-去氢款冬素酯(EMDNT)、款冬巴耳二醇(bauer-7-ene-3β, 16α-diol)、谷甾酮等次级代谢产物含量高于栽培品, 这与传统经验认为的野生品质量较优一致。
此外, 罗尚华等[12]利用1H NMR代谢组学技术评价了4种不同产地泽泻整体代谢物的地缘差异。刘秀斌等[13]采用液质代谢组学分析显示不同采收季节的银杏叶组分差异明显, 并呈现规律性的变化。韩正洲等[14]采用液质代谢组学比较了野生型和栽培型野菊花的化学成分。
黄芪注射液是由黄芪药材经水提醇沉法制备而成, 具有益气养元、扶正祛邪、养心通脉、健脾利湿等功效, 可用于心气虚损、血脉瘀阻之病毒性心肌炎、心功能不全及脾虚湿困之肝炎等症[15]。黄芪注射液生产厂家众多, 由于原料来源、工艺的不同, 不同厂家黄芪注射液产品之间存在一定化学差异, 为用药的安全有效带来一定隐患。阐明不同厂家黄芪注射液产品之间的化学差异状况, 可为质量控制以及标准提高奠定基础, 从而保证临床用药的安全有效。现行黄芪注射液质量标准主要是测定黄芪甲苷的含量[16]。黄芪注射液中还含有黄酮类成分以及大量的初级代谢产物(氨基酸、有机酸、糖类等)。其中, 初级代谢物含量远高于次级代谢产物, 因此, 这些成分的波动也会影响黄芪注射液的质量均一性。本研究[17]采用1H NMR建立黄芪注射液的指纹图谱反映其整体质量特征, 鉴定包括有机酸类、氨基酸类、生物碱类、糖类、黄酮类以及皂苷类等初级和次级代谢物25个。对市售黄芪注射液产品的质量状况进行比较后显示, 所检测到的25种成分在不同厂家产品之间均有差异, 如苏氨酸其最大值与最小值相差40倍, 蔗糖的最大值与最小值相差80倍。次级代谢物的差异相对较小, 如黄芪甲苷最大值与最小值相差3倍。为此, 作者引入了变异系数来定量描述不同代谢物的含量波动范围。由于各成分的含量数据不属于正态分布, 所以采用四分位数间距(QR = P75 -P25)除以中位数(M)和极差(R极差 = Xmax -Xmin)除以M两种方法来计算变异系数(变异系数1 = QR/M, 变异系数2 = R极差/M), 其数值的大小可以反映某一代谢物在不同厂家的含量变化范围。变异系数1表示的是中间50%数据的变异程度, 变异系数2表示两端数据的变异程度, 两者相互补充, 可更加全面地反映整体数据的变异程度。不同代谢物的变异范围不同, 苏氨酸的变异系数1和2分别为6.775 5、29.795 6, 腺苷为4.840 0、7.136 6, 次级代谢物中除了黄芪碱F外, 变异系数相对均较小, 说明黄芪注射液中初级代谢物比次级代谢物整体变异范围大, 即初级代谢物对黄芪注射液的质量均一性影响较大。为了保证临床用药的安全, 应对这些初级代谢产物在黄芪注射液中的作用进行深入研究并在质量标准中规定其含量波动范围。
以上这些实例说明植物代谢组学技术不仅可用于中药材, 而且可用于中成药的化学差异比较, 且与现有技术相比具有一定优势。
2.2 生物效应差异性研究生物效应差异性表征需要阐明:中药作用于机体后, 化学差异是否会导致药效的差异; 以及如何灵敏表征药效学差异性。
2.2.1 药效学差异的直接比较药效学差异是生物学差异最直接的评价方式。如徐珊等[18]采用干酵母致大鼠发热动物模型比较了不同产地黄芩的解热药效差异, 发现河北黄芩较其他两个产地的黄芩解热作用更佳, 吴再旺等[19]也比较了道地与非道地黄芩的解热和抗炎作用差异, 结果显示道地黄芩对小鼠体温及耳肿胀的抑制率均优于非道地黄芩。高景莘等[20]对野生与栽培半夏的镇咳祛痰作用进行了对比, 结果发现野生新半夏的止咳作用优于野生陈半夏和栽培新半夏, 在祛痰作用方面, 野生半夏同样优于栽培半夏。
在对中药进行药效学差异比较时应该选择与中药功效相关的药理模型, 药效学指标可以选择酶、细胞因子、行为学指标等。然后根据数据特征, 选择合适的统计学方法将n个药效学指标的贡献进行加权处理计算综合药效差异度。如果传统的药理学指标敏感性较低时, 可进一步通过代谢组学技术的内源性代谢物(或标志物)辅助比较不同来源中药的药效学差异, 并从代谢角度反映药物对机体的作用差异。如李先恩课题组[21]比较了杭麦冬与川麦冬对健康大鼠生化指标的影响, 结果显示2种麦冬均可以干预心肺功能, 但川麦冬与杭麦冬表现出了一定的药效学差异。采用代谢组学技术进一步分析2种麦冬对正常大鼠血浆内源性代谢物干预作用, 结果显示杭麦冬对正常大鼠血浆溶血磷脂酰胆碱类物质等内源性代谢产物的干预作用更显著, 提示其可能对心血管系统具有更好的药效学作用[22]。李莹等[23]利用生化方法检测有无甘草的四逆汤对大鼠H9c2心肌细胞的存活率以及体内LDH和CK的活性。缺甘草四逆汤与四逆汤均可以提高H9c2心肌细胞存活率, 但四逆汤组作用效果更为明显(P < 0.01);缺甘草四逆汤组与四逆汤组的CK活性有明显差异(P < 0.05), 但LDH活性接近。采用代谢组学技术进一步研究显示四逆汤组与缺甘草四逆汤组在17个生物标志物上具有明显区别, 说明代谢组学技术有助于灵敏反映不同药物作用机体后的药效差异。
2.2.2 基于代谢组学生物学效应的间接比较中药含有多种成分, 对机体的作用也有多个靶点, 药物作用于机体后体现出的是多种成分作用于多个靶点的整合效应。药物作用于机体后对机体代谢通路将产生影响, 药物的药效发挥往往也与代谢通路的调节密切相关。代谢组学分析可通过内源性代谢物及其代谢通路的变化对药物作用后机体的整体代谢状态做出评价, 即代谢组学的整体观可以客观反映药物对机体作用的整体性。
中药往往具有多种功效, 每一种功效的评价又需要采用多种药理模型, 而且有的功效目前还没有建立客观、公认的药理模型。因此, 对难以通过药理模型比较的中药, 可通过内源性标志物的变化间接反映药物的生物效应差异性。作者提出了基于代谢组学的体内差异性评价思路, 作为一种体内差异性评价的间接手段。包括如下步骤:将存在化学差异的药物给予健康动物, 对给药后健康动物的血液及肝、肾、心、脾、肺等脏器进行代谢组学分析, 采用多元统计分析方法确定中药对机体作用后的生物标志物, 以生物标志物代替传统的药理学指标, 分别计算n个生物标志物的差异度, 比较存在化学差异的同种药物对机体作用的差异, 并可根据药物归经的不同选择性分析相关的脏器。
黄芪来源于豆科黄芪属植物膜荚黄芪[Astragalus membranaceus (Fisch.) Bge.]或蒙古黄芪[A. membra-naceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao]的干燥根[9]。现代临床常用于治疗心气虚损、血脉淤阻之病毒性心肌炎、心功能不全及脾虚湿困之肝炎等疾病[24]。产于山西北部恒山山脉及其周边地区(主要是山西大同和忻州等地区)的野生或半野生蒙古黄芪俗称“恒山黄芪”或“正北芪”, 市场采用的恒山黄芪生长年限最少在4年以上, 多远销海内外。随着黄芪需求量的急剧增加, 2年生的育苗移栽黄芪开始成为市场主流品种, 目前主要分布甘肃、内蒙。由于传统和移栽芪生长年限以及种植模式的差异, 两者外观性状也表现出明显差异性。传统蒙古黄芪主根粗直, 末端较细, 俗称“鞭杆芪”; 移栽黄芪主要为平地横栽, 因此主根长度较一致, 上下端生长发育比较均匀但须根较多。本课题组[25]采用基于1H NMR代谢组学技术对两种生长模式的黄芪进行了化学比较, 结果显示山西野生黄芪和甘肃的移栽黄芪存在显著的化学差异, 其中山西黄芪中蔗糖、苏氨酸、醋酸初级代谢产物以及黄芪皂苷Ⅰ、1, 2-二羟基-3, 4-二甲氧基-异黄烷葡萄糖苷、毛蕊异黄酮、芒柄花素、9, 10-二甲氧基-紫檀烷葡萄糖苷等次级代谢产物含量较高, 而甘肃黄芪中α-葡萄糖、天冬氨酸、γ-氨基丁酸、亮氨酸、胆碱、丙氨酸和脯氨酸含量较高。为了进一步确定两种栽培模式的黄芪的生物学效应是否存在差异, 将两种黄芪分别灌胃给予小鼠, 并采用代谢组学技术对给药后小鼠的血液、肺、肝、脾进行比较, 结果发现, 给予黄芪后小鼠的内源性代谢物会发生明显改变, 如血液中氧化三甲胺、乳酸、酮戊二酸、胆碱等, 肝脏中氨基酸(亮氨酸、异亮氨酸、缬氨酸、甘氨酸)和葡萄糖、黄嘌呤等, 肺脏中醋酸、谷氨酸、丙酮酸牛磺酸等。与两者的化学差异相比, 两种生长模式黄芪分别给药导致的体内差异并不大, 差异主要体现在血清中的3-羟基丁酸、N-乙酰化-糖蛋白、丙酮酸、氧化三甲胺, 肝脏中的尿苷、乳酸和肌酐, 肺组织中谷氨酰胺、蛋氨酸、黄嘌呤和甜菜碱, 脾脏中的胆碱、亮氨酸、酪氨酸和烟酰胺。给予黄芪后对小鼠能量代谢、脂质代谢和胆碱代谢等代谢途径产生影响。甘肃的移栽黄芪和山西的野生黄芪对机体代谢影响的差异主要体现在能量代谢, 其中山西黄芪对能量代谢的促进作用略强于甘肃黄芪。
此外, 本课题组采用类似的思路研究了3批不同产地款冬花药材的化学和体内效应差异[26]。
2.3 体内外差异性的相关性分析及差异度阈值确定阐明化学差异和体内差异后需要进一步对两者进行相关性分析, 进而阐明:化学成分的差异与生物学效应的相关性; 以及差异成分的差异度阈值确定, 进而判断中药的合格或优劣。
由于中药化学组成的复杂性, 其化学差异、生物学差异均涉及多个变量, 因此其数据具有多变量高维数据的特征, 所以应采用多种统计学方法对体外化学差异、体内生物学差异进行系统的综合分析, 揭示体外化学差异对体内作用差异的影响规律。统计学方法可选择偏最小二乘法、支持向量机、基于熵的神经网络多目标优化技术、基于模型选择的LARS回归多目标优化技术、基于改进蚁群算法的进化计算多目标优化技术等系统建模方法, 建立体外化学差异对体内差异的相关性模型, 对模型进行有效性验证筛选最适建模方法, 并基于有效数学模型分析对药效具有显著影响的药材化学成分, 并将其作为质量差异性控制成分。
近年来大量的中药谱效关系研究方法为体内外差异性的相关性分析奠定了基础。Wang等[27]建立了一种化学与活性相关联的方法, 并用于槐花与槐米的化学差异、药效差异及其相关性研究。首先采用液质测定了57批样品的化学指纹图谱, 并测定了其抗氧化活性和透明质酸酶抑制活性。然后采用偏最小二成回归(PLSR)和反向传播人工神经网络模型(BP-ANN)进行相关性分析得到3个与生物活性显著相关的成分。进一步的定量检测证实这3个成分含量与抗氧化活性和透明质酸酶抑制活性显著相关。肖云芝等[28]研究了12批鳖甲药材HPLC指纹图谱及其对LX-2肝星状细胞增殖的抑制作用, 采用相关系数法分析显示4号峰与LX-2肝星状细胞增殖的抑制作用相关性最强, 2号和5号峰与抑制作用也具有中等相关性。
采用上述统计学方法确定对药效差异有显著影响的成分后, 其差异度阈值的确定还需要采用成分的敲入和敲出进行验证。通过敲入实验可以定量增加目标成分的含量, 通过敲出实验可以定量降低目标成分的含量[29]。采用敲入或敲出技术构建一组目标成分(群)含量不同的受试药物后, 分析目标成分(群)含量改变对药效学变化的影响, 根据药效学指标的阈值进而确定与中药合格或优劣相关的差异度阈值。其中, 灵敏的药效学指标是差异度阈值确定的关键。
2.4 化学差异导致生物学差异性或趋同性的机制研究化学药物的辅料对其主药的吸收代谢过程存在较大影响。因此, 存在化学差异的中药在被机体吸收或代谢时可能也存在一定差异, 而吸收或代谢上的差异会将中药的化学差异性放大或缩小, 这可能是导致存在化学差异的中药进入体内生物学效应发生趋同(即差异缩小)或差异(差异增加)的重要原因。因此, 吸收代谢差异研究需要阐明存在化学差异的中药进入体内的药物原形及代谢物, 并分析主要成分药代动力学特征。包括如下步骤:采用基于NMR和UPLC-QTOF-MS的代谢组学方法, 对进入体内的药物成分(包括原形物和代谢物)进行分析, 得到药物成分组在体内的代谢轮廓图谱; 对比空白、含药生物样本以及药材图谱, 确定吸收的原形和代谢物成分; 其中原形成分的结构通过与药材中已指认的化学成分对照确定; 代谢物的结构鉴定通过质谱碎片分析确定, 对难以鉴定的代谢物可进行必要的化学分离富集, 得到组成相对简单的组分后进行1D和2D NMR分析。对各组药物在体内的代谢轮廓图谱通过聚类分析和主成分分析等多元统计分析技术确定这些成分在血液及主要脏器(心、肝、脾、肺、肾)中的分布差异。对进入血液和组织中的药物重要成分分别建立相应的含量测定方法, 确定其在体内的含量差异及药代动力学参数差异。
3 展望中药由于其多成分多靶点的作用特点, 其质量控制和评价一直是中药研究的难点问题。由于中药的化学差异性客观存在, 必然对中药药效的发挥存在一定影响, 如何阐明化学差异对生物学差异的影响规律并客观评价这种差异和建立质量标准是中药差异性评价的难点所在。
中药的差异性分析应阐明哪些成分的量变对于药材的药效以及临床应用疗效影响较大, 这类成分在建立药材质量标准时要重点考虑。此外, 如何采用合适的统计学方法通过相关性分析确定与合格或优劣相关的差异度阈值也是难点所在。在体内生物学效应差异性研究中, 能否建立直接反映药效差异的高灵敏体外或体内药理模型也是制约体内差异性评价的关键因素。因此, 中药差异性评价体系的建立还需进行大量系统的方法学研究。
| [1] | Jia Q, Bai Y, Ma Y, et al. Chemical constituents of Fructus Aurantii and Fructus Aurantii Immaturus by HPLC-ESI-MS[J]. Chin Tradit Herb Drugs (中草药), 2005, 36: 169–172. |
| [2] | He P, Li ZY, Fan SC, et al. Differences between Hengshanhuangqi and Chuanghuangqi based on metabolomics and ITS2 sequences[J]. Acta Pharm Sin (药学学报), 2013, 48: 1595–1601. |
| [3] | Mi X, Li ZY, Qin XM, et al. Monitoring of chemical components with different color traits of Tussilago farfara L. using NMR-based metabolomics[J]. Acta Pharm Sin (药学学报), 2013, 48: 1692–1697. |
| [4] | Wang XJ, Li ZY, Xue SY, et al. Quality control over different processed products of Polygalae Radix based on metabolomics[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 1727–1737. |
| [5] | Zhang SS, Xing J, Li ZY, et al. Metabolic essential oil of different Radix Bupleuri by GC-MS[J]. Chin Exp Tradit Med Form (中国实验方剂学杂志), 2014, 20: 84–87. |
| [6] | Li J, Wei YH, Qin XM, et al. Chemical comparison on different parts of Angelica sinensis Radix based on NMR metabolomics[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1409–1415. |
| [7] | He P, Li ZY, Xing J, et al. 1H NMR based metabolic profiling of the processing effect on Rehmanniae Radix[J]. Anal Methods, 2014, 6: 2736–2744. DOI:10.1039/c3ay42119h |
| [8] | Li ZY, Fan ML, Qin XM. Comparison of chemical composition between raw and vinegar-backed Paeoniae Radix Alba using NMR based metabolomic approach[J]. Acta Pharm Sin (药学学报), 2015, 50: 211–217. |
| [9] | Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China (中华人民共和国药典)[S]. 2015ed. Beijing: China Medical Science Press, 2015. |
| [10] | Cao K, Xu Y, Wang RC, et al. Developments of separation, purification and quality control for the chemical constitutions of Tussilago farfara[J]. Nat Prod Res Dev (天然产物研究与开发), 2014, 26: 619–625. |
| [11] | Zhang ZZ, Zhi HJ, Qin XM, et al. Chemical comparison of different Farfarae Flos by NMR based metabolomic approaches[J]. Acta Pharm Sin (药学学报), 2015, 50: 599–604. |
| [12] | Luo SH, Wu SW, Fan G, et al. 1H NMR-based metabonomics for quality evaluation and geographical origin discrimination of Rhizoma Alismatis[J]. J Third Mil Med Univ (第三军医大学学报), 2013, 35: 996–1000. |
| [13] | Liu XB, Zhang Y, Zeng JG, et al. Ingredient profiling of fresh leaves of Ginkgo biloba over different harvest seasons using UPLC-QTOF MSE/metabonomics[J]. J Hunan Agric Univ (湖南农业大学学报), 2014, 40: 650–654. |
| [14] | Han ZZ, Yang Y, Jia HM, et al. Chemical comparison of cultivated and wild type Flos Chrysanthemi Indici base on plant metabolomics and determination of the chemical constituents by UPLC[J]. Chin J Pharm Anal (药物分析杂志), 2017, 37: 1196–1206. |
| [15] | Guo XH. Research progress of pharmacological action and clinical application of Astragalus injection[J]. J Chin Pharm (中国药房), 2015, 26: 3018–3021. |
| [16] | Bai XT, Huo BJ, Zhang B, et al. Rapid detection of astragalloside Ⅳ and total solids in Astragali Injection by NIRS[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 2189–2193. |
| [17] | Qu TL, Wei YH, Li AP, et al. 1H NMR fingerprints of Huangqi injection solution[J]. Acta Pharm Sin (药学学报), 2016, 51: 780–785. |
| [18] | Xu S, Meng QG, Song LL, et al. Comparison of relieving fever function about withdraws of Radix Scutellariae from different originates[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2009, 27: 1176–1180. |
| [19] | Wu ZW, Wang ZM, Lu Y, et al. Comparative study on anti-inflammatory and antipyretic effects between Dao-di herb and non Dao-di herb of Huangqin[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 3628–2632. |
| [20] | Gao JS, Zhang LM, Lu XM, et al. Comparative study of wild Pinelliae rhizome and cultivated Pinelliae rhizome on cough expectorant[J]. J Hunan Univ Tradit Chin Med (湖南中医药大学学报), 2010, 30: 25–27. DOI:10.1016/S0254-6272(10)60008-8 |
| [21] | Wang YX, Sun H, Wang W, et al. Investigate the influences of Ophiopogon japonicas from Sichuan and Hangzhou on biochemical indicators and genuineness[J]. Chin Med J Res Pract (现代中药研究与实践), 2014, 28: 33–36. |
| [22] | Tong JH, Wang YX, Sun H, et al. Pharmacodynamic differences between Hangmaidong and Chuanmaidong based on metabonomics[J]. Acta Pharm Sin (药学学报), 2014, 49: 1451–1456. |
| [23] | Li Y, Fu CM, Ren B, et al. Study on attenuate and synergistic mechanism between Aconiti Lateralis Praeparata Radix and Glycyrrhizae Radix for toxicity reduction based on metabonomic of MI-RI mouse cardiomyocytes[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 3166–3171. |
| [24] | Zhang Q, Gao WY, Man SL. Advances in pharmacological activities of active constituents in Astragalus membranaceus[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 3203–3207. |
| [25] | Li AP, Li ZY, Sun HF, et al. Comparison of two different Astragali Radix by a 1H NMR-based metabolomic approach[J]. J Proteome Res, 2015, 14: 2005–2016. DOI:10.1021/pr501167u |
| [26] | Li ZY, Li J, Zhang ZZ, et al. NMR-based metabolomic analyses for the componential differences and the corresponding metabolic responses of three batches of Farfarae Flos[J]. Chemom Intell Lab Syst, 2017, 165: 1–10. DOI:10.1016/j.chemolab.2017.03.010 |
| [27] | Wang F, Xiong ZY, Li P, et al. From chemical consistency to effective consistency in precise quality discrimination of Sophora flower-bud and Sophora flower:discovering efficacy-associated markers by fingerprint-activity relationship modeling[J]. J Pharm Biomed Anal, 2017, 132: 7–16. DOI:10.1016/j.jpba.2016.09.042 |
| [28] | Xiao YZ, Yu C, Liu CY, et al. Spectrum-activity relationship on anti-hepatic fibrosis efficacy of Trionycis Carapax[J]. Chin Tradit Herbal Drugs (中草药), 2014, 45: 2506–2510. |
| [29] | Xiao XH, Yan D, Yuan HL, et al. Consistency of efficacy-equivalent:key essential point of quality control for Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2009, 40: 1345–1488. |
 2017, Vol. 52
2017, Vol. 52


