2. 海南省人民医院药学部, 海南 海口 570311
2. Department of Pharmacy, Hainan General Hospital, Haikou 570311, China
过去认为, 细胞死亡方式有坏死、凋亡和自噬等。随着科学的进步, 研究者们还发现了其他非凋亡的死亡方式, 如半胱氨酸蛋白酶家族1依赖的焦亡[1]、受体相互作用蛋白激酶1依赖的程序性坏死[2], 多聚二磷酸腺苷核糖聚合酶-1依赖的细胞死亡[3]。2012年Stockwell课题组[4]首次发现小分子erastin能诱导癌基因Ras突变的肿瘤细胞发生一种明显不同于凋亡、坏死和自噬的铁依赖性的细胞死亡方式, 这种死亡的细胞在形态学、基因学、生物化学特征上与传统的死亡方式均有明显的不同, 因其依赖细胞内的铁, 而不是其他金属, 所以命名为ferroptosis, 中文翻译也叫“铁凋亡”。这种死亡方式能被铁螯合剂抑制, 同时也能被一些小分子物质(如ferrostatin-1[4]和liproxstatin-1[5])拮抗, 而凋亡抑制剂(Z-VAD-FMK[4])和坏死性凋亡抑制剂(necrostatin-1[4])对这种死亡无效。现在已发现很多疾病(如帕金森病)的发病机制与ferroptosis的分子机制相似, 而ferroptosis在肝脏中的作用也不容小觑。理解ferroptosis的分子机制和信号通路可以为疾病提供新的诊断和治疗方法。
1 Ferroptosis的生物学特征Ferroptosis诱导剂的发现早于其概念的提出。2003年, erastin首次被发现对Ras癌基因突变的人包皮纤维母瘤细胞(human foreskin fibroblasts expressing oncogenic HRasV12, BJeLR)的致死性作用[6]。随后在2008年, 通过高通量小分子筛选技术发现Ras选择性致死小分子(ras-selective lethal small molecules, RSLs)能以非凋亡的方式杀死BJeLR细胞[7], 凋亡、坏死、程序性坏死和自噬等抑制剂均不能逆转erastin和RSLs诱导的细胞死亡, 而抗氧化剂维生素E (vitamin E, VitE)和铁螯合剂去铁胺(deferoxamine, DFO)却能抑制这种细胞死亡。2012年, Stockwell团队[4]把这种erastin诱导的具有独特形态学、基因学、生物化学特征的细胞死亡命名为ferroptosis。Erastin处理BJeLR细胞后, 其形态学特征表现为线粒体嵴消失, 线粒体变小, 膜密度增加, 细胞变小变圆且相互之间分离。在永生化的纤维母瘤细胞和肾组织中诱导谷胱甘肽过氧化物酶4 (glutathione peroxidase 4, GPX4)遗传失活后发现线粒体外膜破裂, 细胞核仍然保持结构完整性[5]。Ferroptosis的生物化学特征表现为脂质活性氧(reactive oxygen species, ROS)累积, 谷胱甘肽(glutathione, GSH)耗竭, GPX4抑制, 多不饱和脂肪酸释放增加等。Ferroptosis的这些特征有别于其他细胞死亡方式, 具体如表 1所示[8]。
| Table 1 Characteristics of different cell death. LC3: Microtubule-associated proteins light chain 3; MLKL: Human mixed lineage kinase domain-like; RIP 1/3: Receptor interacting protein 1/3; PI3K: Phosphatidylinositol 3-kinase; P62: Nucleoporin 62; PUFA: Polyunsaturated fatty acids; PS: Phosphatidylserine |
Ferroptosis的发生不仅会引起铁代谢紊乱, 同时还会导致大量细胞膜脂质过氧化产物的堆积。细胞膜脂质过氧化的ROS来源, 除了铁介导芬顿反应外, 还包括烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶、过氧化酶体和线粒体等产生的过量ROS。ROS能与脂膜上的多不饱和脂肪酸反应诱导脂质过氧化。细胞内大量脂质过氧化是导致细胞死亡的直接原因, 而GPX4/GSH体系在抑制这种脂质过氧化反应中发挥重要作用[9]。除了铁代谢和GPX4/GSH体系在ferroptosis的调控上发挥主要作用, 其他的如转硫(transsulfuration pathway, TS)途径、甲羟戊酸(me-valonic acid, MVA)途径等也间接参与到ferroptosis的调控中, 如图 1所示。
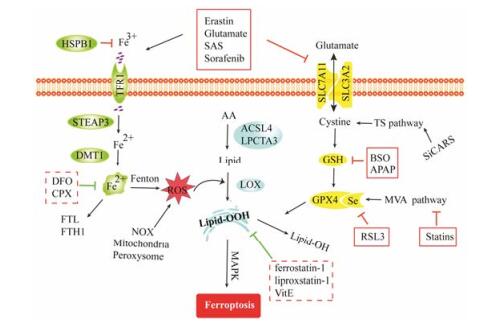
|
Figure 1 The signaling pathway of ferroptosis. HSPB1: Heat shock protein beta 1; CPX: Ciclopirox olamine; MAPK: Mitogen-activated protein kinase; NOX: NADPH oxidase |
Xc−系统是谷氨酸/胱氨酸转运体系统, 由溶质载体家族的一个重亚基3A2和一个特异转运胱氨酸的轻亚基7A11 (specific light-chain subunit of cystine/glutamate antiporter, SLC7A11)通过二硫键共价结合[10]。它介导胞外的L-胱氨酸和胞内的L-谷氨酸进行透膜交换, 摄入的L-胱氨酸合成GSH并作为配体与GPX4结合, 发挥清除脂质过氧化产物的作用。Xc−系统的功能与ferroptosis的发生密切相关。抑制Xc−系统导致合成GSH的前体半胱氨酸严重耗竭并伴随细胞内抗氧化能力不足, 同时GSH依赖的酶如GPX4[11]活性也下降。Xc−系统功能障碍时, 半胱氨酸能将甲硫氨酸作为硫载体通过TS途径生物合成半胱氨酸[12], 发挥着一定的抗氧化作用。TS途径中的基因和代谢物都能调节erastin诱导的ferroptosis。Hayano等[13]使用全基因组RNAi技术发现, siRNA靶向半胱氨酰-tRNA合成酶(cysteinyl-tRNA synthetase, CARS)能够有效抑制erastin诱导的ferroptosis。研究表明, erastin能抑制放射性标记的胱氨酸的摄入[4], 柳氮磺胺吡啶(sulfasalazine, SAS)、谷氨酸盐和索拉菲尼也有类似的作用, 这些Xc−系统转运体抑制剂能诱导不同的细胞如BJeLR细胞、人成纤维肉瘤细胞和人肺癌细胞等发生ferroptosis[8]。丁硫氨酸亚砜胺(buthionine sulfoximine, BSO)不是Xc−系统转运体抑制剂, 但是它可以直接抑制谷氨酸-半胱氨酸连接酶, 减少GSH的合成从而触发ferroptosis[12]。
RSL3和ferroptosis诱导剂(ferroptosis inducing agent, FINs)与erastin等诱导的ferroptosis有着共同的生物学特征, 然而他们并不抑制放射性标记的胱氨酸, 也不耗竭GSH, 而是直接抑制GPX4酶活性进而导致ROS累积。GPX4是唯一能清除生物膜上脂质氢过氧化物的酶, 它的活性中心含有硒代半胱氨酸, 该酶存在于线粒体和细胞质中, 保护细胞免受脂质过氧化作用[14]。因此, GPX4的基因和蛋白表达对细胞存亡至关重要。小鼠敲除Gpx4基因引起胚胎在7.5~8.5天死亡[15]。在可诱导的小鼠神经元Gpx4敲除模型中, 小鼠脊髓发生ferroptosis使其支配的运动神经元消失甚至麻痹[16], 肾小管细胞也对Gpx4敲除引起的ferroptosis敏感。此外, GPX4缺失会诱导T细胞发生ferroptosis, 降低感染的免疫反应[17]。GPX4的生物合成受到MVA途径调节。MVA途径以乙酰辅酶A为原料合成异戊二烯焦磷酸和二甲基烯丙基焦磷酸, 在此途径中产生的代谢物与ferroptosis敏感性的调节有关[18]。化学蛋白组学发现FIN56结合并活化MVA途径的鲨烯合成酶, 抑制MVA途径中非类固醇代谢物, 都将增强FIN56对GPX4的降解。MVA途径抑制剂如他汀类药物, 通过干扰硒代半胱氨酸tRNA的成熟和细胞内GPX4的生物合成而发挥作用, 且这种作用能增强FIN56的杀伤力[12]。
2.2 铁代谢调控途径铁几乎是所有生物不可或缺的微量元素, 它是各种重要酶的活性中心, 包括核糖核苷酸还原酶、线粒体复合酶和富含血红素的酶如细胞色素与铁−硫蛋白等[19]。在正常生理条件下, 只有微量的催化铁存在, 铁以三价铁(ferric iron, Fe3+)的形式与转铁蛋白结合, 然后在铁转运蛋白受体1 (transferrin receptor 1, TFR1)的作用下将Fe3+转入细胞内并定位到核内体上, 再利用前列腺6次跨膜上皮抗原3 (six-transmembrane epithelial antigen of prostate 3, STEAP3)的铁氧还原酶活性还原成二价铁(ferrous iron, Fe2+), 最后, 二价金属转运体1 (divalent metal transporter 1, DMT1)调节Fe2+从核内体释放到胞质的不稳定铁池中, 它的输出由膜上的铁转运蛋白介导[8]。在铁调节机制障碍、反复出血和慢性炎症伴持续实质细胞死亡的病理情况下, 铁会在相应位置超载, 过量的铁除了储存在铁蛋白(ferritin heavy chain 1, FTH1和ferritin light chain, FTL)中, 还通过芬顿反应氧化脂质导致氧化应激[20]。增加铁的摄入或减少铁储存可能导致胞质中铁过载。与ferroptosis耐药细胞株相比, 敏感的Ras突变细胞株会增加TFR1和减少铁蛋白的表达。使用铁螯合剂(如DFO、甲磺酸去铁胺和环吡司乙醇胺)来减轻铁过载能抑制erastin诱导的ferroptosis。增加外源性铁(如柠檬酸铁铵、柠檬酸铁和氯化铁)能增强erastin诱导的细胞死亡。此外, 用RNAi技术抑制铁代谢转录因子能显著增加铁代谢相关蛋白(FTL、FTH1、铁硫簇合酶和富含亮氨酸重复蛋白5)的表达并抑制erastin诱导的ferroptosis[4]。因此, 细胞内铁代谢稳态对ferroptosis的调控有着重要作用。
2.3 脂质和脂氧合酶在ferroptosis中的作用脂质代谢对细胞存亡发挥重要作用。在ferroptosis进程中, 脂质代谢紊乱是细胞的死亡信号。哺乳动物中有6类不同结构的脂质, 包含脂肪酸、鞘磷脂、甘油糖脂、甘油磷脂、异戊烯醇类和甾醇类[21]。其中, 甘油磷脂是生物膜双分子层结构中最主要的成分, 也是ferroptosis发生的关键磷脂, 它包含了不同链长度和不饱和度的酯化脂肪酸, 如花生四烯酸(arachidonic acid, AA)。AA被乙酰辅酶A合成酶长链家族成员4 (acyl-CoA synthetase long-chain family member 4, ACSL4)乙酰化, 然后在溶血卵磷脂酰基转移酶3 (lysophosphatidylcholine acyltransferase 3, LPCAT3)的作用下插入溶血磷脂中, 最后形成含不饱和脂肪酸的磷脂[21]。因此, 不饱和磷脂合成过程中的关键酶ACSL4和LPCAT3被发现与RSL3诱导的ferroptosis直接相关[22]。也有研究发现, 磷脂被脂氧合酶(lipoxygenase, LOX)介导的脂质过氧化在ferroptosis过程中发挥更重要的作用。人体内包含6种LOX, 分别为LOX5、LOX12、LOX12B、LOX15、LOX15B和LOXE3[23]。在诱导ferroptosis时, 主要是12/15-LOX和5-LOX发挥作用。研究表明, 谷氨酸盐诱导的小鼠海马神经元HT-22细胞中12/15-LOX和5-LOX表达都显著上调[24]。Erastin处理的BJeLR细胞, 5-LOX能够被激活并向核膜聚集, 导致脂质过氧化[25]。
3 Ferroptosis在肝脏疾病发生机制中的研究进展铁累积和脂质过氧化是ferroptosis发生的重要机制, 同时也是肝脏疾病发生的关键因素。肝脏的一个重要功能是调节铁稳态, 它通过基因调控铁的转运和储存并以铁动员的机制快速有效地调节肝脏内铁浓度。肝功能的紊乱会导致铁稳态失衡, 进而引发一系列铁相关疾病, 如贫血和铁超载[26]。长期以来, 肝脏的铁积累程度在慢性肝病中已被研究者所认识。无论是酒精性还是非酒精性肝炎都显示, 铁沉积和超载是导致ROS产生和肝脏损伤的主要原因。同时也有研究表明, 铁过载和ROS累积是导致纤维化、肝硬化和肝癌的主要因素[27]。
3.1 Ferroptosis在肝癌中的作用肝细胞癌(hepa-tocellular carcinoma, HCC)是最常见的肝脏原发性肿瘤, 也是全球第五大恶性肿瘤[28]。HCC患者往往铁过量并且在晚期被诊断, 而索拉菲尼是目前唯一能提高晚期HCC患者生存率的口服药物[29]。索拉菲尼是多重激酶抑制剂, 最初发现它能诱导HCC细胞发生凋亡, 促进B细胞淋巴瘤-2蛋白的表达[30], 随后发现它能通过自噬损伤细胞膜和改变蛋白内稳态而发挥一定的抗癌作用[31]。近年的研究表明, 索拉菲尼能诱导HCC细胞产生氧化应激[32], 增加金属硫蛋白1 (metallothionein, MT-1)的表达。MT-1是索拉菲尼对癌症细胞氧化还原代谢的生物标志[33], 其亚型MT-1G是索拉菲尼产生耐药性的重要调节因子, 它通过抑制ferroptosis来促进索拉菲尼的耐药性[34]。虽然索拉菲尼能诱导各种死亡方式, 但是索拉菲尼单剂使用时更容易诱发ferroptosis[35]。Sun等[36]建立的体内外模型证明索拉菲尼和erastin都能诱导肿瘤细胞发生ferroptosis达到抗肿瘤疗效, 并以P62-Kelch like ECH相关蛋白1-核转录相关因子2 (P62-Keap1-NRF2)发挥作用, P62调节Keap1降解, 进而激活NRF2转入核内, 上调铁和ROS代谢相关基因发挥抵抗ferroptosis的作用。但当抑制NRF2活性后, HCC细胞对ferroptosis更敏感, 使得HCC细胞死亡, 达到抗肿瘤效果, 这也为抗肿瘤治疗提供新的分子机制。在真核细胞中, 成视网膜细胞瘤(retinoblastoma, RB)蛋白调节各种基因的转录功能, 并与肝脏肿瘤的发生密切相关[37], 小鼠模型揭示RB蛋白功能紊乱与肝脏肿瘤有着直接的关系, RB功能性缺失在HCC细胞中非常普遍[38]。在HCC细胞中, RB的低表达水平使其对ferroptosis更敏感。当给予索拉菲尼后细胞毒性加剧, 同时, 钝化RB蛋白后氧化应激效应增加, 这些表明肝脏肿瘤细胞的RB蛋白在调节ferroptosis中发挥重要作用[39]。
3.2 Ferroptosis在药物诱导肝毒性中的作用对乙酰氨基酚(acetaminophen, APAP)作为常用的解热镇痛药, 在使用最小剂量(50~100 mg·day−1)时并不会对肝脏造成损伤。但当达到剂量阈值时, 肝脏来不及清除APAP产生的活性代谢产物−乙酰苯醌亚胺(N-acetyl-p-benzoquinone imine, NAPQI), 导致毒性物质堆积造成肝损伤[40]。APAP肝毒性是急性肝损伤最常见的一种, 也成为肝毒性模型最常用的药物[41]。APAP导致肝毒性可以从两方面体现, 第一, APAP破坏细胞内溶酶体, 将Fe2+释放入胞质中, 导致氧化应激[42]。研究表明, 溶酶体调节铁平衡和ROS表达, 它的降解导致大量自由铁释放进入细胞质, 从而敏化ferroptosis; 抑制溶酶体活性能减轻erastin和RSL3诱导的ferroptosis[43], 由此猜测毒性剂量的APAP可能通过破坏溶酶体而对ferroptosis敏感; 第二, APAP与肝脏中蛋白质或者非蛋白质的巯基结合, 在毒性剂量时, 细胞质和线粒体中含巯基的GSH严重耗竭, 导致肝细胞死亡[44], 这也是APAP致肝毒性的最主要原因。2015年Lőrincz等学者[45]发现, APAP诱导的肝损伤能诱导ferroptosis。在APAP肝细胞损伤模型中, 通过比较大鼠原代肝细胞和肝肿瘤细胞HepG2发现, ferrostatin-1能有效抑制大鼠原代肝细胞的生存活力, 而不能逆转APAP导致HepG2细胞的死亡。因为HepG2细胞缺乏细胞色素P450 2E1酶(cytochrome P450 2E1, CYP2E1), 不能将APAP代谢成NAPQI。尽管缺乏CYP2E1, APAP仍然能降低HepG2细胞的生存力, 但不是通过ferroptosis, 可能是以凋亡或坏死的方式发挥作用。
3.3 Ferroptosis在酒精性和非酒精性肝损伤中的作用研究显示酒精能诱导肝细胞的坏死、凋亡和自噬等多种细胞死亡方式。近来研究报道, 酒精诱导的细胞死亡方式还在逐渐被发现过程中。如与细胞肿胀和血浆膜溶解有关的焦亡也被发现和酒精性肝损伤有关[46]。目前还没有关于酒精性肝损伤(alcohol liver damage, ALD)与ferroptosis有关的报道, 但是ferroptosis与脂质过氧化所致的质膜破裂和铁代谢紊乱有关[47], 不难推测二者的相关性, 但尚需要实验数据证明。ALD患者有不同程度的铁负荷, 即使是在饮酒早期其血浆中铁标记物也会增加。随着酒精摄入量增加, 铁在肝脏中慢慢累积[48]。铁过载的程度在ALD患者中通常是比较轻微的, 但是在肝硬化的存在下, 铁过载的严重程度足以被误诊为遗传性血色素沉着症(hereditary hemochromatosis, HH)[49]。HH是一种铁负荷疾病, 常引起肝损伤和纤维化。柠檬酸铁能有效地诱导小鼠原代肝细胞和骨髓衍生巨噬细胞发生ferroptosis, 高铁饮食(high iron diet, HID)小鼠和转基因HH小鼠也会发生严重的ferroptosis, 这些小鼠肝脏中的丙二醛、前列腺素−内过氧化物合成酶2 mRNA (体内ferroptosis的“金指标”)和谷丙转氨酶水平明显升高, NADPH数目明显下降, 天狼星红染色显示HID和HH小鼠的肝脏胶原蛋白沉积, 表明肝脏纤维化增加。单独的SLC7A11−/−不能诱导小鼠发生ferroptosis, 而SLC7A11−/−的铁负荷小鼠却有严重的ferroptosis, 说明铁在ferroptosis中发挥重要作用[50]。酒精诱导的内质网应激[51]和炎症都可能导致肝脏巨噬细胞的铁调素上调和铁滞留。酒精代谢会产生大量ROS, 如过氧化氢和超氧阴离子[52], 在缺氧或促炎因子释放时, 会产生更多的ROS。由于它们半衰期短并且活性高, 往往会快速地与酒精或铁结合形成活性代谢产物, 如羟自由基、氧化亚铁和羟乙基自由基, 从而使得细胞膜发生脂质过氧化[53]。在ALD中, 铁参与氧化应激并催化形成ROS促进肝纤维化[54]。慢性酒精摄入还会导致胞内GSH耗竭, ROS清除能力降低, 肝细胞对氧化应激更敏感[55]。因此, ferroptosis是否在酒精肝的发病机制中发挥重要作用是个值得探讨的课题, 有望为酒精肝的治疗提供新策略。
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)的两大风险因素是肥胖和胰岛素抵抗, 其致病基础是代谢综合征(metabolic syndrome, MS), NAFLD被认为可能是MS的表现。肥胖在NAFLD的发病机制中扮演着关键角色并促进肝脏脂肪变性。游离脂肪酸(free fatty acid, FFA)异常增加是脂肪变性的主要原因。FFA氧化诱导的肝脂毒性及细胞因子介导的内质网应激是细胞损伤的主要因素。铁的存在进一步复杂化NAFLD, 在NAFLD患者中, 存在着不同程度的肝脏铁蓄积[56]。由于肝脏铁超载、肝脏或全身炎症、氧化应激和胰岛素抵抗, NAFLD患者的血浆铁蛋白普遍升高[57]。尽管如此, 它的原因和临床意义至今存在争论[49]。早期体外实验表明, 胰岛素在促进营养物质吸收的同时, 也增加铁的摄入而致铁超载[57]。最近发现, 铁调素可能是直接导致铁紊乱的原因[58]。还有研究表明, 肝细胞坏死泄露的铁被肝巨噬细胞吞噬后增加了肝铁含量[59]。铁超载作用在NAFLD中潜在的病理机制尚未明确, 在肝脏中FFA[60, 61]和铁超载都能诱发氧化应激, 当两者同时刺激肝脏时, 可能表现出协同的肝毒性效应[62]。铁超载与NAFLD的临床特征之间的联系还需要进一步的研究来阐明其机制, 从现有的实验和临床数据来看, 有必要考虑使用铁清除剂作为NAFLD和ALD的辅助治疗[49]。
4 研究前景基于ferroptosis特殊的生物学特征以及研究者对疾病不同治疗手段研究的深入, 这种新发现的细胞死亡方式越来越受到人们的关注, 开发具有促进或抑制ferroptosis的活性药物逐渐成为当前国际药物研究的热点。Ferroptosis在肝脏疾病(特别是肝癌和肝损伤)中的应用也逐渐受到重视。在肝脏肿瘤治疗过程中耐药性是肿瘤治愈的难点问题, 所以针对耐药性寻找新的死亡机制是肿瘤治疗的新突破。如索拉菲尼在肝癌耐药研究方面, 通过改变耐药基因的氧化还原性来增加癌细胞对ferroptosis的敏感度, 这点能为研究肝癌耐药性提供新的思路。同时, 药物性肝损伤研究显示, APAP诱导的肝损伤存在ferroptosis这种新的死亡方式, 进一步拓展了肝损伤治疗策略。但是, 究竟ferroptosis能否发生在其他肝损伤中, 有待进一步研究。这些为今后研究肝脏疾病的治疗靶点提供新方向。
为了更深刻了解ferroptosis在人类肝脏疾病中发挥的作用, 建立各种肝脏疾病ferroptosis模型成为亟需解决的问题, 而要成功建立ferroptosis相关的肝损伤模型, 对可能的靶标和信号通路的抑制或激活将会是一个重要的突破口。药物抑制ferroptosis作用的研究, 能为组织或细胞损伤发生的ferroptosis提供一定的预防和治疗作用。其中, 中药和天然产物及其衍生物在新药研发中占据重要地位, 有望成为治疗某些疾病最有前景的来源。如黄芩素是一种中药提取物, 它能作为ferroptosis抑制剂拮抗erastin诱导的胰腺癌细胞死亡[63]。青蒿酯可作为胰腺癌细胞ferroptosis的活化剂[64]。这些研究为今后开发药物作用靶点提供一定的实践基础, 也为新药研发开拓市场。
| [1] | Bergsbaken T, Fink SL, Cookson BT. Pyroptosis:host cell death and inflammation[J]. Nat Rev Microbiol, 2009, 7: 99–109. DOI:10.1038/nrmicro2070 |
| [2] | Christofferson DE, Yuan J. Necroptosis as an alternative form of programmed cell death[J]. Curr Opin Cell Biol, 2010, 22: 263–268. DOI:10.1016/j.ceb.2009.12.003 |
| [3] | Wang Y, Dawson VL, Dawson TM. Poly(ADP-ribose) signals to mitochondrial AIF:a key event in parthanatos[J]. Exp Neurol, 2009, 218: 193–202. DOI:10.1016/j.expneurol.2009.03.020 |
| [4] | Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis:an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149: 1060–1072. DOI:10.1016/j.cell.2012.03.042 |
| [5] | Angeli JPF, Schneider M, Proneth B, et al. Inactivation of the ferroptosis regulator GPX4 triggers acute renal failure in mice[J]. Nat Cell Biol, 2014, 16: 1180–1191. DOI:10.1038/ncb3064 |
| [6] | Dolma S, Lessnick SL, Hahn WC, et al. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells[J]. Cancer Cell, 2003, 3: 285–296. DOI:10.1016/S1535-6108(03)00050-3 |
| [7] | Wan SY, Stockwell BR. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells[J]. Chem Biol, 2008, 15: 234–245. DOI:10.1016/j.chembiol.2008.02.010 |
| [8] | Xie Y, Hou W, Song X, et al. Ferroptosis:process and function[J]. Cell Death Differ, 2016, 23: 369–379. DOI:10.1038/cdd.2015.158 |
| [9] | Dixon SJ, Stockwell BR. The role of iron and reactive oxygen species in cell death[J]. Nat Chem Biol, 2014, 10: 9–17. |
| [10] | Br er S, Wagner CA. Structure-function relationships of heterodimeric amino acid transporters[J]. Cell Biochem Biophys, 2002, 36: 155–168. DOI:10.1385/CBB:36:2-3:155 |
| [11] | Yang WS, Sriramaratnam R, Welsch ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156: 317–331. DOI:10.1016/j.cell.2013.12.010 |
| [12] | Yang WS, Stockwell BR. Ferroptosis:death by lipid peroxidation[J]. Trends Cell Biol, 2016, 26: 165–176. DOI:10.1016/j.tcb.2015.10.014 |
| [13] | Hayano M, Yang WS, Corn CK, et al. Loss of cysteinyl-tRNA synthetase (CARS) induces the transsulfuration pathway and inhibits ferroptosis induced by cystine deprivation[J]. Cell Death Differ, 2016, 23: 270–278. DOI:10.1038/cdd.2015.93 |
| [14] | Conrad M, Angeli JPF. Glutathione peroxidase 4(GPX4) and ferroptosis:what's so special about it?[J]. Mol Cell Oncol, 2015, 2: e995047. DOI:10.4161/23723556.2014.995047 |
| [15] | Imai H, Hirao F, Sakamoto T, et al. Early embryonic lethality caused by targeted disruption of the mouse PHGPx gene[J]. Biochem Biophys Res Commun, 2003, 305: 278–286. DOI:10.1016/S0006-291X(03)00734-4 |
| [16] | Chen L, Hambright WS, Na R, et al. Ablation of the ferroptosis inhibitor glutathione peroxidase 4 in neurons results in rapid motor neuron degeneration and paralysis[J]. J Biol Chem, 2015, 290: 28097–28106. DOI:10.1074/jbc.M115.680090 |
| [17] | Mai M, Freigang S, Schneider C, et al. T cell lipid peroxidation induces ferroptosis and prevents immunity to infection[J]. J Exp Med, 2015, 212: 51–57. |
| [18] | Tansey TR, Shechter I. Structure and regulation of mammalian squalene synthase[J]. Biochim Biophys Acta, 2000, 1529: 49–62. DOI:10.1016/S1388-1981(00)00137-2 |
| [19] | Zhao X, Wang Y, Wang G, et al. Disruption of iron homeostasis and relevant pharmacotherapies in Alzheimer's disease[J]. Acta Pharm Sin (药学学报), 2016, 51: 866–872. |
| [20] | Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation[J]. Blood, 2003, 102: 783–788. DOI:10.1182/blood-2003-03-0672 |
| [21] | Magtanong L, Ko PJ, Dixon SJ. Emerging roles for lipids in non-apoptotic cell death[J]. Cell Death Differ, 2016, 23: 1099–1109. DOI:10.1038/cdd.2016.25 |
| [22] | Dixon SJ, Winter GE, Musavi LS, et al. Human haploid cell genetics reveals roles for lipid metabolism genes in nonapoptotic cell death[J]. ACS Chem Biol, 2015, 10: 1604–1609. DOI:10.1021/acschembio.5b00245 |
| [23] | Haeggstr m JZ, Funk CD. Lipoxygenase and leukotriene pathways:biochemistry, biology, and roles in disease[J]. Chem Rev, 2011, 111: 5866–5898. DOI:10.1021/cr200246d |
| [24] | Liu Y, Wang W, Li Y, et al. The 5-lipoxygenase inhibitor zileuton confers neuroprotection against glutamate oxidative damage by inhibiting ferroptosis[J]. Biol Pharm Bull, 2015, 38: 1234–1239. DOI:10.1248/bpb.b15-00048 |
| [25] | Chen XS, Funk CD. The N-terminal " beta-barrel" domain of 5-lipoxygenase is essential for nuclear membrane translocation[J]. J Biol Chem, 2001, 276: 811–818. DOI:10.1074/jbc.M008203200 |
| [26] | Anderson ER, Shah YM. Iron homeostasis in the liver[J]. Compr Physiol, 2013, 3: 315–330. |
| [27] | Niederkofler V, Salie R, Arber S. Hemojuvelin is essential for dietary iron sensing, and its mutation leads to severe iron overload[J]. J Clin Invest, 2005, 115: 2180–2186. DOI:10.1172/JCI25683 |
| [28] | Elserag HB. Rising incidence of hepatocellular carcinoma in the United States[J]. N Engl J Med, 1999, 340: 745–750. DOI:10.1056/NEJM199903113401001 |
| [29] | Yao J, Sun W, Chen J, et al. Advances in the study of structural modifications of multi-target anticancer drug sorafenib[J]. Acta Pharm Sin (药学学报), 2012, 47: 1111–1119. |
| [30] | Galmiche A, Ezzoukhry Z, Fran ois C, et al. BAD, a proapoptotic member of the BCL2 family, is a potential therapeutic target in hepatocellular carcinoma[J]. Mol Cancer Res, 2010, 8: 1116–1125. DOI:10.1158/1541-7786.MCR-10-0029 |
| [31] | Shimizu S, Takehara T, Hikita H, et al. Inhibition of autophagy potentiates the antitumor effect of the multikinase inhibitor sorafenib in hepatocellular carcinoma[J]. Int J Cancer, 2012, 131: 548–557. DOI:10.1002/ijc.v131.3 |
| [32] | Chiou JF, Tai CJ, Wang YH, et al. Sorafenib induces preferential apoptotic killing of a drug-and radio-resistant HepG2 cells through a mitochondria-dependent oxidative stress mechanism[J]. Cancer Biol Ther, 2009, 8: 1904–1913. DOI:10.4161/cbt.8.20.9436 |
| [33] | Houessinon A, Fran ois C, Sauzay C, et al. Metallothionein-1 as a biomarker of altered redox metabolism in hepatocellular carcinoma cells exposed to sorafenib[J]. Mol Cancer, 2016, 15: 38–48. DOI:10.1186/s12943-016-0526-2 |
| [34] | Sun X, Niu X, Chen R, et al. Metallothionein-1G facilitates sorafenib resistance through inhibition of ferroptosis[J]. Hepatology, 2016, 64: 488–500. DOI:10.1002/hep.28574 |
| [35] | Louandre C, Ezzoukhry Z, Godin C, et al. Iron-dependent cell death of hepatocellular carcinoma cells exposed to sorafenib[J]. Int J Cancer, 2013, 133: 1732–1742. DOI:10.1002/ijc.v133.7 |
| [36] | Sun X, Ou Z, Chen R, et al. Activation of the p62-Keap1-NRF2 pathway protects against ferroptosis in hepatocellular carcinoma cells[J]. Hepatology, 2016, 63: 173–184. DOI:10.1002/hep.28251 |
| [37] | Knudsen ES, Knudsen KE. Tailoring to RB:tumour suppressor status and therapeutic response[J]. Nat Rev Cancer, 2008, 8: 714–724. DOI:10.1038/nrc2401 |
| [38] | Mayhew CN, Carter SL, Fox SR, et al. RB loss abrogates cell cycle control and genome integrity to promote liver tumorigenesis[J]. Gastroenterology, 2007, 133: 976–984. DOI:10.1053/j.gastro.2007.06.025 |
| [39] | Louandre C, Marcq I, Bouhlal H, et al. The retinoblastoma (Rb) protein regulates ferroptosis induced by sorafenib in human hepatocellular carcinoma cells[J]. Cancer Lett, 2015, 356: 971–977. DOI:10.1016/j.canlet.2014.11.014 |
| [40] | Bunchorntavakul C, Reddy KR. Acetaminophen-related hepatotoxicity[J]. Clin Liver Dis, 2013, 17: 587–607. DOI:10.1016/j.cld.2013.07.005 |
| [41] | Larson AM, Polson J, Fontana RJ, et al. Acetaminophen-induced acute liver failure:results of a United States multicenter, prospective study[J]. Hepatology, 2005, 42: 1364–1372. DOI:10.1002/(ISSN)1527-3350 |
| [42] | Hu J, Kholmukhamedov A, Lindsey CC, et al. Translocation of iron from lysosomes to mitochondria during acetaminophen-induced hepatocellular injury:protection by starch-desferal and minocycline[J]. Free Radic Biol Med, 2016, 97: 418–426. DOI:10.1016/j.freeradbiomed.2016.06.024 |
| [43] | Torii S, Shintoku R, Kubota C, et al. An essential role for functional lysosomes in ferroptosis of cancer cells[J]. Biochem J, 2016, 473: 769–777. DOI:10.1042/BJ20150658 |
| [44] | Li Y, Dai GW, Li Y, et al. Effect of bicyclol on acetaminophen-induced hepatotoxicity:energetic metabolism and mitochondrial injury in acetaminophen-intoxicated mice[J]. Acta Pharm Sin (药学学报), 2001, 36: 723–726. |
| [45] | Lőrincz T, Jemnitz K, Kardon T, et al. Ferroptosis is involved in acetaminophen induced cell death[J]. Pathol Oncol Res, 2015, 21: 1115–1121. DOI:10.1007/s12253-015-9946-3 |
| [46] | Wree A, Eguchi A, Mcgeough MD, et al. NLRP3 inflammasome activation results in hepatocyte pyroptosis, liver inflammation, and fibrosis in mice[J]. Hepatology, 2014, 59: 898–910. DOI:10.1002/hep.v59.3 |
| [47] | Wang S, Pacher P, De Lisle RC, et al. A mechanistic review of cell death in alcohol-induced liver injury[J]. Alcohol Clin Exp Res, 2016, 40: 1215–1223. DOI:10.1111/acer.13078 |
| [48] | Kohgo Y, Ohtake T, Ikuta K, et al. Iron accumulation in alcoholic liver diseases[J]. Alcohol Clin Exp Res, 2005, 29: 189S–193S. DOI:10.1097/01.alc.0000189274.00479.62 |
| [49] | Corradini E, Pietrangelo A. Iron and steatohepatitis[J]. J Gastroenterol Hepatol, 2012, 27: 42–46. DOI:10.1111/j.1440-1746.2011.07014.x |
| [50] | Wang H, An P, Xie E, et al. Characterization of ferroptosis in murine models of hemochromatosis[J]. Hepatology, 2017, 66: 449–465. DOI:10.1002/hep.v66.2 |
| [51] | Ji C. Mechanisms of alcohol-induced endoplasmic reticulum stress and organ injuries[J]. Biochem Res Int, 2012, 2012: 216450. |
| [52] | Cederbaum AI. Cytochrome P4502E1-dependent oxidant stress and upregulation of anti-oxidant defense in liver cells[J]. J Gastroenterol Hepatol, 2006, 21: S22–S25. DOI:10.1111/jgh.2006.21.issue-s3 |
| [53] | Louvet A, Mathurin P. Alcoholic liver disease:mechanisms of injury and targeted treatment[J]. Nat Rev Gastroenterol Hepatol, 2015, 12: 231–242. DOI:10.1038/nrgastro.2015.35 |
| [54] | Philippe MA, Ruddell RG, Ramm GA. Role of iron in hepatic fibrosis:one piece in the puzzle[J]. World J Gastroenterol, 2007, 13: 4746–4754. DOI:10.3748/wjg.v13.i35.4746 |
| [55] | Hirano A, Kaplowitz N, Tsukamoto H, et al. Hepatic mitochondrial glutathione depletion and progression of experimental alcoholic liver disease in rats[J]. Hepatology, 1992, 16: 1423–1427. DOI:10.1002/(ISSN)1527-3350 |
| [56] | Subramaniam N. Pathology of hepatic iron overload[J]. World J Gastroenterol, 2007, 13: 4755–4760. DOI:10.3748/wjg.v13.i35.4755 |
| [57] | Fernándezreal JM, Lópezbermejo A, Ricart W. Cross-talk between iron metabolism and diabetes[J]. Diabetes, 2002, 51: 2348–2354. DOI:10.2337/diabetes.51.8.2348 |
| [58] | Bekri S, Gual P, Anty R, et al. Increased adipose tissue expression of hepcidin in severe obesity is independent from diabetes and NASH[J]. Gastroenterology, 2006, 131: 788–796. DOI:10.1053/j.gastro.2006.07.007 |
| [59] | Sorrentino P, D'Angelo S, Ferbo U, et al. Liver iron excess in patients with hepatocellular carcinoma developed on non-alcoholic steato-hepatitis[J]. J Hepatol, 2009, 50: 351–357. DOI:10.1016/j.jhep.2008.09.011 |
| [60] | Anstee QM, Daly AK, Day CP. Genetic modifiers of non-alcoholic fatty liver disease progression[J]. Biochim Biophys Acta, 2011, 1812: 1557–1566. DOI:10.1016/j.bbadis.2011.07.017 |
| [61] | Fabbrini E, Sullivan S, Klein S. Obesity and nonalcoholic fatty liver disease:biochemical, metabolic, and clinical implications[J]. Hepatology, 2010, 51: 679–689. DOI:10.1002/hep.23280 |
| [62] | Pietrangelo A. Metals, oxidative stress, and hepatic fibrogenesis[J]. Semin Liver Dis, 1996, 16: 13–30. DOI:10.1055/s-2007-1007215 |
| [63] | Xie Y, Song X, Sun X, et al. Identification of baicalein as a ferroptosis inhibitor by natural product library screening[J]. Biochem Biophys Res Commun, 2016, 473: 775–780. DOI:10.1016/j.bbrc.2016.03.052 |
| [64] | Eling N, Reuter L, Hazin J, et al. Identification of artesunate as a specific activator of ferroptosis in pancreatic cancer cells[J]. Oncoscience, 2015, 2: 517–532. DOI:10.18632/oncoscience |
 2017, Vol. 52
2017, Vol. 52


