肿瘤是目前危害人类健康和生命的第二大疾病, 具有发病率高、治愈率低等特点。近20年来, 随着材料学、药剂学的发展, 采用纳米技术递送抗肿瘤药物受到了广泛的探索[1]。尽管肿瘤靶向递药系统能够一定程度提高抗肿瘤药物的肿瘤分布, 但如何设计纳米载体使其可以高效靶向肿瘤部位且具有理想的瘤内浓度和均匀分布成为目前药物靶向递送领域的一个重要目标[2, 3]。纳米载体的体内行为受多种因素影响, 不仅与肿瘤本身的生理病理环境有关, 还与纳米载体本身的理化性质有关, 如粒径、形状、电荷及表面修饰[4, 5]。其中, 粒径具有较为重要的作用[6], 大粒径的纳米载体有利于滞留在肿瘤部位却不利于穿透进入肿瘤内部, 而小粒径的纳米载体能够穿透进入肿瘤内部但滞留性较差。因此构建肿瘤微环境响应的粒径智能化调节纳米载体, 以同时提高纳米载体的肿瘤渗透性和滞留性成为近期研究的热点, 如pH敏感、氧化还原敏感和酶敏感等[7]。
豆荚蛋白酶是一种高度保守的天冬氨酸内切酶, 具有高度严格的酶切水解位置特异性, 其底物的P1位置必须是天冬酰胺[8, 9]。豆荚蛋白酶的表达和活力与多种病理状态有关, 如炎症、动脉粥样硬化和肿瘤等。研究表明豆荚蛋白酶在多种人源性实体瘤中的表达量是上调的, 且与恶性肿瘤的侵袭性和转移性成正相关[10, 11]。据报道, 豆荚蛋白酶存在于细胞内的膜囊泡结构中, 如侵袭性伪足、肌动蛋白皮层, 同时还存在于细胞外膜上[9]。由于其较高的表达量和特异性的酶促水解底物, 豆荚蛋白酶作为酶促靶点用于前药激活和纳米递药系统响应性传递具有一定的潜力。
基于以上观点, 本课题组前期构建了一个粒径仅为30 nm左右的豆荚蛋白酶响应的功能化纳米载体(GNPs-A & C), 由丙氨酸-丙氨酸-天冬酰胺-半胱氨酸-赖氨酸(AK多肽)修饰的金纳米粒和2-氰基-6-氨基苯并噻唑(CABT)修饰的金纳米粒组成。由于其较小的粒径, GNPs-A & C能够通过增强的渗透和保留效应被动靶向至肿瘤部位, 并渗透进入肿瘤内部, 进而在肿瘤微环境中高表达的豆荚蛋白酶作用下暴露出半胱氨酸上的1, 2-巯基氨基, 并与CABT上的氰基发生点击反应[12], 引起纳米粒聚集, 从而提高其肿瘤滞留性。本课题组前期的研究证实GNPs-A & C在体外能够在豆荚蛋白酶作用下粒径从35.6 nm增加到309.6 nm, 且能够有效提高C6细胞的摄取并减少外排[13]。因此在本文中作者进一步考察GNPs-A & C在C6皮下瘤中的靶向蓄积能力, 并以多柔比星(DOX)为模型药物考察其抗肿瘤效果。
材料与方法 试剂与材料氯金酸(国药集团化学试剂有限公司); AK多肽(郑州派和泰德医药科技公司); CABT (上海速博化学科技有限公司); 巯基-聚乙二醇-羧基(相对分子质量: 5 000, 美国Laysan Bio公司); 兔源性抗豆荚蛋白酶一抗(H-300, 美国Santa Cruz Biotechnology公司); 大鼠源性抗小鼠CD34一抗(美国eBioscience公司); 异硫氰酸荧光素标记的驴抗兔二抗和异硫氰酸荧光素标记的驴抗大鼠二抗(美国Proteintech Group公司); 细胞培养皿和培养板(无锡耐思生物科技有限公司)。
细胞及培养鼠源性脑胶质瘤细胞(C6)和人源性乳腺癌细胞(MDA-MB-231)在37 ℃、5%恒温培养箱培养, 培养基为含4 500 mg·L-1 D-葡萄糖、10%胎牛血清和1%双抗(青霉素+链霉素)的DMEM培养基, 所有细胞实验均在细胞生长的对数期进行。
动物BALB/c雌性小鼠[成都达硕实验动物有限公司, 许可证号SCXK (川) 2015-030]饲养在标准环境条件下, 所有动物实验遵循四川大学伦理委员会制定的伦理学要求。
GNPs-AK和GNPs-CABT的制备采用柠檬酸钠还原法制备金纳米粒(GNPs)。具体步骤如下:配制50 mL氯金酸溶液于100 mL圆底烧瓶中, 终质量浓度为0.11 mg·mL-1, 加热至沸腾后, 在剧烈搅拌条件下迅速加入1%柠檬酸钠溶液2 mL, 保持溶液沸腾至颜色变为酒红色, 得到金纳米粒溶液。取金纳米粒溶液10 mL置于EP管中, 加入1 mg·mL-1巯基-聚乙二醇-AK功能片段(SH-PEG-AK)溶液50 μL, 于150 r·min-1、37 ℃条件下孵育8 h得到GNPs-AK。同样, 取金纳米粒溶液10 mL置于EP管中, 加入1 mg·mL-1巯基-聚乙二醇-CABT功能片段(SH-PEG-CABT)溶液50 μL, 于150 r·min-1、37 ℃条件下孵育8 h得到GNPs-CABT。PEG化的金纳米粒(GNPs-PEG)制备方法同上, 巯基-聚乙二醇(SH-PEG)的投料量为10 μg·mL-1。
载DOX功能化金纳米粒的制备取金纳米粒溶液30 mL置于圆底烧瓶中, 加入1 mg·mL-1酸敏感的DOX甲醇溶液150 μL, 于150 r·min-1、37 ℃条件下孵育8 h得到载DOX功能化金纳米粒(GNPs-DOX)。将GNPs-DOX溶液均分成10 mL, 分别置于EP管中并加入1 mg·mL-1 SH-PEG-AK 50 μL、1 mg·mL-1 SH-PEG-CABT 50 μL、1 mg·mL-1 SH-PEG 100 μL, 得到GNPs-DOX-AK、GNPs-DOX-CABT和GNPs-DOX-PEG。
载花箐染料(Cy5.5)功能化金纳米粒的制备方法同上, Cy5.5的投料量为2 μg·mL-1。
活体成像雌性BALB/c小鼠首先用4%水合氯醛麻醉, 将左后侧大腿上部的毛发剃去。将C6和MDA-MB-231重悬在磷酸盐缓冲液(PBS, pH 7.4)和基质胶的混合液(v/v = 1/1)中, 分别取0.1 mL C6和MDA-MB-231混悬液注射入左大腿上部的皮下(接种细胞数分别为3×106个/只和1×106个/只)[14]。接种10天后, 荷C6皮下瘤的BALB/c小鼠尾静脉注射GNPs-Cy5.5-A & C和GNPs-Cy5.5-PEG, 荷MDA-MB-231皮下瘤的BALB/c小鼠尾静脉注射GNPs-Cy5.5-A & C (Cy5.5的注射剂量为1.2 mg·kg-1)[15]。小鼠全身的荧光分布通过活体成像系统(IVIS Spectrum, 美国Caliper公司)获得。
免疫荧光从小鼠身上剥离的肿瘤和主要器官首先用4%多聚甲醛固定24 h, 然后依次在15%蔗糖溶液和30%蔗糖溶液中梯度脱水。10 μm厚度的肿瘤切片首先与抗豆荚蛋白酶一抗在4 ℃条件下孵育过夜(稀释比例为1:100), TBS润洗3次后, 与FITC标记的二抗室温孵育2 h, 最后用4', 6-二脒基-2-苯基吲哚(DAPI)溶液(5 μg·mL-1)染核5 min。10 μm厚度的正常组织切片用DAPI溶液染核5 min。所有切片在激光共聚焦显微镜(Olympus FV1000, 日本)下观察荧光。
抗肿瘤效果评价荷C6皮下瘤BALB/c小鼠的模型建立如上所述, 接种7天后, 所有的小鼠被随机分配为4组(每组10只), 分别为生理盐水组(N.S.)、游离多柔比星组(free DOX)、GNPs-DOX-PEG和GNPs-DOX-A & C组。每组每只小鼠分别尾静脉注射GNPs-DOX-A & C、GNPs-DOX-PEG、free DOX (DOX的给药剂量均为3 mg·kg-1)和生理盐水, 给药间隔为2天1次, 给药次数为5次[16]。最后1次给药后, 对所有小鼠尾静脉给予10%水合氯醛麻醉处死, 取肿瘤和主要器官。对肿瘤和主要器官的石蜡切片进行苏木精和伊红染色(H & E), 另外, 对肿瘤的石蜡切片进行脱氧核苷酸末端标记(TUNEL)染色。
统计学方法实验结果以均值±标准差(x± s), 实验组与对照组的比较是用双尾非配对的Student’s t test分析, P<0.05时认为有显著性差异。
结果与讨论 1 制剂表征由动态光散射法测定结果可以看出(表 1), 金纳米粒粒径为20 nm, 表面修饰SH-PEG及聚集反应片段后粒径增大至35~40 nm, 初步表明SH-PEG、SH-PEG-AK和SH-PEG-CABT成功修饰到GNPs上。
| Table 1 Physiochemical characterization of different formulations. n = 3, x± s. GNPs: Gold nanoparticles; GNPs-PEG: PEGylated gold nanoparticles; GNPs-AK: AK modified gold nanoparticles; GNPs-CABT: CABT modified gold nanoparticles |
本实验中, 首先考察了GNPs-Cy5.5-A & C在进入荷C6皮下瘤小鼠后的豆荚蛋白酶响应性。活体成像结果表明, 在静脉注射0.5 h后, GNPs-Cy5.5-A & C与GNPs-Cy5.5-PEG在C6皮下瘤位置的荧光信号相近(图 1A), 表明相同粒径的纳米粒在进入体循环后可以通过EPR效应到达肿瘤部位且具有相近的外渗量。随着时间的增加, GNPs-Cy5.5-A & C在C6皮下瘤的荧光信号越来越强, 24 h时荧光信号明显高于GNPs-Cy5.5-PEG组, 这是由于GNPs-Cy5.5-A & C在豆荚蛋白酶的触发下发生聚集, 粒径的增长阻碍了GNPs-Cy5.5-A & C从肿瘤间质中向血液中回流[17], 从而增强了GNPs-Cy5.5-A & C在C6皮下瘤中的蓄积, 这些结果表明GNPs-Cy5.5-A & C在体内具有豆荚蛋白酶响应性。此外, 为了进一步验证GNPs-Cy5.5-A & C在肿瘤部位的蓄积量与豆荚蛋白酶表达量呈相关性, 同时考察了GNPs-Cy5.5-A & C在荷MDA-MB-231皮下瘤小鼠中的蓄积量, 而Western blot (WB)检测MDA-MB-231肿瘤中豆荚蛋白酶的表达较低(图 1B)。在0.5 h时, GNPs-Cy5.5-A & C在MDA-MB-231皮下瘤部位的荧光信号与在C6皮下瘤部位相近。然而, 随着时间的增加, MDA-MB-231皮下瘤部位的荧光信号并没有显著地提高, 该结果表明GNPs-Cy5.5-A & C在豆荚蛋白酶缺乏的MDA-MB-231皮下瘤部位没有发生有效聚集, 因此对于GNPs的滞留效果无明显提高, 该结果进一步说明了该功能性纳米粒在肿瘤部位的蓄积与豆荚蛋白酶的表达量密切相关。
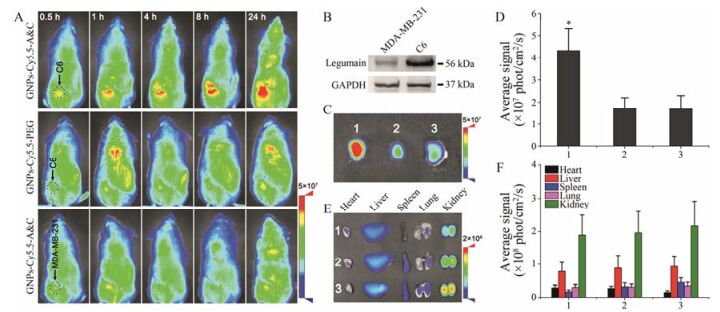
|
Figure 1 In vivo distribution of Cy5.5-loaded functional gold nanoparticles (GNPs-Cy5.5-A & C). A: In vivo living imaging of subcutaneous C6 tumor-bearing treated with GNPs-Cy5.5-A & C and Cy5.5-loaded PEGylated gold nanoparticles (GNPs-Cy5.5-PEG), as well as MDA-MB-231 tumor-bearing BALB/c mice treated with GNPs-Cy5.5-A & C, the dashed frames indicate the tumor site; B: Western blot analysis of legumain expressed in C6 and MDA-MB-231 tumor, glyceraldehyde-3-phosphate dehydrogenase (GAPDH) serves as loading control; C: Ex vivo imaging of tumors collected from mice after 24 h intravenous injection, 1 represents C6 tumor treated with GNPs-Cy5.5-A & C, 2 represents C6 tumor treated with GNPs-Cy5.5-PEG, 3 represents MDA-MB-231 tumor treated with GNPs-Cy5.5-A & C; D: Ex vivo imaging of normal tissues collected from mice after 24 h intravenous injection; E: Region of interest (ROI) analysis of fluorescent signal distributed in tumor; F: ROI analysis of fluorescent signal distributed in normal tissues. n = 8, x± s. *P < 0.05 vs GNPs-Cy5.5-PEG in C6 tumor and GNPs-Cy5.5-A & C in MDA-MB-231 tumor |
离体成像结果显示, GNPs-Cy5.5-A & C在C6肿瘤中的荧光信号明显高于GNPs-Cy5.5-PEG在C6肿瘤及GNPs-Cy5.5-A & C在MDA-MB-231肿瘤中的荧光信号, 与活体成像的结果一致(图 1C)。荧光的半定量分析清楚可见GNPs-Cy5.5-A & C在C6肿瘤中信号值与对照组的差距(图 1D)。具体来说, GNPs-Cy5.5-A & C在C6肿瘤中荧光信号值分别是GNPs-Cy5.5-PEG在C6肿瘤及GNPs-Cy5.5-A & C在MDA-MB-231肿瘤中的2.50倍及2.57倍。这些结果表明GNPs-Cy5.5-A & C可以在豆荚蛋白酶富集的肿瘤中取得较高的蓄积量。另外, 离体成像及半定量分析表明各组主要器官中的荧光信号之间没有明显的区别(图 1E, F)。可以看出, 各组器官中肾脏的荧光分布最强, 表明肾脏可能是主要的清除器官, 原因在于GNPs-Cy5.5-A & C和GNPs-Cy5.5-PEG粒径相对较小。
3 免疫荧光共聚焦图片可以看出C6肿瘤切片中的豆荚蛋白酶的荧光信号明显高于MDA-MB-231肿瘤切片, 表明豆荚蛋白酶在C6肿瘤中高表达而在MDA-MB-231肿瘤中低表达(图 2), 结果与WB检测结果一致。此外, 给予GNPs-Cy5.5-A & C的C6肿瘤切片中Cy5.5荧光信号明显强于GNPs-Cy5.5-PEG在C6肿瘤切片及GNPs-Cy5.5-A & C在MDA-MB-231肿瘤切片中的信号, 表明GNPs-Cy5.5-A & C在C6皮下瘤部位蓄积的更多。值得注意的是这种蓄积量的差异是否由于初始外渗量的差异造成的?为此, 进一步对肿瘤切片的新生血管进行免疫荧光染色, 共聚焦图片可以看出C6肿瘤切片和MDA-MB-231肿瘤切片的新生血管均较为丰富(图 3), 无明显差异, 说明粒径相近的纳米粒可以通过EPR效应获得相近的外渗量。因此更加直接地验证了GNPs-Cy5.5-A & C在C6皮下瘤部位高蓄积量原因是由于其在肿瘤中豆荚蛋白酶的触发下发生聚集, 而大粒径的聚集体阻断其向血液中回流, 从而滞留在其中。

|
Figure 2 Fluorescent distribution of GNPs-Cy5.5-A & C and GNPs-Cy5.5-PEG in C6 tumor as well as GNPs-Cy5.5-A & C in MDA-MB-231 tumor labeled with anti-legumain antibody after 24 h treatment, bar represents 50 µm |
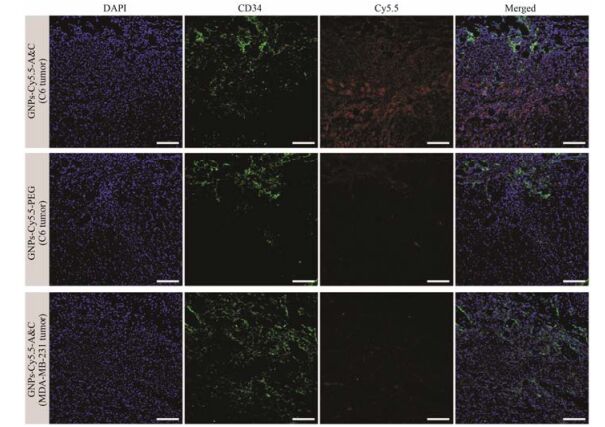
|
Figure 3 Fluorescent distribution of GNPs-Cy5.5-A & C and GNPs-Cy5.5-PEG in C6 tumor as well as GNPs-Cy5.5-A & C in MDA-MB-231 tumor labeled with anti-CD34 antibody after 24 h treatment, bar represents 50 µm |
本研究首先将DOX通过一种pH敏感键连接到GNPs上, 该pH敏感性的DOX荧光探针具有巯基和腙键[18]。尾静脉给药5次后, 给予生理盐水组的C6皮下瘤快速生长, 其生长体积与初始体积比(v/v0)在第19天时为2.03 (图 4A); 游离DOX组和GNPs-DOX-PEG组的肿瘤生长趋势相近, 其v/v0分别为1.58和1.63; GNPs-DOX-A & C组小鼠的v/v0仅为0.82。在第19天时将各组小鼠的肿瘤剥离下来, 可以看出GNPs-DOX-A & C组的肿瘤明显小于其他组(图 4B)。将各组肿瘤称重, 生理盐水组的肿瘤均重为(120.05 ± 25.97) mg (图 4C), 游离DOX组和GNPs-DOX-PEG组的肿瘤质量分别为(83.08 ± 18.11) mg和(87.28 ± 19.87) mg, 低于生理盐水组。相比之下, GNPs-DOX-A & C组的肿瘤均重为(48.86 ± 21.43) mg, 明显低于其他组(P值分别为0.000 02、0.003 14、0.001 86)。这些结果表明GNPs-DOX-A & C具有显著的C6皮下瘤治疗效果, 这与GNPs-DOX-A & C在C6皮下瘤部位较高的蓄积量有关。此外, 作为DOX系统毒性的直接指标, 监测了给药期间荷瘤小鼠的体重, 在连续给予游离DOX后, 小鼠的体重明显下降(图 4D)。连续给予GNPs-DOX-A & C和GNPs-DOX-PEG的小鼠体重没有下降, 与生理盐水组小鼠体重相近, 表明GNPs-DOX-A & C在一定程度上降低DOX的系统毒性。
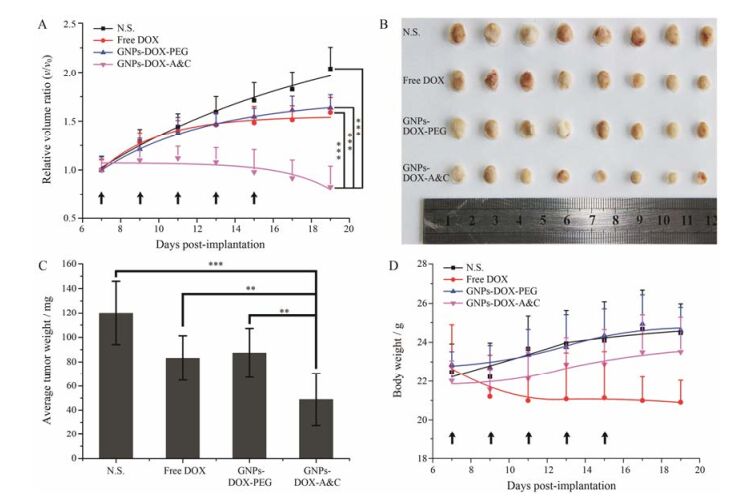
|
Figure 4 In vivo anti-tumor efficacy and toxicity assessment of GNPs-DOX-A & C. A: Relative volume ratio of progressive tumor to initial tumor of C6 subcutaneous tumor-bearing mice treated with different formulations, black arrow indicates the time point for administration; B: Graph of tumors collected from mice after administration with different formulations; C: Average weight of tumors collected from mice after administration with different formulations; D: Body weight of tumor-bearing mice during the administration, black arrow indicates the time point for administration. n = 8, x± s. **P < 0.01, ***P < 0.001 |
为了进一步考察GNPs-DOX-A & C增强抗肿瘤效果的机制, 作者对各组肿瘤切片进行免疫组化染色。H & E染色可以看出, 给予GNPs-DOX-A & C的肿瘤切片组织病变程度明显高于其他组, 并且细胞核的密度也明显少于其他组(图 5A)。与此同时, 还对肿瘤切片进行TUNEL染色来考察肿瘤细胞的凋亡情况, 给予GNPs-DOX-A & C的肿瘤中存在更多的凋亡小体(图 5B)。这些结果与肿瘤生长曲线呈正相关, 表明豆荚蛋白酶响应的GNPs-DOX-A & C可以有效提高多柔比星的抗肿瘤效果。

|
Figure 5 Immunohistochemical assay. A: H & E staining of tumor tissues after administration with different formulations, bar represents 100 µm; B: TUNEL staining of tumor tissue after administration with different formulations, bar represents 100 µm |
此外, 还对各组小鼠的正常组织(心、肝、脾、肺、肾)进行H & E染色。可以看出, 给予游离DOX肿瘤切片有明显的心肌损伤—急性中性粒细胞聚集(图 6), 这主要是由于DOX的心脏毒副作用造成的[19]。相比之下, GNPs-DOX-A & C、GNPs-DOX-PEG和生理盐水组却没有明显的心肌损伤, 表明GNPs-DOX-A & C和GNPs-DOX-PEG可以有效地降低DOX的心脏毒性。同样在其他组织中亦未发现明显的损伤, 表明GNPs-DOX-A & C具有较高的生物安全性。
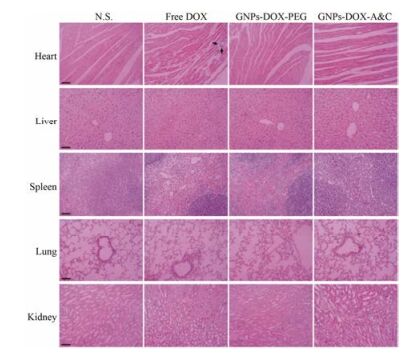
|
Figure 6 H & E staining of normal tissues after administration with different formulations, black arrow indicates the location of neutronphils and bar represents 100 µm |
作者构建了一种肿瘤微环境响应的功能性纳米载体, 由豆荚蛋白酶可切断的多肽片段修饰的GNPs和CABT修饰的GNPs组成。荧光成像结果表明, GNPs-A & C在豆荚蛋白酶富集的C6皮下瘤中的蓄积量明显提高, 且具有较为准确的定位。最为重要的是, GNPs-DOX-A & C显著地提高了DOX在C6皮下瘤部位中的蓄积量, 展示了优越的化疗效果并降低DOX的毒副作用。
| [1] | Gao H, Jiang X. The development of novel tumor targeting delivery strategy[J]. Acta Pharm Sin (药学学报), 2016, 51: 272–280. |
| [2] | Ferrari M. Cancer nanotechnology:opportunities and challenges[J]. Nat Rev Cancer, 2005, 5: 161–171. DOI:10.1038/nrc1566 |
| [3] | Jain RK, Stylianopoulos T. Delivering nanomedicine to solid tumors[J]. Nat Rev Clin Oncol, 2010, 7: 653–664. DOI:10.1038/nrclinonc.2010.139 |
| [4] | Bertrand N, Wu J, Xu X, et al. Cancer nanotechnology:the impact of passive and active targeting in the era of modern cancer biology[J]. Adv Drug Deliver Rev, 2014, 66: 2–25. DOI:10.1016/j.addr.2013.11.009 |
| [5] | Baish JW, Stylianopoulos T, Lanning RM, et al. Scaling rules for diffusive drug delivery in tumor and normal tissues[J]. Proc Natl Acad Sci U S A, 2011, 108: 1799–1803. DOI:10.1073/pnas.1018154108 |
| [6] | Jain RK. Delivery of molecular and cellular medicine to solid tumors[J]. Adv Drug Deliver Rev, 2001, 46: 149–168. DOI:10.1016/S0169-409X(00)00131-9 |
| [7] | Zhang P, Wang Y, Lian J, et al. Engineering the surface of smart nanocarriers using a pH-/thermal-/GSH-responsive polymer zipper for precise tumor targeting therapy in vivo[J]. Adv Mater, 2017. DOI:10.1002/adma.201702311 |
| [8] | Chen JM, Dando PM, Rawlings ND, et al. Cloning, isolation, and characterization of mammalian legumain, an asparaginyl endopeptidase[J]. J Biol Chem, 1997, 272: 8090–8098. DOI:10.1074/jbc.272.12.8090 |
| [9] | Liu C, Sun C, Huang H, et al. Overexpression of legumain in tumors is significant for invasion/metastasis and a candidate enzymatic target for prodrug therapy[J]. Cancer Res, 2003, 63: 2957–2964. |
| [10] | Edgington LE, Verdoes M, Ortega A, et al. Functional imaging of legumain in cancer using a new quenched activity-based probe[J]. J Am Chem Soc, 2013, 135: 174–182. DOI:10.1021/ja307083b |
| [11] | Liu Z, Xiong M, Gong J, et al. Legumain protease-activated TAT-liposome cargo for targeting tumours and their microenvironment[J]. Nat Commun, 2014, 5: 4280. |
| [12] | Dragulescu-Andrasi A, Kothapalli SR, Tikhomirov GA, et al. Activatable oligomerizable imaging agents for photoacoustic imaging of furin-like activity in living subjects[J]. J Am Chem Soc, 2013, 135: 11015–11022. DOI:10.1021/ja4010078 |
| [13] | Ruan S, Hu C, Tang X, et al. Increased gold nanoparticle retention in brain tumors by in situ enzyme-induced aggregation[J]. ACS Nano, 2016, 10: 10086–10098. DOI:10.1021/acsnano.6b05070 |
| [14] | Liu Y, Lu Z, Mei L, et al. Tandem peptide based on structural modification of poly-arginine for enhancing tumor targeting efficiency and therapeutic effect[J]. ACS Appl Mater Interfaces, 2017, 9: 2083–2092. DOI:10.1021/acsami.6b12611 |
| [15] | Ruan S, He Q, Gao H. Matrix metalloproteinase triggered size-shrinkable gelatin-gold fabricated nanoparticles for tumor microenvironment sensitive penetration and diagnosis of glioma[J]. Nanoscale, 2015, 7: 9487–9496. DOI:10.1039/C5NR01408E |
| [16] | Ruan S, Cao X, Cun X, et al. Matrix metalloproteinase-sensitive size-shrinkable nanoparticles for deep tumor penetration and pH triggered doxorubicin release[J]. Biomaterials, 2015, 60: 100–110. DOI:10.1016/j.biomaterials.2015.05.006 |
| [17] | Perrault SD, Walkey C, Jennings T, et al. Mediating tumor targeting efficiency of nanoparticles through design[J]. Nano Lett, 2009, 9: 1909–1915. DOI:10.1021/nl900031y |
| [18] | Ruan S, Yuan M, Zhang L, et al. Tumor microenvironment sensitive doxorubicin delivery and release to glioma using angiopep-2 decorated gold nanoparticles[J]. Biomaterials, 2015, 37: 425–435. DOI:10.1016/j.biomaterials.2014.10.007 |
| [19] | Yu H, Cui Z, Yu P, et al. pH-and NIR light-responsive micelles with hyperthermia-triggered tumor penetration and cytoplasm drug release to reverse doxorubicin resistance in breast cancer[J]. Adv Funct Mater, 2015, 25: 2489–2500. DOI:10.1002/adfm.201404484 |
 2017, Vol. 52
2017, Vol. 52


