随着医学技术的迅猛发展, 利用组织工程技术进行缺损组织和器官的修复与再生已成为一种极具潜力的治疗手段, 生长因子是组织工程中应用的重要的细胞营养物质, 具有诱导和刺激细胞增殖、维持细胞存活等多方面的生物功能。然而, 生长因子多为蛋白类药物, 其半衰期比较短, 在体内容易失去生物活性, 只能在短期内产生效果, 此外, 生长因子的价格昂贵, 治疗成本高。
近年来, 基因治疗技术的发展及其在组织工程领域的应用为这些问题的解决提供了新的策略。将编码有生长因子并具有转染能力的DNA融合于生物可降解材料中构建含DNA的生物支架, 即基因活化支架(gene-activated matrix, GAM)[1]。将GAM直接植入到组织缺损区, 可在植入部位释放DNA并转染附近的细胞。一旦转染成功, 细胞将成为生物反应器, 持续表达并分泌基因所编码的生长因子, 达到对细胞分化和组织再生调控的目的[2, 3]。GAM在结构上包含DNA复合物和支架材料两部分, 这两部分的功能决定了GAM的功能。目前, 关于GAM的研究热点主要集中于仿生支架的设计及如何实现高效的DNA转染这两个方面。
细胞外基质(extracellular matrix, ECM)是体内细胞生长的微环境, 是由纤维蛋白和多糖组成的复杂的网架结构, 它通过黏附因子与细胞表面受体结合, 促使细胞在基质上附着, 细胞则通过自身释放的酶降解基质, 为自身的迁移和增殖创造空间, ECM对维持细胞的生理活动具有重要的作用。支架作为承载细胞附着、生长和增殖的微环境, 应最大程度地模拟ECM的功能。凝胶是组织工程中常用的支架形式, 其交联网络的多孔结构利于细胞的迁移及活性物质的传递, 可以很好地模拟ECM的网架结构。基质金属蛋白酶(matrix metalloproteinase, MMPs)属于细胞内的蛋白水解酶家族。在组织修复过程中, 细胞能够分泌MMPs, 它几乎能降解ECM中的各种蛋白成分, 从而为细胞的迁移与增殖提供空间。RGD肽是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)的短肽, 存在于多种生物细胞外基质中, 能特异性识别细胞表面的整合素并与之结合, 是细胞在ECM中附着和迁移的识别部位。受此启发, Lutolf等[4]用MMPs敏感肽交联聚乙二醇(PEG)制备PEG凝胶, 再将RGD连接到凝胶上构建细胞支架。该凝胶支架兼具细胞黏附因子RGD及MMPs敏感性。依靠RGD介导及MMPs的酶解作用, 人纤维母细胞能够吸附并侵入凝胶内部, 体内研究表明负载骨形成蛋白BMP-2的凝胶支架具有良好的骨修复作用。Kim等[5]将RGD修饰的透明质酸用MMPs敏感肽交联制备凝胶支架, 更好地仿生了ECM的功能, 因为透明质酸是ECM中的主要成分, 它存在于迁移细胞的周围, 能够抑制细胞间的黏附, 促进细胞迁移。Lei等[6]考察了小鼠间充质干细胞在上述凝胶支架中的生长情况, 结果表明MMPs敏感性及RGD的存在有利于细胞在支架中的迁移、生长和增殖。
细胞穿膜肽TAT (transcriptional activator protein)具有高效的入胞能力, 能够迅速破坏内吞体膜, 逃逸溶酶体。TAT已经成功携带多种生物活性物质及载体, 包括蛋白质、DNA、多肽、纳米粒和脂质体等进行细胞内传输, 是一种新型而高效的药物递送工具[7, 8]。利用TAT修饰非病毒载体可以实现高效的基因转染。Torchilin等[9]用TAT修饰负载DNA的脂质体, 构建TAT-liposome-DNA复合物, 其对鼠NIH/3T3成纤维母细胞和H9C2心肌细胞的转染效率显著高于未经TAT修饰的DNA脂质体。
本文率先提出构建一种新型的“细胞外基质仿生型基因活化支架”(ECM-mimicking-GAM, ECM-m-GAM):用TAT修饰脂质体作为高效的基因转染载体, 将其与RGD修饰的透明质酸混合, 加入交联剂MMPs敏感肽(HS-MMP-SH)使透明质酸凝胶化, 得到脂质体/凝胶复合系统。从而将具有高效转染能力的TAT脂质体、细胞黏附因子RGD和对细胞分泌酶MMPs敏感的交联链整合到同一个结构(透明质酸凝胶)中, 完成ECM-m-GAM的构建。本文将优化并报道该支架的制备方法, 表征其表面形态和机械性能, 评价其对DNA复合物的负载及MMPs敏感性释放行为, 为细胞转染及组织修复研究奠定基础。
材料与方法 主要仪器纳米粒径电位分析仪(Zetasizer Nano ZS90, 英国Malvern Instrument公司); 透射电镜(Tecnai 12, 荷兰Philips公司); 核磁共振光谱仪(AVANCEⅡ, 瑞士Bruker公司); 扫描电子显微镜(S-4800, 日本Hitachi公司); 旋转流变仪(RS600, 美国Thervno公司); 荧光显微镜(DMLB2, 德国LEICA公司); 多功能微孔板检测仪(Synergy HT, 美国BioTek公司)。
材料与试剂胆固醇(上海艾韦特医药科技有限公司); (2, 3-二油酰基-丙基)-三甲胺(DOTAP, 德国Lipoid公司); 鱼精蛋白(PRO)、胶原酶(Sigma公司); 绿色荧光蛋白质粒(pEGFP-N1, 南京钟鼎生物技术有限公司); 透明质酸(HA, 华熙福瑞达生物医药有限公司); 1-乙基-3-(3-二甲氨基丙基)碳化二亚胺(EDC)、己二酸二酰肼(ADH)、三乙醇胺(TEA) (上海阿拉丁试剂公司); N-丙烯酰氧基琥珀酰亚胺(NHS-AC, 上海TCI试剂公司); TAT肽(CYGRKKR RQRRR)、RGD肽(GCGYGRGDSPG)、MMPs敏感性多肽HS-MMP-SH (GCRDGPQGIWGQDRCG) (南京金斯瑞生物科技有限公司); 肝素、Triton (上海生工生物工程股份有限公司); 1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[maleimide(polyethylene glycol)-2000], (DSPE-PEG-MAL, Avanti Polar Lipids, Inc.); DSPE-PEG-TAT (本实验室合成); TE缓冲液、PicoGreen dsDNA定量试剂盒(上海翊圣生物科技有限公司); 大鼠骨髓间充质干细胞(BMSCs, 本实验室分离提取); 胎牛血清、LG-DMEM培养基、青霉素-链霉素双抗和胰蛋白酶(Gibco公司)。
TAT-LPD的制备与表征TAT-LPD的制备分成4步:首先, 制备空白阳离子脂质体。按照DOTAP:胆固醇=1:1的比例将两者溶解在氯仿中, 薄膜分散法制备脂质体, 适量HEPES (10 mmol·L-1, pH 7.4)水合, 使最终的脂质浓度为10 mmol·L-1, 超声3~5 min, 采用Extruder使脂质体过0.4 μm的膜11次, 再过0.1 μm的膜11次, 制备粒径小而分布均匀的阳离子脂质体, 4 ℃保存, 备用。第二步, 制备PRO/DNA复合物。精确称取一定量鱼精蛋白(PRO), 溶于HEPES (10 mmol·L-1, pH 7.4)中, 配成质量浓度为1 mg·mL-1 PRO溶液。将PRO和DNA (质粒pEGFP-N1)按照不同比例(w/w)涡旋混合, 室温静置20 min, 得PRO/DNA纳米复合物, PRO和DNA的孵育比例用琼脂糖凝胶电泳进行优化。第三步, 将空白阳离子脂质体与PRO/DNA复合物涡旋混合(最终采用的比例是DOTAP:PRO:DNA=12 μmol:0.6 μg:1 μg), 室温静置30 min, 即得脂质-聚阳离子-DNA复合物(liposome-polycation-DNA complex, LPD)。最后, 将LPD与不同用量的DSPE-PEG-TAT涡旋混合(DSPE-PEG-TAT的用量为LPD脂质总量的5%、10%和20%), 50~60 ℃孵育10 min, 冷至室温, 制备不同含量DSPE-PEG-TAT修饰的LPD (即TAT-LPD)。
LPD及不同比例DSPE-PEG-TAT修饰的LPD的粒径与电位由纳米粒径电位分析仪测量; 10% DSPE-PEG-TAT修饰的LPD经醋酸双氧铀负染15 s, 透射电镜观察。
透明质酸-丙烯酸酯(HA-AC)的合成称取0.5 g透明质酸(HA, MW 42 kDa)溶于50 mL去离子水, 加入EDC 1 g和ADH 9 g, 溶解完全后将体系的pH值调为4.8, 室温反应12 h, 去离子水透析1周(MWCO 8 000~14 000), 冻干, 得HA-ADH。将HA-ADH溶于50 mL HEPES缓冲液(10 mmol·L-1, pH 7.2)中, 加入0.4 g NHS-AC, 反应12 h, 去离子水透析1周(MWCO 8 000~14 000), 冻干, 即得HA-AC, 核磁共振进行表征。
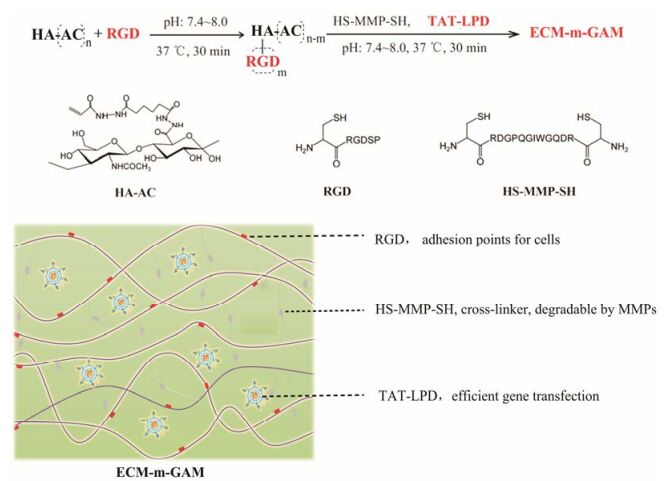
ECM-m-GAM的制备精密称取一定量的RGD溶于0.3 mol·L-1 TEA缓冲液(pH 8.0)中, 配成质量浓度为10 μg·μL-1的RGD溶液, -20 ℃保存。称取HA-AC 20 mg, 溶于0.3 mol·L-1 TEA缓冲液(pH 8.0) 300 μL中, 加入上述RGD溶液5 μL, 混匀, 反应30 min。按上述TAT-LPD的制备方法制备含15 μg DNA的TAT-LPD。称取HS-MMP-SH 7 mg, 溶于0.3 mol·L-1 TEA缓冲液(pH 8.0) 30 μL中。将TAT-LPD和HS-MMP-SH溶液均加入HA-RGD的反应体系中, 补充适量TEA缓冲液使体系的最终体积为500 μL, 混匀, 37 ℃反应30 min成凝胶, 即得ECM-m-GAM, 其中HA-AC用量为4%, RGD终浓度为100 μmol·L-1, DNA浓度为3%。制备示意图见图 1。
|
Figure 1 Schematic illustration of ECM-m-GAM formation. Hyaluronic acid-acrylate (HA-AC) was first modified with RGD peptides using Michael type addition. The residual acrylate groups were then crosslinked using MMP degradable peptides (HS-MMP-SH) in the presence of TAT-LPD nanoparticles. As a result, the cell adhesion factor RGD, MMPs sensitive substrate and efficient gene transfer vector TAT-LPD were all integrated in the hyaluronic acid hydrogel, which was named as ECM-m-GAM. RGD: Arg-Gly-Asp; MMP: Matrix metalloproteinase; TAT: Transcriptional activator protein; TAT-LPD: TAT functioned liposome-polycation-DNA complex |
取适量真空冷冻干燥后GAM, 置于载物台上, 喷金, 扫描电子显微镜观察形貌; 按照ECM-m-GAM的制备方法, 同法制备HA-AC用量为3%的GAM, 旋转流变仪测定两者的弹性模量(G')与黏性模量(G''), 测量参数为应变力0.03、频率范围0.01~1.5 rad·s-1。为了观察TAT-LPD在GAM中的分布, 用特异性的核酸染料Gel-Red对GAM中的质粒DNA进行染色, 然后用荧光显微镜观察。
ECM-m-GAM的MMPs敏感性释放为了评价ECM-m-GAM的MMPs敏感性, 配制两种释放介质: PBS缓冲液(pH 7.4)和PBS缓冲液(pH 7.4, 含0.5 U·mL-1胶原酶)。将GAM分别浸泡在1 mL上述两种不同的释放介质中, 置于37 ℃恒温振荡箱中, 于不同时间点取出释放液800 μL, 并补充新鲜释放介质。
将各时间点取出的释放液50 μL分别置于2 mL EP管中, 每管加入50 μL预先配制的含有肝素(10 mg·mL-1)和1% Triton的TE缓冲液, 涡旋混匀, 放置15 min, 使DNA与磷脂及PRO充分分离, 然后用PicoGreen dsDNA定量试剂盒检测各个时间点DNA的释放情况, 绘制释放曲线。
为了观察释放液中DNA是否仍以纳米复合物的形式存在, 用Gel-Red负染GAM中的DNA, 然后将负染后的GAM浸泡在1 mL PBS缓冲液(pH 7.4, 含0.5 U·mL-1胶原酶)中, 37 ℃恒温振荡12 h, 取适量释放液滴于载玻片上, 用荧光显微镜观察。
ECM-m-GAM体外转染能力的评价取生长旺盛的第3代BMSCs, 弃去培养基, 胰蛋白酶消化, 轻轻吹打细胞至完全脱落并分散后, 离心弃去上清液, 加适量培养液吹散所得细胞。按照1×105个细胞/孔接种于24孔板, 加不含抗生素的完全培养基(10%胎牛血清+ LG-DMEM培养液), 于37 ℃、5%二氧化碳环境下培养。次日, 待贴壁后, 换不含抗生素的完全培养基, 于每孔加入已制备的ECM-m-GAM (含pEGFP-N1质粒), 37 ℃、5%二氧化碳环境下继续培养3天, 弃去培养基并去除支架, 于荧光显微镜下观察[10]。
结果 1 TAT-LPD的制备与表征鱼精蛋白(PRO)是一种正电性的天然高分子材料, 具有很好的生物相容性, 可作为良好的基因载体, 脂质-鱼精蛋白-DNA复合物(LPD)已有多篇文献报道[11, 12]。本课题组将PRO与质粒DNA按一定比例混合, 形成一个呈负电性的PRO/DNA复合物(polyplex), 然后再依靠静电作用使其与DOTAP阳离子脂质体结合, 从而完成对DNA的包裹与压缩, 最后将DSPE-PEG-TAT插入到脂质层中, 完成TAT-LPD的构建。
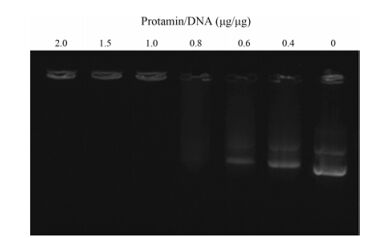
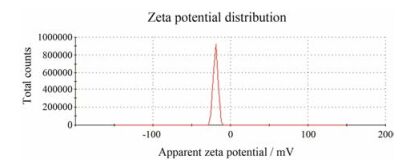
首先, 利用琼脂糖凝胶电泳研究不同比例的PRO与质粒DNA复合后的电泳情况, 结果见图 2, 由图可见, 随着PRO与DNA比例的增加, DNA的条带越来越不明显, 当达到1:1时DNA完全滞留在加样槽中, 说明游离DNA被完全压缩在PRO中, 这时polyplex呈现正电性。然而, 为了下一步polyplex能够与阳离子脂质体顺利结合, 需要polyplex既结合较多的DNA, 又带一定的负电。根据电泳结果, 优选出合适的制备比例为PRO:DNA = 0.6:1, 此时能看到较浅的条带, 说明DNA被部分包裹, polyplex仍带负电, zeta电位测定结果为(-19.2 ± 2.8), 见图 3, 其显著的负电性为阳离子脂质的结合提供了基础。
|
Figure 2 Gel electrophoresis of polyplex prepared with different protamin/DNA ratios |
|
Figure 3 Zeta-potential of polyplex prepared with PRO:DNA = 0.6:1 |
然后, 将DOTAP阳离子脂质体与polyplex按一定比例混合孵育(DOTAP:PRO:DNA = 12 μmol:0.6 μg:1 μg), 静电作用能够使两者顺利地结合在一起形成复合物LPD。由表 1可知, LPD的电位为(31.2 ± 7.93) mV、粒径为(203.8 ± 1.53) nm, 相比于polyplex, 电位发生反转, 粒径明显减小, 表明正电性的DOTAP脂质顺利吸附在polyplex表面, 并最终完成了对DNA的包裹与压缩, 形成稳定的DNA脂质纳米复合物LPD。
| Table 1 Zeta-potential and size of polyplex and LPD nanoparticles with different percentage of DSPE-PEG-TAT (1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-polyethylene glycol-TAT) |
最后, 采用后期孵育(post-insertation)的方法将DSPE-PEG-TAT插入到LPD的脂质层, 完成TAT-LPD的制备。这个方法的具体过程是DSPE-PEG-TAT分散于水中形成胶束, 将DSPE-PEG-TAT胶束和已经制备好的LPD粒子在一定温度(50 ℃)下孵育一定时间(10~40 min), 组成胶束的DSPE-PEG-TAT分子将自动转移到LPD脂质双层中, 因此也被称作胶束转移法[13]。胶束转移法已被Kanda等[14-16]用于将脂质分子插入到脂质体中, 过程简单易于操作。
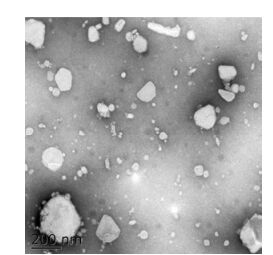
DSPE-PEG-TAT不同用量制备的TAT-LPD的粒径及电位情况, 结果见表 1。从表中可以发现, 随着DSPE-PEG-TAT用量的增加, 其电性越来越低, 这是由于PEG2000在纳米粒表面的屏蔽作用[17]; 此外, 随着用量的增加, LPD的粒径也稍微增大, 这是由于LPD表面的PEG在水中伸展, 具有一定的空间位阻而引起的。上述电位与粒径的变化均表明DSPE-PEG-TAT成功地插入到LPD中, 形成了PEG化的LPD, 即TAT修饰的LPD (TAT-LPD)。DSPE-PEG-TAT用量为10%时, 制备的TAT-LPD用透射电镜进行表征, 结果见图 4, 可见制备的TAT-LPD具有较好的分散性, 粒径在200 nm左右, 与粒径测定结果一致。
|
Figure 4 TEM image of TAT-LPD nanoparticles (10% DSPE-PEG-TAT) |
以透明质酸为骨架, 通过两步法合成了HA-AC, 并用核磁共振进行表征(图 5)。由图可知, 相比于HA, HA-AC在δ 6.2有明显的多重峰, 这应归属于丙烯酸酯基团中的顺式(cis)和反式(trans)氢, 1H NMR结果表明丙烯酸酯已成功连接在透明质酸骨架上。通过δ 6.2峰积分与δ 1.88峰积分的比值可以得出, 丙烯酸酯接枝率约为16%[18]。

|
Figure 5 1H NMR spectrum of HA-AC and HA in D2O |
利用丙烯酸酯(-AC)能够与巯基(-SH)发生迈克尔加成反应, 先将RGD上的巯基与HA骨架上的-AC基团反应, 使RGD连接在HA骨架上, 得到HA-RGD, 再向其中加入TAT-LPD和HS-MMP-SH, 混匀, 并在37 ℃孵育30 min, 利用HS-MMP-SH两端的巯基与HA骨架上剩余的-AC基团反应, 使HA产生交联和凝胶化, 在凝胶化的过程中实现对TAT-LPD的负载, 从而完成脂质体/凝胶复合型基因活化支架的构建。如图 6A所示, ECM-m-GAM呈透明的半固体状(inset), SEM电镜下可见明显的多孔网状交联结构, 表现出典型的凝胶结构特征。

|
Figure 6 SEM image of ECM-m-GAM. The inset shows macroscopic GAM (A). TAT-LPD were stained with Gel-Red post-hydrogel formation and imaged with a fluorescence microscope (B) |
凝胶支架对DNA的负载通过荧光显微镜进行表征, 将ECM-m-GAM用特异性的核酸染料Gel-Red负染后进行观察, 结果见图 6B。由图可见, 凝胶中存在大量呈颗粒状分布的被染成红色的DNA, 这与文献报道的非常一致[19], 表明DNA是以纳米粒形式(TAT-LPD)存在的, ECM-m-GAM成功实现了对TAT-LPD的负载。
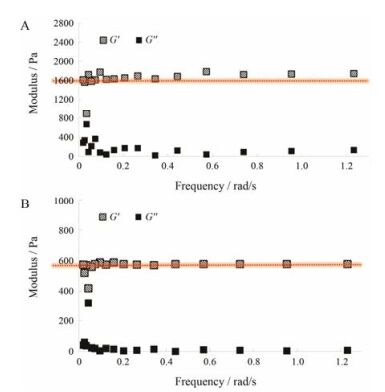
ECM-m-GAM的机械性能利用旋转流变仪进行测定, 结果见图 7。由图可以看出, 不管HA-AC的用量是3%还是4%, 支架的弹性模量(G')始终高于黏性模量(G''), 表明HA-AC用量为3%或4%时均形成了凝胶。此外, 3% HA-AC制备的GAM的弹性模量约为600 Pa, 而4% HA-AC制备的GAM的弹性模量约为1 600 Pa, 说明4% HA-AC制备的GAM具有更高的机械强度, 更适用于支架植入和组织修复, 这与文献报道一致[19]。由此可见, 可以调整HA-AC的用量来控制ECM-m-GAM的机械性能以满足组织修复时对支架机械强度的要求。本研究中, 选用4% HA-AC来制备支架。
|
Figure 7 The elastic (G') and viscous (G'') modulus of ECM-m-GAM. GAM prepared with 4% HA-AC (A); GAM prepared with 3% HA-AC (B) |
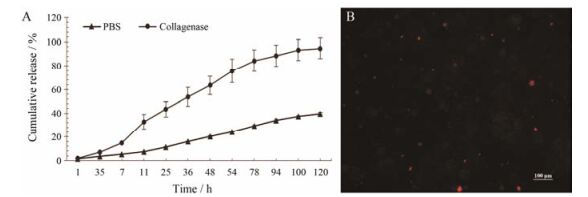
首先, 为了评价ECM-m-GAM的MMPs敏感性, 配制了两种释放介质: PBS缓冲液(pH 7.4)、PBS缓冲液(pH 7.4, 含0.5 U·mL-1胶原酶), DNA的释放曲线见图 8。由图 8A可见, PBS缓冲液体系中DNA的释放呈现明显的缓释行为, 这是由于凝胶的包载作用; 相反, PBS缓冲液(含0.5 U·mL-1胶原酶)中DNA的释放快于PBS缓冲液, 表明ECM-m-GAM具有明显的MMPs敏感性, 这是由于ECM-m-GAM是通过MMPs敏感性多肽HS-MMP-SH将HA交联在一起, 而HS-MMP-SH能够被胶原酶快速断裂, 从而使ECM-m-GAM逐步降解, 最终使DNA快速释放出来。为了证明释放的DNA仍以纳米复合物的形式存在, 作者又将Gel-Red负染后的GAM浸泡在1 mL PBS缓冲液(pH 7.4, 含0.5 U·mL-1胶原酶)中释放12 h, 释放液用荧光显微镜观察。由图 8B可见, 释放液与ECM-m-GAM的观察结果类似, 仍然存在大量呈颗粒状分布的被染成红色的DNA, 表明释放的DNA仍以纳米粒的形式存在, 这将为以后的细胞转染研究奠定基础。
|
Figure 8 DNA release from ECM-m-GAM incubated in PBS (pH 7.4) and PBS (pH 7.4, 0.5 U·mL-1 collagenase) release solutions (A). The released DNA from Gel-Red stained GAM was imaged with a fluorescence microscope (B) |
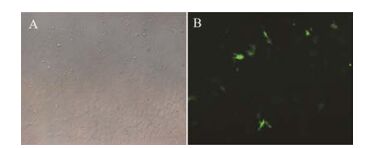
为了进一步证明释放的DNA纳米粒具有转染能力, 考察了负载pEGFP-N1质粒的ECM-m-GAM对BMSCs的转染效果。结果显示, 转染3天去除支架后, 显微镜下观察可见细胞呈单层贴壁生长, 形态呈典型多角形, 细胞生长状态良好(图 9A)。荧光显微镜下观察到部分细胞呈现绿色(图 9B), 说明有绿色荧光蛋白EGFP的表达, 表明从ECM-m-GAM中释放的DNA粒子能够对周围细胞进行转染, 使细胞表达DNA所编码的蛋白, 证明ECM-m-GAM具备作为转染支架的可行性。
|
Figure 9 Bone marrow mesenchymal stem cells (BMSCs) (A) and the expression of enhanced green fluorescent protein (EGFP) in BMSCs (B) after co-cultured with ECM-m-GAM for 3 days (×100) |
GAM技术是综合了组织工程学技术和基因治疗理论的新兴技术, 在组织工程的应用方面具有独特的优势: ①质粒DNA制备技术成熟、稳定性好、价格明显低于纯化的重组生长因子, 且较少量即可转染相当数量的细胞, 降低了成本; ②被转染成功的细胞能在一定时期内持续表达并分泌DNA所编码的生长因子, 有利于克服生长因子半衰期短, 价格昂贵的缺陷; ③目前组织工程常用的基因治疗是预先在体外将种子细胞进行基因转染, 然后再将转染后的细胞植入组织缺损区域。这种方法需要进行种子细胞的分离、培养和转染等步骤, 耗时耗力, 增加成本, GAM可直接移植到缺损区域, 通过对缺损区域细胞的原位转染, 实现生长因子的表达。
本文首先构建TAT修饰的脂质体基因载体(TAT-LPD)并进行表征, 然后用RGD修饰透明质酸, 并与TAT-LPD混合均匀, 在交联剂HS-MMP-SH的作用下使透明质酸凝胶化, 得到内部包载TAT-LPD的MMPs敏感肽交联的RGD-透明质酸凝胶, 完成了ECM-m-GAM的构建。扫描电镜证实ECM-m-GAM具有典型的凝胶结构, 旋转流变仪测定弹性模量和储能模量, 表明ECM-m-GAM具有良好的机械性能, 可以作为组织工程的支架。最后, 建立体外释放模型, 考察ECM-m-GAM在不同释放介质中的释放行为, 证明其具有MMPs敏感性, 此外, 结果表明释放液中DNA仍以纳米复合物的形式存在, 提示释放后的DNA粒子仍然具备LPD的转染能力。为了验证这一推论, 考察了负载pEGFP-N1质粒的ECM-m-GAM对BMSCs的转染效果, 结果显示GAM能够转染BMSCs细胞并使其表达绿色荧光蛋白, 从而直接证明了释放后DNA纳米粒的转染能力, 为ECM-m-GAM的细胞转染和组织修复研究提供了依据。需要提出的是, 本研究尚处于起始阶段, 本文更侧重于包载TAT-LPD的ECM-m-GAM的设计、构建与表征, 而TAT的引入对转染效率的影响及RGD的引入对细胞增殖的影响等将是作者下一步研究的主要内容。
ECM-m-GAM能够将以下功能有机地整合到一起: RGD作为细胞黏附的识别位点, 促进细胞在支架中的附着, 这是细胞在支架中增殖与分化的前提; 细胞在迁移和增殖的过程中分泌MMPs, 使凝胶降解, 一方面为细胞自身的迁移和增殖创造空间, 避免凝胶的网状结构成为细胞迁移和增殖的物理屏障; 另一方面释放出TAT-LPD。由于细胞穿膜肽TAT高效的入胞及溶酶体逃逸能力, 释放出的TAT-LPD将对周围细胞进行高效地原位转染, 从而表达并分泌生长因子, 促进组织修复与再生。这些功能环环相扣、相互促进, 为解决目前基因活化支架仿生性能不足、基因难以控释和转染效率低等问题提供切实可行的方法。
| [1] | Evans CH. Gene delivery to bone[J]. Adv Drug Deliv Rev, 2012, 64: 1331–1340. DOI:10.1016/j.addr.2012.03.013 |
| [2] | Tierney EG, Duffy GP, Cryan SA, et al. Non-viral gene-activated matrices:next generation constructs for bone repair[J]. Organogenesis, 2013, 9: 22–28. DOI:10.4161/org.24329 |
| [3] | Tierney EG, Duffy GP, Hibbitts AJ, et al. The development of non-viral gene-activated matrices for bone regeneration using polyethyleneimine (PEI) and collagen-based scaffolds[J]. J Control Release, 2012, 158: 304–311. DOI:10.1016/j.jconrel.2011.11.026 |
| [4] | Lutolf MP, Lauer-Fields JL, Schmoekel HG, et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration:engineering cell-invasion characteristics[J]. Proc Natl Acad Sci U S A, 2003, 100: 5413–5418. DOI:10.1073/pnas.0737381100 |
| [5] | Kim J, Park Y, Tae G, et al. Synthesis and characterization of matrix metalloprotease sensitive-low molecular weight hyaluronic acid based hydrogels[J]. J Mater Sci Mater Med, 2008, 19: 3311–3318. DOI:10.1007/s10856-008-3469-3 |
| [6] | Lei YG, Gojgini S, Lam J, et al. The spreading, migration and proliferation of mouse mesenchymal stem cells cultured inside hyaluronic acid hydrogels[J]. Biomaterials, 2011, 32: 39–47. DOI:10.1016/j.biomaterials.2010.08.103 |
| [7] | Torchilin VP. Tat peptide-mediated intracellular delivery of pharmaceutical nanocarriers[J]. Adv Drug Deliv Rev, 2008, 60: 548–558. DOI:10.1016/j.addr.2007.10.008 |
| [8] | Fan B, Jin MJ, Huang W, et al. The development of cell-penetrating peptides in drug delivery system[J]. Acta Pharm Sin (药学学报), 2016, 51: 264–271. |
| [9] | Torchilin VP, Levchenko TS, Rammohan R, et al. Cell transfection in vitro and in vivo with nontoxic TAT peptide-liposome-DNA complexes[J]. Proc Natl Acad Sci U S A, 2003, 100: 1972–1977. DOI:10.1073/pnas.0435906100 |
| [10] | Bao TW. Fabrication and Evaluation of PAMAM Dendrimers Complexed rhBMP-2 Gene Activated Matrix for Bone Regeneration (PAMAM树状分子复合rhBMP-2基因活性基质的构建及其骨再生研究)[D]. Hangzhou: Zhejiang University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10335-1012369502.htm |
| [11] | Ma K, Wang DD, Lin Y, et al. Synergetic targeted delivery of sleeping-beauty transposon system to mesenchymal stem cells using LPD nanoparticles modified with a phage-displayed targeting peptide[J]. Adv Funct Mater, 2013, 23: 1172–1181. DOI:10.1002/adfm.v23.9 |
| [12] | Li SD, Huang L. Targeted delivery of antisense oligodeoxynucleotide and small interference RNA into lung cancer cells[J]. Mol Pharm, 2006, 3: 579–588. DOI:10.1021/mp060039w |
| [13] | Bai J. The study of Cationic Lipid Based Gene Delivery System Lipid-mu Peptide-DNA (阳离子脂质基因载体Lipid-mu peptide-DNA的研究)[D]. Shanghai: Shanghai Jiao Tong University, 2012. http://cdmd.cnki.com.cn/article/cdmd-10248-1014008344.htm |
| [14] | Kanda S, Inoue K, Nojima S, et al. Incorporation of a ganglioside and spin-labeled ganglioside analogue into cell and liposomal membranes[J]. J Biochem, 1982, 91: 2095–2098. DOI:10.1093/oxfordjournals.jbchem.a133904 |
| [15] | Uster PS, Allen TM, Daniel BE, et al. Insertion of poly (ethylene glycol) derivatized phospholipid into pre-formed liposomes results in prolonged in vivo circulation time[J]. FEBS Lett, 1996, 386: 243–246. DOI:10.1016/0014-5793(96)00452-8 |
| [16] | Chen Y, Sen J, Bathula SR, et al. Novel cationic lipid that delivers siRNA and enhances therapeutic effect in lung cancer cells[J]. Mol Pharm, 2009, 6: 696–705. DOI:10.1021/mp800136v |
| [17] | Zhang L, Wang Y, Gao HL, et al. The construction of cell-penetrating peptide R8 and pH sensitive cleavable polye-thylene glycols co-modified liposomes[J]. Acta Pharm Sin (药学学报), 2015, 50: 760–766. |
| [18] | Tokatlian T, Cam C, Segura T. Non-viral DNA delivery from porous hyaluronic acid hydrogels in mice[J]. Biomaterials, 2014, 35: 825–835. DOI:10.1016/j.biomaterials.2013.10.014 |
| [19] | Gojgini S, Tokatlian T, Segura T. Utilizing cell-matrix interactions to modulate gene transfer to stem cells inside hyaluronic acid hydrogels[J]. Mol Pharm, 2011, 8: 1582–1591. DOI:10.1021/mp200171d |
 2017, Vol. 52
2017, Vol. 52


