新精神活性物质又称为“合法兴奋剂”和“策划药物”, 它可以产生类似列管毒品的麻醉、兴奋和致幻作用。合成大麻素是目前全球滥用最为严重的新精神活性物质, 它可以产生类似天然大麻素的结合和激动大麻素受体CB1和CB2的药效, 产生类似于天然大麻素的成瘾性和戒断症状。5F-AMB (图 1)为吲唑-3-甲酰胺类合成大麻素类新精神活性物质, 是5F-AB-PINACA的结构衍生物[1, 2], 早于2014年就在日本网上非法贩卖的香草产品中被检出[3]。相关致死案例报道在脂肪组织和股血中均可检测到5F-AMB[4, 5], 然而因合成大麻素的广泛代谢性致其母药在尿液中罕见[6-9], 故尿液中代谢物的鉴定对临床和法庭分析起着至关重要的作用。本研究旨在通过体外人肝微粒体模型模拟人体代谢环境从而确定5F-AMB的I相代谢物及代谢途径, 以填补国内有关其药理学、毒理学、安全性及代谢相关数据信息的空白, 从而为临床和法庭鉴定的尿液检测提供潜在的标志物。

|
Figure 1 Chemical structure of 5F-AMB |
待分析物5F-AMB (C19H26FN3O3: m/z 363.195 82, 由国家毒品实验室缴获物纯化)。D-葡萄糖-6-磷酸二钠盐水合物、β-烟酰胺腺嘌呤二核苷酸磷酸(NADP)钠盐水合物和葡萄糖-6-磷酸脱氢酶(G-6-PDH) (德国Sigma Aldrich公司)。混合男性肝微粒体(pHLM; 蛋白浓度, 20 mg·mL-1, 北京iPhase生物科技有限公司)。微粒体送达后于37 ℃解冻、分装、储存于-80 ℃直至使用。
液质级乙腈、甲醇和甲酸(德国Merck); 超纯水(德国Merck公司的Milli-Q Advantage A10自动蒸馏水机制备)。其他所有试剂和溶剂均为分析纯并未再进一步净化。
色谱及质谱条件超高压液相色谱系统(Thermo Scientific Dionex Ultimate 3000 RSLC)串联带有热电离喷雾离子化源(HESI)的Q Exactive Plus质谱(美国)。色谱柱为ACQUITY UPLC® HSS T3色谱柱(100 mm × 2.1 mm, 1.8 μm), 柱温为35 ℃; 流动相为乙腈(B)-0.1% (v/v)甲酸水(A)溶液, 梯度洗脱, 流速和程序如下: 0.0~7.0 min, 70% A~40% A; 7.0~7.2 min, 40% A~10% A; 7.2~9.0 min保持10% A; 9.0~9.1 min, 10% A~70% A; 9.1~12.0 min保持70% A, 流速持续保持在0.4 mL·min-1。仪器在使用前进行正离子模式下的质量校准。离子源条件如下:离子传输毛细管温度, 350 ℃; 辅气加热温度, 350 ℃; 鞘气流速, 35 AUs; 辅气流速, 10 AUs; 喷雾电压, 3.50 kV, S-透镜RF水平, 60.0。MS采用正离子全扫描模式, 并选取特定质荷比的代谢物母离子作为目标物进行二级质谱分析。代谢物的准确分子量通过软件Thermo MetWorks 1.3 SP4.200版本计算得出。全扫描数据采集参数设置如下:分辨率, 70 000;自动增益控制(AGC), 1.0×106; 最大注射时间(IT), 100 ms; 扫描范围, m/z 70~1050。目标离子的二级参数设置如下:分辨率, 17 500;目标物AGC, 5.0×105; 最大IT, 50 ms; 分离窗, m/z 0.6;正态碰撞能量, 20%、40%、60%。
体外人肝微粒体代谢模型的制备与代谢物分析将5F-AMB溶于甲醇制备成5 mmol·L-1的溶液, 吸取1 μL与新鲜配制的NADPH再生系统溶液(终体积: 200 μL, 由100 mmol·L-1磷酸盐缓冲液(pH 7.4), 1.3 mmol·L-1 NADP+, 3.3 mmol·L-1 G-6-P, 0.4 U·mL-1 G-6-PDH, 3.3 mmol·L-1 Mg2+, 1 mg·mL-1微粒体蛋白组成)。反应由预孵育的再生系统(3.3 mmol·L-1 Mg2+, 1.3 mmol·L-1 NADP+, 3.3 mmol·L-1 G-6-P, 0.4 U·mL-1 G-6-PDH)的加入启动, 混合物在37 ℃孵育1 h。之后, 加入乙腈200 μL, 并将溶液于14 000 ×g离心10 min。然后吸取100 μL上清将其转移入玻璃进样瓶中, 进样量5 μL。利用TF软件Xcalibur Qual Browser 4.0.27.10版本进行系统控制和数据采集。
将空白溶液和未加母药的孵育反应系统溶液作为对照同样进行分析。合成大麻素5F-AMB在未加入微粒体的孵育体系中的稳定性研究同样被进行(37 ℃, 1 h)以确证代谢物由微粒体的引入而生成。
结果实验共发现5F-AMB的9种体外代谢物, 5F-AMB的保留时间为8.24 min, 9种代谢物的保留时间在3.49~6.29 min之间, 检测误差均在2.0 ppm以内(图 2, 图 3, 表 1), 分别为烷基链羟化代谢物1种(M1)、酯键水解合并烷基链羟化代谢物3种(M2~M4)、酯键水解合并吲唑环羟化代谢物1种(M5)、酯键水解代谢物1种(M6)、酯键水解合并脱氟氧化代谢物1种(M7)、酯键水解合并脱氟氧化羧化代谢物1种(M8)、脱氟氧化至戊酸代谢物1种(M9)。羟化发生在烷基链的代谢物共4种(M1~M4), 发生在吲唑环的代谢物共1种(M5)、发生在戊烷基链的代谢物共计2种(M1、M2)、发生在丁烷基侧链部分的代谢物共计2种(M3、M4)。由羟化代谢发生的位点、数目及峰面积上来看, 羟化代谢反应优先发生在戊烷基链, 其次是吲唑环, 再次是丁烷基侧链部分, 羟化的目的是使分子极性增大, 更有利于体内通过代谢后排出体外。图 2为母药5F-AMB及其所有代谢物的提取离子峰色谱图。图 3阐释了所有代谢物的特征碎片离子及碎裂途径。根据提取离子色谱峰的峰面积, 主要代谢物为酯键水解、酯键水解合并脱氟氧化、酯键水解合并戊烷基链羟化和酯键水解合并吲唑环羟化代谢物。表 1总结了孵育1 h后所有代谢物的代谢反应类型、保留时间、母离子的准确质量数[M+H]+ (m/z)、实际质量数[M+H]+ (m/z)、质量误差、分子式、离子碎片和峰面积。代谢物被标记为“M”, 代谢反应途径由图 4所示。
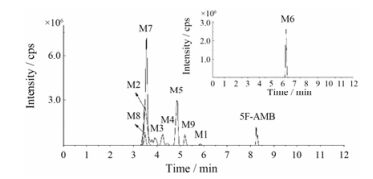
|
Figure 2 Combined extracted ion chromatograms of 5F-AMB and metabolites (M1-M9) identified in human liver microsomes |
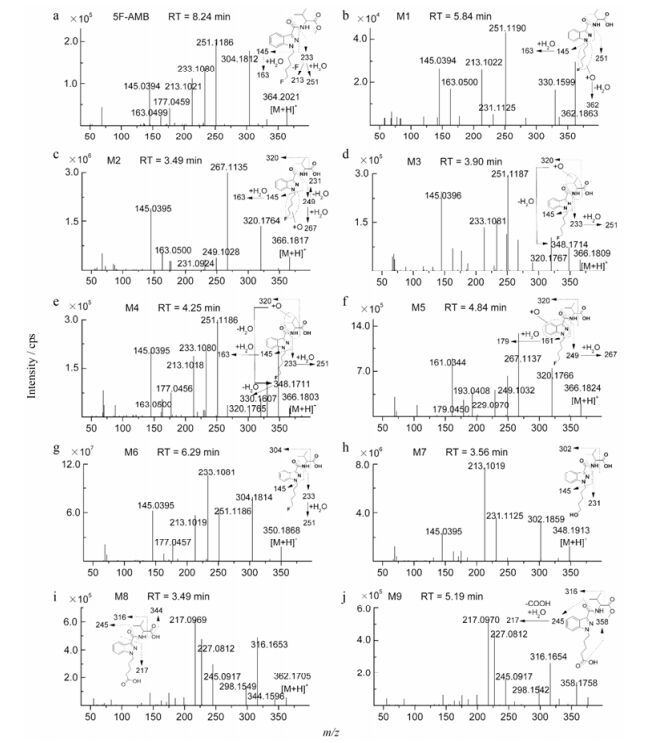
|
Figure 3 Product ion mass spectra and assigned fragmentation patterns for 5F-AMB (a) and all metabolites (b-j) that were identified after human liver microsomes incubation. Markush bond indicates unassigned metabolic position |
| Table 1 Identification of 5F-AMB metabolites after 1 h incubation with human liver microsomes. NA: Not applicable |
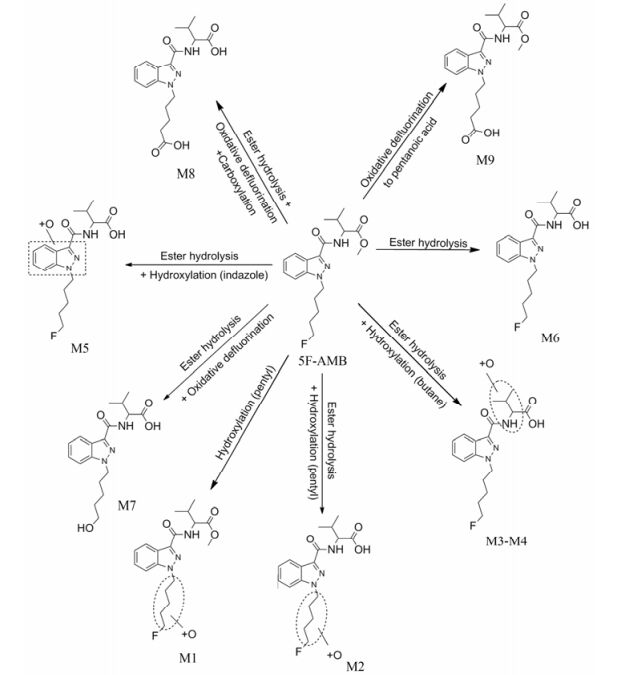
|
Figure 4 Proposed metabolic pathways of 5F-AMB in human liver microsomes. Unassigned metabolic positions are depicted as Markush structures |
5F-AMB的代谢稳定性研究结果显示其半衰期短清除率高, 表明其代谢稳定性低, 在体内会被迅速代谢[10]。从代谢产物的提取离子色谱图峰面积得知, 5F-AMB以酯键水解、酯键水解合并脱氟氧化、酯键水解合并戊烷基链羟化和酯键水解合并吲唑环羟化代谢物为主, 其中酯水解代谢物M6是最主要的代谢产物, 拟下一步制备该代谢物的对照品加以证实。本实验发现孵育时间为1 h时, 肝微粒体体外模型生成了未在肝细胞体外模型中发现的F6 (其对应M3前的小峰, 经进一步通过二级质谱确认M3前的小峰其质谱碎裂规律同M2, 故证实羟化位点也发生在了戊烷基链)、F10及F15, 但并未发现文献[10]中报道的结合葡萄糖醛酸的Ⅱ相代谢产物(F1~F3、F8、F11、F12)。本研究建立了有效的肝微粒体体外代谢模型基质中新型毒品5F-AMB代谢物的LC-MS/MS检测方法, 并发现了体外实验中肝微粒体和肝细胞代谢模型的差异性。该方法简便快捷, 但仍需进一步收集分析真实尿样并与其中的代谢物加以对比筛查后确定最终代谢标志物, 为临床和法庭案例中滥用此新精神活性物质的检测提供尿液标志物。
| [1] | Shevyrin V, Melkozerov V, Nevero A, et al. Identification and analytical characteristics of synthetic cannabinoids with an indazole-3-carboxamide structure bearing a N-1-methoxycarbonylalkyl group[J]. Anal Bioanal Chem, 2015, 407: 6301–6315. DOI:10.1007/s00216-015-8612-7 |
| [2] | Wohlfarth A, Castaneto MS, Zhu M, et al. Pentylindole/pentylindazole synthetic cannabinoids and their 5-fluoro analogs produce different primary metabolites:metabolite profiling for AB-PINACA and 5F-AB-PINACA[J]. AAPS J, 2015, 17: 660–677. DOI:10.1208/s12248-015-9721-0 |
| [3] | Uchiyama N, Shimokawa Y, Kawamura M, et al. Chemical analysis of a benzofuran derivative, 2-(2-ethylaminopropyl) benzofuran (2-EAPB), eight synthetic cannabinoids, five cathinone derivatives, and five other designer drugs newly detected in illegal products[J]. Forensic Toxicol, 2014, 32: 266–281. DOI:10.1007/s11419-014-0238-5 |
| [4] | Hasegawa K, Wurita A, Minakata K, et al. Postmortem dis-tribution of AB-CHMINACA, 5-fluoro-AMB, and di-phenidine in body fluids and solid tissues in a fatal poisoning case:usefulness of adipose tissue for detection of the drugs in unchanged forms[J]. Forensic Toxicol, 2015, 33: 45–53. DOI:10.1007/s11419-014-0245-6 |
| [5] | Hess C, Stockhausen S, Kernbach-Wighton G, et al. Death due to diabetic ketoacidosis:induction by the consumption of synthetic cannabinoids?[J]. Forensic Sci Int, 2015, 257: e6–11. DOI:10.1016/j.forsciint.2015.08.012 |
| [6] | Sobolevsky T, Prasolov I, Rodchenkov G. Detection of JWH-018 metabolites in smoking mixture post administration urine[J]. Forensic Sci Int, 2010, 200: 141–147. DOI:10.1016/j.forsciint.2010.04.003 |
| [7] | Scheidweiler KB, Jarvis MJ, Huestis MA. Nontargeted SWATH acquisition for identifying 47 synthetic cannabinoid metabolites in human urine by liquid chromatography high resolution tandem mass spectrometry[J]. Anal Bioanal Chem, 2015, 407: 883–897. DOI:10.1007/s00216-014-8118-8 |
| [8] | Castaneto MS, Wohlfarth A, Pang SK, et al. Identification of AB-FUBINACA metabolites in human hepatocytes and urine using high-resolution mass spectrometry[J]. Forensic Toxicol, 2015, 33: 295–310. DOI:10.1007/s11419-015-0275-8 |
| [9] | Chimalakonda KC, Seely KA, Bratton SM, et al. Cyto-chrome P450-mediated oxidative metabolism of abused synthetic cannabinoids found in K2/Spice:identification of novel cannabinoid receptor ligands[J]. Drug Metab Dispos, 2012, 40: 2174–2184. DOI:10.1124/dmd.112.047530 |
| [10] | Andersson M, Diao X, Wohlfarth A, et al. Metabolic profiling of new synthetic cannabinoids AMB and 5F-AMB by human hepatocyte and liver microsome incubations and high-resolution mass spectrometry[J]. Rapid Commun Mass Spectrom, 2016, 30: 1067–1078. DOI:10.1002/rcm.v30.8 |
 2017, Vol. 52
2017, Vol. 52


