番石榴Psidium guajava L.为桃金娘科Myrtaceae番石榴属Psidium植物。因其为重要的粮食作物和具有良好的药用价值[1], 故在热带和亚热带地区均有种植。此植物不同部位具有不同的药物用途, 如根和不成熟果实可治疗胃肠炎和腹泻[2]; 成熟果实可通便和除口臭[3]; 叶水提取液可作退热剂和解痉剂[4]; 树皮具止血功效[5]; 花蕊具有止咳作用等[6]; 种子具有较好抗肿瘤作用[7]。近年来, 国内外学者主要对番石榴叶及果实的化学成分进行了较深入的研究, 并报道了大量的黄酮、萜类及有机酸类等成分[8-10], 而有关其根部位的化学成分研究较少。作为从番石榴植物各个部位(包括果实、叶、皮、花及根)分离活性成分研究的一部分, 作者对番石榴根进行了系统的化学成分研究。此次报道从乙醇提取物的乙酸乙酯部分分离到7个乌苏烷型三萜化合物, 包括1个新化合物、5个首次在此植物中分离得到的化合物, 结构如图 1。并对新化合物进行了体外细胞毒活性测定, 结果显示较好的体外抑制人肝瘤细胞Bel 7402活性。
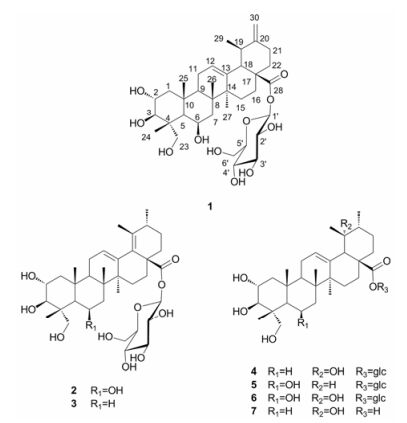
|
Figure 1 Structures of compounds 1-7 |
化合物1 白色无定形粉末(甲醇), [α]D25 -35.8 (c 0.026, MeOH); HR-ESI-MS准分子离子峰m/z: 665.389 6 [M+H]+ (计算值665.390 1, C36H56O11); 1H NMR和13C NMR数据见表 1。
| Table 1 NMR of compound 1 (600 MHz for 1H NMR, CD3OD; 150 MHz for 13C NMR, CD3OD) |
化合物1 10%硫酸乙醇显色为粉色, Liebermann-Burchard阳性反应, 提示化合物为三萜类化合物。HR-ESI-MS给出准分子离子峰m/z: 665.389 6 [M+ H]+ (计算值665.390 1, C36H56O11), 给出分子式为C36H56O11。1H NMR (表 1)显示, 4个单峰甲基信号: δH 1.06 (s, 3H, H-24)、1.40 (s, 3H, H-25)、1.09 (s, 3H, H-26)和1.16 (s, 3H, H-27); 1个双峰甲基信号: δH 1.03 (d, 3H, J = 6.5 Hz, H-29); 3个烯质子信号, 其中包括一对环外双键质子: δH 5.32~5.33 (m, 1H, H-12)、4.64 (br.s, 1H, H-30)和4.69 (br.s, 1H, H-30)。13C NMR (表 1)显示, 两组双键碳信号, 其中包括一对末端双键: δC 127.8 (C-12)、138.5 (C-13)、105.5 (C-20)和154.3 (C-30)。以上信息提示化合物1母核结构为具末端双键的12-烯-28-酸-乌苏烷型三萜[11, 12]。
对1H NMR和13C NMR分析, 化合物1具有一分子葡萄糖的结构单元[13]:糖端基质子信号δH 5.34 (d, 1H, J = 8.2 Hz, H-1'); 6个连氧碳信号δC 96.0、78.4、78.3、74.0、71.4和62.6。根据葡萄糖端基质子的偶合常数为8.2 Hz, 提示所连接的糖单元为β-葡萄糖。化合物1经酸水解, 气相色谱检测, 保留时间与β-D-葡萄糖对照品结果一致, 提示化合物所连接的糖为β-D-葡萄糖[14]。另外, 在1H NMR和13C NMR谱中, 除上述葡萄糖质子和葡萄糖碳信号外, 1H NMR还显示5个连氧质子: δH 3.72~3.76 (m, 1H, H-2)、3.29~3.40 (m, 1H, H-3)、4.38 (br.s, 1H, H-6)、3.43 (d, 1H, J = 11.2 Hz, H-23)和3.58 (d, J = 11.2 Hz, H-23);结合HSQC谱分析, 13C NMR还显示4个连氧碳信号: δC 69.9 (C-2)、78.7 (C-3)、68.6 (C-6)和66.0 (C-23)。综合上述分析, 提示化合物1是具四羟基取代的乌苏烷型三萜苷。
HMBC谱中(图 2), H-1 (δH 1.91~1.94)和H-3 (δH 3.29~3.40)与C-2 (δC 69.9)具有远程相关, 提示C-2位有OH取代; H-23 (δH 3.43, 3.58)与CH3-24 (δH 1.06)和C-3 (δC 78.7)具有远程偶合, 提示C-3位有OH取代, 同时提示C-23位有OH取代; H-6 (δH 4.38)与C-5 (δC 49.0)、C-8 (δC 44.1)和C-10 (δC 38.6)有远程相关, 提示C-6位有OH取代; 两个末端双键质子δH 4.64 (br.s, 1H, H-30)和4.69 (br.s, 1H, H-30)均与C-19和C-21有远程偶合, 提示此双键在C-20和C-30位上; 糖端基质子H-1' (δH 5.34)与C-28 (δC 175.8)具有远程偶合, 提示葡萄糖连接在C-28位。NOESY谱中, H-2显示与H-24和H-25相关; H-3与H-5、H-6和H-23具有相关, 提示化合物的羟基取代的相对构型为2α-OH、3β-OH、6β-OH和23α。综上分析, 化合物1的结构鉴定为2α, 3β, 6β, 23-四羟基乌苏酸-12, 20(30)-双烯-28-O-β-D-葡萄糖苷。经Scifinder检索, 化合物1为新化合物。
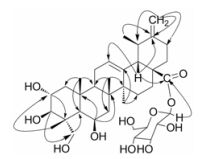
|
Figure 2 Key HMBC of compound1 |
AB Sciex 5600质谱仪; Bruker AVANCE Ⅲ HD 600 MHz型核磁共振波谱仪(瑞士布鲁克公司), TMS为内标; CD3OD为溶剂。Finnigan Trace DSQ气质联用色谱仪(美国Thermo公司); Perkin Elmer 343型旋光测定仪(美国Perkin Elmer公司); Aglient 1100制备液相(美国安捷伦公司), YMC-Actus ODS-AC18 (250 mm × 10 mm, 5 µm)半制备柱(日本YMC公司)。柱色谱硅胶(200~300目), 薄层色谱硅胶(青岛海洋化工), 凝胶Sephadex LH-20 (日本三菱株式会社), 显色剂为5%浓硫酸乙醇溶液。常规分析纯化学试剂购自国药集团化学试剂有限公司。
番石榴根于2014年7月中旬采自广东省珠海市, 由江西中医药大学付小梅副教授鉴定, 标本(No. 201407003)现存于江西中医药大学现代中药制剂教育部重点实验室。
1 提取与分离自然干燥的番石榴根(10.2 kg)粉碎, 经90%乙醇加热回流3次, 每次1 h, 提取液减压回收得流浸膏980 g, 所得流浸膏用适量的水分散, 然后依次用石油醚、乙酸乙酯萃取, 剩余部分旋干溶剂后, 用甲醇溶解。回收溶剂得石油醚部分86.0 g、乙酸乙酯部分146.2 g、甲醇部分596.5 g。
取乙酸乙酯萃取部位(145 g)进行硅胶柱色谱分离, 以二氯甲烷-甲醇(100:0, 50:1, 25:1, 10:1, 5:1, 1:1, 0:100)梯度洗脱得到Fr.1~9。Fr.3 (13.5 g)经硅胶柱(二氯甲烷-甲醇)分离, 得Fr.3-1~3-48。合并Fr.3-16~3-21, 再经Sephadex LH-20柱色谱(MeOH)分离, 得化合物7 (15 mg)。Fr.4 (21.9 g)经硅胶柱(二氯甲烷-甲醇)分离, 得Fr.4-1~4-86。合并Fr.4-18~3-23, 再经Sephadex LH-20柱(MeOH)分离, 得化合物3 (9 mg)。Fr.5 (17.9 g)经硅胶柱(二氯甲烷-甲醇)分离, 得Fr.5-1~5-52。合并Fr.2-15~2-20, 再经半制备柱色谱(甲醇-水=30:70, 3 mL·min-1), 得到化合物1 (7 mg, tR= 10.5 min)和化合物2 (8 mg, tR= 11.7 min)。Fr.6 (25.8 g)经硅胶柱(二氯甲烷-甲醇)分离, 得Fr.6-1~6-71。合并Fr.6-16~6-24, 再经半制备柱色谱(甲醇-水=30:70, 3 mL·min-1), 得到化合物4 (5 mg, tR= 11.2 min)、化合物5 (8 mg, tR= 12.6 min)和6 (9 mg, tR= 13.8 min)。
2 结构鉴定化合物1 白色无定形粉末(甲醇), [α]D25 -35.8 (c 0.026, MeOH); HR-ESI-MS给出准分子离子峰m/z: 665.389 6 [M+H]+ (计算值665.390 1, C36H56O11); 1H NMR和13C NMR数据见表 1。
化合物2 白色粉末(甲醇); ESI-MS m/z: 687.3 [M+Na]+, 结合核磁共振C、H谱, 提示分子式C36H56O11。1H NMR (600 MHz, CD3OD) δH: 5.44 (1H, dd, J = 5.5, 2.3 Hz, H-12), 5.40 (1H, d, J = 8.2 Hz, glc-H-1), 4.37 (1H, s, H-6), 3.81 (1H, dd, J = 12.0, 1.8 Hz, glc-H-6a), 3.76 (1H, ddd, J = 11.4, 9.6, 4.6 Hz, H-2), 3.68 (1H, dd, J = 12.0, 4.2 Hz, glc-H-6b), 3.59 (1H, d, J = 11.2 Hz, H-23a), 3.44 (1H, d, J = 11.2 Hz, H-23b), 3.27~3.42 (4H, m, H-3, glc-H-2, 3, 4, 5), 1.76 (s, H-25), 1.43 (3H, s, H-29), 1.16 (3H, s, H-24), 1.11 (3H, d, J = 7.0 Hz, H-30), 1.06 (3H, s, H-26), 0.98 (3H, s, H-27)。13C NMR (150 MHz, CD3OD) δC见表 2。以上1H NMR、13C NMR数据与文献[15]一致, 故鉴定化合物2为2α, 3β, 6β, 23-四羟基乌苏酸-12, 18-双烯-28-O-β-D-葡萄糖苷。
| Table 2 13C NMR (150 MHz, CD3OD) spectral data of compounds 2-7 |
化合物3 白色粉末(甲醇); ESI-MS m/z: 649.3 [M+H]+, 结合核磁共振C、H谱, 提示分子式C36H56O10。1H NMR (600 MHz, CD3OD) δH: 5.39~5.42 (1H, m, H-12), 5.39 (1H, d, J = 8.0 Hz, glc-H-1), 3.80 (1H, dd, J = 12.1, 1.9 Hz, glc-H-6a), 3.70~3.74 (1H, m, H-2), 3.67 (1H, dd, J = 12.1, 4.5 Hz, glc-H-6b), 3.50 (1H, d, J = 11.1, H-23a), 3.26~3.40 (6H, m, H-23b, H-3, glc-H-2, 3, 4, 5), 1.75 (3H, s, H-25), 1.10 (3H, d, J = 7.1 Hz, H-30), 1.09 (3H, s, H-29), 1.01 (3H, s, H-24), 0.93 (3H, s, H-26), 0.70 (3H, s, H-27)。13C NMR (150 MHz, CD3OD) δC见表 2。以上1H NMR、13C NMR数据与文献[16]一致, 故鉴定化合物3为2α, 3β, 23-三羟基乌苏酸-12, 18-双烯-28-O-β-D-葡萄糖苷。
化合物4 白色粉末(甲醇); ESI-MS m/z: 689.3 [M+Na]+, 结合核磁共振C、H谱, 提示分子式C36H58O11。1H NMR (600 MHz, CD3OD) δH: 5.31~5.34 (1H, m, H-12), 5.32 (1H, d, J = 8.4 Hz, glc-H-1), 3.80 (1H, dd, J = 12.0, 2.2 Hz, glc-6a), 3.68~3.72 (1H, m, H-2), 3.68 (1H, dd, J = 12.0, 4.7 Hz, glc-6b), 3.50 (1H, d, J = 11.0 Hz, H-23a), 3.35~3.42 (5H, m, H-3, glc-H-2, 3, 4, 5), 3.27 (1H, d, J = 11.0 Hz, H-23b), 1.34 (3H, s, H-27), 1.21 (3H, s, H-29), 1.04 (3H, s, H-25), 0.93 (3H, d, J = 6.5 Hz, H-30), 0.78 (3H, s, H-26), 0.70 (3H, s, H-24)。13C NMR (150 MHz, CD3OD) δC见表 2。以上1H NMR、13C NMR数据与文献[17]一致, 故鉴定化合物4为nigaichigoside F1。
化合物5 白色粉末(甲醇); ESI-MS m/z: 689.3 [M+Na]+, 结合核磁共振C、H谱, 提示分子式C36H58O11。1H NMR (600 MHz, CD3OD) δH: 5.34 (1H, d, J = 8.2 Hz, glc-H-1), 5.30 (1H, m, H-12), 4.37 (1H, s, H-6), 3.79 (1H, dd, J = 12.0, 2.0 Hz, glc-H-6a), 3.73~3.74 (1H, m, H-2), 3.68 (1H, d, J = 12.0, 4.5 Hz, H-glc-H-6b), 3.58 (1H, d, J = 11.4 Hz, H-23a), 3.43 (1H, d, J = 11.4 Hz, H-23b), 3.28~3.41 (5H, m, H-3, glc-H-2, 3, 4, 5), 1.40 (3H, s, H-25), 1.10 (3H, s, H-24), 1.09 (3H, s, H-26), 1.06 (3H, s, H-27), 0.96 (3H, s, H-29), 0.90 (3H, d, J = 6.5 Hz, H-30)。13C NMR (150 MHz, CD3OD) δC见表 2。以上1H NMR、13C NMR数据与文献[18]一致, 故鉴定化合物5为积雪草苷C。
化合物6 白色粉末(甲醇); ESI-MS m/z: 705.4 [M+Na]+, 结合核磁共振C、H谱, 提示分子式C36H58O12。1H NMR (600 MHz, CD3OD) δH: 5.36 (1H, t, J = 3.0 Hz, H-12), 5.31 (1H, d, J = 8.2 Hz, glc-H-1), 4.39 (1H, s, H-6), 3.80 (1H, dd, J = 12.0, 2.1 Hz, glc-H-6a), 3.73~3.77 (1H, m, H-2), 3.68 (1H, d, J = 12.0, 4.6 Hz, H-glc-H-6b), 3.59 (1H, d, J = 11.2 Hz, H-23a), 3.42 (1H, d, J = 11.2 Hz, H-23b), 3.23~3.39 (5H, m, H-3, glc-H-2, 3, 4, 5), 1.40 (3H, s, H-25), 1.33 (3H, s, H-27), 1.22 (3H, s, H-29), 1.07 (3H, s, H-24), 1.05 (3H, s, H-26), 0.94 (3H, d, J = 6.6 Hz, H-30)。13C NMR (150 MHz, CD3OD) δC见表 2。以上1H NMR、13C NMR数据与文献[19]一致, 故鉴定化合物6为2α, 3β, 6β, 19α, 23-五羟基乌苏酸-12, 18-双烯-28-O-β-D-葡萄糖。
化合物7 白色粉末(甲醇); ESI-MS m/z: 511.3 [M+Na]+, 结合核磁共振C、H谱, 提示分子式C30H48O5。1H NMR (600 MHz, CD3OD) δH: 5.30 (1H, like s, H-12), 3.70 (1H, m), 3.50 (1H, d, J = 11.2 Hz, H-23a), 3.36 (1H, m), 3.28 (1H, d, J = 11.2 Hz, H-23b), 2.52 (1H, s, H-18), 1.35 (3H, s), 1.20 (3H, s), 1.04 (3H, s), 0.93 (3H, d, J = 6.6 Hz, H-30), 0.81 (3H, s), 0.71 (3H, s)。13C NMR (150 MHz, CD3OD) δC见表 2。以上1H NMR、13C NMR数据与文献[20]一致, 故鉴定化合物7为2α, 3β, 19α, 23-四羟基乌苏酸(2α, 3β, 19α, 23-tetrahydroxylurs-12-en-28-oic acid)。
3 化合物1酸水解参照文献[14], 取2 mg化合物1溶解于5 mL 3 mol·L-1三氯乙酸中, 120 ℃加热2 h后减压浓缩至干, 干燥过夜。依次加入20 μL (2S)-1-氨基-2-丙醇-甲醇(1:8)混合液, 17 μL乙酸-甲醇(1:4)及13 μL 3%氰基硼氢化钠甲醇溶液。上述混合液放置65 ℃水浴加热2 h。冷却后缓慢加入3 mol·L-1三氟乙酸至pH为1, 减压浓缩, 残余物真空干燥过夜, 再加入吡啶和乙酸酐各0.2 mL, 置100 ℃水浴加热1 h。冷却后, 加适量水, 用三氯甲烷萃取, 用0.5 mol·L-1 Na2CO3和水各洗滤3次。三氯甲烷层加入无水硫酸钠干燥后过滤, 注入气质联用色谱仪。
4 化合物1抗肿瘤活性测定采用MTT法, 参照文献[21], 将处于对数生长期Bel 7402细胞按每孔100 μL接种于96孔培养板内, 每孔7.5×103细胞, 培养24 h后, 加入以培养基稀释的化合物1工作液, 终浓度为25 μmol·L-1。实验中每个浓度均为3个复孔, 另设空白对照孔。细胞在37 ℃、5% CO2条件下分别孵育48 h后, 去除培养基, PBS洗1次后, 每孔加入新鲜培养基100 μL和MTT (5 mg·mL-1, 用生理盐水配制) 20 μL; 继续培养4 h后, 去除孔中的培养基和MTT, 每孔加入二甲基亚砜(DMSO) 100 μL, 用酶标仪测OD570-630值。样品对Bel 7402的抑制率按下述公式计算:抑制率(%) = [(OD0-ODS) / OD0] × 100%, OD0为对照组吸收值, ODS为测试样品吸收值。
| [1] | Holetz FB, Pessini GL, Sanches NR, et al. Screening of some plants used in the Brazilian folk medicine for the treatment of infectious diseases[J]. Mem Inst Oswaldo Cruz, 2002, 97: 1027–1031. DOI:10.1590/S0074-02762002000700017 |
| [2] | Tona L, Kambu K, Mesia K, et al. Biological screening of traditional preparations from some medicinal plants used as antidiarrhoeal in Kinshasa, Congo[J]. Phytomedicine, 1999, 6: 59–66. DOI:10.1016/S0944-7113(99)80036-1 |
| [3] | Smith J, Nigel H. Tropical Forests and their Crops[M]. London: Cornell University Press, 1992: 102. |
| [4] | Heinrich M, Ankli A, Frei B, et al. Medicinal plants in Mexico:healers consensus and cultural importance[J]. Soc Sci Med, 1998, 47: 1859–1871. DOI:10.1016/S0277-9536(98)00181-6 |
| [5] | Leonti M, Vibrans H, Sticher O, et al. Ethnopharmacology of the Popoluca, Mexico:an evaluation[J]. J Pharm Phar-macol, 2001, 53: 1653–1669. DOI:10.1211/0022357011778052 |
| [6] | Cabieses F. Notes of Traditional Medicine, Rationalizing the Irrational. Ⅱ[M]. Ciselpesa:Perú National Council of Science and Technology, 1993:378. |
| [7] | Numata A, Yang P, Takahashi C, et al. Cytotoxic triter-penes from Chinese medicine, Goreishi[J]. Chem Pharm Bull, 1989, 37: 648–651. DOI:10.1248/cpb.37.648 |
| [8] | Begum S, Hassan SI, Siddiqui BS, et al. Triterpenoids from the leaves of Psidium guajava[J]. Phytochemistry, 2002, 61: 399–403. DOI:10.1016/S0031-9422(02)00190-5 |
| [9] | Arima H, Danno GI. Isolation of antimicrobial compounds from Guava (Psidium guajava L.) and their structural elucidation[J]. Biosci Biotechnol Biochem, 2002, 66: 1727–1730. DOI:10.1271/bbb.66.1727 |
| [10] | Qádan F, Petereit F, Nahrstedt A. Polymeric proanthocyanidins from Psidium guajava[J]. Sci Pharm, 2005, 73: 113–125. |
| [11] | Doddrell DM, Khong PW, Lewis KG. The stereochemical dependence of 13C chemical shifts in olean-12-enes and urs-12-enes as an aid to structural assignment[J]. Tetrahedron Lett, 1974, 27: 2381–2384. |
| [12] | Seo S, Tomita Y, Tori K. Carbon-13 NMR spectra of urs-12-enes and application to structural assignments of components of Isodon japonicus Hara tissue cultures[J]. Tetrahedron Lett, 1975, 16: 7–10. DOI:10.1016/S0040-4039(00)71763-1 |
| [13] | Agrawal PK. NMR spectroscopy in the structural elucida-tion of oligosaccharides and glycosides[J]. Phytochemistry, 1992, 31: 3307–3330. DOI:10.1016/0031-9422(92)83678-R |
| [14] | Xin WB, Chou GX, Wang ZT. Triterpenoids and saponins from the leaves of Uncaria hirsute[J]. Helv Chim Acta, 2009, 92: 638–644. DOI:10.1002/hlca.v92:4 |
| [15] | Adnyana IK, Tezuka Y, Banskota AH, et al. Quad-ranosides Ⅰ-Ⅴ, new triterpene glucosides from the seeds of Combretum quadrangulare[J]. J Nat Prod, 2000, 63: 496–500. DOI:10.1021/np990581+ |
| [16] | Durham DG, Liu IX, Richards RME. Unsaturated E-ring triterpenes from Rubus pinfaensis[J]. Phytochemistry, 1996, 42: 505–508. DOI:10.1016/0031-9422(96)00016-7 |
| [17] | Xiao HM, Zu LB, Li SP, et al. Chemical constituents from dried fruits of Rubus chingii[J]. Chin J Med Chem (中国药物化学杂志), 2011, 21: 220–226. |
| [18] | Weng XX, Chen YY, Shao Y, et al. A new ursane-type triterpene saponin from Centella asiatica[J]. Chin J Pharm (中国药学杂志), 2011, 42: 187–189. |
| [19] | Dijoux MG, Lavaud C, Massiot G, et al. A saponin from leaves of Aphloia madagascariensis[J]. Phytochemistry, 1993, 34: 497–499. DOI:10.1016/0031-9422(93)80037-S |
| [20] | Shigenaga S, Kouno I, Kawano N. Triterpenoids and glycosides from Geum japonicum[J]. Phytochemistry, 1985, 24: 115–118. DOI:10.1016/S0031-9422(00)80818-3 |
| [21] | Zhang Z, Wang S, Qiu H, et al. Waltonitone induces hu-man hepatocellular carcinoma cells apoptosis in vitro and in vivo[J]. Cancer Lett, 2009, 286: 223–231. DOI:10.1016/j.canlet.2009.05.023 |
 2017, Vol. 52
2017, Vol. 52


