2. 安徽省中医药科学院药物化学研究所, 安徽 合肥 230038
2. Department of Medicinal Chemistry, Anhui Academy of Chinese Medicine, Hefei 230038, China
肿瘤细胞的侵袭与迁移是恶性肿瘤最重要的生物学特征, 也是恶性肿瘤难以治愈的主要原因, 在癌症相关的死亡率中所占比例超过90%[1, 2]。肿瘤细胞侵袭转移到邻近组织或器官是一个多步骤复杂的过程。在此过程中, 肿瘤细胞必须具备降解细胞外基质及基底膜功能, 而基质金属蛋白酶(matrix metalloproteinases, MMPs)在降解细胞外基质及基底膜过程中能够起重要的作用[3]。有关研究发现, MMP-2和MMP-9的表达与肿瘤细胞的迁移和侵袭密切相关[4, 5]。通过抑制肿瘤细胞的侵袭与迁移达到抑制其在体内扩散的目的, 是临床治疗恶性肿瘤重要而有效的手段[6-8]。
川芎嗪(图 1)是中药川芎中的主要活性生物碱, 具有扩张血管、抑制血小板聚集、防止血栓形成等多种作用, 临床上被广泛用于缺血性脑血管病的治疗并取得较好疗效[9]。近年来研究证明川芎嗪可诱导肿瘤细胞凋亡[10, 11]。Zheng等[12]研究表明川芎嗪有抑制肺癌A549细胞增殖和迁移作用, TMP (tetramethylpyrazine, 7.3 mmol·L-1)与细胞作用24 h后, 对肺癌A549细胞增殖的抑制率仅为20%左右。

|
Figure 1 Structures of TMP, curcumin and 1 |
姜黄素(图 1)是中药姜黄中主要活性成分, 药理研究表明姜黄素具有抑制多种肿瘤细胞增殖、侵袭、转移和血管生成作用[13]。同时Guan等[14]研究显示姜黄素可抑制MDA-MB-231乳腺癌细胞的迁移。Ai等[15]设计了一系列姜黄素衍生物, 具有较好的抗肿瘤活性, 其中图 1中的化合物1(IC50 = 2.19 ± 0.14 μmol·L-1)抗肿瘤活性优于顺铂(cisplatin, DDP, IC50 = 8.10 ± 0.97 μmol·L-1)、TMP (IC50>200 μmol·L-1)和姜黄素(curcumin, IC50 = 38.12 ± 2.87 μmol·L-1)。但是, 近来研究[16]发现姜黄素稳定性差, 易转化成的非活性化合物。Potter等[17]将姜黄素的结构简化, 用哌啶酮代替β-二酮, 设计合成了一系列3, 5-二芳基亚甲基-4-哌啶酮衍生物, 生物学评价显示有一定的抗肿瘤作用。
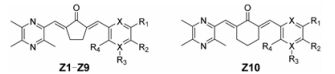
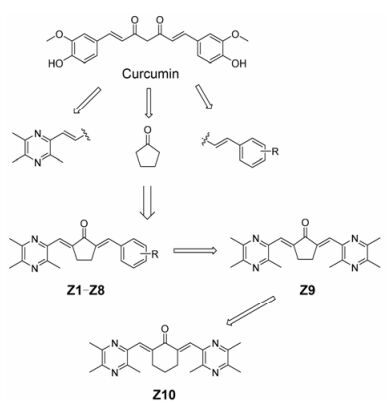
本课题组努力寻求具有抗迁移和抗侵袭效果的抗癌剂时, 以川芎嗪为先导化合物, 将药效团拼合原理和构象限制策略引入姜黄素以获得具有新骨架的化合物, 由于姜黄素的不稳定和生物活性差的特点, 本研究组将姜黄素结构简化, 保留单羰基结构。首先, 川芎嗪取代姜黄素的3-甲氧基-4-羟基苯基部分; 其次, 通过用环戊酮部分代替β-二酮, 姜黄素中的两个取代的苯基之间的连接被构象限制(图 2)。建立在理论基础上, 设计合成了10个川芎嗪类衍生物, 并对其针对A549、A549/DDP和HBE细胞株的抗增殖活性进行生物学评价。此外, 选择其中的一些代表性化合物评价其抗迁移和抗侵袭效应, 并进一步研究其机制。
|
Figure 2 The design of ligustrazine derivatives |
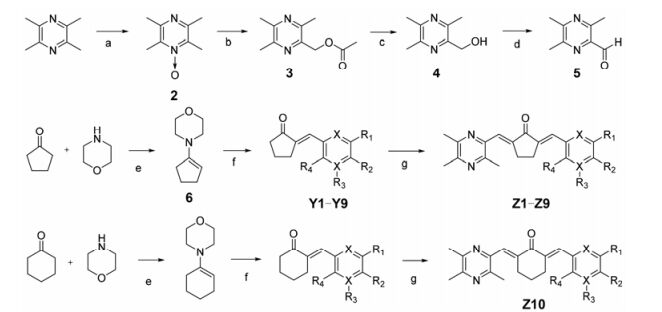
在合成目标化合物Z1~Z8时, 为了提高产率以及防止取代的苯甲醛和环戊酮两边同时发生缩合, 先将环戊酮与吗啉反应生成烯胺, 再与取代的苯甲醛进行单边缩合。
目标化合物结构经NMR、ESI-MS确证, 化合物的合成见合成路线1, 化合物的理化数据见表 1、2。
| Table 1 Structure and physical property of target compounds |
| Table 2 Spectral data of target compounds |
由于DDP的抗肿瘤细胞增殖活性远强于TMP和姜黄素, 所以选用DDP为阳性对照, 选用不同浓度梯度的待测物与A549、A549/DDP和HBE细胞作用48 h。MTT法结果显示(表 3), 目标化合物均表现出一定的抗增殖活性, 其中化合物Z8对A549和A549/DDP细胞株的IC50分别为41 ± 2.5、35 ± 1.1μmol·L-1, 化合物Z10对A549和A549/DDP细胞株的IC50分别为17 ± 1.5、22 ± 1.4μmol·L-1, 化合物Z10和Z8对A549/DDP细胞株的抗增殖活性优于DDP (88 ± 6.9μmol·L-1), 而DDP (15 ± 2.9μmol·L-1)对A549细胞株的抗增殖活性与化合物Z10相当, 强于化合物Z8。与A549细胞株相比, 化合物Z9对A549/ DDP有较好的抗增殖活性。所有目标化合物对HBE细胞株有较弱的抑制作用。
|
Scheme1 Synthetic route of target compounds |
| Table 3 The inhibitory activities of compounds anti-proliferation induced by A549, A549/DDP and HBE. n = 3, x± s. The anti-proliferative activities of compounds against all the tested cell lines were determined using the MTT assay, cisplatin (DDP) was taken as the positive control. The results were expressed as the IC50. ND: Not determined |
初步构效关系显示, 当R1、R2、R3为-OCH3时, 细胞株的抗增殖作用优于单甲氧基取代和双甲氧基取代。当R2为Cl或Br时, 抗增殖活性没有明显的差异。当中间体的连接桥为环己酮时, 活性优于环戊酮。双川芎嗪衍生物与单川芎嗪衍生物的抗增殖活性没有明显的差异。为了进一步讨论该类化合物的构效关系, 在后续的研究中, R1、R2、R3将引入其他不同类型的取代基。同时, 右侧芳环引入其他杂环, 如吡啶、咪唑、呋喃等。进一步研究其对抑制细胞增殖活性的影响。
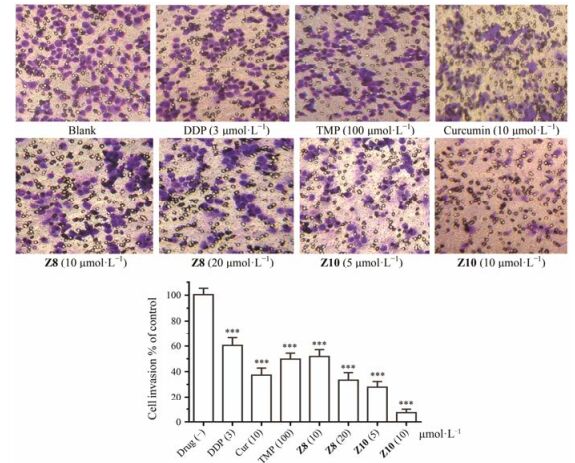
2.2 目标化合物对A549细胞迁移和侵袭的影响基于MTT实验结果, 以DDP、TMP和姜黄素为阳性对照。分别采用划痕实验(图 3)和transwell小室实验(图 4)进一步检测抗增殖活性较好的化合物Z8和Z10对A549细胞株迁移及侵袭的影响。

|
Figure 3 Anti-migration effect of compounds on A549 cells via scratch assay. Representative images of A549 cells were treated with vehicle, 3 μmol·L-1 DPP, 100 μmol·L-1 TMP, 10 μmol·L-1 curcumin, 10 μmol·L-1 Z8, 10 μmol·L-1 Z10for 24 h and 48 h, respectively |
|
Figure 4 Anti-invasion effect of compound Z8(concentration of 10, 20 μmol·L-1) and Z10(concentration of 5, 10 μmol·L-1) on A549 cells via transwell invasion assay. DPP, TMP and Cur (curcumin) were used as positive control. ***P < 0.001 vs drug (-) |
划痕实验结果表明目标化合物Z8和Z10对A549细胞的迁移能力有不同程度的抑制作用, 其中化合物Z10对A549细胞迁移的抑制作用优于DDP、TMP和姜黄素, 化合物Z8的抑制作用优于DDP、TMP, 与姜黄素抑制作用相当。Transwell小室实验结果显示, 阳性对照DDP、TMP和姜黄素对A549细胞侵袭抑制率分别为40% (3 μmol·L-1)、49% (100 μmol·L-1)和62% (10 μmol·L-1)。化合物Z8对A549细胞侵袭抑制率达到65% (20μmol·L-1), Z10对A549细胞侵袭抑制率高达92% (10μmol·L-1), 对细胞的侵袭能力的抑制呈现出效应剂量依赖关系。化合物Z10和Z8抑制A549细胞侵袭活性优于TMP (P<0.001), 化合物Z8在20μmol·L-1水平浓度对A549细胞侵袭抑制作用与姜黄素(10μmol·L-1)相当, 尤其是化合物Z10对A549细胞侵袭有显著的抑制作用。
2.3 蛋白质印迹(Western blotting)为了进一步确定目标化合物对A549细胞迁移和侵袭能力影响的机制。A549细胞分别用不同浓度的化合物Z8和Z10作用48 h后, Western blotting结果显示(图 5), MMP-2和MMP-9的浓度水平呈降低的趋势。这些发现表明, 化合物Z10和Z8可能通过下调MMP-2和MMP-9的浓度水平来抑制A549细胞的迁移和侵袭。

|
Figure 5 Analysis of expression of MMP-2 and MMP-9 in A549 cells exposed to 0, 5, 10 or 20 μmol·L-1 Z8and Z10for 48 h by Western blotting |
选用不同浓度梯度的待测物与A549细胞作用24 h, 采用流式细胞仪分析目标化合物Z8和Z10对细胞周期进展的影响, 结果如图 6所示, A549细胞与Z10处理48 h后, G2/M期细胞百分比从11.34%增加至18.12% (5 μmol·L-1)、31.78% (10 μmol·L-1)和63.42% (20 μmol·L-1)。与Z8处理48 h后, G2/M期细胞百分比从14.79%增加至31.30% (5 μmol·L-1)、50.12% (10 μmol·L-1)和62.53% (20 μmol·L-1)。结果显示, 与待测物作用的A549细胞株

|
Figure 6 Cell cycle analysis of A549 cell treated with compound Z8and Z10at concentrations of 0, 5, 10 and 20 μmol·L-1 for 48 h, showing enhanced dose-dependent G2/M arrest with treatment of Z8and Z10. All experiments were performed in triplicate. a, A: 0 μmol·L-1; b, B: 5 μmol·L-1; c, C: 10 μmol·L-1; d, D: 20 μmol·L-1 |
导致其在G2/M期的剂量依赖性蓄积, 并且在处理48 h后G0/G1期的细胞伴随减少。这些结果表明, 化合物Z8和Z10主要通过在G2/M期的细胞周期阻滞而不是凋亡来抑制A549细胞增殖。
小结MTT实验结果表明化合物Z10和Z8具有一定的抗增殖活性。进一步通过划痕实验和Transwell小室实验考察其抗迁移和抗侵袭效应, 结果表明化合物Z10和Z8对A549细胞的迁移和侵袭有显著的抑制作用。而Western blotting实验表明, 化合物Z10和Z8可能通过下调MMP-2和MMP-9的浓度水平来抑制A549细胞的迁移和侵袭。细胞周期结果显示化合物Z8和Z10主要通过在G2/M期的细胞周期阻滞而不是凋亡来抑制A549细胞增殖。本研究结果对进一步优化设计川芎嗪类衍生物作为抗癌剂的研究具有一定的指导意义。
实验部分LCQ ADVANTAGE MAX液质连用质谱仪(Finnig公司); Bruker 300 MHz超导核磁共振仪(CDCl3为溶剂, TMS为内标); WRS-1B数字熔点仪1台(上海精密科学仪器有限公司, 温度未校正); 苯甲醛等原料购于国药集团试剂有限公司; 其他试剂均为市售分析纯; 柱色谱所用硅胶均为烟台德信生物科技有限公司产品。
1 化合物的合成[18-20] 1.1 川芎嗪单氮氧化物的合成(2)在250 mL三颈烧瓶中依次加入川芎嗪(15.0 g, 0.1 mol)、30% H2O2溶液(24 mL, 0.2 mol)和冰醋酸15 mL, 94 ℃反应12 h, TLC (石油醚-乙酸乙酯1:1)检测反应基本完全后, 冷却后, 用50% NaOH溶液调节pH 10, 二氯甲烷萃取(3×30 mL), 合并有机相, 无水Na2SO4干燥, 减压浓缩, 得川芎嗪单氮氧化物白色晶体13.2 g, 收率78.8%, mp 82.4~84.1 ℃。
1.2 (3, 5, 6-三甲基吡嗪-2-基)乙酸甲酯的合成(3)在250 mL三颈烧瓶中依次加入川芎嗪单氮氧化物(13.2 g, 86.8 mmol)、乙酸酐(31.2 mL, 330.4 mmol), 130 ℃反应5 h, TLC (石油醚-乙酸乙酯1:1)检测反应基本完全后, 蒸除过量乙酸酐, 得黑色浆状物(3, 5, 6-三甲基吡嗪-2-基)乙酸甲酯。
1.3 2-羟甲基-3, 5, 6-三甲基吡嗪的合成(4)往上步反应得到的(3, 5, 6-三甲基吡嗪-2-基)乙酸甲酯中加入20% NaOH溶液80 mL, 室温反应12 h, TLC (石油醚-乙酸乙酯1:1)检测反应基本完全, 过滤, 滤液用二氯甲烷萃取(3×50 mL), 合并有机相, 无水Na2SO4干燥, 浓缩, 石油醚重结晶, 得淡黄色针状结晶, 即为2-羟甲基-3, 5, 6-三甲基吡嗪纯品9.7 g, 收率57.8%, mp 75.3~77.2 ℃。
1.4 3, 5, 6-三甲基吡嗪-2-甲醛的合成(5)在250 mL三颈烧瓶中依次加入2-羟甲基-3, 5, 6-三甲基吡嗪(9.5 g, 62.5 mmol)、MnO2 (16.2 g, 187.5 mmol)和无水乙醇100 mL, 回流12 h, TLC (石油醚-乙酸乙酯2:1)检测反应基本完全, 冷却, 过滤, 减压回收乙醇, 得黄色固体, 经硅胶柱色谱(石油醚-乙酸乙酯4:1)纯化, 得淡黄色固体8.8 g, 收率93.9%, mp 84.7~86.5 ℃。
1.5 (2E, 5E)-2-(4-甲氧基苯亚甲基)-5-[(3, 5, 6-三甲基吡嗪-2-基)亚甲基]环戊酮的合成(Z1)在250 mL三颈烧瓶中依次加入环戊酮(10 mL, 0.115 mol)、吗啉(10 mL, 0.114 mol)和苯100 mL, 连接油水分离器, 在110 ℃下反应至无水生成为止。冷却至室温, 加入对甲氧基苯甲醛(13 mL, 0.115 mol), 升温至110 ℃, 回流8 h。TLC (石油醚-乙酸乙酯1:1)检测反应完全, 逐滴滴加6 mol·L-1的盐酸溶液50 mL, 常温下搅拌1 h, 再逐滴加入10% Na2CO3溶液115 mL, 常温下搅拌30 min, 将溶液倒入分液漏斗中, 静置分层, 收集有机层并用无水硫酸钠干燥, 浓缩。用40 mL无水乙醇溶解, 加入1.5 g川芎醛(0.01 mol), 冰浴条件下缓慢滴加10% NaOH乙醇溶液5 mL, 反应约1 h, TLC (石油醚-乙酸乙酯2:1)检测反应基本完全, 滤出沉淀, 沉淀用无水乙醇洗涤, 经硅胶柱色谱(二氯甲烷-乙酸乙酯2:1)纯化得Z1黄色晶体2.01 g, 收率为61.2%, mp 160.2~161.7 ℃。
类似方法合成目标化合物Z2~Z10。
2 目标化合物生物活性的评价 2.1 细胞培养将A549、A549/DDP和HBE细胞, 用含10%小牛血清的RPMI 1640培养液, 于37 ℃、5% CO2和95%空气的培养箱中培养并传代。A549/DDP细胞除上述培养条件外, 还需加入0.2 μg·mL-1的DDP维持培养, 以维持细胞的耐药性。
2.2 目标化合物对A549、A549/DDP和HBE细胞增殖的影响取对数生长期的各株细胞以每孔5×103个接种于96孔板内, 每组6个复孔, 培养24 h后备用。实验组以倍比稀释的方法由低到高分别加入不同浓度的待测化合物, 终质量浓度分别为0.079、0.158、0.315、0.625、1.25、2.5、5、10、20、40μg·mL-1, 阴性对照组只加培养基, 不加药物, 并以顺铂(3 μmol·L-1)作为阳性对照药。药物作用48 h后, 加入MTT溶液(5 mg·mL-1) 20 μL, 继续培养4 h, 弃去各孔内液体, 每孔加入200 μL二甲基亚砜(DMSO)置震荡器上震荡5 min, 测定A570并求出各组细胞的IC50, 抑制率= (对照组OD值-药物组OD值)/对照组OD值×100%。
2.3 目标化合物对A549细胞迁移能力的影响(划痕实验)取对数生长期的A549细胞以每孔5×104个接种于24孔板中, 待细胞生长至90%面积时备用。DDP对A549细胞的IC50约3.2 μg·mL-1, 当其剂量为0.8 μg·mL-1 (约3μmol·L-1)时细胞生长抑制率为16.5% (48 h后), 属于相对低毒剂量, 故选用DDP为0.8 μg·mL-1作为抑制细胞迁移的阳性对照; 将Z10的低毒剂量10 μmol·L-1 (10%<细胞抑制率<20%)用于检测待测化合物对细胞迁移的抑制作用; 空白对照组不加顺铂或待测化合物; 用200 μL规格的Tip头进行划痕, 要求划痕直且宽度一致; 在划痕及加待测药物后24、48 h, 分别用TS100-F DH1倒置光学显微镜拍照记录。
2.4 目标化合物对A549细胞侵袭能力的影响(transwell小室法)基质胶用冷过滤蒸馏水稀释至规定浓度, 加到transwell小室中, 制备细胞悬液备用。用无血清培养基轻洗凝胶, 用PBS漂洗3次。在小室内加入1×105个细胞, 用含有不同浓度的待测化合物Z8及Z10共同孵育(一般选择中低毒浓度, 本实验选择的浓度在IC20附近)。小室下层加入500 μL含10%胎牛血清(FBS)和100 ng·mL-1 EGF (表皮生长因子)的培养液, 37 ℃条件下孵育24 h。孵育结束时, 在膜的上表面层细胞仔细用湿棉签轻轻擦去Matrigel凝胶和聚碳酯膜上表面的细胞, 并做好标记, 用冰预冷的甲醛固定30 min。侵入基底膜下表面的细胞用甲醇固定和0.5%结晶紫染色30 min。细胞面朝下, 置于载玻片上, 摄像, 在倒置显微镜下计数移至微孔膜下层的穿膜细胞数。每个样本计数5~10个视野, 求出每个视野平均穿膜细胞数。(倍数: 200×)。
2.5 Western blotting实验将A549细胞接种在6 cm培养皿中。当其在孔区域中生长至80%时, 细胞分别用Z8和Z10(0、5、10、20μmol·L-1)处理。弃培养液, PBS润洗两次, 胰酶(不加EDTA)消化收集, 加细胞裂解液200 μL, 混匀后于冰浴中放置30 min, 通过离心(14 000×g, 4 ℃, 10 min)得到蛋白提取液。使用BCA蛋白测定试剂盒测定蛋白质浓度。对于蛋白质印迹分析, 在SDS-PADE凝胶上分离等量的蛋白质并转移到硝酸纤维素NC膜。将印迹在封闭缓冲液(TBST中的5%脱脂奶粉)中在室温下封闭1 h, 然后与兔抗人MMP-2和MMP-9的抗体的稀溶液, 兔抗人β-肌动蛋白(β-actin)的抗体在封闭缓冲液中4 ℃过夜。然后将印迹与合适的第二抗体温育, 使用β-actin作为上样对照。使用化学发光成像系统显现蛋白条带。以Image J软件采集数据, 计算灰度值。
2.6 细胞周期通过碘化丙啶(PI)染色进行细胞周期分析。将A549细胞接种在培养皿中并用不同剂量的化合物Z10和Z8处理24 h时, 随后进行PBS洗涤。用冷的70%乙醇在4 ℃固定至少12 h后, 然后将细胞在PBS中洗涤1次, 并在含有RNA酶和PI的PBS中在黑暗中悬浮30 min。然后通过流式细胞仪(BD Facsverse)分析细胞。
| [1] | Nilay S, Yibin K. Unravelling the complexity of metastasis -molecular understanding and targeted therapies[J]. Nat Rev Cancer, 2011, 11: 735–748. DOI:10.1038/nrc3125 |
| [2] | Chen KM, Wei H, Ling SR, et al. Expression and signifi-cance of transforming growth factor-β1 in epithelial ovarian cancer and its extracellular matrix[J]. Oncol Lett, 2014, 8: 2171–2174. |
| [3] | Duarte S, Baber J, Fujii T, et al. Matrix metalloproteinases in liver injury, repair and fibrosis[J]. Matrix Biol, 2015, 44: 147–156. |
| [4] | Kessenbrock K, Plaks V, Wer Z. Matrix metallopro-teinases:regulators of the tumor microenvironment[J]. Cell, 2010, 141: 52–67. DOI:10.1016/j.cell.2010.03.015 |
| [5] | Sani IK, Marashi SH, Kalalinia F. Solamargine inhibits migration and invasion of human hepatocellular carcinoma cells through down-regulation of matrix metalloproteinases 2 and 9 expression and activity[J]. Toxicol In Vitro, 2015, 29: 893–900. DOI:10.1016/j.tiv.2015.03.012 |
| [6] | Chai SH, Seow HY, Neoh HP, et al. MicroRNAs associated with tumour migration, invasion and angiogenic properties in A549 and SK-Lu1 human lung adenocarcinoma cells[J]. Lung Cancer, 2014, 83: 154–162. DOI:10.1016/j.lungcan.2013.11.024 |
| [7] | Shi QQ, Li J, Feng ZQ, et al. Effect of ginsenoside Rh2 on the migratory ability of HepG2 liver carcinoma cells:recruiting histone deacetylase and inhibiting activator protein 1 transcription factors[J]. Mol Med Rep, 2014, 10: 1779–1785. DOI:10.3892/mmr.2014.2392 |
| [8] | Kulrut B, Prasit P, Tony B, et al. High threshold of β1 integrin inhibition required to block collagen I-induced membrane type-1 matrix metalloproteinase (MT1-MMP) activation of matrix metalloproteinase 2(MMP-2)[J]. Cancer Cell Int, 2014, 14: 99. DOI:10.1186/s12935-014-0099-3 |
| [9] | Guo SK, Chen KJ, Qian ZH, et al. Tetramethylpyrazine in the treatment of cardiovascular and cerebrovascular diseases[J]. Planta Med, 1983, 47: 89. DOI:10.1055/s-2007-969959 |
| [10] | Yu KM, Chen Z, Pan XK, et al. Tetramethylpyrazine-mediated suppression of C6 gliomas involves inhibition of chemokine receptor CXCR4 expression[J]. Oncol Rep, 2012, 28: 955–960. DOI:10.3892/or.2012.1866 |
| [11] | Cao J, Miao Q, Miao S, et al. Tetramethylpyrazine (TMP) exerts antitumor effects by inducing apoptosis and autophagy in hepatocellular carcinoma[J]. Int Immuno-pharmacol, 2015, 26: 212–220. DOI:10.1016/j.intimp.2015.03.028 |
| [12] | Zheng CY, Xiao W, Zhu MX, et al. Inhibition of cyclooxy-genase-2 by tetramethylpyrazine and its effects on A549 cell invasion and metastasis[J]. Int J Oncol, 2012, 40: 2029–2037. |
| [13] | Ajaikumar BK, Preetha A, Bharat BA. Curcumin inhibits proliferation, invasion, angiogenesis and metastasis of different cancers through interaction with multiple cell signaling proteins[J]. Cancer Lett, 2008, 269: 199–225. DOI:10.1016/j.canlet.2008.03.009 |
| [14] | Guan F, Ding YM, Zhang YM, et al. Curcumin suppresses proliferation and migration of MDA-MB-231 breast cancer cells through autophagy-dependent Akt degradation[J]. PLoS One, 2016, 11: e0146553. DOI:10.1371/journal.pone.0146553 |
| [15] | Ai Y, Zhu B, Ren CP, et al. Discovery of new monocarbonyl ligustrazine -curcumin hybrids for intervention of drug-sensitive and drug-resistant lung cancer[J]. J Med Chem, 2016, 59: 1747–1760. DOI:10.1021/acs.jmedchem.5b01203 |
| [16] | Nelson KM, Dahlin JL, Bisson J, et al. The essential medicinal chemistry of curcumin[J]. J Med Chem, 2017, 60: 1620–1637. DOI:10.1021/acs.jmedchem.6b00975 |
| [17] | Potter E, Jha M, Bhullar KS, et al. Investigation of fatty acid conjugates of 3, 5-bisarylmethylene-4-piperidone de-rivatives as antitumor agents and human topoisomerase-Ⅱa inhibitors[J]. Bioorg Med Chem, 2015, 23: 411–421. DOI:10.1016/j.bmc.2014.12.042 |
| [18] | Deng LJ, Guo XL, Li Z, et al. Ligustrazine derivatives. Part 4:design, synthesis, and biological evaluation of novel ligustrazine-based stilbene derivatives as potential cardiovascular agents[J]. Chem Biol Drug Des, 2012, 79: 731–739. DOI:10.1111/jpp.2012.79.issue-5 |
| [19] | Xu YY, Cao Y, Ma HK, et al. Design, synthesis and molecular docking of α, β-unsaturated cyclohexanone analogous of curcumin as potent EGFR inhibitors with antiproliferative activity[J]. Bioorg Med Chem, 2013, 21: 388–394. DOI:10.1016/j.bmc.2012.11.031 |
| [20] | Liu D, Yu WS, Li JJ, et al. Novel 2-(E)-substituted ben-zylidene-6-(N-substituted aminomethyl)cyclohexanones and cyclohexanols as analgesic and anti-inflammatory agents[J]. Med Chem Res, 2013, 22: 3779–3786. DOI:10.1007/s00044-012-0362-x |
 2017, Vol. 52
2017, Vol. 52