2. 北京市神经外科研究所, 首都医科大学附属北京天坛医院, 北京 100050
2. Beijing Neurosurgical Institute, Beijing Tian Tan Hospital, Capital Medical University, Beijing 100050, China
银屑病是一种以淋巴细胞异常活化、角质形成细胞异常增殖分化和炎症细胞浸润为特征的常见的慢性炎症性皮肤疾病, 主要组织病理特征包括:表皮内细胞角化不全或角化过度、真皮内血管膨大扭曲、多种炎性细胞浸润等[1]。
大量的证据表明, 银屑病是在多基因遗传背景下发生的、以T细胞为主的多种免疫细胞共同参与的免疫功能调节异常的疾病[2-4]。应用环孢霉素(cyclosporine, CsA)、他克莫司(tacrolimus, FK506)等T细胞免疫抑制剂[5]及特异性T细胞抑制剂(抗CD4单克隆抗体, OKTcdr4a)治疗银屑病均有一定疗效[6]。将银屑病患者非皮损区皮肤移植到重症联合免疫缺陷(severe combined immune deficiency, SCID)小鼠, 注射来自银屑病患者经超抗原和IL-2活化的T淋巴细胞, 能在后者诱发银屑病样皮损等[7]。T细胞在银屑病发病过程中的作用可简单归纳如下:抗原呈递细胞(antigen-presenting cell, APC)捕获抗原, 加工处理后呈递于细胞表面。在外周淋巴器官中活化CD4+ T细胞; 活化的CD4+ T细胞进入皮肤活化局部的APCs; 此APCs再进一步活化表皮内的CD8+ T细胞; CD8+ T细胞活化增殖, 产生细胞因子、趋化因子、黏附分子和生长因子等, 导致银屑病一系列特征性病理改变的发生, 如角朊细胞增殖和分化不全、血管内皮细胞的改变等[8]。
咪喹莫特(imiquimod, IMQ)是Toll样受体(toll-like receptor, TLR) 7/8的特异性激活剂[9], 可以特异性与浆细胞样树突状细胞(plasmacytoid dendritic cells, pDC)内涵体TLR7结合, 诱导pDC分泌大量的干扰素(interferon, IFN)-α。IMQ广泛应用于治疗尖锐湿疣、肛周疣、日光性角化病及基底细胞癌等[10, 11]。但IMQ应用于有银屑病倾向的患者会诱发和加重病情[12-14], 因此研究者将其用于小鼠并成功诱发出银屑病样病理改变[15]。相比其他异体移植、基因敲除或基因突变等形成的银屑病小鼠模型, IMQ诱导银屑病样炎症小鼠模型是在自然免疫状态下诱导产生的, 是一个研究银屑病及其治疗药物的更理想的小鼠模型[16]。
目前针对银屑病的治疗主要是对症治疗, 包括维甲酸类、维生素D3衍生物、糖皮质激素类、免疫抑制剂及生物制剂等[17]。雷公藤系卫矛科雷公藤属植物, 它作为传统中药, 其提取物因具有免疫抑制而作为抗炎类药物被广泛用于包括银屑病在内的免疫相关疾病的治疗。其中雷公藤甲素(triptolide, LA)是从卫矛科植物雷公藤中分离出的活性最高的环氧化二萜内酯化合物, 是雷公藤的主要有效成分之一, 经药理和临床试验表明LA对各种类型的银屑病均具有较好疗效[18, 19]。然而值得注意的是LA有很大的毒性, 急性毒性实验显示LA的半数致死量(median lethal dose, LD50)为0.94 mg·kg-1 [20, 21], 在发挥药效作用的同时会有很大的不良反应, 如生殖毒性。因此, 提取、纯化有效成分并进行改造, 增加疗效, 降低毒副作用, 是现代中药发展的重要内容。化合物2-propenoic acid, 3-(4-fluorophenyl)-, (3bS, 4aS, 5aR, 6R, 6aS, 7aS, 7bS, 8aS, 8bS)-1, 3, 3b, 4, 4a, 6, 6a, 7a, 7b, 8b, 9, 10-dodecahydro-6a-(1-hydroxy-1-methylethyl)-8b-methyl-1-oxotrisoxireno [4b, 5:6, 7:8a, 9]phenanthro[1, 2-c]furan-6-yl ester, (2E)-(LB-1)是LA类似物(图 1), 具有更低的急性毒性, 并且水溶性好[22]。因此, 本实验拟研究LB-1对IMQ诱导小鼠银屑病样炎症的影响, 及LB-1对T细胞等方面的影响以探讨其抑制银屑病样的作用机制, 从而为今后应用防治干预银屑病奠定理论基础。

|
Figure 1 The structures of LA and LB-1 were presented. LA: Triptolide; LB-1: 2-Propenoic acid, 3-(4-fluorophenyl)-, (3bS, 4aS, 5aR, 6R, 6aS, 7aS, 7bS, 8aS, 8bS)-1, 3, 3b, 4, 4a, 6, 6a, 7a, 7b, 8b, 9, 10-dodecahydro-6a-(1-hydroxy-1-methylethyl)-8b-methyl-1-oxo trisoxireno[4b, 5:6, 7:8a, 9]phenanthro[1, 2-c]furan-6-yl ester, (2E)- |
雌性BALB/c小鼠, 雌性, 体重18~20 g, 购自维通利华(合格证号: SCXK京2009-0007)。所有动物实验均在中国医学科学院药物研究所动物中心进行, 严格按照中国实验动物使用规定进行及获得药物研究所动物实验伦理委员会批准。饲养环境:动物房保持通风、干燥, 室温22~25 ℃, 湿度50%~70%, 自由饮水和饮食。IMQ乳膏购自北京协和医院: 12袋/盒, 每袋250 mg (每盒3 g)。LB-1由中国医学科学院药物研究所药物化学张东明老师课题组合成。
分组及造模给药造模 将小鼠刮除背部皮肤, 2 cm × 3 cm大小暴露区。根据小鼠分组给予外用基质(50 mg凡士林)或者50 mg IMQ乳膏, 每日1次, 连续7天。观察局部皮肤变化, 计算银屑病样炎症的校正银屑病样皮损面积和疾病严重程度(psoriasis area and severity index, PASI)评分, 评分标准如下所述。照相记录。于第7天脱颈处死小鼠, 取局部皮损组织剔除皮下脂肪组织, 置于4%多聚甲醛用于HE染色, 分离脾脏, 称重并组织研磨分离淋巴细胞。
分组 实验分为4组, 对照组、IMQ模型组和LB-1给药组(IMQ + 2 mg·kg-1 LB-1和IMQ + 4 mg·kg-1 LB-1)。LB-1给药组造模当天给药, 腹腔注射, 连续给药7天。
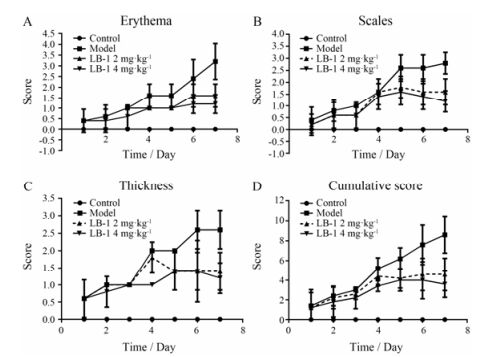
PASI评分依据PASI评分标准, 给予小鼠皮损处红斑(erythema)、鳞屑(scales)及浸润增厚程度(thickness)给予0~4的积分, 将三者积分相加得到总分。PASI评分标准: 0, 无; 1, 轻度; 2, 中度; 3, 重度; 4, 极重度。
苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色石蜡切片4 μm浸入二甲苯15 min×2后, 依次浸入100%酒精2 min, 95%酒精3 min×2, 80%酒精3 min, 蒸馏水洗涤3 min, 苏木素染色5 min, 自来水迅速洗去浮色, 蒸馏水稍洗, 70%盐酸乙醇分化(镜下观察), 自来水温和冲洗10~30 min, 蒸馏水稍洗, 1%伊红液染色1 min, 镜下观察。自然风干过夜, 再用中性树胶封片。在显微镜下观察记录切片情况。染色结果显示, 细胞浆红色, 细胞核蓝紫色。
脾脏分离淋巴细胞的流式细胞术检测脾脏取出, 去掉被膜, 放入预冷匀浆器中手工匀浆3~5 min, 直至不见组织块为止; 200目滤网(钢网)过滤匀浆液; 依次加入红细胞裂解液[0.16 mol·L-1 NH4Cl, 0.17 mol·L-1 Tris (pH 7.45), HCl调pH至7.2], 淋巴细胞分离液, 室温800 ×g离心30 min, 离心试管中细胞匀浆分为3层, 小心吸取中间量最少的一层絮状物, PBS离心洗2遍(1 000 r·min-1, 5 min), 计数细胞, PBS调整细胞密度至每毫升1×106个, 取100 μL细胞悬液, 加入7 μL封闭液, 封闭5~10 min; 依次加入荧光标记抗体(CD3-APC-647、CD4-FITC和CD8-PE), 常温避光孵育1 h, 加入PBS 1 mL, 1 350 r·min-1离心8 min以洗去未标记抗体, 加PBS调至200 μL体积重悬细胞, 上机检测(BD FACS Calibur), 以FlowJo分析软件记录并分析结果。
统计学分析采用SPSS 19对实验结果进行统计分析, 均数和标准误以x±s表示。两组之间采用t-test检测, 3组或3组以上采用one-way ANOVA检测, 各组之间显著性差异以P < 0.05。
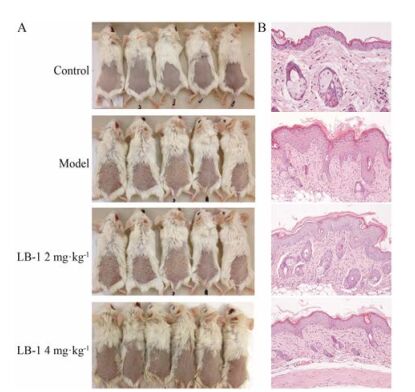
结果 1 LB -1抑制IMQ诱导的小鼠银屑病样炎症实验显示, 对照组小鼠背部皮肤未见明显改变, 而模型组小鼠背部皮肤于外用IMQ乳膏3天后渐渐出现红色斑疹、斑块及鳞屑, 第7天最为明显, 呈典型的银屑病样改变(图 2A)。与模型组相比, 2 mg·kg-1 LB-1给药组红斑、鳞屑有所减轻, 4 mg·kg-1 LB-1给药组小鼠背部皮肤仅有轻度红斑、鳞屑的出现, 第7天改变明显较模型组轻。模型组小鼠皮损的PASI评分显著高于LB-1给药组(图 3)。
|
Figure 2 Effects of LB-1 on morphologic changes induced by imiquimod of BALB/c mice. Establishment of imiquimod induced psoriasiform model (A) and efficacy of LB-1 for psoriasis using HE staining assay (B). Magnification 200× |
|
Figure 3 The effects of LB-1 on imiquimod induced psoriasiform inflammation evaluated by psoriasis area and severity index (PASI) score. A: Erythema; B: Scales; C: Thickness; D: Cumulative score |
在病理改变方面, 模型组小鼠皮损表现为明显的角化过度、棘层肥厚及真皮炎性细胞浸润, 与人类银屑病的病理改变非常相似; 2和4 mg·kg-1 LB-1给药组小鼠皮损病理改变明显减轻, 且4 mg·kg-1 LB-1给药组对小鼠皮损病理改变效果优于2 mg·kg-1给药组, 但是相比对照组皮肤, 4 mg·kg-1 LB-1给药组仍然可见轻度的角化过度、棘层肥厚及炎性浸润等(图 2B)。
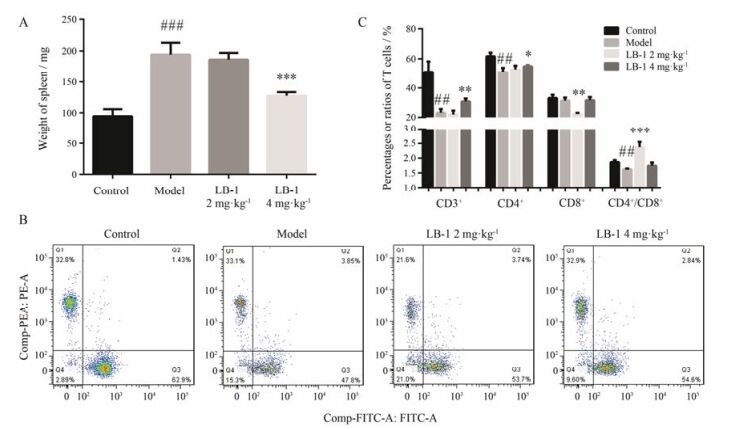
3 LB -1改变IMQ诱导的银屑病小鼠脾T淋巴细胞的含量研究发现, 外用IMQ通过系统作用可以引起小鼠脾脏增大[15], 本次实验结果也发现了同样的结果, 与对照组相比, 模型组小鼠连续外用IMQ 7天, 脾脏明显肿大(P < 0.001);与模型组小鼠相比, 4 mg·kg-1 LB-1给药组小鼠可以明显抑制脾脏的增大(P < 0.001, 图 4A)。
|
Figure 4 Effect of LB-1 treatment on the percentages of CD3+ T cells, CD4+ T cells and CD8+ T cells in the spleens. A: LB-1 reduces the splenomegaly induced by IMQ. B, C: LB-1 alters the percentages of CD4+-FITC T cells, CD8+-PE T cells and CD3+-APC-647 T cells in the spleens. n = 5, x±s. ##P < 0.01, ###P < 0.001 vs control group; *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
通过流式细胞术对小鼠脾脏分离的免疫细胞进行分类检测(图 4B), 实验结果显示, 与对照组小鼠相比, 模型组小鼠脾脏中CD3+ T和CD4+ T细胞的百分比明显降低(P < 0.01)。与模型组相比, 2 mg·kg-1LB-1组能够抑制脾CD8+ (P < 0.01) T淋巴细胞百分比, 上调CD4+/CD8+ T淋巴细胞比值(P < 0.001);而LB-1 4 mg·kg-1组上调脾CD3+ T (P < 0.01)和CD4+ T (P < 0.05)淋巴细胞的百分比, 但仍然低于对照组小鼠CD3+ T和CD4+ T细胞的百分比(图 4C)。4 mg·kg-1 LB-1给药组亦能上调CD4+/CD8+比值, 但与模型组相比没有显著性差异(P > 0.05)。说明2 mg·kg-1 LB-1组对小鼠脾脏中的CD8+ T细胞及CD4+/CD8+ T淋巴细胞比值有明显的作用, 而4 mg·kg-1 LB-1组对小鼠脾脏中的CD4+ T细胞有明显的作用而不是CD8+ T细胞。
讨论银屑病属于自身免疫性疾病, 具有严重的皮肤危害, 发病范围广, 病程反复又很难治愈[23]。由于动物一般不会自发形成银屑病, 因此理想的银屑病动物模型的制备需要满足以下几个条件: ①能在组织病理上模拟银屑病的特征, 如表皮增生、变厚及表皮分化异常、炎性浸润、血管增生等; ②有一个与银屑病相似的发病机制; ③对目前抗银屑病药物治疗有效[24]。但是目前尚无任何动物模型能够模拟出全部的银屑病样表症及其相关的炎症情况。
已报道的银屑病小鼠模型包括以下几类[25, 26]: ①自发性小鼠模型; ②遗传基因工程性小鼠模型; ③ T细胞为基础的小鼠模型; ④靶基因表达的小鼠模型; ⑤异体移植小鼠模型。相比其他小鼠模型, 基于正常免疫功能的小鼠IMQ银屑病模型能从很多方面反映出银屑病的特征[13, 16], 局部皮肤出现红斑、鳞屑和增厚, 炎症可见, 组织病理改变包括过度增殖的角质形成细胞、角化不全、颗粒层消失, 真皮出现了包括T细胞、pDC和中性粒细胞等炎性细胞的浸润。在炎性细胞因子方面, IMQ诱导银屑病小鼠IL-17/IL-23、IL-22、IL-15、IL-36、IL-6和TNF-α等高表达[15, 27, 28]。拮抗T细胞的功能后能明显减轻皮肤炎症, 进一步证明T细胞在IMQ诱导小鼠银屑病样炎症中的重要作用。本实验结果发现, 模型组小鼠外用IMQ乳膏2~3天后渐渐出现红斑鳞屑、皮肤肥厚等表现, 病理改变出现了角化过度、棘层肥厚及真皮炎性细胞浸润, 一直持续至实验结束; 而对照组小鼠表皮无明显改变。本结果与van der Fits等[15]的研究结果一致, 说明实验模型建立成功。而LB-1明显减缓了局部皮肤红斑、鳞屑的出现; 病理改变可见轻度角化过度、棘层肥厚及真皮炎症细胞浸润, 但较之模型组银屑病样炎症明显减轻。
以往研究发现, IMQ通过系统作用引起小鼠脾脏肿大[15]。同样, 本实验发现模型组小鼠的脾脏明显大于LB-1给药组小鼠, 两组脾脏重量有显著差异。由于T细胞在银屑病免疫异常的启动及维持中发挥重要作用, 为了进一步证实LB-1对银屑病样炎症的抑制作用可能与免疫T细胞有关, 本实验应用流式细胞术分析小鼠脾脏的T淋巴细胞百分比构成。模型组银屑病样炎症小鼠肿大的脾脏分离的细胞中CD3+ T、CD4+ T细胞百分比明显低于对照组小鼠, CD8+ T细胞无明显差异, 因此CD4+/CD8+的比值亦显著减低, 2 mg·kg-1 LB-1组能够抑制小鼠脾脏中的CD8+ T细胞、上调CD4+/CD8+ T淋巴细胞, 而4 mg·kg-1 LB-1组显著上调小鼠脾脏中的CD4+ T细胞和CD3+ T细胞百分比, 说明不同剂量LB-1对小鼠银屑病模型的保护机制是不同的。
综上, IMQ外用于BALB/c小鼠可以诱导出明显的银屑病样炎症, 是一个理想的研究银屑病的小鼠模型。大量T细胞浸润到皮损组织及小鼠脾脏中, T细胞的构成较对照组小鼠有显著差异, 说明T细胞参与了银屑病样炎症的形成。LB-1具有显著减轻IMQ诱导的银屑病炎症的作用, 但是不能完全抑制银屑病的形成; 对脾脏中T细胞的影响, 提示LB-1可能通过调节T细胞百分比构成而发挥抗炎作用。此结果为进一步研究LB-1及其他以雷公藤甲素为主要活性成分的雷公藤制剂在银屑病的临床应用上具有一定的指导意义。
| [1] | Schön MP, Boehncke WH. Psoriasis[J]. N Engl J Med, 2005, 352: 1899–1912. DOI:10.1056/NEJMra041320 |
| [2] | Austin LM, Ozawa M, Kikuchi T, et al. The majority of epidermal T cells in psoriasis vulgaris lesions can produce type 1 cytokines, interferon-γ, interleukin-2, and tumor necrosis factor-α, defining TC1(cytotoxic T lymphocyte) and TH1 effector populations:a type 1 differentiation bias is also measured in circulating blood T cells in psoriatic patients[J]. J Invest Dermatol, 1999, 113: 752–759. DOI:10.1046/j.1523-1747.1999.00749.x |
| [3] | Robert C, Kupper TS. Inflammatory skin diseases, T cells, and immune surveillance[J]. N Engl J Med, 1999, 341: 1817–1828. DOI:10.1056/NEJM199912093412407 |
| [4] | Nickoloff BJ. The search for pathogenic T cells and the genetic basis of psoriasis using a severe combined immunodeficient mouse model[J]. Cutis, 2000, 65: 110. |
| [5] | Baker BS, Griffiths CEM, Lambert S, et al. The effects of cyclosporin A on T-lymphocytes and dendritic cells sub-population in psoriasis[J]. Br J Dermatol, 1987, 116: 503–510. DOI:10.1111/bjd.1987.116.issue-4 |
| [6] | Prinz J, Braun-Falco O, Meurer M, et al. Chimaeric CD4 monoclonal antibody in treatment of generalised pustular psoriasis[J]. Lancet, 1991, 338: 320–321. |
| [7] | Wrone-Smith T, Nickoloff BJ. Dermal injection of immunocytes induces psoriasis[J]. J Clin Invest, 1996, 98: 1878–1887. DOI:10.1172/JCI118989 |
| [8] | Walsh SR, Shear NH. Psoriasis and the new biologic agents:interrupting a T-AP dance[J]. CMAJ, 2004, 170: 1933–1941. DOI:10.1503/cmaj.1031335 |
| [9] | Wagner TL, Ahonen CL, Couture AM, et al. Modulation of TH1 and TH2 cytokine production with the immune response modifiers, R-848 and imiquimod[J]. Cell Immunol, 1999, 191: 10–19. DOI:10.1006/cimm.1998.1406 |
| [10] | Steinmann A, Funk JO, Schuler G, et al. Topical imiquimod treatment of a cutaneous melanoma metastasis[J]. J Am Acad Dermatol, 2000, 43: 555–556. |
| [11] | Novak N, Yu CF, Bieber T, et al. Toll-like receptor 7 ago-nists and skin[J]. Drug News Perspect, 2008, 21: 158–165. |
| [12] | Wu JK, Siller G, Strutton G. Psoriasis induced by topical imiquimod[J]. Australas J Dermatol, 2004, 45: 47–50. DOI:10.1111/ajd.2004.45.issue-1 |
| [13] | Rajan N, Langtry JA. Generalized exacerbation of psoriasis associated with imiquimod cream treatment of superficial basal cell carcinomas[J]. Clin Exp Dermatol, 2006, 31: 140–141. DOI:10.1111/ced.2006.31.issue-1 |
| [14] | Patel U, Mark NM, Machler BC, et al. Imiquimod 5% cream induced psoriasis:a case report, summary of the literature and mechanism[J]. Br J Dermatol, 2011, 164: 670–672. |
| [15] | van der Fits L, Mourits S, Voerman JS, et al. Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the IL-23/IL-17 axis[J]. J Immunol, 2009, 182: 5836–5845. DOI:10.4049/jimmunol.0802999 |
| [16] | Swindell WR, Johnston A, Carbajal S, et al. Genome-wide expression profiling of five mouse models identifies similarities and differences with human psoriasis[J]. PLoS One, 2011, 6: e18266. DOI:10.1371/journal.pone.0018266 |
| [17] | Rahman M, Alam K, Ahmad MZ, et al. Classical to current approach for treatment of psoriasis:a review[J]. Endocr Metab Immune Disord Drug Targets, 2012, 12: 287–302. DOI:10.2174/187153012802002901 |
| [18] | Li JH, Hu A, Zheng WJ, et al. Screening of target protein of triptolide on psoriasis by molecular docking[J]. Chin Pharm J (中国药学杂志), 2014, 49: 1133–1138. |
| [19] | Lin CA. Treatment of Tripterygium wilfordii in 78 cases of patients with unusual psoriasis[J]. Chin J Dermatovenereol (中国皮肤性病学杂志), 1995, 9: 175. |
| [20] | Liu MX, Dong J, Yang YJ, et al. Preparation and toxicity of triptolide-loaded poly (D, L-lactic acid) nanoparticles[J]. Acta Pharm Sin (药学学报), 2004, 39: 556–560. |
| [21] | Li XJ, Jiang ZZ, Zhang LY. Triptolide:progress on research in pharmacodynamics and toxicology[J]. J Ethnopharmacol, 2014, 155: 67–79. DOI:10.1016/j.jep.2014.06.006 |
| [22] | Niu F, Li Y, Lai FF, et al. LB-1 exerts antitumor activity in pancreatic cancer by inhibiting HIF-1α and Stat3 signaling[J]. J Cell Physiol, 2015, 230: 2212–2223. DOI:10.1002/jcp.24949 |
| [23] | Zhang JZ. The prevalence and risk factors of psoriasis[J]. Pract J Clin Med (实用医院临床杂志), 2013, 10: 4–6. |
| [24] | Schon MP. Animal models of psoriasis:a critical appraisal[J]. Exp Dermatol, 2008, 17: 703–712. DOI:10.1111/exd.2008.17.issue-8 |
| [25] | Gudjonsson JE, Johnston A, Dyson M, et al. Mouse models of psoriasis[J]. J Invest Dermatol, 2007, 127: 1292–1308. DOI:10.1038/sj.jid.5700807 |
| [26] | Peng LX, Li XY. Advances in animal models of psoriasis[J]. Int J Dermatol Venereol (国际皮肤性病学杂志), 2009, 35: 260–262. |
| [27] | Res PC, Piskin G, de Boer OJ, et al. Overrepresentation of IL-17A and IL-22 producing CD8 T cells in lesional skin suggests their involvement in the pathogenesis of psoriasis[J]. PLoS One, 2010, 5: e14108. DOI:10.1371/journal.pone.0014108 |
| [28] | Ortega C, Fernández AS, Carrillo JM, et al. IL-17-producing CD8+ T lymphocytes from psoriasis skin plaques are cytotoxic effector cells that secrete Th17-related cytokines[J]. J Leukoc Biol, 2009, 86: 435–443. DOI:10.1189/JLB.0109046 |
 2017, Vol. 52
2017, Vol. 52


