地黄为玄参科植物地黄(Rehmannia glutinosa Libosch.)的新鲜或干燥块根, 具有清热生津之功效[1]。研究表明, 地黄叶中主要含有环烯醚萜苷类化合物梓醇及苯乙醇苷类化合物毛蕊花糖苷。近年来, 随着对地黄的深入研究, 人们逐渐开始关注对地黄叶的开发利用, 以期发现其入药的可能。目前, 地黄叶已被收载于1988年版《北京市中药材标准》[2]: “地黄叶苦、寒, 归心、肝、肾经, 清热, 活血, 益气养阴, 补肾, 用于少气乏力, 面色无华, 口干咽燥, 气阴两虚证, 外用于恶疮, 手足癣”。地黄叶总苷胶囊主要药效成分为从地黄叶中提取的苯乙醇苷类[3], 具有滋阴补肾、凉血活血之功, 能够使肾小球通透性增高, 减轻肾小球的高滤过, 从而有减少蛋白尿和保护肾功能的作用, 适用于慢性肾小球肾炎轻症属气阴两虚者。
糖尿病肾病(diabetic nephropathy, DN)是糖尿病患者最常见的微血管病变范畴, 在多种炎症因子的作用下, DN患者出现肾脏纤维化, 最终导致肾功能衰竭, 也是糖尿病患者的主要死亡原因之一[4]。肠道微生物作为数量庞大、种类繁多的微小生命体对人类健康具有重要意义, 肠道细菌在肥胖、糖尿病和心血管疾病等疾病中起着重要作用[5]。大量研究表明, 糖尿病与肠道菌群的种类与数量存在一定的关系。相比正常人, 糖尿病患者体内的益生菌数量则明显减少, 即肠道益生菌的数量对改善血糖水平有一定作用[6]。因此, 肠道菌群的调控已经成为一系列代谢性疾病防控的新方向。
本文在建立糖尿病肾病大鼠模型的基础上, 通过16S rDNA测序的方法研究评价地黄叶总苷提取物和地黄叶总苷胶囊对糖尿病肾病大鼠肠道菌群的调节作用, 以从肠道微环境的角度揭示地黄叶总苷改善糖尿病肾病的作用机制及科学内涵。
材料与方法 仪器与设备RS232G紫外分光光度计(Eppendorf公司); DYY-6C电泳仪, PCR仪2720, 凝胶成像系统, 台式紫外分析仪(BG公司); Agilent, 2100, BioTek, FLx800, Promega, QuantiFluorTBS380 (Agilent公司); Illumina Miseq高通量测序仪(Illumina公司); 三诺血糖仪GA-3型及血糖试纸(三诺公司); AcquityTM UPLC超高效液相色谱系统, XevoTM TQ质谱系统和Masslynx 4.1质谱工作站软件(美国Waters公司)。
实验动物SD大鼠, 雄性, 体质量(220 ± 20) g, 购自浙江省实验动物中心, 动物许可证号: SCXK (浙2014-0001), 动物房温度(22 ± 2) ℃, 湿度(55 ± 10) %, 12 h明暗交替。
药品与试剂地黄叶(产地河南, 经段金廒教授鉴定为玄参科多年生草本地黄Rehmannia glutinosa Libosch.的干燥叶); 厄贝沙坦片购自赛诺菲(杭州)制药有限公司(批号: 5A394);黄葵胶囊购自江苏苏中药业集团股份有限公司(批号: 16060216);地黄叶总苷胶囊购自四川美大康药业股份有限公司(批号: 150802);链脲佐菌素(streptozotocin, STZ)购自美国Sigma公司; 毛蕊花糖苷(acteoside, 批号16012703, 质量分数99.57%)、梓醇(catalpol, 批号15071603, 质量分数98.90%) (中国食品药品检定研究院); 血清尿素氮(serum urea nitrogen, BUN)试剂盒、血肌酐(serum creatinine, Scr)试剂盒和尿蛋白(urine protein, UP)试剂盒购自南京建城生物工程有限公司; 琼脂糖(英杰公司, 75510-019); EB-溴化乙锭清除液(生工生物工程有限公司, EX328); PowerSoil® DNA提取试剂盒(美国MoBio公司, 12888); 5*反应缓冲液, 脱氧核糖核苷三磷酸(dNTP, 10 mmol·L-1), 5* High GC Buffer (美国Sigma公司); Axy Prep DNA Gel Extration试剂盒(美国Axygen公司, AP-GX-500); TruSeq Nano DNA LT Sample Prep试剂盒(武汉锦奥生物科技有限公司, FC-121-4001或FC-121-4002); Agencourt AMPure XP Beads试剂盒(美国Beckman Coulter公司, A63881); Quant-iT PicoGreen dsDNA Assay试剂盒(Invitrogen公司, P7589); Agilent High Sensitivity DNA试剂盒(美国Agilent Technologies公司, 5067-4626);甲酸和乙腈等均为色谱纯; 水为Millipore超纯水。
供试药物的制备与成分分析取地黄叶500 g, 加入80%乙醇回流2 h, 提取3次, 合并提取液, 减压浓缩, 浓缩至生药浓度1.0 g·mL-1, 加入0.5%羧甲基纤维素钠超声溶解配制成0.5 g·mL-1药液, 即为地黄叶总苷提取物(total glycoside extracted from leaves of Rehmannia, TLR), 待用。地黄叶总苷胶囊(dihuangye total glycoside capsule, DTG)为四川美大康药业股份有限公司提供的地黄叶总苷胶囊内容物, 加入0.5%羧甲基纤维素钠超声溶解配制成1 g·mL-1药液。分别取TLR及DTG药液, 13 000 r·min-1离心10 min, 取上清液2 μL进样。
UPLC-TQ-MS条件色谱柱为Acquity UPLC BEH C18 (100 mm × 2.1 mm, 1.7 μm), 流动相为0.1%甲酸水(A)-乙腈(B), 梯度洗脱: 0~3 min, 97% A; 3~9 min, 97%~5% A。体积流量: 0.4 mL·min-1, 柱温: 35 ℃, 进样量: 2 μL。离子化模式: ESI-; 检测方式为多反应检测(MRM方式); 毛细管电压: 3.0 kV; 离子源温度: 150 ℃; 脱溶剂气温度: 550 ℃; 脱溶剂气体积流量: 1 000 L·h-1; 锥孔气体积流量: 50 L·h-1; 碰撞气流量: 0.15 mL·min-1。测定的毛蕊花糖苷及梓醇的主要质谱参数见表 1。
| 表 1 Mass spectrometry parameters of each component |
随机选择6只SD大鼠, 作为正常组(C组), 以普通饲料喂养; 另取42只SD大鼠为造模组, 以高糖高脂饲料+ 5%葡萄糖水喂养。喂养21天后, 记录各组大鼠体质量, 同时造模组腹腔注射STZ 3天, C组腹腔注射枸橼酸缓冲液, STZ给药方法:大鼠实验前禁食12 h, STZ临用前以0.1 mmol·L-1枸橼酸-枸橼酸钠缓冲液(pH 4.5)配制成浓度为1%溶液, 按45 mg·kg-1腹腔内注射[7]。注射STZ 72 h后, 取正常组与造模组大鼠24 h尿液, 测定24 h UP; 采用眼眶后采血, 测定Scr及BUN; 采集血样测定空腹血糖(fasting blood glucose, FBG), 评估造模情况。
动物分组、给药及样品的采集将造模成功的大鼠根据血糖水平随机分为7组:模型组(M)、黄葵胶囊组(0.75 g·kg-1·d-1, HK)、厄贝沙坦组(27 mg·kg-1·d-1, YX)、地黄叶总苷胶囊低剂量组(216 mg·kg-1·d-1, JNL)、地黄叶总苷胶囊高剂量组(360 mg·kg-1·d-1, JNH)、地黄叶总苷提取物低剂量组(4.3 g·kg-1·d-1, DHYL)和地黄叶总苷提取物高剂量组(7.2 g·kg-1·d-1, DHYH)。正常组与模型组灌胃等量的生理盐水。给药组连续灌胃2周药物后, 收集新鲜粪便于-80 ℃条件下保存分析测定。取24 h尿液, 测定24 h UP; 采用腹主动脉采血, 测定Scr及BUN; 采集血样测定FBG。
粪便基因组DNA的提取与检测称取200 mg粪便样品, 采用PowerSoil® DNA提取试剂盒提取粪便DNA, 并用0.8%琼脂糖凝胶电泳判断分子大小, 运用紫外分光光度法对DNA进行定量, 取适量的DNA样品于离心管中, 使用无菌水稀释样品至1 ng·μL-1。
16S rDNA-V4区PCR扩增以上述稀释后的基因组DNA为模板, 进行PCR扩增。PCR反应的条件为: 98 ℃预变性5 min; 98 ℃变性0.5 min; 50 ℃退火0.5 min; 0.5 min延伸72 ℃; 共27个循环; 72 ℃扩展延伸5 min; 4 ℃保存。PCR产物使用2%琼脂糖凝胶进行电泳检测; 根据PCR产物进行等浓度混样, 充分混匀后使用2%琼脂糖凝胶电泳检测PCR产物, 切取目的片段并用Axygen凝胶回收试剂盒回收目的片段。PCR产物进行定量混合后, 使用TruSeq Nano DNA LT Library Prep试剂盒进行测序文库构建并使用MiSeq Reagent Kit V4 (600 cycles)进行2×300 bp的双端测序。前引物序列: ACTCCTACGGGAGGCA GCA; 后引物序列: GGACTACHVGGGTWTCTAAT。
16S rDNA文库构建与高通量测序本实验利用Illumina公司的TruSeq Nano DNA LT Library Prep试剂盒进行建库。采用Illumina MiSeq平台对样本DNA片段进行双端(paired-end)测序。利用FLASH软件(v1.2.7, http://ccb.jhu.edu/software/FLASH/), 对通过质量初筛的双端序列根据重叠碱基进行配对连接。最后, 根据每个样本所对应的Index信息(即Barcode序列, 为序列起始处用于识别样本的一小段碱基序列), 将连接后的序列识别分配入对应样本(要求Index序列完全匹配), 从而获得每个样本的有效序列。
结果 1 供试药物成分分析采用外标法按上述色谱条件检测, 得出地黄叶总苷提取物及地黄叶总苷胶囊中毛蕊花糖苷质量分数分别为6.833和136.1 mg·g-1; 且地黄叶总苷提取物中还含有梓醇6.326 mg·g-1。此外, 地黄叶总苷提取物给药溶液和地黄叶总苷胶囊给药溶液相应剂量中毛蕊花糖苷的含量保持一致。色谱图见图 1。
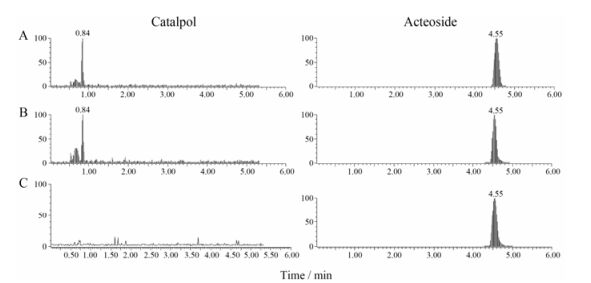
|
Figure 1 MRM chromatogram of reference substances (A), the total glycoside extracted from leaves of Rehmannia (TLR) (B), Dihuangye total glycoside capsule (DTG) (C) |
FBG水平在16.7 mmol·L-1以上的大鼠被认为是糖尿病大鼠, 见表 2。此外, 与正常组相比, 造模组24 h UP的数量、BUN及Scr显著增加(均P < 0.01)。结果显示, 早期糖尿病肾病模型复制成功, 并且存在肾小球滤过功能的损伤。给药15天后, 测定FBG, 并收集24 h尿液, 测定24 h UP量; 腹主动脉取血, 测定Scr及BUN。结果显示, 给药组能显著降低肾小球滤过功能的损伤, 尤其是地黄叶总苷胶囊。见图 2。
| Table 2 The establishment and investigation of diabetic nephropathy rats. FBG: Fasting blood glucose; Scr: Serum creatinine; BUN: Serum urea nitrogen; UP: Urine protein. n = 6, x±s. **P < 0.01 vs control group |
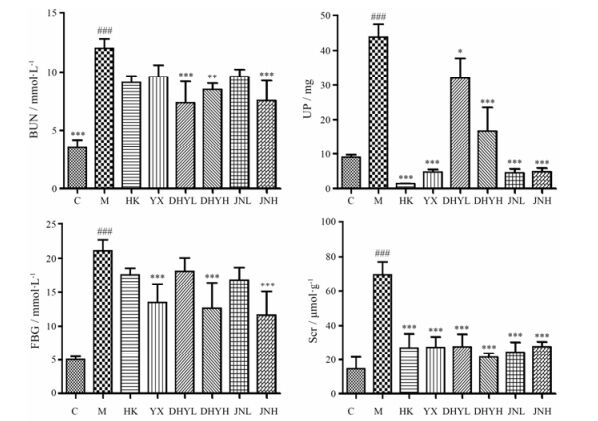
|
Figure 2 Determination of FBG, Scr, BUN and UP among control group, model group and administered group. C: Control group; M: Model group; HK: Huangkui capsule group; YX: Irbesartan group; DHYL: TLR low dose group; DHYH: TLR high dose group; JNL: DTG low dose group; JNH: DTG high dose group. n = 6, x±s. ###P < 0.001 vs C group; *P < 0.05, **P < 0.01, ***P < 0.001 vs M group |
粪便样品高质量序列比例均可达60%以上, 各组粪便样品间无显著性差异, 见表 3。长度分布在300~500 bp内, 长度为450 bp的序列最多, 从序列长度的分布来看, 与16S rDNA-V4区序列长度大致吻合, 可用于后续分析。
| Table 3 High quality sequences of samples. n = 6, x±s |
根据序列的相似性(本分析中阈值设定为97%), 将有效序列归为多个操作分类单元(operational taxonomic units, OTU), 并将OTU中全部序列与相关数据库GreenGenes (http://greengenes.lbl.gov/cgi-binJD_Tutorial/nph-16S.cgi)进行比对, 找出与之最相近且可信度达80%以上的细菌种属信息, 采用QIIME软件分析测序结果。利用Mothur计算在97%的相似水平上每个样品的OTU数量, 可代表样品物种的丰度。在所有样品在门分类水平中, OTU数量最多可达到1 434, 最少为1 002。且样品均不存在未分类OTU。见表 4。
| Table 4 Operational taxonomic units (OTU) classification and classification status identification results. n = 6, x±s |
为比较不同样本的多样性, 首先对OTU丰度矩阵中的全部样本根据最低测序深度统一进行随机重抽样, 即“序列量拉平处理”, 从而校正测序深度引起的多样性差异。随后, 使用QIIME软件分别对每个样本计算多样性指数。Alpha多样性(alpha diversity)反映的是单个样品内部的物种多样性, 通过群落丰度指数与群落多样性指数来衡量, 群落丰度指数包括Chao1和ACE, 此指数值越大说明群落的丰富度越高; 群落多样性指数包括Shannon与Simpson, 此指数值越大, 说明样品的物种多样性越高。结果表明, 由Chao1和ACE指数可看出, 正常组、黄葵胶囊组、厄贝沙坦组、地黄叶总苷低剂量组、地黄叶总苷胶囊低剂量组、地黄叶总苷胶囊高剂量组与模型组相比均有统计学意义(P < 0.05)。且与正常组相比, 模型组的群落丰富度显著降低; Shannon与Simpson指数不具有统计学意义(P > 0.05)。由此可见, 糖尿病肾病可降低大鼠肠道菌群丰富度, 但对物种多样性无显著性差异。由图 3稀疏曲线可看出, 当前测序深度足以反映当前样本所包含的多样性, 继续增加测序深度已无法检测到大量的尚未发现的新OTU。
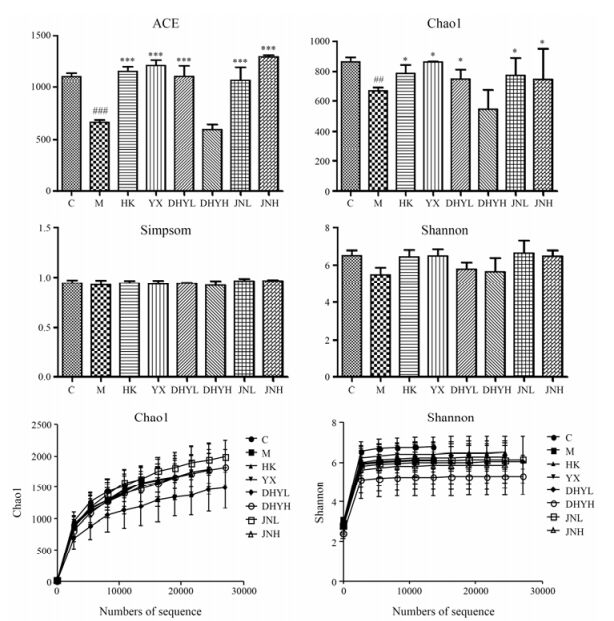
|
Figure 3 Rarefaction curve and diversity index of each group. n = 6, x±s. ##P < 0.01, ###P < 0.001 vs C group; *P < 0.05, ***P < 0.001 vs M group |
对各组中每个样本在分类学水平上的数量进行统计, 并且用柱状图表示在门和属分类学水平上的物种比例。在门的水平上整体的群落结构差异并不大(图 4A)。各组中主要的门水平类有Actinobacteria (放线菌门)、Bacteroidetes (拟杆菌门)、Cyanobacteria (蓝细菌)、Deferribacteres (脱铁杆菌门)、Firmicutes (厚壁菌门)、Proteobacteria (变形菌门)、TM7、Tenericutes (软皮菌类)和Verrucomicrobia (疣微菌门), 其中占比例最多的是厚壁菌门, 其次是拟杆菌门与变形菌门, 革兰阳性菌厚壁菌门与革兰阴性菌拟杆菌门在群落结构上占有绝对优势。在属分类水平上, 如图 4B所示, 在正常组、模型组与各给药组中相对丰度较高的为乳酸杆菌属。
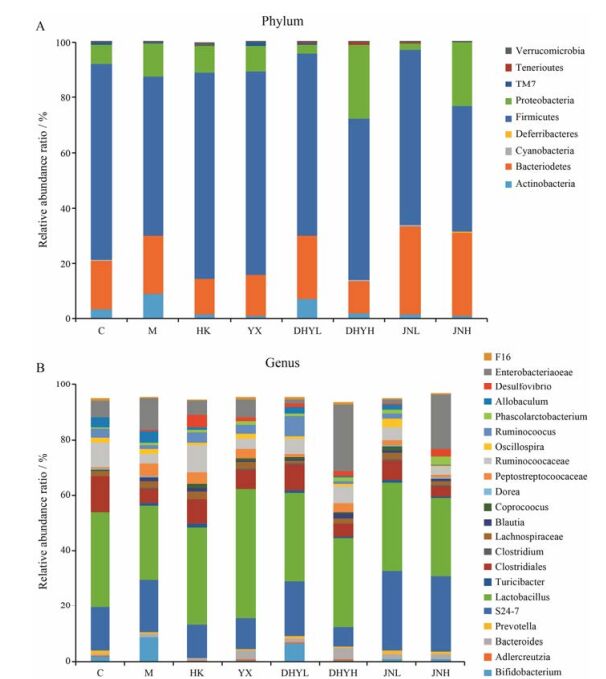
|
Figure 4 The differences in the community composition between the phylum (A) and the genus (B) units. The width of different patches indicates the relative abundance ratio of different species |
通过Galaxy在线分析平台(http://huttenhower.sph.harvard.edu/galaxy/), 提交属水平的相对丰度矩阵进行LEfSe分析。LEfSe能自动对各分类水平的组成进行统计分析, 并能够在组与组之间寻找有统计学差异的物种[8]。经LEfSe分析(图 5), 与正常组相比, 糖尿病肾病模型组大鼠肠道菌群中门、纲、目、科和属分类水平上均发现差异菌群。在科及属分类的菌群中, 双歧杆菌属、传代菌属、消化链球菌科、脱硫弧菌属和SMB53在模型组呈现上调趋势, 乳酸杆菌属、梭菌属、理研菌科和瘤胃菌科在模型组呈现下调趋势。各组药物能不同程度地改善以上肠道菌群在模型组中的相对丰度(图 6)。
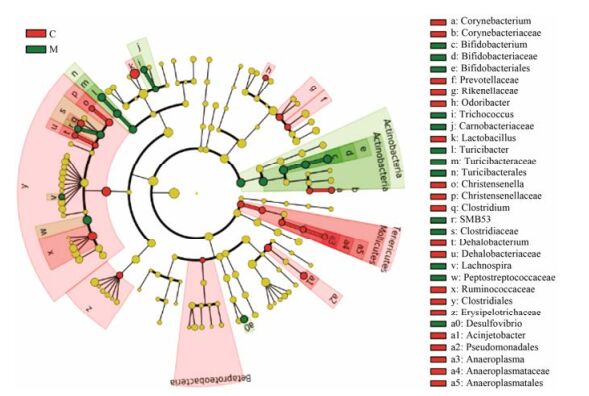
|
Figure 5 Classification of group classification based on classification tree |

|
Figure 6 Average relative abundance of difference features flora in feces of all treatment groups. n = 6, x±s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs C group; *P < 0.05, **P < 0.01, ***P < 0.001 vs M group |
目前制备糖尿病肾脏病大鼠模型的研究比较深入。主要采用高糖高脂饮食加STZ诱导注射或反复诱导的方法。经高糖高脂饮食后可诱导出现胰岛素抵抗, 注射STZ后, 胰岛细胞破坏及功能受损严重, 获得的模型接近于2型糖尿病肾病临床症状。本实验在此糖尿病肾病模型方法的基础进行改良, 采用高糖高脂饲料+5%葡萄糖饮水+小剂量多次注射STZ的方法[7], 结果显示, 高糖引起渗透性利尿, 加速肾脏损伤; 血胰岛素明显升高; 且此方法成模时间相对短, 成模率高, 可用于对糖尿病肾病机制及相关治疗的研究。
本文建立了糖尿病肾病大鼠模型, 并通过16S rDNA测序的方法评价地黄叶总苷提取物和地黄叶总苷胶囊对糖尿病肾病大鼠肠道菌群的调节作用, 以从肠道微环境的角度揭示地黄叶总苷改善糖尿病肾病的作用机制。
研究发现, 与正常组相比, 糖尿病肾病模型组大鼠肠道内菌群从门水平到属水平均发生了变化。Larsen等[9]研究表明, 糖尿病大鼠肠道菌中厚壁菌门/拟杆菌门的比值降低, 且此比值和糖耐量成正相关性。由图 3A所示, 在门分类水平上, 模型组大鼠肠道菌中厚壁菌门丰度下降, 拟杆菌门丰度上升, 主要原因可能是厚壁菌门中多数细菌是产丁酸盐菌[10], 据文献[11, 12]报道丁酸盐是一种抗炎的短链脂肪酸盐, 可为肠黏膜提供营养, 增强肠黏膜免疫。由此说明, 糖尿病肾病造成一定程度的大鼠肠道菌群失调。
值得注意的是, 双歧杆菌为肠道内有益菌群, 而本研究结果显示, 与正常组相比, 模型组双歧杆菌属比例显著增加, 原因可能是高糖状态下, 机体自身发生应激反应, 逆转机体慢性炎症反应状态[13]。在微生物类群中, 乳酸杆菌是一群生活在机体内益于宿主健康的微生物, 其调节免疫功能的作用已被广泛认可[14]。此外, 乳酸杆菌的比例较高, 可增加胰岛素分泌[15]。因此, 增加乳酸杆菌比例被认为对2型糖尿病患者具有降低感染和血糖的保护作用, 提示肠道菌群的改变是糖尿病肾病改善的主要原因之一[16]。与正常组相比, 糖尿病肾病模型组大鼠肠道菌中乳酸杆菌属比例显著降低。这可能是由于尿液或尿酸在体液中积累, 导致大部分富含氮的废弃物通过体内肠道来进行释放, 使得利用其作为营养物质的微生物群落处于优势地位, 导致大鼠肠道微生物菌群失调[17, 18]。给药组中乳酸杆菌属比例有所回升, 尤其是厄贝沙坦组、地黄叶总苷提取物低剂量组和地黄叶总苷胶囊低剂量组, 结果表明地黄叶总苷可改善STZ诱导的糖尿病肾病大鼠肠道菌群的失调。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 20l5: 124-125. |
| [2] | Shen X, Li DF, Zong GZ, et al. Effects of total saponins extracted from leaves of Rehmannia on accelerated nephrotoxic nephritis induced by rabbit IgG in rat[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2010, 16: 167–169. |
| [3] | Kuang YW. Study on the Dynamic Accumulation of Catalpol in Fresh Leaves of Rehmannia glutinosa and Its Anti-psoriasis Effect (鲜地黄叶中梓醇的积累动态及其抗银屑病作用的研究)[D]. Shanghai: Academy of Military Medical Sciences, 2009. http://cdmd.cnki.com.cn/Article/CDMD-90106-2009124618.htm |
| [4] | Lv M, Chen Z, Hu G, et al. Therapeutic strategies of diabetic nephropathy:recent progress and future perspectives[J]. Drug Discov Today, 2015, 20: 332–346. DOI:10.1016/j.drudis.2014.10.007 |
| [5] | Tilg H, Moschen AR. Microbiota and diabetes:an evolving relationship[J]. Gut, 2014, 63: 1513–1521. DOI:10.1136/gutjnl-2014-306928 |
| [6] | Mclean MH, Jr DD, Miller LM, et al. Does the microbiota play a role in the pathogenesis of autoimmune diseases?[J]. Gut, 2015, 64: 332–341. DOI:10.1136/gutjnl-2014-308514 |
| [7] | Lin Q. The Establishment of Rat Model of Type 2 Diabetic Nephropathy and the Inhibitory Effect of Lentiviral Vector-mediated siRNA on Type Ⅰ Collagen (2型糖尿病肾病大鼠模型的建立及慢病毒载体介导siRNA对Ⅰ型胶原抑制作用的研究)[D]. Shanghai: Second Military Medical University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-90024-1011118192.htm |
| [8] | Scher JU, Sczesnak A, Longman RS, et al. Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis[J]. Elife, 2013, 2: e01202. |
| [9] | Larsen N, Vogensen FK, van den Berg FW, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PLoS One, 2010, 5: e9085. DOI:10.1371/journal.pone.0009085 |
| [10] | Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490: 55–60. DOI:10.1038/nature11450 |
| [11] | Hamer HM, Jonkers D, Venema K, et al. Review article:the role of butyrate on colonic function[J]. Aliment Pharmacol Ther, 2008, 27: 104–119. |
| [12] | Louis P, Flint HJ. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine[J]. Fems Microbiol Lett, 2009, 294: 1–8. DOI:10.1111/fml.2009.294.issue-1 |
| [13] | Wang ML, Xu AG. Analysis of intestinal microflora in patients with type 2 diabetes mellitus[J]. J Guangdong Med (广东医学), 2013, 34: 2006–2010. |
| [14] | Cao ZH, Liu YS, Pan HB, et al. Advances in research on probiotics function and mechanism of lactic acid bacteria[J]. Food Sci Technol (食品工业科技), 2015, 36: 366–370, 377. |
| [15] | Simon MC, Strassburger K, Nowotny B, et al. Intake of Lactobacillus reuteri improves incretin and insulin secretion in glucose-tolerant humans:a proof of concept[J]. Diabetes Care, 2015, 38: 1827–1834. DOI:10.2337/dc14-2690 |
| [16] | Lin Z, Zu XP, Xie HS, et al. Research progress in mechanism of intestinal microorganisms in human diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 843–852. |
| [17] | Guo HL, Shao YY, Menghe B, et al. Research on the relation between gastrointestinal microbiota and disease[J]. Microbiol China (微生物学通报), 2015, 42: 400–410. |
| [18] | Vaziri ND, Wong J, Pahl M, et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney Int, 2012, 83: 308–315. |
 2017, Vol. 52
2017, Vol. 52


