2. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
正常人体的肠道细菌重量约为1 kg, 与肝脏重量相当, 它们参与了体内代谢的全过程。这个人体内的“特殊器官”由不同的菌群组成, 与宿主在长期进化过程中形成了能相互交流物质和信息的肠道微生态系统[1]。正常情况下, 肠道菌群保持着动态平衡, 然而, 一旦菌群在定植部位、种类、数量和生物学特性上发生异常变化, 这种平衡被打破, 可引起疾病[2]。溃疡性结肠炎(ulcerative colitis, UC)是一种主要累及直肠、结肠黏膜和黏膜下层的慢性非特异性炎症, 其病因及发病机制尚未明确[3]。越来越多的研究表明:肠道菌群失调与UC的发生密切相关, 其机制可能是肠道菌群紊乱引起肠黏膜的过度免疫反应和持续的肠道慢性炎症, 最终诱发UC的发生[4, 5]。Scanlan等[6]研究表明, IL-10基因敲除小鼠的UC模型组在无菌条件下不会形成肠道炎症, 说明肠道菌群很可能是一个诱导因素, 在UC中发挥作用。
目前临床治疗UC的药物主要有激素、磺胺类和免疫抑制剂等, 但效果均欠佳。黄芩汤出自张仲景《伤寒论》, 由黄芩9 g、白芍6 g、炙甘草6 g、大枣6 g组成, 是清热止痢、和中止痛的经典方剂。临床上应用黄芩汤治疗UC也已取得了显著疗效[7, 8]。本课题组前期研究结果显示:黄芩汤具有抗炎和抗氧化应激作用, 能够明显改善UC模型大鼠的结肠组织病变损伤, 可能是通过抑制TLR4/Myd88/NF-κB通路活化, 进而下调促炎细胞因子NO、IL-17和PGE2表达实现的[9-11]。然而, 黄芩汤与肠道菌群之间的关系尚不清楚。本实验采用高通量测序技术研究黄芩汤对复合法[三硝基苯磺酸(TNBS) +乙醇]诱导UC大鼠模型的肠道菌群的影响。
材料与方法 实验动物雄性Wistar大鼠, 6~8周龄, 体重180~200 g, SPF级, 由北京维通利华实验动物技术有限公司提供。许可证号: SCXK (京) 2012-0001。动物饲养室保持23 ± 1.5 ℃, 相对湿度(45 ± 15) %。
药材、试剂及仪器黄芩(Scutellaria baicalensis Georgi)、白芍(Paeonia lactiflora Pall.)、炙甘草(Glycyrrhiza uralensis Fisch.)和大枣(Ziziphus jujuba Mill.)均购自北京仟草药业有限公司, 经中国中医科学院中药研究所李先端研究员鉴定为合格药材。黄芩汤水提物按照文献[12]方法提取得到。柳氮磺胺吡啶肠溶片(salazosulfapyridine, SASP, 批号: 09150403, 上海信谊天平药业有限公司); TNBS (美国Sigma公司); 大便隐血试验试纸(苏州浩欧博生物医药有限公司); DNA提取试剂盒(Omega Bio-tek公司, 美国); 2%琼脂糖凝胶(Espana); TransStart FastPfu DNA Polymerase (北京全式金生物技术有限公司); AxyPrep DNA Gel Extraction Kit (Axygen Biosciences公司, 美国; 高速台式冷冻离心机(Eppendorf 5424R, 德国); 超微量分光光度计(NanoDrop2000, Thermo Fisher Scientific公司, 美国); 电泳仪(DYY-6C, 北京市六一仪器厂); PCR仪(ABI GeneAmp® 9700, 美国); MISEQ测序仪(Illumina Miseq, 美国)。
造模方法采用Morris等[13]报道的方法制备大鼠UC模型, 大鼠禁食24 h后一次性将TNBS (100 mg·kg-1)和50%乙醇溶液0.25 mL用橡胶输液管缓慢注入距肛门约8 cm处的肠腔内, 捏紧肛门, 倒置5 min即可。对照组注入相同体积的生理盐水, 术后常规饲养。
实验分组及样品采集每只大鼠在代谢笼中单独喂养, 按体重随机平均分为对照组、模型组和黄芩汤给药组, 每组5只。造模3天后开始给药, 黄芩汤给药组以20 g·kg-1给药量灌胃给药; 对照组和模型组灌胃等剂量的生理盐水, 每日1次, 连续10天。末次给药后各组大鼠禁食不禁水, 用代谢笼采集大鼠新鲜粪便3~5粒, 立即放入灭菌后的离心管中, 超低温保存, 以备肠道菌群分析。麻醉处死大鼠, 取出距肛门8 cm处结肠组织, 沿肠系膜缘剪开肠腔, 用生理盐水冲洗肠内容物, 10%甲醛溶液固定肠标本。石蜡包埋进行常规病理切片, 制作3 μm厚连续切片, 苏木精-伊红染色, 于光学显微镜下观察病理组织学改变。
指标检测及方法按照Cooper等[14]方法, 每日称量各组大鼠体重, 记录每组大鼠的大便性状, 采用大便隐血检测试纸对每组大鼠的粪便进行隐血检测, 试纸反应区任何位置出现蓝绿色, 均视为阳性结果。
疾病活动指数(DAI)评分 取大鼠体重下降分数(无, 0分; 1%~5%, 1分; 6%~10%, 2分; 11%~15%, 3分; > 15%, 4分)、大鼠大便隐血分数(阴性, 1分; 阳性, 2分; 血便, 4分)和大鼠大便性状分数(正常, 0分; 软便, 1分; 腹泻, 4分)三者的平均值。在造模后的第1、4、8和12天分别对各组大鼠进行疾病活动指数评分。
病理学指标 肉眼及镜下观察结肠组织形态。按常规包埋、切片, 厚度为4 μm, 进行HE染色, 高倍显微镜下选取视野, 根据溃疡大小、炎症浸润和结构损伤程度等进行结肠组织病变损伤程度比较。
粪便菌群基因组DNA提取与PCR扩增利用DNA提取试剂盒, 依照试剂盒说明书步骤提取大鼠粪便的基因组DNA。PCR扩增细菌16S核糖体RNA基因的V3~V4可变区(扩增条件为: 95 ℃解链3 min, 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 45 s, 25个循环, 再72 ℃延伸10 min), 采用引物338F 5'-ACTCCTACGGGAG GCAGCAG-3', 806R 5'-GGACTACHVGGGTWTCTA AT-3'。对于每个样本, 分别加上8 bp的标签序列。每个样品的扩增均进行3次重复, 反应体系为20 μL, 包括5 × FastPfu Buffer 4 μL、2.5 mmol·L-1 dNTPs 2 μL、引物(5 μmol·L-1)各0.8 μL、FastPfu Polymerase 0.4 μL和模板DNA 10 ng。Illumina MiSeq测序:从2%琼脂糖凝胶中回收扩增子, 依照AxyPrep DNA Gel Extraction Kit说明书进行纯化, 再用QuantiFluorTM-ST进行定量。将纯化后的扩增子等量混合, 根据Illumina MiSeq测序平台的标准流程进行双末端测序。原始数据提交到NCBI Sequence Read Archive (SRA)数据库。
测序得到的原始数据经过 Adapter removing和低质量碱基去除步骤等优化得到Pass filtered data, 再利用Mothur 1.34软件拼接并除去引物。用UPARSE 7.1软件聚类生成操作分类单元(OTU), 相似度为97%。再用UCHIME软件鉴别嵌合体序列, 并将之去除。使用silva (SSU115) 16S核糖体RNA数据库进行分类学比对, 算法为RDP Classifier, 置信阈值为70%[15]。
统计学方法所有数据以均数±标准差(x±s)表示, 采用SPSS 20.0统计软件分析。数据符合正态分布且方差齐时采用单因素方差分析, 否则用秩和检验, P < 0.05为差异有显著统计学意义, P < 0.01为差异有极显著统计学意义, 使用GraphPad Prism 6软件制图。
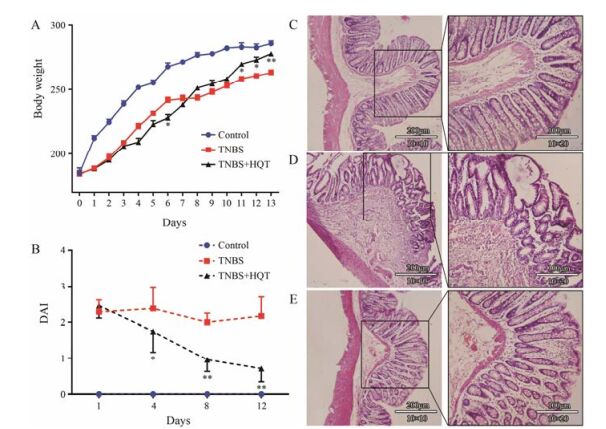
结果 1 一般情况与疾病活动指数评分对照组大鼠在13天实验中反应正常、无腹泻血便, 体重逐渐增加。模型组和黄芩汤给药组在造模后第1~3天出现不同程度的精神萎靡、嗜卧扎堆、体重增长缓慢、进食饮水减少、大便溏或软粒状伴黏冻、个别出现脓血。第4天后, 黄芩汤给药组精神萎靡好转、体重增加、大便脓血情况改善。各组大鼠体重变化见图 1A。DAI评分显示, 第1天模型组和黄芩汤给药组的DAI评分与对照组比较有显著差异(P < 0.01);第4天后, 与模型组比较, 黄芩汤给药组DAI评分显著降低(P < 0.05)。各组大鼠DAI评分见图 1B。
|
Figure 1 Role of Huangqin Tang (HQT) against trinitrobenzene sulfonic acid (TNBS)-induced colitis in rats. Representative H & E-stained colorectum sections (10×10 and 10×20 magnification) in three groups. A: Body weight change after TNBS induction of colitis; B: Disease activity index (DAI) in each group; C: Control group; D: TNBS group; E: TNBS+HQT group. n = 5, x±s. *P < 0.05, **P < 0.01 vs TNBS group |
肉眼观察大鼠结肠组织, 对照组大鼠结肠外观正常, 未见充血, 未见明显病变; 模型组大鼠结肠明显充血, 直肠部位肠黏膜颜色呈褐色, 肠黏膜和肌层明显变薄, 粪便有节, 味恶臭; 黄芩汤给药组大鼠结肠充血, 肠颜色及肠黏膜和肌层厚度与模型组相比有不同程度减轻。
结肠组织HE染色结果见图 1C~E。镜下观察大鼠结肠组织, 对照组大鼠结肠黏膜完整, 肌层结构正常, 未见炎症; 模型组大鼠结肠黏膜有炎症, 细胞浸润, 结肠腺体消失, 被浸润的炎症细胞替代, 个别黏膜层明显变薄, 个别肌层组织炎症较重, 失去了正常结构; 黄芩汤给药组结肠黏膜炎症浸润, 与模型组相比, 肠腺溃疡和肌层病变都有明显改善。
3 菌群的多样性分析采用α和β多样性分析, 描述和评价菌群的整体结构。由表 1显示, OTU数目的变化中, 模型组较对照组有升高趋势, 黄芩汤给药组较模型组有降低趋势, 差异均不显著(P > 0.05)。Shannon指数主要用来估算样本中微生物多样性, Shannon值越大, 说明群落多样性越高。模型组群落多样性较对照组显著升高(P < 0.05), 黄芩汤给药组较模型组有降低趋势。Ace与Chao指数是对菌群物种的总数评估。数据表明, 模型组较对照组有升高趋势, 黄芩汤给药组较模型组有降低趋势, 均无显著性差异。Coverage指数是指各样品文库的覆盖率, 各组数值均在0.9以上, 说明样本序列中未被测出的概率较低。稀释性曲线[15]用来比较测序数据量不同的样本中物种的丰富度, 由图 2A显示, 绝大多数样本曲线趋于平缓, 表明样本所含OTU数量趋于稳定, 测序数据量能够反映样本中总OTU数量。Shannon-Wiener是反映样本中微生物多样性的指数[16], 由图 2B显示, 样本曲线都趋于平缓且分布较为集中, 说明测序数据量足够大, 可以反映样本中绝大多数的微生物信息。Venn图显示, 3组共有610个OTU, 对照组和模型组共有652个OTU, 模型组和黄芩汤给药组共有668个OTU, 如图 2C。PCA主成分分析和PCoA主坐标分析结果显示, 3组菌群结构差异明显(图 2D, E)。基于β多样性距离的非度量多维尺度分析(NMDS), 通过点与点间的距离体现对不同样本间的差异程度, 对照组、模型组和黄芩汤给药组组间样本未重叠(图 2F), 表明组间肠道菌群构成有明显差异。
| Table 1 The rat gut microbiota diversity indexes in various groups. n = 5, x±s. *P < 0.05 vs control group. OUT: Operational taxonomic units |

|
Figure 2 Rarefaction curves determined at the 97% similarity level (A). Shannon-Wiener curves of samples, calculated using mothur (B). Venn diagram of OTU in the three groups (C). Multiple sample PCA analysis (D). Multiple sample PCoA analysis (E). Multiple sample NMDS analysis (F). Samples of the control group indicated by Z, samples of the TNBS group indicated by M, and samples of the TNBS+HQT group indicated by G |
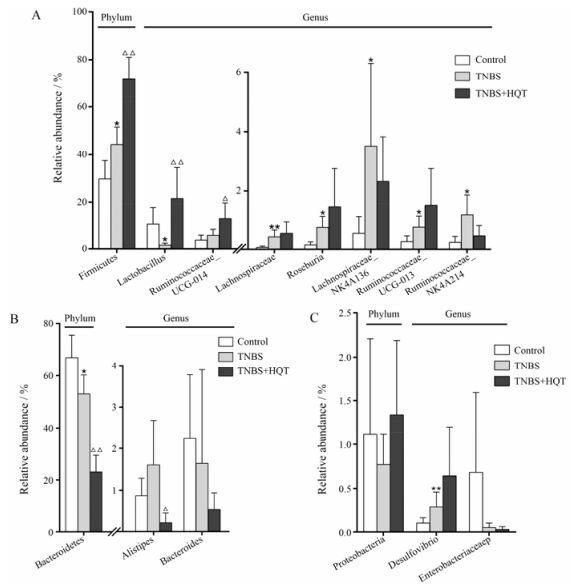
门水平:与对照组相比, 模型组厚壁菌门丰度增多(P < 0.05), 拟杆菌门丰度减少(P < 0.05)。见图 3和表 2。属水平:模型组厚壁菌门的Lactobacillus (乳酸杆菌属)显著减少(P < 0.05), 厚壁菌门的Lachnospiraceae (毛螺菌属)、变形菌门的Desulfovibrio (脱硫弧菌属)显著增多(P < 0.01), 厚壁菌门的Roseburia (罗氏菌属)、Lachnospiraceae_NK4A136_group (毛螺菌属)、Ruminococcaceae_UCG-013、Ruminococcaceae_NK4A214 (瘤胃菌属)显著增多(P < 0.05)。见图 3、图 4和表 2。

|
Figure 3 Gut microbial community structure of 15 samples. A: Microbial community bar plot by phylum; B: Microbial community bar plot by genus. Samples of the control group indicated by Z, samples of the TNBS group indicated by M, and samples of the TNBS+HQT group indicated by G |
| Table 2 The relative abundance of rat gut microbiota in various groups. n = 5, x±s. *P < 0.05, **P < 0.01 vs control group; △P < 0.05, △△P < 0.01 vs TNBS group |
|
Figure 4 Effect of HQT on gut microbial relative abundance in rat. A: Relative abundance within Firmicutes; B: Relative abundance within Bacteroidetes; C: Relative abundance within Proteobacteria. n = 5, x±s. *P < 0.05, **P < 0.01 vs control group; △P < 0.05, △△P < 0.01 vs TNBS group |
门水平:与模型组比较, 黄芩汤给药组厚壁菌门丰度增多(P < 0.01), 拟杆菌门丰度减少(P < 0.01)。见图 3和表 2。属水平:黄芩汤给药组厚壁菌门的Lactobacillus (乳酸杆菌属)显著增多(P < 0.01), Ruminococcaceae_UCG-014 (瘤胃菌属)显著增多(P < 0.05), 拟杆菌门的Alistipes (理研菌属)显著减少(P < 0.05)。见图 3、图 4和表 2。
4.3 菌群的统计学分析为了确定各组之间具有显著差异的细菌类群, 在组间进行了LEfSe (linear discriminate analysis size effect)分析。LEfSe分析是一种广泛用于基因和细菌学分类领域的统计学方法, 可以识别两种或以上生物标志物, 实现多个分组之间的比较, 从而找到组间在丰度上有显著差异的物种。由图 5显示, 对照组在Bacteroidetes (拟杆菌门)、Bacteroidia (拟杆菌纲)、Prevotellaceae (普雷沃氏菌科)、Alloprevotella (拟普雷沃菌属)和Bifidobacterium (双歧杆菌属)丰度较高; 模型组在Bacteroidales_S24_7 (拟杆菌属)、Lachnospiraceae (毛螺菌科)、Rikenellaceae (理研菌科)、Alistipes (理研菌属)和Ruminococcaceae_NK4A214 (瘤胃菌属)丰度较高; 黄芩汤给药组在Firmicutes (厚壁菌门)、Clostridiales (梭菌目)、Clostridia (梭菌属)、Lactobacillaceae (乳酸杆菌科)、Lactobacillus (乳酸杆菌属)、Bacilli (芽孢杆菌纲)、Desulfovibrio (脱硫弧菌属)、Roseburia (罗氏菌属)、Ruminococcaceae (瘤胃菌属)和Lachnospiraceae (毛螺菌属)丰度较高。

|
Figure 5 Difference in dominant microorganisms between groups. A: Distribution histogram based on LDA; B: Cladogram. Samples of the control group indicated by Z, samples of the TNBS group indicated by M, and samples of the TNBS+HQT group indicated by G |
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD), 是一种慢性肠道炎症性疾病。近年来, 许多研究表明, UC与肠黏膜屏障损伤、遗传易感性和环境因素有关[4, 5]。有研究报道IL-10-/-、TRAF6IEC-KO和TMF-/-的小鼠更易诱发溃疡性结肠炎[17, 18]。临床治疗UC通常采用抗炎或免疫抑制药物治疗, 但存在停药后易复发、长期用药不良反应多、部分顽固性病例疗效不理想等缺点[10]。中医药在治疗UC中具有明显的优势, 已有许多临床和实验研究报道[7, 8]。本课题组前期研究已经表明, 黄芩汤通过其抗炎和抗氧化活性能有效改善UC模型大鼠结肠组织病变损伤, 抑制NF-κB通路活化, 降低促炎细胞因子NO、IL-17和PGE2的表达水平。最近, 越来越多的研究集中在肠道菌群失调与UC的关系[19, 20], 其机制可能是肠道菌群紊乱引起肠黏膜的过度免疫反应和持续的肠道慢性炎症, 最终诱发UC的发生[4, 5]。因此, 研究TNBS诱导的大鼠UC模型中黄芩汤与肠道微生物群之间的关系具有重要意义。
在本研究中, 观察黄芩汤在复合法(TNBS+乙醇)诱导的大鼠UC模型中的抗炎作用。模型组大鼠在造模3天后出现不同程度的精神萎靡、双目暗淡、嗜卧扎堆、竖毛、毛泽无光、体重减轻、进食饮水减少、大便溏或软粒状伴黏冻、个别出现脓血。HE染色结果显示, 与模型组相比, 黄芩汤给药组明显改善直肠部肠黏膜颜色和肌层厚度。
肠道微生物群落结构直方图揭示了微生物种类及其相对丰度。在各组中Firmicutes (厚壁菌门)和Bacteroidetes (拟杆菌门)占据了90%以上, 其次是Tenericutes (柔壁菌门)、Proteobacteria (变形菌门)、Verrucomicrobia (疣微菌门)和Cyanobacteria (蓝藻菌门) (图 3A)。在所有样本中均检测出Bacteroidales_ S24-7 (拟杆菌属)、Prevotella_9 (普雷沃氏菌属)、Lactobacillus (乳酸杆菌属)、Ruminococcaceae_UCG-014 (瘤胃菌属)、Lachnospiraceae (毛螺菌属) (图 3B), 这5种菌属丰度之和在每个样品中都超过了50%, 但无论是组内还是组间都存在明显的差异。这也说明了微生物群落的构成存在着很大的个体差异。
本研究采用LEfSe (LDA effect size)确定各组之间具有显著差异的细菌类群。结果表明, 对照组发现12个分类群; 模型组发现11个分类群; 黄芩汤给药组发现27个分类群。Porphyromonadaceae (紫单胞菌科)和Bifidobacteriaceae (双歧杆菌科)只出现在对照组中。有研究表明, 双岐杆菌能够酸化肠道内环境, 抑制腐败菌和病原菌的生长, 保护肠屏障, 减少肉毒素进入血液[21, 22], 说明它们对维持正常肠道菌群平衡有重要的作用; 在模型组中, 显著差异类群包括Bacteroidales_S24_7_group (拟杆菌属)、Lachnospiraceae (毛螺菌属)、Rikenellaceae (理研菌科)、Alistipes (理研菌属), 说明它们在溃疡性结肠炎的活动期发挥重要作用; 在黄芩汤给药组中, 显著差异类群包括Lactobacillus (乳酸杆菌属)、Ruminococcaceae_UCG_014 (瘤胃菌属)、Roseburia (罗氏菌属)、Desulfovibrio (脱硫弧菌属), 表明它们在溃疡性结肠炎的恢复期起重要作用。这些结果说明, 黄芩汤可以改变肠道中的微生物组成并抑制某些细菌的增殖。
已有研究表明[23-25], 乳酸杆菌能够酵解碳水化合物产生乳酸, 帮助人体消化吸收, 酸化肠道内环境, 阻止有害菌在肠上皮的黏附作用, 刺激免疫球蛋白的产生, 增强宿主免疫力的作用。与对照组相比, 模型组乳酸杆菌属显著减少(P < 0.05), 黄芩汤给药后显著增多(P < 0.01)。上述结果表明, 黄芩汤可以促进肠道中益生菌的生长。
Desulfovibrio (脱硫弧菌属)是一种硫酸盐还原菌, 已报道与溃疡性结肠炎、结肠癌和以肥胖、胰岛素抵抗为代表的代谢综合征的发生发展有关[26]。在模型组中, Desulfovibrio丰度显著增多(P < 0.01)。有研究表明, Clostridium leptum (柔嫩梭菌属)与肠道炎症疾病的发生有一定相关性[27]。Zhang等[28]使用C. leptum类群特异性DGGE比较溃疡性结肠炎患者病变黏膜菌与正常黏膜附着的C. leptum亚群的组成, 发现直肠部位病变和正常黏膜C. leptum亚群存在明显差异, 提示该菌群增多与UC的发生相关。本研究中发现, 黄芩汤减少了造模后增多的Clostridium leptum (柔嫩梭菌属)。因此, 黄芩汤在UC恢复期中可以抑制有害菌的增殖。
与对照组相比, 模型组Ruminococcaceae (瘤胃菌属)丰度增多, 其中Ruminococcaceae_UCG-013、Ruminococcaceae_NK4A214显著增多(P < 0.05), Ruminococcaceae_UCG-014增多但不显著。与模型组相比, 黄芩汤给药组Ruminococcaceae_NK4A214减少但不显著, Ruminococcaceae_UCG-014显著增多(P < 0.05), Ruminococcaceae_UCG-013增多但不显著。黄芩汤对溃疡性结肠炎大鼠肠道菌群中的瘤胃菌属出现“双向调节”现象值得进一步深入研究。
综上, 黄芩汤可能通过增加肠道内益生菌丰度, 降低有害菌丰度, 调整肠道的微生态平衡, 从而发挥治疗UC的作用。从中也可以看出疾病与菌群、药物之间存在着复杂的网络关系。基于目前对肠道菌群在UC中的认识, 近年来有研究者提出应用粪便菌群移植[29]来重建UC患者肠腔内菌群平衡, 从而达到治疗目的。但由于目前益生菌、益生元制剂所含菌种有限, 无法完全重建UC患者肠道微生态。这提示, 可以将黄芩汤和微生物制剂联合应用, 为临床用药提供新思路。
| [1] | Shen H. Ulcerative Colitis:the Past, Present and Future of Chinese and Western Medicine (溃疡性结肠炎:中西医的过去、现在与未来)[M]. Nanjing: Southeast University Press, 2012: 29-34. |
| [2] | Yin YN, Wang CL, Liu XW, et al. Gastric and duodenum microflora analysis after long-term Helicobacter pylori infection in Mongolian Gerbils[J]. Helicobacter, 2011, 16: 389–397. DOI:10.1111/j.1523-5378.2011.00862.x |
| [3] | Ordás I, Eckmann L, Talamini M, et al. Ulcerative colitis[J]. Lancet, 2012, 380: 1606–1619. DOI:10.1016/S0140-6736(12)60150-0 |
| [4] | Wang ZJ, Chen YP, Huang JY, et al. Effect of colonning on intestinal microecology in patients with ulcerative colitis[J]. Guandong J Med (广东医学), 2016, 37: 2033–2035. |
| [5] | Lin Z, Zu XP, Xie HS, et al. Research progress in mechanism of intestinal microorganisms in human diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 843–852. |
| [6] | Scanlan PD, Shanahan F, O'Mahony C, et al. Culture-independent analyses of temporal variation of the dominant fecal microbiota and targeted bacterial subgroups in Crohn's disease[J]. J Clini Micro, 2006, 44: 3980–3988. DOI:10.1128/JCM.00312-06 |
| [7] | Yu XD, Lü XZ, Dong WB. Clinical observation on treatment of ulcerative colitis with Huangqin decoction[J]. J Emerg Tradit Chin Med (中国中医急症), 2010, 19: 1510. |
| [8] | Gu ZJ. Investigation of the Therapeutical Mechanisms on the Ulcerative Colitis by Rheum Tanguticum Polysaccharide (大黄多糖治疗溃疡性结肠炎的机制研究)[D]. Xi'an: Fourth Military Medical University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-90032-1013033759.htm |
| [9] | Wang DF, Wang YL, Wang YW, et al. Effect of Huangqin Tang on the function of regulatory TLR4/My D88 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2016, 51: 1558–1563. |
| [10] | Wang YW, Zhang HH, Wang YL, et al. Effect of Huangqin Tang on the regulatory NF-κB p65 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2015, 50: 21–27. |
| [11] | Zhuang SX. Study on the Antioxidative Stress of Huangqin Tang on Ulcerative Colitis Through the Nrf2 Pathway (黄芩汤调控Nrf2通路对溃疡性结肠炎的抗氧化应激作用机制研究)[D]. Beijing: China Academy of Chinese Medical Sciences, 2016. http://cdmd.cnki.com.cn/Article/CDMD-84502-1016240194.htm |
| [12] | Tao L, Zhuang S, Wang Y, et al. Flavonoid profiling of a traditional Chinese medicine formula of Huangqin Tang using high performance liquid chromatography[J]. Acta Pharm Sin B, 2016, 6: 148–157. DOI:10.1016/j.apsb.2016.01.001 |
| [13] | Morris GP, Beck PL, Herridge MS, et al. Hapten-induced model of chronic inflammation and ulceration in the rat co-lon[J]. Gastroenterology, 1989, 96: 795–803. DOI:10.1016/S0016-5085(89)80079-4 |
| [14] | Cooper HS, Murthy SN, Shah RS, et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J]. Lab Invest, 1993, 69: 238–249. |
| [15] | Amato KR, Yeoman CJ, Kent A, et al. Habitat degradation impacts black howler monkey (Alouatta pigra) ga-strointestinal microbiomes[J]. ISME J, 2013, 7: 1344–1353. DOI:10.1038/ismej.2013.16 |
| [16] | Wang Y, Sheng HF, He Y, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags[J]. Appl Environ Microbiol, 2012, 78: 8264–8271. DOI:10.1128/AEM.01821-12 |
| [17] | Bel S, Elkis Y, Elifantz H, et al. Reprogrammed and trans-missible intestinal microbiota confer diminished susceptibility to induced colitis in TMF-/- mice[J]. Proc Nat Acad Sci U S A, 2014, 111: 4964–4969. DOI:10.1073/pnas.1319114111 |
| [18] | Vlantis K, Polykratis A, Welz PS, et al. Original article:TLR-independent anti-inflammatory function of intestinal epithelial TRAF6 signalling prevents DSS-induced colitis in mice[J]. Gut, 2016, 65: 935–943. DOI:10.1136/gutjnl-2014-308323 |
| [19] | Annese V, Daperno M, Rutter MD, et al. European evidence based consensus for endoscopy in inflammatory bowel disease[J]. J Crohns Colitis, 2013, 7: 982–1018. DOI:10.1016/j.crohns.2013.09.016 |
| [20] | Panes J, Bouhnik Y, Reinisch W, et al. Imaging techniques for assessment of inflammatory bowel disease:joint ECCO and ESGAR evidence-based consensus guidelines[J]. J Crohns Colitis, 2013, 7: 556–585. DOI:10.1016/j.crohns.2013.02.020 |
| [21] | Salminen S, Bouley C, Boutron MC, et al. Functional food science and gastrointestinal physiology and function[J]. Br J Nutr, 1998, 80: 147–171. DOI:10.1079/BJN19980108 |
| [22] | Sanz Y, Nadal I, Sánchez E. Probiotics as drugs against human gastrointestinal infections[J]. Recent Pat Anticancer Drug Discov, 2007, 2: 148–156. DOI:10.2174/157489107780832596 |
| [23] | Bernet MF, Brassart D, Neeser JR, et al. Lactobacillus acidophilus LA 1 binds to cultured human intestinal cell lines and inhibits cell attachment and cell invasion by enterovirulent bacteria[J]. Gut, 1994, 35: 483–489. DOI:10.1136/gut.35.4.483 |
| [24] | Ljungh A, Wadström T. Lactic acid bacteria as probiotics[J]. Cur Issues Intes Micro, 2006, 7: 73–90. |
| [25] | Galdeano CM, Perdigon G. The probiotic bacterium Lacto-bacillus casei induces activation of the gut mucosal immune system through innate immunity[J]. Clin Vaccine Immunol, 2006, 13: 219–226. DOI:10.1128/CVI.13.2.219-226.2006 |
| [26] | Chen K. Analysis of Sulfate-Reducing Bacteria in the Gut of Ulcerative Colitis Patients (溃疡性结肠炎患者肠道硫酸盐还原菌的检测)[D]. Shanghai: Shanghai Jiao Tong University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10248-1015028507.htm |
| [27] | Gao XJ, Li T, Wei B, et al. Regulatory mechanisms of gut microbiota on intestinal CYP3A and P-glycoprotein in rats with dextran sulfate sodium-induced colitis[J]. Acta Pharm Sin (药学学报), 2017, 52: 34–43. |
| [28] | Zhang M, Liu B, Zhang Y, et al. Structural shifts of mu-cosa-associated Lactobacilli and Clostridium leptum subgroup in patients with ulcerative colitis[J]. J Clin Micro, 2007, 45: 496–500. DOI:10.1128/JCM.01720-06 |
| [29] | Angelberger S, Reinisch W, Makristathis A, et al. Temporal bacterial community dynamics vary among ulcerative colitis patients after fecal microbiota transplantation[J]. Am J Gastroenterol, 2013, 108: 1620–1630. DOI:10.1038/ajg.2013.257 |
 2017, Vol. 52
2017, Vol. 52


