2. 中国科学院广州生物医药与健康研究院, 广东 广州 510530
2. Guangzhou Institutes of Biomedicine and Health, Chinese Academy of Sciences, Guangzhou 510530, China
阿尔茨海默病(Alzheimer’s disease, AD), 俗称老年痴呆, 是最常见的一种中枢神经退行性疾病。截止到2015年, 全球的老年痴呆患者已有4 680万, 并且在2050年将会达到1.315亿[1, 2], 造成严重的社会负担和经济负担。随着老龄化的进一步加剧, 痴呆患者数量将进一步上升[3], 但迄今为止, AD的诊断和治疗仍没有获得突破性进展, 现有的药物仅能改善患者症状, AD仍是不治之症。
AD发病机制非常复杂, 目前尚不清楚确切的发病机制, 可以确知的是脑内神经元的大量死亡与神经突触的丢失。因此, 通过保护神经元来治疗AD是最直接的手段。目前的策略主要是通过直接作用于神经元[4], 和作用于脑内其他细胞来调控神经元的微环境[5, 6]。
传统AD药物是直接作用于神经元本身, 比如已上市的几种AD药物(多奈哌齐、美金刚和加兰他敏等)均通过调控神经元突触功能起作用, 但仅能改善症状并不能改变AD发病进程。我国对AD药物研究起步较早, 在上世纪80年代浙江省医学科学院和中国科学院上海药物研究所的研究人员就从蛇足草中提取乙酰胆碱酯酶抑制剂石杉碱甲用于治疗痴呆[7]; 上海药物研究所的耿美玉研究团队[8]研制了国际上第一个靶向β-淀粉样蛋白(β-amyloid, Aβ)的寡糖类药物971, 并于2009年实现了成果转让, 该药于2013年7月完成了255例轻中度AD患者Ⅱ期临床研究, 目前正处于Ⅲ期临床研究。当前, 第一大假说Aβ (主要由神经元分泌)和第二大假说的tau蛋白(聚集在神经元胞内)都基于对神经元的直接保护, 也均遭遇重大危机。2016年礼来旗下的Aβ单抗solanezumab[9]及TauRx治疗公司的聚集抑制剂LMTX[10]均在Ⅲ期临床中失败。2017年, 又有3家公司宣布其AD候选药未能通过Ⅲ期临床试验, 分别为默沙东的β分泌酶(beta-site amyloid precursor protein cleaving enzyme, BACE)抑制剂verubecestat (MK-8931)、Accera公司的神经元新陈代谢改善药物AC-1204及灵北制药的选择性五羟色胺受体拮抗剂idalopirdine (Lu-AE58054)。这一系列失败给基于神经元的新药研发前景蒙上了巨大的阴影, 当前急需探索更多的治疗路径来研制抗AD药物。
基于神经胶质细胞调控脑内微环境从而保护神经元[5, 6]的AD新药研发策略正在兴起, 中枢神经系统的微环境主要由神经元与胶质细胞(包括小胶质细胞、星形胶质细胞和少突胶质细胞)组成。基于神经胶质细胞的新药研发目前主要通过抑制神经炎症修复小胶质细胞功能来实现, 小胶质细胞作为中枢神经系统最为重要的免疫效应细胞, 对维持脑的健康发挥着重大作用, 对神经元起着支持、营养和保护的作用。因此, 基于其生理病理功能寻找新靶点和新药已经成为AD药物研发的一条新思路。本综述主要通过小胶质细胞与神经元之间的相互作用来论述靶向小胶质细胞治疗AD的可能性, 并分析相关小分子药物的研究现状来探讨神经炎症抑制剂用于AD治疗的重要意义。
1 小胶质细胞与神经元的相互作用小胶质细胞是中枢神经系统内的吞噬细胞, 在正常生理状态下, 小胶质细胞处于静止状态, 通过细胞突起的拓展和收缩监控其所在脑区的微环境, 监视脑内是否存在病理性物质或细胞碎片[11]; 同时小胶质细胞在神经环路的可塑性调控方面起着重要的作用, 包括参与神经元树突棘的生理性修饰, 释放神经营养因子(脑源性神经营养因子、胶质细胞源性神经营养因子和神经生长因子等)及抗氧化物质等保护神经元[12]。
当被病理性物质(如死亡的神经元、毒性蛋白、外源性异物和病原体等)激活后, 小胶质细胞突起迅速伸展到损伤部位, 同时启动天然免疫反应[13]。小胶质细胞识别病理性物质主要通过受体识别损伤信号相关分子模式(damage-associated molecular patterns, DAMPs)或病原信号相关分子模式(pathogen-associated molecular patterns, PAMPs)[13]。常见的模式识别受体包括Toll样受体(Toll-like receptors, TLR)、NLR样受体(NOD-like receptors, TLR)、甘露糖受体(mannose receptor, MR)、清道夫受体(scavenger receptor, SR)和晚期糖基化终产物受体(receptor for advanced glycation end products, RAGE)等 [13-17]。通过模式识别受体检测到损伤信号后, 小胶质细胞启动胞内相关通路, 释放促炎因子(TNF-α、IL-1β、IL-6和IFNγ等), 通过吞噬清除毒性物质后炎症随之消散[18]。但如果小胶质细胞持续激活, 大量促炎因子或其他神经毒性物质(一氧化氮、过氧化物和兴奋性氨基酸等)的释放将直接影响小胶质细胞对毒性物质的吞噬能力, 同时这些毒性物质会对神经元造成不同程度的损伤, 产生神经毒性[18]。
反过来, 受损的神经元可通过分泌细胞因子、核苷酸及趋化因子等信号分子招募小胶质细胞并调控其活性, 这些信号分子可分为“find me”、“eat me”及“help me”等信号[19]。其中“help me”信号可刺激小胶质细胞保护神经元, 而“find me”信号招募小胶质细胞抵达受损的神经元处, “eat me”信号则协助小胶质细胞清除凋亡的神经元[19]。如神经元可通过CX3CL1/CX3CR1和CD200/CD200R调节小胶质细胞的不同激活表型, 神经元和小胶质细胞之间的这种双向交流对维持脑健康起着至关重要的作用。来自神经元的趋化因子CX3CL1与小胶质细胞上的CX3CR1结合后, 抑制IL-1β、TNF-α和IL-6等炎症因子的产生和释放[20]。另外, 神经元还可以表达CD200作用于小胶质细胞上的CD200R, CD200和CD200R结合后, 受体上的酪氨酸残基磷酸化, 下调酪氨酸激酶活性, 最终抑制p38有丝分裂原激活蛋白激酶(mitogen-activated protein kinase, p38-MAPK)、c-Jun氨基末端激酶(Jun N-terminal kinases, JNK)等炎症信号通路及IL-1β、IL-6和TNF-α等炎症因子[21]。但是, 这种双向交流也易于形成恶性循环, 受损的神经元本身分泌的细胞信号分子活化小胶质细胞, 其持续释放的神经毒性物质将进一步损伤神经元。
2 小胶质细胞在阿尔茨海默病中的重要作用小胶质细胞的异常活化是AD的重要生理特征之一。在AD患者脑内, Aβ斑块附近存在大量的激活态小胶质细胞, 检测发现炎症因子含量明显升高[22]。体内外实验表明, 聚集的Aβ与过度磷酸化的tau蛋白均能直接造成小胶质细胞过度活化, 从而分泌大量炎症因子, 继而激活静息态的胶质细胞, 进一步放大炎症反应[18]。近几年, 全基因组关联研究新发现了多种AD相关危险基因, 如2013年发现的CD33、CR1、TREM2、CD2AP及HLA-DRB5/HLA-DRB1等[23-25], 这些新发现的基因大多与小胶质细胞有关, 这表明以小胶质细胞为基础的神经炎症反应不仅仅是AD发病的次级产物, 更参与到AD发病的各个阶段。TREM2是表达于小胶质细胞表面的免疫受体, 其表达可增强小胶质细胞对Aβ的清除能力[26]。因此, 减弱小胶质细胞过度活化、抑制神经炎症越来越受到人们的关注。
3 基于小胶质细胞的药物开发小胶质细胞介导的神经炎症理论为AD新药开发提供了靶点和思路。药物作用靶点包括在信号转导过程中扮演重要角色的表面受体, 如TLRs、RAGE和过氧化物酶体增殖物活化受体γ (peroxisome proliferator activated receptor γ, PPAR γ)等, 及受体接收信号后活化的下游激酶, 如受体相互作用蛋白1 (receptor-interacting protein, RIP1)和MAPK等。
3.1 Toll样受体TLRs是最常见的模式识别受体之一, 表达于多数免疫细胞, 介导天然免疫反应, 到目前为止, 小鼠中已发现12种TLR, 而在人类中也已发现10种, 其中TLR1-TLR10在两个种属中均相当保守[27]。在小胶质细胞中, TLRs识别侵入性病原体, 启动非特异性免疫。TLRs激活后聚集髓样分化因子88 (myeloid differentiation primary response gene 88, MyD88), 最终激活核转录因子-κB (nulear transcription factor κB, NF-κB)信号通路, 释放炎症因子[28-30]。TLR2和TLR4基因多态性均发现与迟发型AD相关[27], 在AD转基因小鼠模型中, Aβ斑块中TLR2、TLR4、TLR5、TLR7和TLR9的转录水平明显上调[31]。针对不同亚型TLR的小分子抑制剂结构不同, 如基于吗啡酮结构改造的TLR4抑制剂环丙甲羟二羟吗啡酮(图 1, 化合物1)的抑制活性是吗啡酮活性的近100倍, 同时抑制脂多糖(LPS)诱导BV-2小胶质细胞一氧化氮的产生, 在体内也有一定的疗效[32]。Fung等[33]通过基于TLR5结构的高通量筛选获得的天然产物girollion (图 1, 化合物2), 能同时抑制MyD88依赖和非依赖的TLR信号通路, 阻断炎症因子IL-6和IL-8的生成。

|
Figure 1 Toll-like receptor inhibitors |
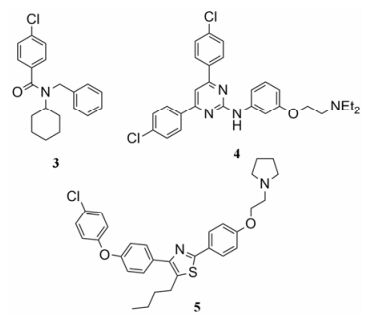
RAGE表达于小胶质细胞和星形胶质细胞等多种神经胶质细胞, 与Aβ结合后激活胶质细胞, 引起炎症级联反应[34]。神经元上的RAGE与Aβ结合后, 刺激NF-κB信号通路诱导释放巨噬细胞集落刺激因子(macrophage colony stimulating factor, M-CSF)[34]。M-CSF与小胶质细胞上M-CSF受体结合后, 引起免疫应答, 促进SR和载脂蛋白E (apoli poprotein, ApoE)的表达, 导致炎症因子TNF-α、IL-1β和IL-6上调[35]。抑制小胶质细胞RAGE表达及活化能够抑制Aβ介导的小胶质细胞炎症反应和脑部Aβ的沉积, 此外还可增强乙酰胆碱酯酶活性, 从而改善认知功能的退化[36]。FPS-ZM1 (图 2, 化合物3)是Deane等[37]研究得到的RAGE抑制剂, 与RAGE V区域结合的Ki值为25 nmol·L-1, 还可抑制转基因小鼠脑内可溶性Aβ的聚集, 同时抑制Aβ与RAGE的结合从而抑制炎症因子的表达, 目前处于临床研究阶段。Han等[38]基于RAGE的空间结构设计, 修饰天然单体argpyrimidine结构得到的氨基吡啶类RAGE抑制剂(图 2, 化合物4), 在转基因小鼠模型的表型筛选中表现出抑制脑部可溶性Aβ的聚集功能, 也能有效抑制Aβ与RAGE的结合。噻唑化合物通过抑制Aβ与RAGE的结合来抑制炎症因子表达[39], 该类化合物是由Lee等[40]通过两种已知的拮抗剂结构设计得到的。其中三取代的噻唑化合物(图 2, 化合物5)抑制Aβ与RAGE结合的半数抑制浓度(IC50)值为0.91 μmol·L-1, 剂量在10 μmol·L-1时抑制率达到64.2%。
|
Figure 2 RAGE antagonists |
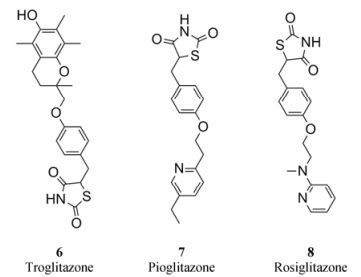
PPARγ将炎症与新陈代谢联系起来, 参与炎症反应和体内稳态控制, 在小胶质细胞内促进PPARγ的激活能够降低促炎因子的表达, 发挥抗炎作用[39]。PPARγ激动剂包括恶唑烷二酮类化合物和部分非甾体抗炎药。近年来研究表明, 恶唑烷二酮类化合物能够通过抑制小胶质细胞活化起到保护神经元的功能, 干预中枢神经退行性疾病[41]。治疗2型糖尿病的药物曲格列酮(troglitazone, 图 3, 化合物6)、吡格列酮(pioglitazone, 图 3, 化合物7)和罗格列酮(rosiglitazone, 图 3, 化合物8)都是PPARγ抑制剂。吡格列酮和罗格列酮都能抑制Aβ诱导的小胶质细胞激活[42], 显著减少AD模型动物脑部淀粉样蛋白。曲格列酮可通过上调PPARγ活性抑制LPS诱导的BV2细胞在炎症状态下的诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)表达, 罗格列酮也在2005年被报道能够改善轻度认知障碍和早期AD症状[41]。
|
Figure 3 PPARγ inhibitors |
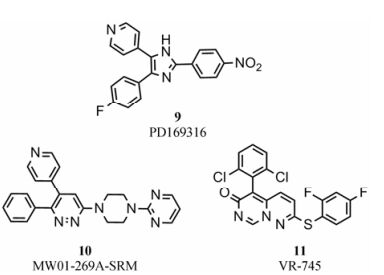
MAPK是一种蛋白激酶, 在多种不同的细胞信号转导途径中充当共同的信号转导成分, 可调节基因表达、细胞增殖、分化、有丝分裂和凋亡等过程。p38-MAPK是MAPK家族中的一员, 存在4种亚型(α、β、γ和δ)[43]。炎症刺激可激活p38-MAPK, 影响生物体内致炎与抗炎因素的平衡。p38-MAPK可在转录水平上调节iNOS和环氧化酶-2 (cyclooxygenase, COX-2)的表达[43], 上调TNF-α和IL-1β等促炎因子的表达, 在炎症反应中起重要作用。尸检发现AD患者脑内p38-MAPK活性明显增加, 其上游通路中MKK6含量同样增加, 这些均发生在AD的早期[44, 45]。p38-MAPK可逆抑制剂PD169316[46] (图 4, 化合物9)的IC50值为89 nmol·L-1, 通过抑制p38-MAPK信号通路可以抑制注射Aβ的大鼠的海马体神经元凋亡。小分子化合物MW01-269A-SRM[47] (图 4, 化合物10)在体外实验中表现出选择性抑制p38α-MAPK活性的能力, 在AD模型小鼠中能够减少海马体中IL-1β、TNFα和S100β蛋白含量, 并对小鼠的行为缺陷有所改善, 为后续p38抑制剂用于治疗AD的研究打下基础。p38-MAPK抑制剂VR-745[48] (图 4, 化合物11)同样表现出很好的抑制活性和临床疗效, 用于AD的治疗已进入临床Ⅱ期。
|
Figure 4 p38-MAPK inhibitors |
RIP1是调控细胞坏死和凋亡的重要上游激酶, 同时也参与多种炎症信号通路, 能够接受TNF和TLR家族配体刺激引发炎症反应[49-53]。通过TNF受体1, RIP1驱动多条炎症信号通路[Fas配体、TNF相关凋亡诱导配体(TNF-related apoptosis-inducing ligand, TRAIL)、TLR3及TLR4][52]。抑制RIP1的活性可以作为多种炎症疾病的治疗手段。哈佛大学医学院袁钧瑛博士[54]设计了第一个RIP1激酶小分子抑制剂Nec-1 (图 5, 化合物12), 研究表明Nec-1能够有效减轻APP/PS1小鼠的认知损伤, 同时降低脑内Aβ及tau异常。目前Nec-1的临床Ⅰ期研究在欧洲启动, 希望完成安全性研究后将这一药物应用在肌萎缩性脊髓侧索硬化症及AD的治疗中。Harris等[55]优化得到的RIP1小分子抑制剂(IC50 = 10 nmol·L-1, 图 5, 化合物13)结合RIP1磷酸化位点起到抑制其活性的作用, 由于结构上的延展性, 该化合物可以成为较好的先导物。手性小分子GSK963[56] (图 5, 化合物14)作为高选择性的RIP1抑制剂, 在激酶检测实验中IC50值为8 nmol·L-1, 优于Nec-1 (IC50 = 1 μmol·L-1), 有助于揭示RIP1激酶在炎症反应中的角色。

|
Figure 5 RIP1 inhibitors |
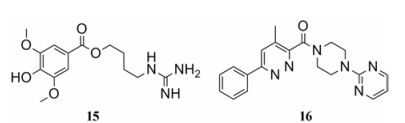
表型筛选在新药, 尤其是“first-in-class”的创新药研发中扮演最重要角色[57]。据统计, 从1999到2008年间美国FDA通过的50种首次发现的小分子新药中, 有17种是通过靶标药物筛选, 28种是通过表型筛选得到的。对于AD这种机制复杂、靶标未明的疾病, 通过神经免疫细胞的表型筛选, 和AD模型小鼠记忆和认知能力评价显然是发现新药的最重要途径。复旦大学朱依谆教授研究组[58]发现益母草碱(SCM-198) (图 6, 化合物15)能够抑制小胶质细胞过度活化, 减轻Aβ诱导的大鼠认知损伤, 同时该化合物对降脂和治疗脑卒中具有明显疗效, 近期该化合物已成功转让。另外, 本研究组[59]通过小胶质细胞表型筛选发现的哌哒甲酮(图 6, 化合物16)能够有效抑制神经炎症, 在多种AD模型上均能改善认知能力, 同时还能保护神经元, 该化合物目前已经获得国家食品药品监督管理局(CFDA)的临床试验批准, 将于近期推进Ⅰ期临床研究。
|
Figure 6 Unknown target neuro-inflammation inhibitors |
小胶质细胞作为神经系统的免疫效应细胞, 在中枢神经系统病变和炎症反应中发挥着重要作用。小胶质细胞释放炎症因子和神经元表面受体接收信号的各个通路并非彼此孤立, 而是相互渗透相互协调, 这为基于小胶质细胞功能障碍的神经退行性疾病药物研发提供了更多靶点和思路, 研究人员可以基于参与炎症反应的各个表面受体和一系列下游激酶结构功能设计神经炎症抑制剂。虽然在临床前已有多个化合物表现出较好的临床前药效, 但由于免疫系统的复杂性, 还需在基础和临床研究上进行更深入的探讨。
AD在全球范围内尚无有效的治疗手段, 因此, 各国的AD创新药均处于同一起跑线上。近年来, 一系列针对Aβ药物和Tau药物未能满足主要终点而失败, 也迫切需要研究者改变当前AD药物研发的现状, 需要各学科的科学家、医学家“八仙过海, 各显其能”, 任何可能的探索都值得去尝试。需要强调的是, 对于AD这样的复杂疾病, 单一靶点药物可能难以奏效, 联合用药会是未来AD的解决方案。本研究组的探索和候选新药[59], 也是希望未来能与其他药物形成联合用药的方式治疗AD。
| [1] | Global Observatory for Ageing and Dementia Care and the PSSRU. Improving healthcare for people living with dementia coverage, quality and costs now and in the future[R]. London:Alzheimer's Disease International, 2016. |
| [2] | Alzheimer's Disease International. The global economic impact of dementia[R]. London:Alzheimer's Disease International, 2010. |
| [3] | Wang J, Xia Y, Grundkeiqbal I, et al. Abnormal hyperphosphorylation of Tau:sites, regulation, and molecular mechanism of neurofibrillary degeneration[J]. J Alzheimer's Dis, 2013, 33: 123–139. |
| [4] | Wang XY, Chen J, Zhang JT. Effect of ginsenoside Rg1 on learning and memory impairment induced by β-amyloid peptide (25-35) and its mechanism of action[J]. Acta Pharm Sin (药学学报), 2001, 36: 1–4. |
| [5] | Lambertsen KL, Clausen BH, Babcock AA, et al. Microglia protect neurons against ischemia by synthesis of tumor necrosis factor[J]. J Neurosci, 2009, 29: 1319–1330. DOI:10.1523/JNEUROSCI.5505-08.2009 |
| [6] | Kerschensteiner M, Stadelmann C, Dechant G, et al. Neurotrophic cross-talk between the nervous and immune systems:implications for neurological diseases[J]. Ann Neurol, 2003, 53: 292–304. DOI:10.1002/(ISSN)1531-8249 |
| [7] | Wang R, Yan H, Tang X, et al. Progress in studies of huperzine A, a natural cholinesterase inhibitor from Chinese herbal medicine[J]. Acta Pharmacol Sin, 2006, 27: 1–26. DOI:10.1111/aphs.2006.27.issue-1 |
| [8] | Fan Y, Hu J, Li J, et al. Effect of acidic oligosaccharide sugar chain on scopolamine-induced memory impairment in rats and its related mechanisms[J]. Neurosci Lett, 2005, 374: 222–226. DOI:10.1016/j.neulet.2004.10.063 |
| [9] | Doody RS, Thomas RG, Farlow MR, et al. Phase 3 trials of solanezumab for mild-to-moderate Alzheimer's disease[J]. N Engl J Med, 2014, 370: 311–321. DOI:10.1056/NEJMoa1312889 |
| [10] | Gauthier S, Feldman HH, Schneider LS, et al. Efficacy and safety of tau-aggregation inhibitor therapy in patients with mild or moderate Alzheimer's disease:a randomised, controlled, double-blind, parallel-arm, phase 3 trial[J]. Lancet, 2016, 388: 2873–2884. DOI:10.1016/S0140-6736(16)31275-2 |
| [11] | Davalos D, Grutzendler J, Yang G, et al. ATP mediates rapid microglial response to local brain injury in vivo[J]. Nat Neurosci, 2005, 8: 752–758. DOI:10.1038/nn1472 |
| [12] | Panja D, Bramham CR. BDNF mechanisms in late LTP formation:a synthesis and breakdown[J]. Neuropharmacology, 2014, 76 Pt C: 664–676. |
| [13] | Guan Y, Ranoa DR, Jiang S, et al. Human TLRs 10 and 1 share common mechanisms of innate immune sensing but not signaling[J]. J Immunol, 2010, 184: 5094–5103. DOI:10.4049/jimmunol.0901888 |
| [14] | Sterka D, Marriott I. Characterization of nu-cleotide-binding oligomerization domain (NOD) protein expression in primary murine microglia[J]. J Neuroimmunol, 2006, 179: 65–75. DOI:10.1016/j.jneuroim.2006.06.009 |
| [15] | Galea I, Palin K, Newman TA, et al. Mannose receptor expression specifically reveals perivascular macrophages in normal, injured, and diseased mouse brain[J]. Glia, 2005, 49: 375–384. |
| [16] | Khoury JE, Hickman SE, Thomas CA, et al. Scavenger receptor-mediated adhesion of microglia to beta-amyloid fibrils[J]. Nature, 1996, 382: 716–719. DOI:10.1038/382716a0 |
| [17] | Srikanth V, Maczurek AE, Phan TG, et al. Advanced glycation end products and their receptor RAGE in Alzheimer's disease[J]. Neurobiol Aging, 2011, 32: 763–777. DOI:10.1016/j.neurobiolaging.2009.04.016 |
| [18] | Hickman S, Allison E, El Khoury J. Microglial dysfunction and defective beta-amyloid clearance pathways in aging Alzheimer's disease mice[J]. J Neurosci, 2008, 28: 8354–8360. DOI:10.1523/JNEUROSCI.0616-08.2008 |
| [19] | Li Y, Du X, Liu C, et al. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo[J]. Dev Cell, 2012, 23: 1189–1202. DOI:10.1016/j.devcel.2012.10.027 |
| [20] | Limatola C, Ransohoff RM. Modulating neurotoxicity through CX3CL1/CX3CR1 signaling[J]. Front Cell Neuro-sci, 2014, 8: 229. |
| [21] | Hernangomez M, Carrillosalinas FJ, Mecha M, et al. Brain innate immunity in the regulation of neuroinflammation:therapeutic strategies by modulating CD200-CD200R interaction involve the cannabinoid system[J]. Curr Pharm Design, 2014, 20: 4707–4722. DOI:10.2174/1381612820666140130202911 |
| [22] | McGeer PL, Itagaki S, Tago H, et al. Reactive microglia in patients with senile dementia of the Alzheimer type are positive for the histocompatibility glycoprotein HLA-DR[J]. Neurosci Lett, 1987, 79: 195–200. DOI:10.1016/0304-3940(87)90696-3 |
| [23] | He X, Sun BG. Roles of microglia and immune receptors in Alzheimer's disease[J]. Acta Pharm Sin (药学学报), 2014, 49: 774–780. |
| [24] | Crehan H, Holton P, Wray S, et al. Complement receptor 1(CR1) and Alzheimer's disease[J]. Immunobiology, 2012, 217: 244–250. DOI:10.1016/j.imbio.2011.07.017 |
| [25] | Singaraja RR. TREM2:a new risk factor for Alzheimer's disease[J]. Clin Genet, 2013, 83: 525–526. DOI:10.1111/cge.12108 |
| [26] | Melchior B, Garcia A, Hsiung B, et al. Dual induction of TREM2 and tolerance-related transcript, Tmem176b, in amyloid transgenic mice:implications for vaccine-based therapies for Alzheimer's disease[J]. Asn Neuro, 2010, 2: 157–170. |
| [27] | O'Neill LA, Bowie AG. The family of five:TIR-domain-containing adaptors in Toll-like receptor signaling[J]. Nat Rev Immunol, 2007, 7: 353–364. DOI:10.1038/nri2079 |
| [28] | Laplantine E, Fontan E, Chiaravalli J. NEMO specifically recognizes K63-linked poly-ubiquitin chains through a new bipartite ubiquitin-binding domain[J]. EMBO J, 2009, 28: 2885–2895. DOI:10.1038/emboj.2009.241 |
| [29] | Su F, Bai F, Zhou H, et al. Microglial toll-like receptors and Alzheimer's disease[J]. Brain Behav Immun, 2016, 52: 187–198. DOI:10.1016/j.bbi.2015.10.010 |
| [30] | Wang LZ, Tian Y, Yu JT, et al. Association between late-onset Alzheimer's disease and microsatellite polymorphisms in intron Ⅱ of the human toll-like receptor 2 gene[J]. Neurosci Lett, 2011, 489: 164–167. DOI:10.1016/j.neulet.2010.12.008 |
| [31] | Frank S, Copanaki E, Burbach GJ, et al. Differential regulation of toll-like receptor mRNAs in amyloid plaque-associated brain tissue of aged APP23 transgenic mice[J]. Neurosci Lett, 2009, 453: 41–44. DOI:10.1016/j.neulet.2009.01.075 |
| [32] | Selfridge BR, Wang X, Zhang Y, et al. Structure-activity relationships of (+)-naltrexone-inspired toll-like receptor 4(TLR4) antagonists[J]. J Med Chem, 2015, 58: 5038–5052. DOI:10.1021/acs.jmedchem.5b00426 |
| [33] | Fung S, Sofiyev V, Schneiderman J, et al. Unbiased screening of marine sponge extracts for anti-inflammatory agents combined with chemical genomics identifies girolline as an inhibitor of protein synthesis[J]. ACS Chem Biol, 2014, 9: 247–257. DOI:10.1021/cb400740c |
| [34] | Li M, Shang DS, Zhao WD, et al. Amyloid beta interaction with receptor for advanced glycation end products up-regulates brain endothelial CCR5 expression and promotes T cells crossing the blood-brain barrier[J]. J Immunol, 2009, 182: 5778–5788. DOI:10.4049/jimmunol.0803013 |
| [35] | Fang F, Lue L, Yan S, et al. RAGE-dependent signaling in microglia contributes to neuroinflammation, Aβ accumulation, and impaired learning/memory in a mouse model of Alzheimer's disease[J]. FASEB J, 2010, 24: 1043–1055. DOI:10.1096/fj.09-139634 |
| [36] | Arancio O, Zhang H, Chen X, et al. RAGE potentiates Aβ-induced perturbation of neuronal function in transgenic mice[J]. EMBO J, 2004, 23: 4096–4105. DOI:10.1038/sj.emboj.7600415 |
| [37] | Deane R, Singh I, Sagare AP, et al. A multimodal RAGE-specific inhibitor reduces amyloid β-mediated brain disorder in a mouse model of Alzheimer disease[J]. J Clin Invest, 2012, 122: 1377–1392. DOI:10.1172/JCI58642 |
| [38] | Han YT, Choi G, Son D, et al. Ligand-based design, synthesis, and biological evaluation of 2-aminopyrimidines, a novel series of receptor for advanced glycation end products (RAGE) inhibitors[J]. J Med Chem, 2012, 55: 9120–9135. DOI:10.1021/jm300172z |
| [39] | Landreth G, Jiang Q, Mandrekar S, et al. PPARγ agonists as therapeutics for the treatment of Alzheimer's disease[J]. Neurotherapeutics, 2008, 5: 481–489. DOI:10.1016/j.nurt.2008.05.003 |
| [40] | Lee YS, Kim H, Kim Y, et al. Synthesis and structure-activity relationships of tri-substituted thiazoles as RAGE antagonists for the treatment of Alzheimer's disease[J]. Bioorg Med Chem Lett, 2012, 22: 7555–7561. DOI:10.1016/j.bmcl.2012.10.022 |
| [41] | Watson GS, Cholerton BA, Reger MA, et al. Preserved cognition in patients with early Alzheimer disease and amnestic mild cognitive impairment during treatment with rosiglitazone:a preliminary study[J]. Am J Geriatr Psychiatry, 2005, 13: 950–958. |
| [42] | Combs CK, Johnson DE, Karlo JC, et al. Inflammatory mechanisms in Alzheimer's disease:inhibition of β-amyloid-stimulated proinflammatory responses and neurotoxicity by PPARγ agonists[J]. J Neurosci, 2000, 20: 558–567. |
| [43] | Lee JC, Laydon JT, McDonnell PC, et al. A protein kinase involved in the regulation of inflammatory cytokine biosynthesis[J]. Nature, 1994, 372: 739–746. DOI:10.1038/372739a0 |
| [44] | Sun A, Liu M, Nguyen XV, et al. p38 MAP kinase is acti-vated at early stages in Alzheimer's disease brain[J]. Exp Neurol, 2003, 183: 394–405. DOI:10.1016/S0014-4886(03)00180-8 |
| [45] | Zhu X, Rottkamp CA, Hartzler A, et al. Activation of MKK6, an upstream activator of p38, in Alzheimer's disease[J]. J Neurochem, 2001, 79: 311–318. |
| [46] | Ashabi G, Alamdary SZ, Ramin M, et al. Reduction of hippocampal apoptosis by intracerebroventricular administration of extracellular signal-regulated protein kinase and/or p38 inhibitors in amyloid beta rat model of Alzheimer's disease:involvement of nuclear-related factor-2 and nuclear factor-κB[J]. Basic Clin Pharmacol, 2013, 112: 145–155. DOI:10.1111/bcpt.2013.112.issue-3 |
| [47] | Munoz L, Ralay RH, Roy SM, et al. A novel p38 alpha MAPK inhibitor suppresses brain proinflammatory cytokine up-regulation and attenuates synaptic dysfunction and behavioral deficits in an Alzheimer's disease mouse model[J]. J Neuroinflamm, 2007, 4: 21. DOI:10.1186/1742-2094-4-21 |
| [48] | Bagley MC, Davis T, Dix MC, et al. Microwave-assisted Ullmann C-S bond formation:synthesis of the P38alpha MAPK clinical candidate VX-745[J]. J Org Chem, 2009, 749: 8336–8342. |
| [49] | Silke J, Rickard JA, Gerlic M. The diverse role of RIP kinases in necroptosis and inflammation[J]. Nat Immunol, 2015, 16: 689–697. DOI:10.1038/ni.3206 |
| [50] | Degterev A, Huang Z, Boyce M, et al. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J]. Nat Chem Biol, 2005, 1: 112–119. DOI:10.1038/nchembio711 |
| [51] | Degterev A, Hitomi J, Germscheid M, et al. Identification of RIP1 kinase as a specific cellular target of necrostatins[J]. Nat Chem Biol, 2008, 4: 313–321. DOI:10.1038/nchembio.83 |
| [52] | Lukens JR, Vogel P, Johnson GR, et al. RIP1-driven auto-inflammation targets IL-1alpha independently of inflam-masomes and RIP3[J]. Nature, 2013, 498: 224–227. DOI:10.1038/nature12174 |
| [53] | Ofengeim D, Yuan J. Regulation of RIP1 kinase signaling at the crossroads of inflammation and cell death[J]. Nat Rev Mol Cell Biol, 2013, 14: 727–736. DOI:10.1038/nrm3683 |
| [54] | Yang SH, Lee DK1, Shin J, et al. Nec-1 alleviates cognitive impairment with reduction of Aβ and tau abnormalities in APP/PS1 mice[J]. EMBO Mol Med, 2017, 9: 61–77. DOI:10.15252/emmm.201606566 |
| [55] | Harris PA, King BW, Bandyopadhyay D, et al. DNA-encoded library screening identifies benzo[J]. J Med Chem, 2016, 59: 2163–2178. DOI:10.1021/acs.jmedchem.5b01898 |
| [56] | Berger SB, Harris P, Kasparcova K, et al. Characterization of GSK'963:a structurally distinct, potent and selective inhibitor of RIP1 kinase[J]. Cell Death Discov, 2015, 1: 15009. DOI:10.1038/cddiscovery.2015.9 |
| [57] | Moffat JG, Vincent F, Lee JA, et al. Opportunities and challenges in phenotypic drug discovery:an industry perspective[J]. Nat Rev Drug Discov, 2017, 16: 531–543. DOI:10.1038/nrd.2017.111 |
| [58] | Hong ZY, Shi XR, Zhu K, et al. SCM-198 inhibits microglial overactivation and attenuates Aβ1-40-induced cognitive impairments in rats via JNK and NF-кB pathways[J]. J Neuroinflamm, 2014, 19: 147. |
| [59] | Zhou W, Zhong G, Fu S, et al. Microglia-based phenotypic screening identifies a novel inhibitor of neuroinflammation effective in Alzheimer's disease models[J]. ACS Chem Neurosci, 2016, 7: 1499–1507. DOI:10.1021/acschemneuro.6b00125 |
 2017, Vol. 52
2017, Vol. 52


