2. 中国医学科学院, 北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Natural Products and Functions, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
二甲双胍(metformin, Met)是包括美国糖尿病学会、欧洲糖尿病学会、国际糖尿病联盟和中国糖尿病学会等众多权威学会推荐的治疗2型糖尿病的一线用药[1-3]。二甲双胍通过激活AMPK, 改善肝脏和肌肉的胰岛素抵抗, 是其抗高血糖作用的基础[4-6]。正常平稳的血糖可减少高血糖对胰岛的毒性作用, 从而改善胰岛β细胞功能。然而其对胰岛细胞的直接作用及机制并未进行深入的探讨。
胰岛β细胞具有高度发达的内质网, 机体依赖其分泌胰岛素。高糖或高脂情况下, 胰岛素分泌的工作负荷巨大, 导致了内质网应激(endoplasmic reticulum stress, ERS)的激活并促进了细胞凋亡与糖尿病的发生[7, 8]。
因此, 本研究采用高脂饮食诱导的2型糖尿病C57BL/6J小鼠, 长期给予二甲双胍, 采用高葡萄糖钳夹技术评价其对胰岛β细胞功能的影响, 并检测了胰腺中与胰腺增殖与成熟、脂质代谢相关的基因及内质网应激相关的基因与蛋白变化, 探讨二甲双胍对糖尿病小鼠模型的胰岛β细胞功能可能的作用机制, 为其临床合理应用提供依据。
材料与方法药品与试剂 盐酸二甲双胍片, 澳大利亚艾华大药厂; 胰岛素(优泌林), 美国礼来制药公司; 胰岛素ELISA试剂盒, ALPCO公司; Real-time PCR试剂盒, Takara公司; PDX-1 (sc-25403)、ATF4 (sc-200)、CCAAT-enhancer-binding protein homologous protein (CHOP, sc-575), Santa Cruz Biotechnology公司; phosphorylated eIF2α (Ser51, 9721), 美国Cell Signaling Technology公司; 内参蛋白β-actin, Abmart公司。
动物分组 正常雄性C57BL/6J小鼠, 购自北京维通利华实验动物技术有限公司, 许可证编号为SCXK (京) 2002-0003。饲养于中国医学科学院药物研究所动物室SPF级动物房。喂养正常饲料至14周龄时, 开始给予高脂饮食(脂肪含量20%)。高脂喂养4个月, 模型即可形成。根据空腹血糖、胰岛素耐量实验中给予胰岛素后40 min时的血糖下降百分数、甘油三酯(triglyceride, TG)、胆固醇(cholesterol, CHO)与体重(body weight, BW)等5个指标将小鼠均匀分为2组, 分别为模型组(model)、二甲双胍组(model+Met, 每日200 mg·kg-1), 分组情况见表 1。另取正常雄性C57小鼠10只作为正常对照组(control, Con); 模型及给药组, 每组动物各10只。给药体积为0.05 mL/10 g体质量, 每天给药1次, 连续给药58天。自第1天起每隔3日测定1次体重。
| Table 1 Animal grouping. C57 mice were grouped according to the fasting blood glucose (FBG), blood glucose (BG) decrease at 40 min in the insulin tolerance test (ITT), triglycerides (TG), cholesterol (CHO) and body weight (BW). There is no significance between the two groups. n = 10, mean ± SEM |
动物实验和取材 给药第52天, 每组取4~6只动物进行高血糖钳夹实验, 考察胰岛β细胞功能的变化; 动物处死后分离胰腺, 放置于液氮中迅速冷冻, 然后置于低温冰箱保存, 用于检测胰腺生化指标的变化及分子机制探讨研究。第58天, 处死每组未做高糖钳夹实验的动物, 组织取材同上, 取胰腺用于免疫组化检测。
腹腔注射葡萄糖耐量实验(IPGTT) 给药第49天, 动物禁食4 h (自由饮水)后, 腹腔注射葡萄糖(2 g·kg-1)。分别于糖负荷前的0时, 糖负荷后的30、60、120 min尾尖采血10 µL。测定血糖与血脂含量。采用葡萄糖氧化酶法测定血糖, 并计算血糖曲线下面积(AUC), 公式如下:
AUC (mg·dL-1·h-1) = (BG0 + BG30)×15/60 + (BG30 + BG60) × 15/60 + (BG60 + BG120) × 30/60
(BG0、BG30、BG60、BG120分别代表给予葡萄糖负荷后0、30、60、120 min的血糖值)。
高血糖钳夹实验(hyperglycemic clamp technique) 动物禁食4~6 h后, 用戊巴比妥钠进行麻醉(50 mg·kg-1, ip), 固定于实验台, 经颈总静脉行插管手术以输注葡萄糖。待动物状态平稳后, 开始高糖钳夹实验。尾尖采集血样。经静脉插管并于1 min内输注葡萄糖(250 mg·kg-1), 使小鼠血糖在5 min内急剧上升达到较高水平, 之后持续输入10%葡萄糖。定期测定血糖, 并根据实时血糖调整葡萄糖输注速率(glucose infusion rate, GIR)。当血糖平稳且接近14 mmol∙L-1时, 增加测定频率, 每5 min测定一次血糖。当连续4次测定血糖值均为14 ± 0.5 mmol∙L-1时, 即达到钳夹稳态期。取0、5、10、15 min及钳夹稳态期时的血样用于测定胰岛素水平。胰岛素含量用ELISA方法测定。实验中GIR值代表了胰岛β细胞的功能, 其计算公式为GIR (mg·kg-1·min-1) =葡萄糖输注速率(mL·min-1) × 100 (mg·mL-1) ÷体重(g)。
胰腺病理形态 待血糖钳夹实验结束后, 处理剩余的动物, 分离胰腺, 生理盐水冲洗。拭干后, 取胰尾部分用Bourin’s液固定, 常规石蜡包埋, 5 μm切片, 进行HE染色。
胰腺组织中与增殖、胆固醇代谢及内质网应激相关因子mRNA与蛋白表达水平检测
mRNA表达水平的检测 取胰腺组织100 mg, 加入Trizol裂解。目的基因扩增的采用两步法, 预变性, 95 ℃ 30 s, 95 ℃ 5 s→60 ℃ 31 s, 40个循环。测定各基因的溶解温度Ct值, 并将各个样本的Ct值与其内参基因β-actin的Ct值通过数据处理计算出2-ΔΔCt, 使数据统一化, 比较目的基因的组间差异。目的基因引物序列如下:胰十二指肠同源框因子-1 (Pdx-1), 5'-CCCGAATGGAACCGAGCCT-3' (F), 5'-CCCGAG GTCACCGCACAAT-3' (R); 肝X受体蛋白β (Lxr-β), 5'-AAGGACTTCACCTACAGCAAGGA-3' (F), 5'-AA GGACTTCACCTACAGCAAGGA-3' (R)。
蛋白表达水平的检测 胰腺组织约100 mg, 加入蛋白裂解液, 超声匀浆, 充分裂解, 冰浴放置。离心后取上清, 获得总蛋白样品。采用Western blot检测目的蛋白。
统计学处理 数据采用mean ± SEM表示, 多组间比较采用方差分析, P<0.05为差异有统计学意义。
结果 1 二甲双胍对C57小鼠体质量的影响自给药第4天起, model+Met组小鼠的体质量呈下降趋势。自给药第16天起, model+Met组体质量与model组相比显著下降(图 1, P<0.05)。第43天起, 体重下降趋势更加明显(P<0.01)。结果提示, 二甲双胍对体质量有显著的减轻作用。
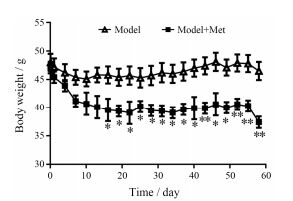
|
Figure 1 Body weight of C57 mice were recorded every three days during 58 days treated with vehicle or metformin (Met, 200 mg·kg-1 ig, once daily). n = 8-10, mean ± SEM. *P < 0.05, **P < 0.01 vs model group |
给药第49天, 二甲双胍显著降低胰岛素抵抗小鼠的血浆TG (表 2, P<0.05) 与总CHO(P<0.05), 提示二甲双胍对血脂的调节与脂质代谢紊乱的改善作用。
| Table 2 Plasma lipid levels in C57 mice after 49 days of treatment of metformin. n = 8-10, mean ± SEM. #P < 0.05, ###P < 0.001 vs Con group; *P < 0.05 vs model group |
给药第49天, 腹腔注射葡萄糖并测定C57小鼠的糖耐量。Model组小鼠0时血糖与Con组相比, 无显著差异(表 3)。Model+Met组0时血糖显著低于model组(P<0.01), 30 min时的血糖及时间-血糖曲线的AUC显著低于model组(P<0.05), 提示二甲双胍治疗后的C57小鼠胰岛β细胞功能有所改善。
| Table 3 Plasma glucose level and area under the curve (AUC) of introperitoneal glucose tolerance test (IPGTT) after 49 days treatment of metformin. After 4 h of fasting, the mice were injected with 2 g·kg-1 glucose. Glucose at 0, 30, 60 and 120 min were tested and the AUC was calculated according to glucose levels. n = 8-10, mean ± SEM. #P < 0.05, ##P < 0.01 vs Con group; *P < 0.05, **P < 0.01 vs model group |
至钳夹实验稳态期时, 各实验组的血糖均值均已调节至14 ± 0.5 mmol∙L-1 (图 2A)。在维持相同稳态血糖水平下与model组小鼠相比, model+Met组的GIR值显著增加, 增长率为77.7% (P<0.05, 图 2B)。表明给予二甲双胍治疗后, C57小鼠胰岛β细胞对葡萄糖刺激的胰岛素分泌反应性有所增加, 胰岛素分泌功能增强。二甲双胍组空腹血清胰岛素显著低于模型组, 提示胰岛素抵抗状态得以缓解(图 2C, P<0.05)。二甲双胍组给予葡萄糖刺激后, 胰岛素的一相(图 2D, P<0.001) 及钳夹稳态期的胰岛素分泌的增加比率显著高于模型组(图 2D, P<0.05)。上述结果提示:长期给予二甲双胍能显著改善C57小鼠糖刺激的胰岛素分泌功能。
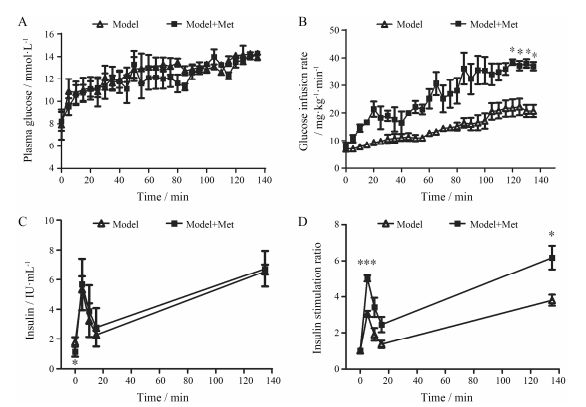
|
Figure 2 The β-cell sensitivity to glucose in C57 mice is improved after treatment of metformin. A: Plasma glucose; B: Glucose infusion rate; C: Plasma insulin level; D: Insulin stimulation ratio during the hyperglycemic clamp in C57 mice treated with vehicle or metformin for 52 days. Mice were fasted for 4-6 h before the experiment. n = 4-5, mean ± SEM. *P < 0.05, ***P < 0.001 vs model group |
通过HE染色可以观察到, 与Con组(图 3A)相比, model组C57小鼠的胰岛中会出现脂肪空泡、血肿及一定程度的炎性浸润, 胰岛边缘形态不规则化(图 3B)。给予二甲双胍后, 胰岛中脂肪空泡缩小、囊肿和血肿明显减少, 胰岛形态规则化(图 3C)。上述结果提示, 二甲双胍可一定程度恢复2型糖尿病C57小鼠的胰岛形态。
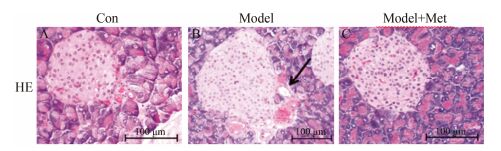
|
Figure 3 The effects of metformin on histopathological morphology of the pancreas of C57 diabetic mice. A: Control group; B: Model group; C: Model+Met group. Arrow, fat drop and fibroblast. HE, hematoxylin and eosin staining |
Pdx-1是胰腺发育、成熟和分化的重要调节基因。Model组C57小鼠胰腺中Pdx-1显著低于Con组, 提示该模型的胰腺增殖及胰岛素合成能力减低; 二甲双胍能显著上调C57小鼠胰腺中Pdx-1的mRNA表达(图 4A, P<0.01)。Model组小鼠胰腺中胆固醇代谢关键基因Lxr-β的mRNA表达较Con组显著减少, 表明该模型动物胰腺中存在胆固醇代谢紊乱状态(图 4B, P<0.001)。二甲双胍能显著上调胰腺内Lxr-β的mRNA表达水平(图 4B, P<0.01)。上述结果提示:二甲双胍可能通过促进胆固醇代谢和胰腺增殖, 从而改善C57小鼠的胰岛β细胞功能。

|
Figure 4 Pdx-1 (A) and Lxr-β (B) mRNA levels. Total RNA was extracted from pancreas of C57 mice and analyzed by real-time PCR. Results are means ± SEM determined from three experiments performed in triplicate or quadruplicate and are expressed as fold-change of mRNA levels in control C57 mice pancreas. ##P < 0.01, ###P < 0.001 vs Con group; **P < 0.01 vs model group |
Western blot结果显示(图 5A), 与Con组相比, model组小鼠胰腺中的PDX-1蛋白表达水平显著降低(图 5B, P<0.01);内质网应激相关因子, 包括PERK通路中的磷酸化eIF2α (P<0.01), 及其下游的ATF4 (P<0.01) 和CHOP (P<0.01) 蛋白表达量较Con组显著增加(图 5C~E), 提示C57小鼠胰腺存在典型的内质网应激。与model组相比, model+Met组小鼠胰腺中的PDX-1蛋白表达显著增加(图 5B, P<0.01); PERK通路中的eIF2α磷酸化水平有所降低, 但无显著差异(图 5C, P = 0.10), 其下游的ATF4 (图 5D, P<0.001) 和CHOP (图 5E, P<0.05) 蛋白表达量也较model组显著减少。该结果提示, 二甲双胍对C57小鼠的内质网应激状态的缓解可能主要是通过调节PERK通路中的ATF4与CHOP实现。
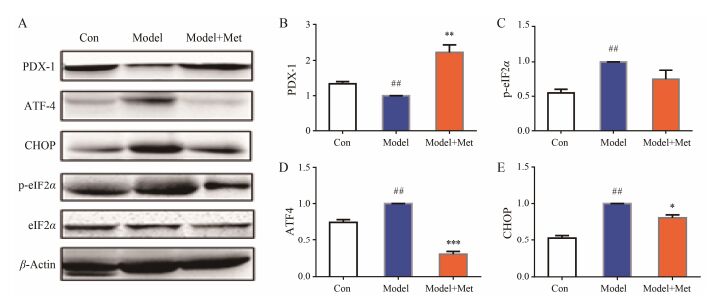
|
Figure 5 Western blot analysis (A) comparing changes in pancreatic protein expression of PDX-1 (B), phosphorylated eIF2α (C), ATF4 (D) and CHOP (E) of C57 mice. Total eIF2α and β-actin protein served as loading controls. All the bands were quantified by densitometry and are expressed as fold change compared with control. n = 3-4, mean ± SEM. ##P < 0.01 vs Con group; *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
2型糖尿病患者的血糖水平可通过运动和合理饮食加以干预。但对大部分人群而言, 药物干预是最有效的方式。与其他降糖药相比, 二甲双胍的优越性在于很少引起低血糖, 体质量增加。因此, 2017年版《美国糖尿病学会指南》给出的建议为[1]: 2型糖尿病患者一旦确诊, 应当立即服用二甲双胍。此外, 近年来多项研究报道了二甲双胍的多重作用, 如对癌症及心血管疾病的益处[9, 10]。因此, 探讨其作用机制对解释其多重作用及指导联合用药意义深远。
本研究采用了高葡萄糖钳夹技术测定胰岛细胞功能。该技术是评价胰岛细胞功能的金标准[11]。实验中得到的胰岛素分泌曲线及GIR值, 能够体现胰岛素的双相分泌及最大分泌量。本研究中的结果显示, 二甲双胍能够显著增加高葡萄糖钳夹实验中的GIR值(P<0.05), 并可增加静脉葡萄糖刺激后一相的胰岛素分泌量(P<0.001) 和钳夹稳态时的β细胞的最大分泌能力(P<0.05)。表明二甲双胍能使C57小鼠β细胞对葡萄糖刺激的反应性增强, 胰岛素分泌能力增加。
因此, 后续实验探索了上述观察到的二甲双胍改善作用的可能机制。实时荧光定量PCR结果显示, 二甲双胍可显著上调C57小鼠胰腺中Pdx-1 (P<0.01) 与Lxr-β (P<0.01) 基因的表达。Pdx-1是促进胰腺发育和胰岛细胞分化的重要调节因子[12], 上述结果提示二甲双胍可一定程度促进胰腺的增殖。此外, 肝X受体(LXR)是一个核激素受体, 其主要作用是感应和调节机体的胆固醇稳态[13, 14]。本研究中的结果提示二甲双胍可能通过改善脂质代谢从而增强C57小鼠胰岛细胞功能。
内质网应激可激活3条信号通路, 包括IRE1α、PERK及ATF6通路。短期的内质网应激可缓解胞内错误折叠蛋白堆积的压力, 然而长期的内质网应激状态则会诱导细胞凋亡。PERK通过形成二聚体可使eIF2α磷酸化, 后者可以阻止eIF2/GTP/Met-tRNAi翻译起始复合物的形成而抑制蛋白质的合成, 从而减少蛋白质在内质网腔内的堆积。eIF2α长期活化可激活下游的ATF4, 并启动CHOP诱导的凋亡[15]。
本研究考察了PERK通路中相关蛋白的变化。结果显示, 二甲双胍可通过下调PERK通路中的eIF2α的磷酸化、ATF4和CHOP蛋白的表达, 增加胰岛素合成相关因子PDX-1的表达, 一定程度缓解C57小鼠胰岛细胞中内质网应激状态。上述结果表明, 二甲双胍很可能通过作用于PERK通路, 调节eIF2α-ATF4-CHOP而改善C57小鼠的胰岛β细胞功能。
此外, 本研究并未考察二甲双胍对内质网应激的另两条通路: ATF6与IRE1α的影响。因此, 二甲双胍对胰岛细胞的益处不能排除对这两条通路的调控, 这是本研究的局限之一。因此, 今后的研究会更加全面及深入探讨二甲双胍对这两条通路的调控, 并采用基因沉默等手段的干预, 明确内质网应激在二甲双胍对胰岛细胞的功能影响中扮演的角色。
综上所述, 二甲双胍可改善2型糖尿病小鼠C57BL/6J胰岛细胞对葡萄糖刺激的胰岛素分泌, 增加其胰岛素分泌功能。其机制可能与促进胰腺增殖与脂质代谢, 缓解内质网应激压力有关。然而, 对内质网应激通路的干预是直接或间接作用, 仍然有待后期的探索与阐明。
| [1] | Chamberlain JJ, Herman WH, Leal S, et al. Pharmacologic therapy for type 2 diabetes:synopsis of the 2017 American Diabetes Association Standards of Medical Care in Diabetes[J]. Ann Intern Med, 2017, 166: 572–578. DOI:10.7326/M16-2937 |
| [2] | Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes:a patient-centered approach:position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD)[J]. Diabetes Care, 2012, 35: 1364–1379. DOI:10.2337/dc12-0413 |
| [3] | Mu YM, Ji LN, Ning G, et al. Chinese experts consensus statement on metformin in the clinical practice:2016 updated[J]. Chin J Diabetes (中国糖尿病杂志), 2016, 24: 871–884. |
| [4] | Zhou G, Myers R, Li Y, et al. Role of AMP-activated protein kinase in mechanism of metformin action[J]. J Clin Invest, 2001, 108: 1167–1174. DOI:10.1172/JCI13505 |
| [5] | Moreno-Navarrete JM, Ortega FJ, Rodríguez-Hermosa JI, et al. OCT1 expression in adipocytes could contribute to increased metformin action in obese subjects[J]. Diabetes, 2011, 60: 168–176. DOI:10.2337/db10-0805 |
| [6] | Tahrani AA, Bailey CJ, Del Prato S, et al. Management of type 2 diabetes:new and future developments in treatment[J]. Lancet, 2011, 378: 182–197. DOI:10.1016/S0140-6736(11)60207-9 |
| [7] | Laybutt DR, Preston AM, Akerfeldt MC, et al. Endoplas-mic reticulum stress contributes to β cell apoptosis in type 2 diabetes[J]. Diabetologia, 2007, 50: 752–763. DOI:10.1007/s00125-006-0590-z |
| [8] | Haataja L, Manickam N, Soliman A, et al. Disulfide mispairing during proinsulin folding in the endoplasmic reticulum[J]. Diabetes, 2016, 65: 1050–1060. DOI:10.2337/db15-1345 |
| [9] | Anabtawi A, Miles JM. Metformin:non-glycemic effects and potential novel indications[J]. Endocr Pract, 2016, 22: 999–1007. DOI:10.4158/EP151145.RA |
| [10] | Burla AK, Lobato NS, Fortes ZB, et al. Cardiac fibrosis and vascular remodeling are attenuated by metformin in obese rats[J]. Int J Cardiol, 2013, 165: 483–487. DOI:10.1016/j.ijcard.2011.09.012 |
| [11] | DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique:a method for quantifying insulin secretion and resistance[J]. Am J Physiol, 1979, 237: E214–E223. |
| [12] | Johnson JD, Bernal-Mizrachi E, Alejandro EU, et al. Insulin protects islets from apoptosis via Pdx1 and specific changes in the human islet proteome[J]. Proc Natl Acad Sci U S A, 2006, 103: 19575–19580. DOI:10.1073/pnas.0604208103 |
| [13] | Li X, Zhang S, Blander G, et al. SIRT1 deacetylates and positively regulates the nuclear receptor LXR[J]. Mol Cell, 2007, 28: 91–106. DOI:10.1016/j.molcel.2007.07.032 |
| [14] | Nomiyama T, Bruemmer D. Liver X receptors as therapeutic targets in metabolism and atherosclerosis[J]. Curr Athero-scler Rep, 2008, 10: 88–95. DOI:10.1007/s11883-008-0013-3 |
| [15] | Eizirik DL, Cardozo AK, Cnop M. The role for endoplasmic reticulum stress in diabetes mellitus[J]. Endocr Rev, 2008, 29: 42–61. DOI:10.1210/er.2007-0015 |
 2017, Vol. 52
2017, Vol. 52


