阿尔茨海默病(Alzheimer's disease, AD)是一种由多因素引起的神经退行性疾病, 其发病机制较为复杂, 包括: β-淀粉样蛋白(amyloid β-protein, Aβ)的异常沉积、tau蛋白的过度磷酸化和线粒体异常等[1, 2]。据国际阿尔茨海默病协会统计, 全球AD患者约4 600万, 预计到2030年, 将达到7 470万[3]。然而, 目前临床使用的药物仅有乙酰胆碱抑制剂和N-甲基-D-天冬氨酸受体拮抗剂, 且治疗效果都不尽如人意[4]。因此, 对于AD这种多因素疾病, 单一靶标的干预很难得到理想的效果。治疗多因素疾病时, 研究者逐渐改变单靶点药物治疗的思路, 并向多靶点、多通路的思路转变, 中药作为天然药物的重要组成部分, 有多成分-多靶点的治疗机制, 且越来越多的天然药物通过FDA认证[5]。因此, 阐明中药治疗多基因类疾病的物质基础及分子机制, 受到了研究者广泛的关注和重视。
远志, 始载于《神农本草经》, 性辛、温, 味苦, 归心、肾、脾经, 具有安神益智、交通心肾等功效[6];现代药理学研究证明[7], 远志具有改善学习记忆、抗氧化、保护神经元和保护心脑血管等作用; 临床应用与实验研究表明[8], 远志具有明确改善阿尔茨海默病病理表现的作用。然而, 由于阿尔茨海默病发病的病因和病机比较复杂, 且远志中化学成分多样, 通过实验进行研究存在一定的困难。虽然有实验研究表明, 远志中化学成分具有保护脑活性和抗AD的作用, 但是其治疗AD的主要活性成分和分子机制尚未完全阐明。因此, 本研究运用系统药理学的思路和方法, 从分子角度及系统水平分析远志防治阿尔茨海默病的药效活性成分和可能的分子网络机制, 挖掘远志的潜在治疗作用, 以期为临床使用提供科学依据。
材料与方法小分子数据库的构建 收集TCMID数据库[9] (http://www.megabionet.org/tcmid/)中远志化学成分结合已报道的远志化学成分相关文献[8, 10-13], 共得到远志中的化学成分111个。由ChemSpider[14] (http://www.chemspider.com/Default.aspx)、PubChem (https://pubchem.ncbi.nlm.nih.gov/)数据库中下载上述化学成分的2D分子结构文件, 截止数据分析时, 暂未被数据库收录, 但已有文献报道的成分通过Chemdraw软件进行2D分子结构的绘制。将上述所有2D分子结构文件转化为3D结构, 构建小分子数据库。
ADME评估 ADME/T (absorption, distribution, metabolism and excretion of drugs/toxicity)是由王永华团队[15]所开发的一种借助机器学习、计算化学及现代统计学等方法来预测药物先导分子与机体相互作用的中药系统药理学方法模型。将上述搜集整理后的化学成分通过ADME/T模型, 主要参考口服生物利用度(bioavailability, OB)和类药性(drug-likeness, DL)两个关键参数进行活性化合物的筛选。继而使用Discovery Studio (DS)软件中ADME模块[16]对筛选后的化学成分进行血脑屏障通透性(blood brain barrier, BBB)考察, 并以打分所得血脑屏障通透性水平(BBB level)为评判标准。
靶点预测及验证 Pharmmapper服务器(http://59.78.96.61/pharmmapper)是一个免费访问的Web服务器, 它运用反向药效团匹配的方法通过对TargetBank、Binding DB、DrugBank与PDTD数据库的检索, 自动为给定小分子(药品、天然产物或其他新发现的化合物与未识别的连接靶点)找到最佳的映射靶点[17, 18]。将通过OB、DL和BBB筛选出的小分子, 以MOL2的格式上传到Pharmmapper在线分析平台, 其中Select Targets Set选择Human Protein Targets Only (v2010, 2241), 其余参数均为默认设置。本研究将上述预测到的靶点信息与TTD (Therapeutic Target Database, http://bidd.nus.edu.sg/group/cjttd/)、CTD (Comparative Toxicogenomics Database, http://ctdbase.org/)数据库中阿尔茨海默病的靶点进行验证, 筛选出有明确抗阿尔茨海默病的靶点。
构建成分-靶点-疾病网络模型 根据上述远志化学成分-潜在靶点预测结果, 应用Cytoscape软件分别构建靶点-疾病(target-disease, T-D)与化学成分-靶点网络(component-target, C-T)模型, 并运用软件中Merge功能, 将两个网络模型合并成化学成分-靶点-疾病(component-target-disease, C-T-D)网络模型。运用软件中Network analyer功能, 进一步对网络模型中的相互关系进行分析。
通路分析及靶点功能注释 将筛选的靶点, 进一步映射到KEGG数据库(http://www.kegg.jp/)中, 并且将对应的通路进行整理与分析, 运用Visio软件进行通路图的绘制。同时通过MAS3.0 (http://bioinfo.capitalbio.com/mas3/)生物分子功能注释平台对上述靶点进行GO富集分析, 将Species选择Homo sapiens (Human); Molecule Type选择protein; Database Symbols选择UniProtKB; Functions选择gene、mRNA、protein和pathway, 其余参数为默认设置, 并且将富集的疾病部分进行MeSH (https://www.nlm.nih.gov/mesh/)分类分析。
结果 1 主要活性成分与潜在靶蛋白分析本研究将收集的111个远志化学成分, 分别用C1~C111表示(表 1)。通过ADME评估, 以OB≥ 30%、DL≥0.18[19]和BBB level≥3[20]为标准, 对111个化学成分进行筛选, 得到符合条件的成分共10个, 分别为:皂苷类化合物1个、远志口山酮类化合物3个、寡糖脂类化合物3个和其他类3个。将上述10个化学成分, 通过Pharmmapper服务器与TTD、CTD数据库验证后, 预测出关于AD的作用靶点共13个: β-分泌酶(beta-secretase 1, BACE1)、钙调蛋白(calmodulin, CALM1)、凝血素(prothrombin, F2)、糖原合酶激酶-3β (glycogen synthase kinase-3 beta, GSK3β)、胰岛素样生长因子(insulin-like growth factor Ⅰ, IGF1)、胰岛素样生长因子1受体(insulin-like growth factor 1 receptor, IGF1R)、尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, PLAU)、过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor gamma, PPARγ)、超氧化物歧化酶(superoxide dismutase, SOD2)、胆碱酯酶(cholinesterase, BCHE)、一氧化氮合酶(nitric-oxide synthase, NOS3)、雌激素受体(estrogen receptor, ESR)、胱氨酸天冬氨酸蛋白酶(caspase-3, CASP3) (表 2)。将化学成分与靶点对应关系进行分析后发现, 化合物1, 3, 6, 7-tetramethoxyxanthone的口服生物利用度最高, 为102.4%, 显示此化合物口服时, 通过胃肠道中的被动吸收, 进入血液循环后的疗效可能得到较好地发挥。其次为化合物3-hydroxy-2, 8-dimeth oxyxanthone (99.07%)和tenuifoliose D (92.44%); 就类药性而言, 化合物onjisaponin E (0.7186) 则位于首位, 表明此化合物开发为药物的可能性最高; 血脑屏障通透性方面, 化合物tenuifoliose B (OB = 76.99%, DL = 0.3079, BBB level = 1) 具有较好的生物利用度与类药性的同时, 其血脑屏障通透性最高, 且实验研究表明, 其可与大鼠齿状回突触的相互作用, 能改善大鼠学习记忆的活性[7]。分析结果显示:在10个活性成分中, 10.00%的成分对应4个靶点, 40.00%的成分对应5个靶点, 30.00%的成分对应6个靶点, 20.00%的成分对应7个靶点。这些成分与靶点的对应数量关系验证了中药通过多成分-多靶点发挥作用的机制, 同时验证了中药中化学成分间的协同作用, 显示中药治疗多因素多基因类疾病的优势。
| Table 1 Ingredients of Polygala Radix |
| Table 2 Information of potential targets from active ingredients of Polygala Radix. OB: Bioavailability; DL: Drug-likeness; LogBB: Blood brain partitioning; BBB level: Blood brain barrier level; BACE1: Beta-secretase 1; CALM1: Calmodulin; F2: Prothrombin; GSK3β: Glycogen synthase kinase-3 beta; IGF1: Insulin-like growth factor 1; IGF1R: Insulin-like growth factor 1 receptor; PLAU: Urokinase-type plasminogen activator; PPARγ: Peroxisome proliferator-activated receptor gamma; SOD2: Superoxide dismutase; BCHE: Cholinesterase; NOS3: Nitric-oxide synthase; ESR: Endothelial; CASP3: Caspase-3 |
运用Cytoscape软件构建的C-T-D网络模型中(图 1), 共包含10个化学成分, 13个靶点及1种疾病, 其中中心透明的大脑图形代表AD疾病, 粉红色三角形代表靶蛋白, 蓝色圆形代表远志中的化学成分。利用Network analyer功能对网络模型进行分析发现, 在C-T-D网络模型中包含24个节点, 74个边, 其网络半径为2, 网络直径为3, 最短路径为552, 网络的特征路径长度为1.982, 表明经过1.982步即可互相转化。从C-T-D图可以发现, 远志中10个化学成分与多个靶点间产生相互作用, 此现象符合中药多成分-多靶点的治疗机制。从化合物的网络特征分析来看, BACE1与GSK3β为C-T-D网络模型中网络度最好(核心)的靶点, 10个活性成分均与这两个靶点有潜在的结合作用, 其次分别为F2、ESR、CASP3、PPARγ、PLAU、BCHE、NOS3、IGF1、SOD2、CALM1和IGF1R。

|
Figure 1 omponents-targets-disease network. (   |
经过文献挖掘并对上述数据研究发现, 远志可能通过多种途径治疗AD:其一, 研究表明[21, 22], BACE1在Aβ生成中起着关键的作用, 而PPARγ[23]的活化能够降低Aβ的沉积、增强海马区认知功能和逆转记忆力下降, 因此, 远志中的化学成分可能通过对这两个蛋白的调控而发挥治疗AD效果; 其二, 靶点GSK3β[24]负责Tau蛋白的过度磷酸化, 在Tau蛋白过度磷酸化的假说中, 被认为是其中的关键分子, 并且GSK3β与细胞凋亡相关, 远志中19个活性成分均与此靶点存在相互作用, 因此推测远志可能通过调控Tau蛋白的磷酸化, 达到治疗AD的效果; 第三, 靶点NOS3与靶点SOD2均与氧化作用相关[25, 26], 而过度的氧化标志物在AD患者脑中的改变非常明显, 该结果预示远志可能通过抗氧化作用, 达到治疗AD的作用; 最后, 靶点ESR、IGF和IGF1R均与细胞的增殖分化、生长存活相关[27, 28], 这3个靶点在治疗AD的过程中可能起到协同或辅助的治疗作用。综上所述, 远志治疗AD可能通过对Aβ异常沉积与Tau蛋白过度磷酸化进行调控、抗氧化, 参与细胞增殖分化等多个途径发挥其治疗效果, 这可能与远志改善学习记忆、抗氧化和神经元保护等药理作用相关。
3 生物通路分析将上述13个靶点, 全部映射到KEGG数据库中, 并对结果进行分析整理(图 2), 图中橘色长方形为靶点所映射的位点, 灰色长方形为未映射但与通路有关的位点。通过对通路图的分析发现:首先, Tau蛋白磷酸化水平受到细胞内CASP3和GSK3β的共同调节, CASP3和GSK3β表达平衡对Tau蛋白是否能够磷酸化具有重要的意义。结合表 2发现, 远志中这10个活性成分均与GSK3β存在潜在的结合关系, 5个活性成分(onjisaponin E、1, 7-dimethoxyxanthone、tenuifoliose B、sibiricose A6和polygalacic acid)与CASP3存在相关关系, 初步推测, 上述成分可能通过3条途径治疗AD:其一, 10个活性成分与靶点GSK3β作用, 控制Tau蛋白的过度磷酸化; 其二, 与CASP3相互作用, 调节Tau蛋白的正常磷酸化。这两种途径共同发挥作用, 使Tau蛋白的磷酸化水平处在正常的生理状态, 从而控制神经纤维缠结(NFTs), 达到直接治疗AD的作用; 第三, 化合物onjisaponin E与靶点CALM1相互作用, 间接参与线粒体介导的细胞凋亡。通过对通路图分析发现, 化合物onjisaponin E可能通过控制线粒体过多分裂, 从而调节细胞损伤和神经元的死亡, 达到干预AD发病的作用。上述两条直接与AD相关的作用途径均与细胞凋亡通路相关。除细胞凋亡通路外, 还发现远志中的活性成分可能参与其他通路的调节, 进而对AD起到辅助治疗的作用:其一, 化合物onjisaponin E、1, 3, 6, 7-tetramethoxy xanthone、polygalacic acid与IGF1结合后, 通过作用IGF1R可以相继激活胰岛素信号通路(insulin signaling pathway)、PI3K-Akt-mTORC signaling pathway, 最终激活PPARγ。动物实验证明[23], PPARγ的活化能够降低Aβ的沉积、增强海马区认知功能、逆转记忆力下降; 其二, 远志中的活性成分3-hydroxy-2, 8-dimeth oxyxanthone可直接与NOS3相互作用来调控心肌细胞的存活或使血管平滑肌松弛。综上所述, 远志中的化学成分通过对多靶点、多通路的调节, 从而达到干预或治疗AD的作用。

|
Figure 2 Enriched KEGG pathways of potential targets from main active ingredients of Polygala Radix. The orange rectangle (  |
运用MAS 3.0生物分子注释系统对远志化学成分预测出的13个作用靶点进行GO富集分析, 将其中富集的疾病部分进行MeSH分类。结果如图 3所示, 发现Alzheimer's disease所对应的靶点数目最多, 为10个; 除AD外, 有6个靶点对应了如帕金森病(Parkinson disease)、亨廷顿病(Huntington disease)、肌萎缩性侧索硬化(amyotrophic lateral sclerosis)和肌强直性营养不良(myotonic dystrophy)等其他神经退行性疾病; 所占比例最大(70.37%)的疾病分类为神经系统疾病(nervous system diseases, MeSH分类为C10)。结果表明, 远志除具有治疗AD的作用, 可能还有治疗其他神经退行性疾病乃至神经系统类疾病的潜在作用, 这与远志安神益智、解郁的功效, 促进神经干细胞增殖、抗氧化、清除自由基和保护神经胆碱能系统等药理作用有关。
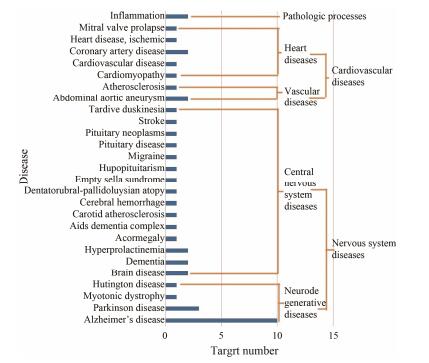
|
Figure 3 GO biological pathway analysis and MeSH classification results |
本研究通过ADMT评估、反向药效团匹配、构建C-T-D网络模型、KRGG分析、GO富集分析及MeSH分类, 明确了远志中10个活性分子, 其中包含口山酮类化合物3个、皂苷类化合物1个、寡糖酯类化合物3个和其他类3个。通过对网络模型的分析发现, BACE1与GSK3β为C-T-D网络模型中网络度最好(核心)的靶点, 而远志可能作用于BACE1、PPARγ靶点调控Aβ, 作用于靶点GSK3β调控Tau蛋白的磷酸化, 作用于靶点NOS3与SOD2调节氧化作用, 作用于靶点ESR、IGF和IGF1R调节细胞的增殖分化和生长存活等多途径防治AD。通过多途径治疗AD, 充分发挥了中药治疗疾病的多成分-多靶点机制, 但成分间存在的是协同作用还是拮抗作用暂不明确, 需要进一步的实验验证。通过KEGG分析, 发现远志治疗阿尔茨海默病主要通过调控细胞凋亡通路直接发挥疗效, 而调节细胞凋亡通路的途径可能包含两种: ① 活性成分与靶点GSK3β作用, 控制Tau蛋白的过度磷酸化; 与CASP3相互作用, 调节Tau蛋白的正常磷酸化。这两种途径共同发挥作用, 使Tau蛋白的磷酸化水平处在正常的生理状态, 从而控制神经纤维缠结, 达到直接治疗AD的作用; ② 化合物onjisaponin E可能通过控制线粒体过多分裂, 从而调节细胞损伤和神经元的死亡, 达到治疗AD的作用。KEGG结果显示, 远志中化学成分可能通过激活PPARγ, 调控心肌细胞的存活或使血管平滑肌松弛达到辅助的治疗效果, 但远志中的成分对通路是上调还是下调的具体机制还不明确, 需要进一步阐述。GO分析及MeSH分类的结果显示, 远志对神经系统类疾病存在着潜在的治疗作用。
本研究采用系统药理学的方法对远志中化学成分进行综合性分析, 阐释了远志中潜在活性成分群的分子作用机制, 进一步揭示了中药多成分-多靶点-多通路的治疗机制, 为中药防治由多基因引起的复杂疾病的治疗机制研究提供了思路。
| [1] | Bolós M, Perea JR, Avila J. Alzheimer's disease as an inflammatory disease[J]. Biomol Concepts, 2017, 8: 37–43. |
| [2] | Kandimalla R, Reddy PH. Therapeutics of neurotransmitters in Alzheimer's disease[J]. J Alzheimers Dis, 2017, 57: 1049–1069. DOI:10.3233/JAD-161118 |
| [3] | Li L. Advances in Alzheimer's disease in China[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2015, 19: 765–783. |
| [4] | Xie HG. Drug treatment of Alzheimer's disease[J]. World Clinical Drugs (世界临床药物), 2017, 38: 83–87. |
| [5] | Peng Y, Li PP, Li L, et al. Progress of clinical trials in Alzheimer's disease drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 1185–1195. |
| [6] | Pu YJ, Wang DD, Zhang FS, et al. Herbal textual research on Polygalae Radix[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 211–218. |
| [7] | Liu DW, Kang LP, Ma BP. Chemical constituents and pharmacological activities of Polygala tenuifolia Willd.: research advances[J]. J Int Pharm Res (国际药学研究杂志), 2012, 39: 32–36. |
| [8] | Zhang TZ, Rong WW, Li Q, et al. Research progress on Polygalae Radix[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2381–2389. |
| [9] | Xue R, Fang Z, Zhang M, et al. TCMID: traditional Chinese medicine integrative database for herb molecular mechanism analysis[J]. Nucleic Acids Res, 2013, 41: D1089–D1095. |
| [10] | Liu J, Yang X, He J, et al. Structure analysis of triterpene saponins in Polygala tenuifolia by electrospray ionization ion trap multiple-stage mass spectrometry[J]. J Mass Spectrom, 2007, 42: 861–873. DOI:10.1002/(ISSN)1096-9888 |
| [11] | Song YL, Zeng KW, Shi TX, et al. Sibiricasaponins A-E, five new triterpenoid saponins from the aerial parts of Poly gala sibirica[J]. Fitoterapia, 2013, 84: 295–301. DOI:10.1016/j.fitote.2012.12.017 |
| [12] | Hu Y, Liu M, Liu P, et al. Possible mechanism of the antidepressant effect of 3, 6'-disinapoyl sucrose from Polygala tenuifolia Willd[J]. J Pharm Pharmacol, 2011, 63: 869–874. DOI:10.1111/j.2042-7158.2011.01281.x |
| [13] | Song YL, Jiang Y, Zhou SX, et al. Studies on chemical constituents on aboveground of polygalasibirica[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 27–29. |
| [14] | Kelly R, Kidd R. Editorial: ChemSpider -a tool for natural products research[J]. Nat Prod Rep, 2015, 32: 1163–1164. DOI:10.1039/C5NP90022K |
| [15] | Wang YH, Yang L. Systems pharmacology-based research framework of traditional Chinese medicine[J]. World Chin Med (世界中医药), 2013, 8: 801–808. |
| [16] | Pang XC, Wang Z, Fang JS, et al. Network pharmacology study of effective constituents of traditional Chinese medicine for Alzheimer's disease treatment[J]. Acta Pharm Sin (药学学报), 2016, 51: 725–731. |
| [17] | Liu X, Ou YS, Yu B, et al. PharmMapper server: a web server for potential drug target identification using pharmacophore mapping approach[J]. Nucleic Acids Res, 2010, 38: W609–W614. DOI:10.1093/nar/gkq300 |
| [18] | Gao Y, Gao L, Gao XX, et al. An exploration in the action targets for antidepressant bioactive components of Xiaoyaosan based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2015, 50: 1589–1595. |
| [19] | Zheng C, Wang J, Liu J, et al. System-level multi-target drug discovery from natural products with applications to cardiovascular diseases[J]. Mol Divers, 2014, 18: 621–635. DOI:10.1007/s11030-014-9521-y |
| [20] | Yang YF, Wang L, Yan SJ, et al. Discovery studio software in the analysis of the blood-brain barrier penetrations of activee components of traditional Chinese medicines[J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27: 739–740. |
| [21] | Zhao J, Deng Y, Jiang Z, et al. G protein-coupled receptors (GPCRs) in Alzheimer's disease: a focus on BACE1 related GPCRs[J]. Front Aging Neurosci, 2016, 8: 58. |
| [22] | Yao XM, Zhou YY, Li XX, et al. Research progress of prevention and treatment of Alzheimer's disease by BACE1 by traditional Chinese medicine monomer and its active ingredients[J]. Acta Chin Med Pharmacol (中医药学报), 2016, 44: 99–102. |
| [23] | Song N, Qin C. The role of PPARγ in Alzheimer's disease and its impact factors[J]. J Med Postgra (医学研究生学报), 2015, 28: 989–994. |
| [24] | Chu J, Lauretti E, Praticò D. Caspase-3-dependent cleavage of Akt modulates tau phosphorylation via GSK3β kinase: implications for Alzheimer's disease[J]. Mol Psychiatr, 2017, 22: 1002–1008. DOI:10.1038/mp.2016.214 |
| [25] | Hua Y, Zhao H, Kong Y, et al. Association between Alzheimer's disease and the NOS3 gene Glu298Asp polymor phism[J]. Int J Neurosci, 2014, 124: 243–251. DOI:10.3109/00207454.2013.834336 |
| [26] | Wang Q, Liu YQ. Pathological mechanism of Polygala Radix on Alzheimer 's disease[J]. Chin J Gerontol (中国老年学杂志), 2016, 36: 505–509. |
| [27] | Garcia J, Ahmadi A, Wonnacott A, et al. Association of insulin-like growth factor-1 receptor polymorphism in dementia[J]. Dement Geriatr Cogn Disord, 2006, 22: 439–444. DOI:10.1159/000095803 |
| [28] | Pradhan M, Baumgarten SC, Bembinster LA, et al. CBP mediates NF-κB-dependent histone acetylation and estrogen receptor recruitment to an estrogen response element in the BIRC3 promoter[J]. Mol Cell Biol, 2011, 32: 569–575. |
 2017, Vol. 52
2017, Vol. 52


