2. 浙江工业大学药学院, 浙江 杭州 310014
2. College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China
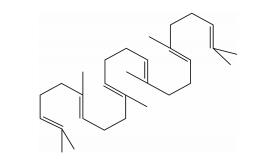
1916年, 日本科学家Tsujimoto[1]在深海Ai-zam6和Heratsuno—zam6鲨鱼肝油中发现一种新的淡黄色不饱和烃类化合物, 经分离、鉴定将其命名为“squalene”(Squ), 即角鲨烯。Squ是一种脂质不皂化物, 其化学结构类似β-胡萝卜素异戊间二烯化合物, 由2, 6, 10, 15, 19, 23-六甲基-2, 6, 10, 14, 18, 22-廿四碳六烯构成的不饱和烃(图 1)。Squ主要存在于深海鲨鱼、牦牛和橄榄油等动植物中, 具有携带氧、降血脂、降胆固醇、防止动脉粥样硬化、调节免疫功能及抗癌防癌等多种生理功能, 是一种具有防病治病作用的海洋生物活性物质[2]。Kabuto等[3]研究发现, 角鲨烯对小鼠帕金森氏症具有一定的治疗作用。Santana等[4]证明了含角鲨烯的紫花苜蓿叶乙醇提取物有抗焦虑作用。但角鲨烯在抗抑郁方面的作用未见报道, 本研究目的是了解角鲨烯的抗抑郁作用。
|
Figure 1 Chemical structure of 2, 6, 10, 15, 19, 23-hexamethyl-2, 6, 10, 14, 18, 22-tetracosahexaene (squalane, Squ) |
在抑郁的发生过程中, 谷氨酸兴奋性毒性在中枢神经损伤和抑郁的形成过程中发挥着重要作用[5]。谷氨酸毒性通路主要包括以下过程:当各种刺激引起突触前谷氨酸递质释放, 谷氨酸能激活突触后膜上谷氨酸受体(NMDAR), 使通过NMDAR的钙离子升高, 引起钙调蛋白激酶Ⅱ (calmodulin kinaseⅡ, CaMKⅡ)自磷酸化, 后者与NMDAR亚单位NR2B羧基端相结合, 催化进一步自磷酸化, 引发一系列与钙相关的生化反应, 从而生成大量自由基和NO, 同时线粒体的功能发生紊乱, 导致细胞的结构破坏, 甚至坏死, 神经系统发生退行性病变, 从而导致抑郁的发生[6]。
因此, 本研究在考察角鲨烯对抑郁模型小鼠的行为学影响的同时, 也考察其对抑郁小鼠兴奋性氨基酸特别是谷氨酸和谷氨酸毒性通路相关蛋白的影响, 以了解角鲨烯抗抑郁作用的可能神经生物学机制。
材料与方法试剂 药用植物油(江西金源天然香料有限公司, 批号20150116);角鲨烯胶丸(浙江海力生制药有限公司, 规格:每粒0.25 g, 批号160103);盐酸氟西汀(fluoxetine, FH) (常州四药制药有限公司, 批号20150223);实验前用0.9%氯化钠注射液配成所需浓度的溶液。谷氨酸(glumatic acid, GLU)对照品(中国食品药品检定研究院, 批号140624-200805, 纯度为100.0%); 正亮氨酸对照品(norleucine, Nle, 北京百灵威科技有限公司, 纯度: 98%, 批号L960N22);对照品均用甲醇/水(50:50) 溶解并稀释至所需浓度。丙二醛(malondialdehyde, MDA, 批号: 20150813)、总超氧化物歧化酶(superoxide dismutase, SOD, 批号: 20150811)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px, 批号: 20160810)、考马斯亮蓝蛋白测定试剂盒(批号: 20160715) 均购自南京建成生物工程研究所。N-甲基-D-天冬氨酸受体亚基ε-2 (N-methyl-D-aspartate receptor subunits epsilon-2, NMDAε2, 批号: SC-365597)、CaMKⅡ (批号: SC-13082)、神经性一氧化氮合酶(neuronal nitric oxide synthase, NOS1, SC-418493) 和磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase, GAPDH, 批号: SC-32233) 购自美国Santa Cruz公司。异硫氰酸苯酯(美国Sigma公司, 批号BCBB1912V); 色谱纯乙腈(德国Merck公司); 分析纯醋酸、醋酸钠、盐酸、三乙胺等试剂均来自国药集团试剂公司; 实验用水均为双蒸水。
仪器 XR-XZ301旷场实验分析系统(高30 cm, 内径50 cm, 被等分为面积相等的25个等边方格)、SuperFst强迫游泳实验分析系统(规格为直径为15 cm, 高度为20 cm)、SuperTst高通量悬尾实验分析系统(上海欣软信息科技有限公司); LC-20AT液相色谱系统(包括自动进样器、紫外检测器和工作站) (日本岛津公司); 色谱柱: VP-ODS色谱柱(250 mm × 4.6 mm, 5 μm); X-22R Centrifuge型高速低温离心机(美国Beckman公司); 电泳转膜系统(美国Bio-rad公司); Amersham Imager 600多功能成像仪(美国GE公司); -80 ℃低温冰箱(中国海尔公司); Locator 8 PLUS液氮罐(美国Thermo公司)。
实验动物及分组 健康雄性BALB/C小鼠60只, 平均体重20~22 g, 由上海斯莱克实验动物有限责任公司提供[合格证号SCXK (沪) 20120002]。平衡饮食3天后, 每只小鼠单笼饲养, 然后随机分为① 空白对照组:不刺激, 并灌胃(ig)给予药用植物油; ② 模型组: 13种慢性刺激制作慢性轻度不可预知刺激(CUMS)模型, 并ig给予药用植物油; ③ 高剂量组(CUMS+ Squ-H): CUMS, 并ig给予角鲨烯80 mg·kg-1·d-1。④ 中剂量组(CUMS+Squ-M): CUMS, 并ig给予角鲨烯40 mg·kg-1·d-1; ⑤ 低剂量组(CUMS+Squ-L): CUMS, 并ig给予角鲨烯20 mg·kg-1·d-1; ⑥ 阳性对照组: CUMS, 并ig给予氟西汀10 mg·kg-1·d-1。每组动物10只, 均常规饮水, 造模2周后, 阳性对照组和各给药组连续给药3周。角鲨烯的剂量是根据本实验室的预实验确定。
CUMS模型的建立 本实验采用Willner等[7]抑郁模型方式造模。正常组除外的5组, 每日给予不可预见应激刺激, 包括18 h食物剥夺、4 h噪音、10 min闪光、15 min热刺激(45 ℃)、2 h制动、5 min冷冻(4 ℃)、15 min摇晃(频率每秒1次)、18 h湿笼(100 mL水)、1 min夹尾、16 h饮水剥夺、5 min游泳(25 ℃)、20次电击(30 V, 30 s)、24 h异物, 以上刺激每天随机安排1种, 同种刺激在整个实验周期中可出现多次, 但不能连续出现, 使动物不能预知刺激的发生, 14天一个循环, 共造模5周。每周测体质量1次。
旷场实验(open field test, OFT) 在末次灌胃给药前一日, 每组取10只动物, 在室温为25 ℃的安静实验室内将小鼠小心放在自发活动旷场箱底中心, 观察5 min内活动情况。观察方法为① 水平穿行方格数: 3爪以上跨入邻格或者重心落入为1次有效穿行; ② 竖直站立次数:前肢离开水平地面1 cm以上的为1次站立。分别计算水平运动得分、垂直运动得分。每次做完实验后清理箱内残留物, 清除上1只大鼠的气味, 以免影响下1只大鼠的行为。
糖水偏好实验(sucrose preference test, SPT) 实验开始前, 在安静的房间内先训练每只小鼠适应含糖饮水:每笼同时放置2个水瓶, 第1个24 h, 2瓶均装有1%的蔗糖水; 第2个24 h, 一瓶装有1%蔗糖水, 另一瓶装有蒸馏水。禁食禁水10 h后, 进行小鼠的蔗糖饮水实验。同时给予每组小鼠事先定量好的1瓶1%蔗糖水, 1瓶蒸馏水。1 h后, 取走2瓶水称重, 记录每组的蔗糖水消耗量、蒸馏水消耗量及总液体消耗量。于实验的第0、35天各测量1次。蔗糖水偏好度(%) = (蔗糖水消耗量/总液体消耗量)×100%。
小鼠尾悬挂实验(tails suspension test, TST) 于末次灌胃给药l h后, 每组取10只动物, 在安静无风的室内, 将小鼠尾部距末端约2 cm处, 用医用胶布粘贴固定在悬尾仪上, 使小鼠呈倒挂状态, 两侧有黑色挡板隔开, 遮挡小鼠视线, 使其不受外界干扰悬挂6 min, 记录后4 min内小鼠累计不动时间(指小鼠停止挣扎, 身体呈垂直倒悬状态, 静止不动)。
强迫游泳实验(forced swimming test, FST) 于末次灌胃给药2 h后, 每组取10只动物, 将小鼠单独放入强迫游泳仪的圆柱形玻璃缸中, 缸内水深10 cm, 水温(25 ± 2) ℃, 从小鼠入水后计时6 min, 记录后4 min内游泳累计不动时间(指小鼠在水中停止挣扎, 或显示漂浮状态, 仅有微小的肢体运动以保持头部浮在水面)。每只动物做完后即换水。
脑组织处理 处死前16 h各组小鼠禁食但不禁水, 16 h后用乙醚麻醉小鼠, 腹主动脉取血, 取血后处死动物, 再用生理盐水进行灌流, 待流出的血液较澄清后, 冰浴下分离小鼠脑海马用锡箔纸包好, 做好标记, 保存于-80 ℃冰箱中。在样品保存期间, 每只动物的海马组织统一用液氮研磨成粉后, 分成3等份, 保存于液氮中, 分别用于以下指标测试。
氧化及抗氧化指标测定 将部分海马组织于4 ℃复温, 按1:9比例加入预冷的生理盐水, 匀浆后静置5 min, 3 500 r·min-1离心15 min, 收集上清液, 测蛋白含量。同时将上清液按MDA含量及SOD和GSH-Px活力测定试剂盒说明进行测定。
RP-HPLC测定海马谷氨酸含量 根据相关文献[8]进行测定。
样品的制备 取部分海马组织于4 ℃复温, 精确称重后1:10 (w/v)加入生理盐水, 冰浴下超声裂解30 s; 在4 ℃、2 500 r·min-1离心30 min, 测蛋白含量, 取上清液0.5 mL, 加含100 μmol·L-1内标液2.0%高氯酸1 mL混匀, 4 ℃、14 000 r·min-1离心30 min, 取上清液作为HPLC样品溶液。
柱前衍生 衍生试剂为1 mol·L-1三乙胺乙腈溶液:取三乙胺139 μL, 加乙腈861 μL, 混匀; 0.1 mol·L-1异硫氰酸苯酯乙腈溶液:取异硫氰酸苯酯12 μL, 加乙腈988 μL, 混匀。柱前衍生取氨基酸对照品溶液及样品溶液200 μL, 分别置1 mL离心管中, 加正亮氨酸内标溶液(100 μmol·L-1) 10 μL, 加入1 mol·L-1三乙胺乙腈溶液100 μL, 0.1 mol·L-1异硫氰酸苯酯乙腈溶液100 μL, 混匀, 室温放置1 h, 加入400 μL正己烷, 放置10 min, 取下层溶液, 用水稀释10倍, 用0.45 μm滤器过滤, 进样10 μL。
色谱条件 色谱柱为Inertsil ODS-3色谱柱(250 mm × 4.6 mm, 5 μm); 柱温40 ℃; 检测波长为254 nm; 进样量为10 μL; 流动相A为0.1 mol·L-1醋酸钠溶液(用乙酸调节pH 6.5)-乙腈(95:5), 流动相B为乙腈-水(80:20), 梯度洗脱程序0~2 min, 100% A; 2~15 min, 100%→90% A; 15~25 min, 90%→70% A; 25~33 min, 70%→55% A; 33~43 min, 0% A; 43~53 min, 100% A。
Western blot蛋白免疫印迹法 各组取海马组织样本0.1 g加细胞裂解液(含蛋白酶和磷酸化酶抑制剂) 250 μL, 匀浆后, 冰上静置30 min, 4 ℃、12 000 ×g离心20 min, 取上清, BCA法进行蛋白定量。上样量为50 μg蛋白, 电泳分离及转膜后, 室温下用5%脱脂奶粉封闭1 h, 4 ℃孵育一抗NMDAε2 (1:500)、CaMKⅡ (1:500)、NOS1 (1:200) 和GADPH (1: 1 000) 过夜, TBST洗膜3次, 每次5 min, 结束后加入二抗反应1 h, 洗膜3次, 每次5 min。放入凝胶成像仪中曝光, 使用GE-Imager 600专用软件对条带进行定量分析, 得出各条带积分吸光度IA, 以GADPH作为内参照, 所有实验重复3次。
蛋白表达量= (IA目的蛋白给药组/IAGADPH给药组)
蛋白相对表达量= (IA给药组目的蛋白/IA给药组GADPH) / (IA空白对照组目的蛋白/IA空白对照组GADPH)
统计学处理 实验数据以均数±标准差(x±s)表示。数据进行单因素方差分析后, 用SNK-q检验进行各组间均数两两比较分析, P < 0.05表示差异有统计学意义。
结果 1 角鲨烯对小鼠体重的影响与空白对照组比较, 模型组小鼠造模2周和5周, 体重增加显著减慢(P < 0.05)。除低剂量组外, 阳性组和高、中剂量组小鼠在2周时体重增加显著减慢(P < 0.05), 但在5周时体重增加显著, 基本达到正常组水平(P < 0.05)。与模型组比较, 各给药组和阳性对照组小鼠体重在2周没有差别, 在连续给药3周后明显增加(P < 0.05), 高、中剂量组基本达到阳性对照组水平, 结果见表 1。
| Table 1 The effects of Squ on the body weight in the chronic unpredictable mild stress (CUMS) mice. n = 10, x±s. *P < 0.05 vs control group; #P < 0.05 vs CUMS group. H: High dose; M: Middle dose; L: Low dose |
与空白对照组比较, 模型组造模5周, 其糖水偏好率显著性降低(P < 0.05), 但给药组小鼠在第5周, 各剂量组基本达到正常组水平(P > 0.05)。与模型组相比, 各给药组和阳性对照组小鼠在5周糖水偏好率明显增高(P < 0.05), 高、中剂量组基本达到阳性对照组水平, 结果见表 2。
| Table 2 The effects of Squ on sucrose preference in depression mice. n = 10, x±s. *P < 0.05 vs control group; #P < 0.05 vs CUMS group |
与空白对照组比较, 模型组和低剂量组小鼠水平运动次数和垂直运动次数显著性降低(P < 0.05)。与模型组相比, 阳性对照组和高、中剂量组小鼠水平运动次数和垂直运动次数增加(P < 0.05), 高、中剂量组基本达到阳性对照组水平, 结果见表 3。
| Table 3 The effects of squalene on the OFT, the immobility durations of TST and FST in the depressive mice. n = 10, x±s. *P < 0.05 vs control group; #P < 0.05 vs CUMS group. FST: Forced swimming test; OFT: Open field test; TST: Tails suspension test |
与空白对照组比较, 模型组和各给药组小鼠悬尾实验不动时间明显延长(P < 0.05)。与模型组相比, 各给药组和阳性对照组小鼠悬尾实验不动时间缩短(P < 0.05), 结果见表 3。
5 角鲨烯对小鼠强迫游泳实验不动时间的影响与空白对照组比较, 模型组小鼠强迫游泳实验的不动时间明显延长(P < 0.05)。与模型组相比, 各给药组和阳性对照组小鼠强迫游泳实验不动时间缩短(P < 0.05), 各给药组基本达到阳性对照组水平, 结果见表 3。
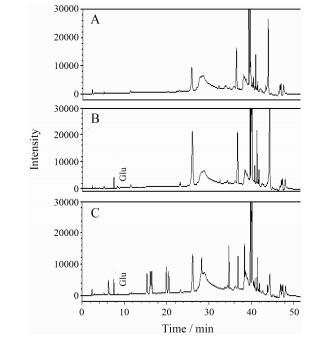
6 角鲨烯对小鼠海马GLU的影响本次柱前衍生RP-HPLC法测定GLU, 其线性范围为5~400 μmol·L-1, 相关系数r2大于0.99。小鼠海马样本采用此异硫氰酸苯酯柱前衍生方法及色谱分析条件进行分析, 结果如图 2所示, 图中GLU峰分离度较好, 杂质峰较少, 表明此方法对海马样本有较好的分离效果。
|
Figure 2 Chromatogram of blank (A), standard glutamate (GLU, B) and hippocampal GLU of mice (C) |
本次实验各组样本分析结果如下, 与空白对照组比较, 抑郁模型组大鼠海马组织的GLU含量升高, 有明显统计学差异(P < 0.05)。与抑郁模型组比较, 高剂量组和阳性对照组小鼠GLU含量明显降低(P < 0.05), 高剂量组基本达到阳性对照组水平, 结果见表 4。
| Table 4 The effect of Squ on immobility duration the concen trations of GLU of in the depressive mice. n = 10, x±s. *P < 0.05 vs control group; #P < 0.05 vs CUMS group |
与空白对照组相比, 抑郁模型组小鼠海马SOD和GSH-Px酶活力显著性降低(P < 0.05), MDA含量显著性增加(P < 0.05)。抑郁小鼠在连续ig给予阳性药物(10 mg·kg-1·d-1)和角鲨烯(80、40和20 mg·kg-1·d-1) 30天后, 小鼠SOD和GSH-Px活力均较模型组显著增加(P < 0.05), MDA含量显著降低(P < 0.05), 结果详见表 5。
| Table 5 Effects of Squ on the contents of MDA and the activity of SOD and GSH-Px in the hippocampus of depression mouse. n = 10, x±s. *P < 0.05 vs control group; #P < 0.05 vs CUMS group. MDA: Malondialdehyde; SOD: Superoxide dismutase; GSH-Px: Glutathione peroxidase |
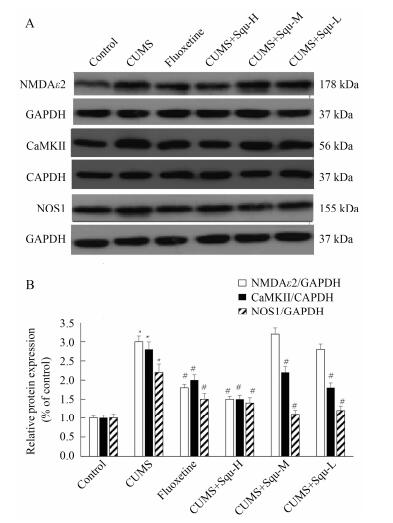
与空白对照组比较, 抑郁模型组大鼠海马组织的NMDAε2、CaMKⅡ和NOS1蛋白表达分别上调了3.0、2.8和2.2倍(P < 0.05)。与抑郁模型组比较, 高剂量组和阳性对照组小鼠的NMDAε2蛋白分别下调了40%和50% (P < 0.05), 而阳性对照组和各给药组的CaMKⅡ蛋白分别下调了29%、46%、21%和36%;NOS1蛋白分别下调了33%、39%、50%和44% (P < 0.05), 结果见图 3。
|
Figure 3 The changes of Squ inducing N-methyl-D-aspartate receptor subunits epsilon-2 (NMDAε2, calmodulin kinaseⅡ (CaMKⅡ) and neuronal nitric oxide synthase (NOS1) protein expression in the hippocampus of depression mouse. A: Repre sentative photographs; B: Statistical analysis. n = 3, x±s. *P < 0.05 vs control group; #P < 0.05 vs CUMS group |
本次实验采用13种不同刺激对雄性BALB/C小鼠连续刺激35天, 经过行为学实验确认, 建立了经典的慢性轻度不可预见应激抑郁模型。给予抑郁小鼠角鲨烯后发现, 角鲨烯能增加抑郁小鼠的糖水偏好率和敞箱实验水平运动次数和垂直运动次数, 缩短TST和FST的不动时间, 表现出一定的抗抑郁作用。
近年研究表明, 抑郁的发生与神经内分泌密切相关。慢性应激引起下丘脑-垂体-肾上腺皮质(hypothalamic-pituitary-adrenocortical, HPA)轴功能亢进, 产生大量的糖皮质激素, 高水平的糖皮质激素导致兴奋性氨基酸(主要是GLU)过多释放, 增加细胞外GLU的堆积, 导致兴奋毒性, 最终引起神经退行性疾病-抑郁的发生[9]。Lowy等[10]报道, 引起抑郁的慢性应激常常导致海马兴奋性氨基酸含量显著增高。本实验的13种慢性刺激后, 模型组出现了抑郁症状, 同时, 海马的GLU也明显升高, 与文献报道基本一致。Kass等[11]报道, GLU可诱导海马神经元凋亡。二者的具体机制是什么?GLU通过谷氨酸毒性通路生成大量自由基, 这些氧自由基的产生抑制了突触体前膜对GLU的再摄取, 加强GLU的兴奋性毒性, 同时酶系统和线粒体的功能也发生紊乱, 导致细胞的结构破坏, 甚至坏死, 神经系统发生退行性病变, 最终导致抑郁的发生[6]。Gałecki等[12]报道, 在抑郁症患者脑中MDA含量明显升高, 而抗抑郁药物显著降低脑MDA和蛋白质羰基合物, 这说明抑郁症不仅影响相关代谢蛋白, 也影响氧化应激。本次实验的结果发现, 抑郁模型组小鼠海马SOD和GSH-Px活力的降低, MDA和GLU含量增加, GLU毒性通路的相关蛋白NMDAε2、CaMKⅡβ和NOS1的表达上调, 这些结果初步说明了抑郁与氧化应激和谷氨酸毒性密切相关。
角鲨烯是否通过影响上述神经内分泌系统发挥抗抑郁作用?角鲨烯是由6个非共轭双键构成的类异戊二烯类化合物, 具有较强的抗氧化活性[2]。角鲨烯的抗氧化机制在于角鲨烯的低电离阈值使其能够提供或接收电子而没有破坏细胞的分子结构, 并且角鲨烯可以中断脂质自动氧化途径中氢过氧化物的链式反应[13]。在本次实验中, 角鲨烯增加小鼠海马的SOD和GSH-Px活力, 降低MDA含量, 说明角鲨烯降低了抑郁小鼠的氧化应激, 减少了O-产生。但有研究[3]没有观察到角鲨烯对中枢抗氧化酶(SOD和GSH-Px等)和硫代巴比妥类反应物质的表达, 分析发现, 该研究中给药剂量相当于临床用药, 但给药时间只有2周, 此外动物选用的是体重大于30 g以上的老年小鼠。Obulesu等[14]研究发现角鲨烯增加青年大鼠海马的SOD和GSH-Px活力, 降低MDA含量, 但在老年大鼠仅能降低MDA外, 反而降低了SOD和GSH-Px活力。本次实验选用的20~22 g的青壮年小鼠, 所以得到了与Obulesu等类似的结果。对于角鲨烯是如何改变中枢抗氧化酶(SOD和GSH-Px等)活性的问题, 作者推测, 由于活性氧可导致抗氧化酶GSH-Px和SOD的失活, 当角鲨烯清除了活性氧, 使被活性氧抑制的抗氧化酶恢复了活性, 从而表现出抗氧化酶活性增高。另外, 本次研究发现, 给予角鲨烯后观察到NOS1蛋白的表达下调。由于中枢的NO主要通过NOS1介导产生[15], NOS1蛋白的表达下调引起相应NO产生减少, 角鲨烯抗氧化作用可减少O-产生, 而NO与O-反应产生的毒性产物NOO-能损伤中枢神经元[15], 这个结果表明角鲨烯可能通过减少中枢神经系统NO和O-的产生来降低NOO-的毒性作用, 角鲨烯这种降低氧化应激能力也许是其降低抑郁的一种机制。
大量的动物模型研究表明, NR2B是各种有害刺激作用于大脑和其他组织的早期的敏感标记物[16]。本研究的NMDAε2蛋白就是NMDA的亚类NR2B, 给予角鲨烯后, 可观察到NMDAε2蛋白表达下调, 可能原因是角鲨烯抑制了氧自由基引起的脑突触体释放GLU。另外, 由于在中枢神经系统中NO可以激活邻近细胞的鸟苷酸环化酶或者二磷酸腺苷环化酶, 促进神经递质如GLU的释放[17]。本次实验观察到角鲨烯组NOS1表达下调, 引起NO减少, 这也可能引起相应的GLU释放减少。这两种作用降低了细胞外GLU浓度, 从而减弱GLU对NMDAε2刺激, 导致NMDAε2蛋白表达相应下调。由于GLU和H2O2均可使细胞内游离钙浓度显著增加[18], 且前面的研究已经发现, 角鲨烯可降低氧自由基和GLU浓度, 推测角鲨烯可能通过影响氧化应激和GLU间接地降低细胞内钙离子浓度, 低浓度的钙离子与CaMKⅡ结合减少, 从而适应性地降低CaMKⅡ表达, 减少了后续的钙相关的生化反应如激活NOS1蛋白的表达。
总之, 角鲨烯抑制了抑郁小鼠氧自由基引起的脑突触体释放GLU, 同时也抑制了由此而引起的氧自由基生成, 另外, 也观察到给予角鲨烯后, 谷氨酸毒性通路的相关蛋白表达下调。这些结果表明, 角鲨烯具有抗抑郁作用, 其抗抑郁作用可能与其消除氧化应激和改善谷氨酸毒性通路相关蛋白表达有关。
| [1] | Tsujimoto M. A highly unsaturated hydrocarbon in shark liver oil[J]. J Ind Eng Chem, 1916, 8: 889–896. DOI:10.1021/i500010a005 |
| [2] | Liu CY, Ma MH, Jin GF, et al. Research process on squalene and bioactivities[J]. J Chin Ins Food Sci Technol (中国食品学报), 2015, 15: 147–156. |
| [3] | Kabuto H, Yamanushi TT, Janjua N, et al. Effects of squalene/ squalane on dopamine levels, antioxidant enzyme activity, and fatty acid composition in the striatum of Parkinson's disease mouse model[J]. J Oleo Sci, 2013, 62: 21–28. DOI:10.5650/jos.62.21 |
| [4] | Santana LC, Brito MR, Oliveira GL, et al. Mikania glomerata: phytochemical, pharmacological, and neurochemical study[J]. Evid Based Complement Alternat Med, 2014, 2014: 710410. |
| [5] | Choi DW. Ionic dependence of glutamate neurotoxicity[J]. J Neurosci, 1987, 7: 369–379. |
| [6] | Huang CC, Hsu KS. Activation of NMDA receptors reduces metabotropic glutamate receptor-induced long-term depression in the nucleus accumbens via a CaMKⅡ-dependent mechanism[J]. Neuropharmacology, 2012, 63: 1298–1307. DOI:10.1016/j.neuropharm.2012.08.008 |
| [7] | Willner P, Towdl A, Sampson D, et al. Reduction of sucrose preference by chronic unpredictable mild stress and its restora tion by a tricyclic anti-depressant[J]. Psychopharmacology, 1987, 93: 358–364. |
| [8] | Deng ZY, Liu LF, HU MM, et al. Content determination of nine kinds of amino acids neurotrasmitters in rat brain tissue by HPLC with pre-column PITC derivatization[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2015, 32: 827–831. |
| [9] | Sapolsky RM. The possibility of neurotoxicity in the hippo campus in major depression: a primer on neuron death[J]. Biol Psyehiatry, 2000, 48: 755–765. DOI:10.1016/S0006-3223(00)00971-9 |
| [10] | Lowy MT, Gault L, Yamamoto BK. Rapid communication: adrenalectomy attenuates stress-induced elevations in extracellular glutamate concentrations in the hippocampus[J]. J Neurochem, 1993, 61: 1957–1960. DOI:10.1111/jnc.1993.61.issue-5 |
| [11] | Kass IS, Lipton PJ. Mechanisms involved in irreversible anoxic damage to the in vitro rat hippocampal slice[J]. Physiol, 1982, 332: 459–472. DOI:10.1113/jphysiol.1982.sp014424 |
| [12] | Gałecki P, Szemraj J, Bieńkiewicz M, et al. Lipid peroxidation and antioxidant protection in patients during acute depressive episodes and in remission after fluoxetine treatment[J]. Pharmacol Rep, 2009, 61: 436–447. DOI:10.1016/S1734-1140(09)70084-2 |
| [13] | Preez HD. Squalene-antioxidant of the future?[J]. Nat Med, 2008, 33: 106–112. |
| [14] | Obulesu T, Anandan R, Mathew S, et al. Antioxidant defence of dietary squalene supplementation on n-3 poly unsaturated fatty acids (PUFA)-mediated oxidative stress in young and aged rats[J]. Fish Technol, 2015, 52: 48–52. |
| [15] | Margrie TW, Rostas JAP, Sah P. Presynaptic long-term depression at a central glutamatergic synapse: a role for CaMKⅡ[J]. Nat Neurosci, 1998, 1: 378–383. DOI:10.1038/1589 |
| [16] | Consogno E, Dorigo C, Racagni G, et al. Modication of presynaptic CaM kinase Ⅱ affinity for ATP in hippocampus after long term blockade of serotonin reuptake[J]. Life Sci, 2000, 67: 1957–1967. |
| [17] | Watanabe A, Ono M, Shibata S, et al. Effect of nitric oxide synthase inhibitor, N-nitro-L-arginine methylester, on light-induced phase delay of circadian rhythm of wheel-running activity in golden hamster[J]. Neurosci Lett, 1995, 192: 25–28. DOI:10.1016/0304-3940(95)11599-R |
| [18] | Li L. Protective effects of FLZ-52A salvianolic acid A and schisanhenol on oxidative stress induced injuries of cerebral cells and their mechanism (FLZ-52A等三种抗氧化剂对氧应激(oxidative stress)损伤脑细胞的保护作用及其作用机制研究)[D]. Beijing: Peking Union Medical College, 1997. |
 2017, Vol. 52
2017, Vol. 52


