将活性小分子化合物、蛋白大分子、疫苗、免疫治疗物及基因等药物包裹或吸附于功能化的纳米载体结构中形成纳米载药系统, 可以调节释药速度, 增加生物膜的透过性, 改变在体内的分布, 提高生物利用度等, 以此来提高药物的安全性和有效性[1-3]。纳米载药系统的表面性质和药物释放行为直接影响其在体内的生物活性。纳米载体的表面性质可影响体内药物输送过程中与生理物质相互作用及器官组织分布效果, 而可控的药物释放行为则可有效调控药物在合适疾病发生部位以合适释放速率发挥最佳治疗效果, 并减少正常器官的药物非特异性损伤或其他毒副作用[4]。目前, 纳米载药系统主要包括纳米脂质体、脂质纳米粒、纳米胶束、纳米微乳、纳米囊和纳米晶药物等。其制备方法主要有材料自组装[5]、纳米沉淀[6]、原位合成/聚合[7]和高压均化[8]等。然而这些技术普遍存在所制备得到的纳米颗粒结构不一致、粒径分布较宽、粒子合成过程复杂和粒子批次间差异较大等局限性[9]。
微流控(microfluidics)是至少在一个维度为微米级别, 即数十至数百微米的低维通道结构中, 处理加工或操控微小(1×10-9~1×10-18 L)流体所涉及的科学和技术[10]。微流控技术的发展源自20世纪90年代, 主要应用于分析化学领域的研究。2006年7月, Nature杂志发表了一系列关于微流控技术的文章, 对微流控技术作了详细的介绍, 并强调了微流控技术在生物医药研究领域中的应用前景[10-12], 之后, 微流控在生物医药研究领域中的应用如雨后春笋铺展开来。微流控技术操控下的流体具有独特的性质, 如层流和液滴等, 借助这些独特的流体现象, 可以实现一系列常规方法所难以完成的微粒加工, 包括流体混合增强和精准控制的纳米结构组装。微流控技术具有精确的流体控制、可设计的各种形状微通道及多通道程序化混合工艺, 为合成粒子形貌结构均一、粒径分布均匀和批次质量重复可控的纳米粒提供新契机[13-15]。正是由于微流控具有这样一些特点, 使得该技术在纳米药物递送领域中具有广泛应用前景。
本综述将主要介绍微流控技术的原理及其在不同结构类型的纳米药物递送系统制备中的应用。从材料筛选、结构组装和构效关系等方面对微流控技术在纳米载药系统构建应用的研究进展进行系统的介绍, 并对基于微流控技术的纳米药物递送系统未来发展前景和挑战进行展望。
1 微流控技术 1.1 微流控的流体特性微流控通道的尺寸通常在微纳米级, 其中形成的微纳尺度流体与宏观流体性质显著不同。雷诺系数(Reynolds number, Re)用于衡量作用于流体上的惯性力与黏性力相对大小。Re大意味着惯性力占主要地位, 流体呈紊流流动状态, 在一般管道Re < 2 000为层流状态, 而在微流控中的微米级尺度流体的Re极低, 通常远小于100, 属于典型的层流, 黏性力的影响远大于惯性力, 使得其流体动力学的性质可预测。而对于宏观流体, 其Re较大, 受到的惯性力作用较大, 表面张力作用不明显, 一般不显示层流状态。另一方面, 微纳流体在流动时的伯克利数(Peclet number)较大, 此时流体中的微纳颗粒及小分子物质的随机扩散不容忽略, 分子运动行为也会发生改变。
在微流控管道中, 微纳尺度流体由于流动阻力大, 液体间不易混合。对于不互溶液体, 在层流状态下扩散更难以形成, 两相界面得以明显的保留(图 1a); 而互溶液体在此层流状态下也会形成界面, 不同液体间的扩散随着时间的延长沿横向/纵向进行(图 1b)。随着混合液体的特性、通道结构尺寸等多种因素的变化, 微流控管道中的流体会形成塞状流、分层流、液滴流和环形流等多种不同的流型[16]。由此, 互溶或不互溶液体间的流体行为使得其在不同粒子的合成中得以应用。由于在微流控通道内流体通过的体积极小, 借助驱动装置精准调控液体流量和流速, 就像一个微量定量的精准反应器, 互溶液体间可通过对流体的控制和加剧混合来迅速得到大小均一、重复性好的粒子; 不互溶液体间通过在混合过程中界面保留及边界流体对中间流体的剪切得到均一的单乳/复乳液滴结构等。
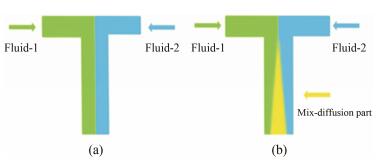
|
Figure 1 Schematic illustration of mixing interface of different microfluids: (a) interface of immiscible fluids; (b) interface of miscible fluids (yellow means the mix color of green and blue) |
针对微纳尺度流体的特性, 微流控芯片通道的结构设计显得尤为重要。通道的结构(尺寸、通道形状和壁面等)会对流体状态产生显著影响[17-20]。微流控通道一般由入口、主通道、辅助通道和出口组成。主通道是流体发生混合、分离和相关反应的主要部位, 辅助通道随着Y型、T型和扇骨型等结构向主通道引入流体进行混合、分离和反应, 最终经过物理/化学反应后的流体从出口流出。流体驱动主要依靠电压、热能和蠕动压差等方式。不同驱动装置对流体混合时间、顺序及速度精确可控, 有利于调控液体间的相互混合。最常见的通道为平直结构(图 2a), 为增强流体的有效混合, 会将通道进一步设计成二维曲线(图 2b)/折线型结构甚至较为复杂的三维结构, 如弧形(图 2c)、人字形、特斯拉(图 2d)、Z形、蛇形和双螺旋等。通过对三维微通道不同结构的设计, 更有利于液体在微通道的弯折、起伏结构中以较低Re情况下产生剧烈的涡旋搅拌作用而增强混合效力, 减少混合时间[16, 21-24]。

|
Figure 2 Schematic illustration of different channel structures of microfluidic chip: (a) flat structure channel; (b) curved struc ture channel; (c) three-dimensional arc microfluidic chip; (d) Tesla mixer |
目前, 常用的纳米药物输送系统(脂质体、胶束、无机纳米粒和聚合物纳米粒等)通常采用宏观流体相互作用原理进行制备, 其制备工艺过程较繁琐且存在批次间结构差异, 所得纳米粒的粒径分布不均一、分散性和重复性较差, 对于化学药和基因药物的包载效率较低[25-31]。造成此现象的主要原因在于纳米粒的形成过程涉及分子尺度的组装, 而人为操作宏观液体混合很难达到精准控制。利用微流控技术对流体流速和流量的精确控制可以使不同时机引入的液体成分充分混合且高度均一有序, 制备得到的纳米粒在粒子结构均一性、批次间可重复性和药物包载率等方面均表现出明显的优势。
2.1 脂质纳米载体递药系统脂质体是由脂质双分子层构成的封闭囊泡结构, 在药物递送领域中已经被广泛的应用。但是传统的脂质体制备技术(如乙醇/乙醚注入法、逆向蒸发法、pH梯度法、薄膜分散法、超声分散法和冷冻干燥法等)过程较繁琐, 制得的脂质体单分散性、稳定性较差。与传统制备工艺过程相比, 微流控技术可以通过对流体进行精细控制并快速得到结构粒径均一性良好的脂质纳米粒(lipid nanoparticles, LNPs)。Li等[32]用聚二甲基硅氧烷/玻璃制备了具有S型通道人字形结构的微流控芯片(图 3), 芯片内通道深度70 µm, 宽度200 µm, 利用注射泵在第1个入口处通入中性脂材和阳离子脂材的乙醇溶液, 第2个并排入口处通入酸性的小干扰RNA (small inference RNA, siRNA) Hepes-柠檬酸缓冲液, 第3个入口处通入缓冲液或转铁蛋白-聚乙二醇-胆固醇(transferrin-polyethylene glycol-cholesterol, Tf-PEG-Chol)的乙醇溶液, 进行脂质纳米粒的一步合成(microfluidic focusing, MF), 并在成粒性、生物学效应和肿瘤抑制方面与实验室常规多步法(bulk-method, BM) (脂材与siRNA混合后用后插法引入Tf-PEG-Chol)进行对比研究, 结果发现, 与多步法制备的脂质体(151.8 ± 1.8 nm, PDI = 0.216) 比较, 微流控所得脂质体(132 ± 1.6 nm, PDI = 0.129) 相比粒径更小更均一, 细胞摄取效率更高, 基因沉默效率更高(MF: 81% > BM: 69%)。在抑瘤方面也明显优于BM所制备粒子(抑瘤效率分别为60.4%和14%)。这些结果充分说明, 通过微流控技术得到粒径与结构更加均一的脂质纳米粒, 可以显著改善粒子的生物学效应。
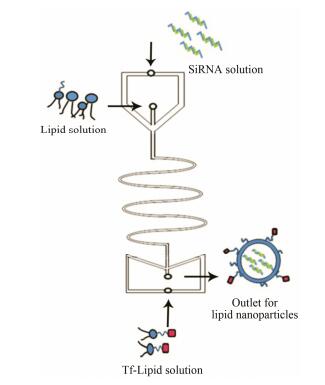
|
Figure 3 Schematic illustration of “S” type channel microflu idic chip for construction of lipid nanoparticles (LNPs) |
微流控技术用于制备脂质体的成粒性优势已经在多种脂材的脂质体构建中得以验证[32, 33], 但由于普通的微流控设备尺寸较小、生产规模小和产率低始终是困扰微流控技术制备脂质体产业化发展的难题。Hood等[34]设计了高深宽比(深度:宽度= 100:1) 的垂直流体聚集的微流控体系, 提高了微流控芯片制备脂质体的产率。通过调整通道内的流体流速比(缓冲液通道流速与脂材通道流速的比值)从10到100, 可以得到粒径在80~200 nm的纳米脂质体, 生产速率可达1.6 mg·min-1 (近100 mg·h-1)。
2.2 以聚合物为载体的纳米药物递送系统 2.2.1 聚合物胶束两亲性嵌段共聚物在水中自组装组成聚合物胶束, 其核心区域的疏水片段聚集区可包裹疏水性药物, 将其亲水外壳设计成阳离子片段则可用于静电吸附方式包载负电性生物大分子药物。因聚合物的嵌段比例易于调整和易于进行修饰的特点, 聚合物胶束广泛应用于药物递送系统。传统制备方法包括透析法、乳化法、溶剂挥发法和冷冻干燥法等[35, 36]制得的胶束多分散系数较大, 且胶束结构不易调控。通过调整微流控的流速和芯片结构, 可实现载体组装结构的调整, 从而有利于改善纳米胶束的制剂学和生物学性质。
Moffitt课题组[37-39]利用气液两相分段的微流控芯片装置, 制备了一系列包裹小分子药物的两嵌段聚合物胶束, 并探讨了不同制备条件对纳米粒形态结构的影响。这种气液两相的芯片包括长100 mm、宽200 µm和高150 µm的正弦曲线结构的反应通道和长740 mm、宽200 µm的正弦结构的加工通道。此外, 为了稳定气泡的形成, 在氩气罐和芯片之间串联了一个1 cm长的芯片通道用于通入稳定的氩气流, 并设计成加工通道内的液体压力至少比反应通道内高出一个数量级的结构。制备工艺采用注射泵控制材料和溶剂从3个通道分别流入, 随后与通过氩气罐控制压力的氩气进行混合。Wang等[40]利用这种芯片研究了用常规方法和微流控芯片制备制剂时化学条件的变化(溶剂组成、含水量、聚合物浓度和盐溶液)对聚苯乙烯-聚丙烯酸聚合物形态的影响。研究结果发现, 相同化学条件下, 利用微流控芯片与传统方法制得的纳米胶束在形态上有所不同。传统的制备工艺胶束的自组装过程主要受到分子间相互作用力的影响, 形成热力学稳定的纳米胶束粒子。而使用微流控芯片制备纳米胶束, 除了分子间作用力, 剪切力也部分影响组装过程, 在气液两相界面处产生的较高的剪切作用力下容易发生分子片段间的碰撞和聚集, 导致胶团内链段发生重新排列而倾向于形成动力学稳定的纳米胶束。
2.2.2 聚合物纳米粒多糖聚合物通过强静电作用力结合无定形药物并形成沉淀的过程, 不利于药物形成有规律的结晶状态。在传统制备工艺中, 将药物滴加至多糖溶液中长时间搅拌以充分混合均匀, 但这种长时间搅拌的方法对纳米粒的粒径控制非常有限, 通过改变体系中pH值、药物与载体的电荷比等主要参数对载药颗粒的性状改善也有限。Tran等[41]利用Y-型通道的毫升级微流体反应器, 在Y型芯片顶端两个通道内分别注入姜黄素的氢氧化钾溶液和壳聚糖的醋酸溶液制备载药复合物。通过在不同轴向距离收集纳米复合物来调整载体和药物在微流控内的滞留时间, 并对注射泵流速、药物/聚合物浓度、溶液pH值和管道直径的调节, 得到粒径在200~300 nm的粒子。在最优工艺下, 姜黄素和壳聚糖复合物粒径为115 nm左右, 电位15 mV, 载药量为72% (w/w), 显著提升了姜黄素的溶解度和生物利用度。这些结果说明, 利用微流控芯片技术可以突破常规方法的局限, 有利于聚合物复合物纳米粒的粒径调节, 也有利于通过改变体系pH值、材料浓度和相对比例进一步优化复合物形成过程。
微流控芯片技术还可以突破常规方法对粒径控制和重复性差的限制, 并且可通过三维水流动力聚焦芯片批量制备出聚合物纳米粒。Lim[42]等通过多层影音石板术和多层软蚀刻技术设计了多层的三维流体聚焦微流控芯片模板, 并利用聚二甲基硅氧烷和硬化剂覆盖模板形成孔道。将聚乳酸-羟基乙酸-聚乙二醇共聚物[poly(lactic-co-glycolic acid)-polyethylene glycol, PLGA-PEG]的乙腈溶液注入第2个相互连接的孔道内, 与通过第1和第3个相互连接的小孔注入的乙腈混合, 同时在另一个通道内通入一定量去离子水, 通过注射泵对流速的调控, 得到聚合物前驱溶液, 每100 µL聚合物前驱溶液与1 mL水溶液在磁力搅拌下边滴加边混合, 2 h内完成混合过程, 可得到粒径在13~150 nm的聚合物纳米粒, 粒径控制好, 可重复性强, 可批量化生产。
2.3 无机纳米粒无机纳米粒因其独特的理化性质、表面易功能修饰化和优良的生物相容性在生物医疗领域的癌症治疗上引起广泛的研究[43]。无机纳米粒的制备常有两个阶段:一是成核阶段, 即当过饱和的无机盐溶液在一些条件如pH和温度变化的作用下沉积为不溶性单体并组装成小的无机纳米粒; 二是增长阶段, 在成核基础上, 小的粒子开始发生粒径的增长和形状的改变, 在此过程中常规方法的制备因条件的限制导致所得无机纳米粒不稳定, 易聚集增大[44]。利用微流控可以对这两个过程进行更精准化的控制, 通过增强的混合能力和流体的流速调控得到粒子性更好的粒子[45]。
氧化铁纳米颗粒在生物医学领域可作为磁共振成像对比增强剂或用于热疗, 但其晶体的性质强烈依赖于它们的尺寸。研究人员主要围绕控制成核生长过程来获得分散性较好的纳米粒, Abou等[46]尝试了利用微流控芯片的快速混合和流体控制来制备氧化铁纳米颗粒, 在研究中发现选用二维Y型结构芯片会出现氧化铁沉积现象, 为此又设计了三维毫米级微流控流体装置, 设有两个同轴流向的通道, 汇合口至出口处的长度为3 cm, 一个通入铁的前体盐溶液, 一个通入强碱溶液, 通过控制流体的流速来控制流体在管内的停留时间在10~48 s之间, 大大减缓了芯片内氧化铁的沉积, 并得到单分散性较好的氧化铁纳米颗粒。此外, 通过微流控技术还制备了单分散性好的CdS[47]、CdSe-ZnS[48]和二氧化硅[49]等纳米粒, 这些结构和大小更加均一化, 可检测的磁性或荧光信号的无机纳米粒在体内成像应用中具有广阔的发展前景, 载药后更有利于实现诊疗一体化。
2.4 杂化纳米粒在药物输送系统的研究中, 多组分结构复杂的杂化粒子常被赋予更多的功能性(减毒、响应性、靶向性、诊疗一体化和联合递送等)[50, 51]。然而, 粒子结构的复杂性也使得其制备工艺变得更为复杂, 可控性也随之变差。传统工艺制备杂化纳米粒主要存在以下问题: ① 粒子批次间差异大, 重复性差; ② 粒子粒径分布较宽; ③ 多组分复杂结构的引入难以保证粒子结构的单一性, 所得粒子常为含有目标结构粒子和其他结构粒子的混杂体[52, 53], 这些问题都使得杂化纳米粒在常规工艺制备和应用研究上受到一定的阻碍和干扰。通过微流控技术对流体的精确控制、对通道结构/不同入口位置的设计, 可以显著地改善脂质-聚合物杂化纳米粒(lipid-polymer hybrid nanoparticles, LPNs)和无机-有机杂化纳米粒等颗粒的组装过程中对亲疏水性和电荷相互作用的依赖, 有效提升流体相互作用在粒子组装中的作用, 进而达到对杂化粒子结构高度可控的目的。
2.4.1 脂质-聚合物杂化纳米粒脂质-聚合物杂化纳米粒的结构通常为聚合物的内核和脂质/脂质体-聚乙二醇等构成的外壳, 组成核壳型结构, 表现出聚合物纳米粒和脂质体的互补特性, 尤其在物理稳定性和生物相容性方面有明显的优势, 成为近年来药物递送系统的研究热点[54], 常规工艺制备脂质-聚合物纳米粒的方法较复杂。应用微流控技术可以快速得到粒子分散性好和结构均一的纳米粒。
Zhang等[55]选用了三级芯片(图 4), 芯片由聚二甲基硅氧烷材料制备, 6个入口, 1个出口, 两条直形混合通道, 一个增强混合的双螺旋区域, 向芯片的一级入口处注入亲水性药物的水溶液, 向芯片的二级入口处注入PLGA/阳离子脂材的N, N-二甲基甲酰胺溶液(N, N-dimethyl formamide, DMF), 使得两者在第1个流体交汇处通过快速的纳米沉淀和增强的混合效能得到载药的内核结构, 阳离子脂材亲水性头部向内。在第2个流体交汇处引入水, 在前面得到的内核外层形成水层并依次通过第3个流体交汇处与三级入口处注入的中性脂材相互作用, 最终在出口处得到粒径均一、包封率高和结构稳定的核壳型LPNs。

|
Figure 4 Schematic illustration of three-stage microfluidic chip for construction of rigid nanovesicle |
利用微流控技术在得到粒度、结构均一粒子的基础上, 可进一步利用微流控技术的精准可控性对纳米粒组装结构进行更为科学充分的探索和论证, Valencia等[53]选用了特斯拉结构的芯片, 向一级入口处通入PLGA的乙腈溶液, 二级入口处通入脂材的水溶液, 以流速比10:1、总流速50 µL·min-1不变的速度合成了外层包被脂材的PLGA纳米粒。在此基础上, 又通过调整脂材与PLGA的浓度比(1:10~1:1 000) 研究了PLGA外部脂材覆盖率与粒子稳定性的关系, 通过改变脂材上基团(-COOH、-CH3、-NH2)考察了改变粒子电位的规律性并验证了lipid/ PLGA的核壳型结构。常规方法制备的纳米粒由于宏观流体可控性较差、粒子结构单一性差, 为lipid/ PLGA、PLGA和lipid粒子的混合共存体, 在PBS中粒子的粒径不能保持稳定, 而微流控技术下所得的粒子由于lipid/PLGA结构的高度均一性, 使得其在PBS中能够稳定地存在。也证明了微流控的快速混合有利于控制LPNs的成核和生长, 使得粒子结构均一性得以保证, 为此类结构载体系统的构建摸索出一定的规律。
2.4.2 无机-有机杂化纳米粒Liu等[56]利用硼硅玻璃毛细管和玻璃片制得三维流体聚焦微流控芯片, 将用浸渍法包载甲氨蝶呤的多孔硅、酸性可降解的缩醛葡聚糖及醇溶性好的紫杉醇、索拉菲尼一起加入到乙醇后通入芯片的内管作为内分散相, 在外管通入聚乙烯醇的水溶液作为外部连续相, 内外管设定流速分别为3和100 mL·h-1, 缩醛葡聚糖的水不溶性使其在内外管交接处自组装与多孔硅结合得到包载有3种化学药品的多孔硅/缩醛葡聚糖复合物, 再通过化学反应在粒子表面引入细胞穿膜肽, 所得粒子表面平滑度和细胞相容性良好, 粒子粒径均一, 在pH 5.0下缩醛葡聚糖6 h内得到充分的降解以促进药物的释放, 大大简化了制备过程。Valencia等[53]将CdSe/ZnS量子点溶于THF通入特斯拉微流控芯片的中间入口, 在两端入口处通入脂材的水溶液, 得到脂材包裹的量子点, 电镜结果显示每个粒子中都精准地包含3~4个量子点, 显示出微流控对粒子合成的精准控制。Kim等[57]利用向微流控芯片通入相应的脂材和蛋白质, 得到了模拟高密度脂蛋白粒子, 并在中间通道内引入疏水性药物或无机纳米晶体对其进行包载, 得到的粒子重复性均一性良好, 在诊疗一体化方向有良好的发展前景。
3 微流控在载体材料筛选中的应用在材料自组装或乳化制备过程中常存在混合强度小、混合不均匀、粒子结构单一性差、易受实验人员或操作条件影响和批次间易产生差异性的问题, 容易导致一些有可能形成纳米粒的载体材料因制备方法的不适而被淘汰。微流控技术的粒子合成过程工艺参数高度可控、结果可重复性高和制备快捷等特点, 有利于对载体材料进行快速筛选, 减少了载体材料组装粒子的假阴性结果, 使材料得到更大效率的应用。
Chen等[58]利用二级微流控芯片, 在一级通道中通入阳离子脂材的乙醇溶液与等体积的带负电siRNA水溶液迅速混合得到LNPs, 在二级通道中, 通过加入大量缓冲液稀释LNPs来稳定制备的粒子。在制备了稳定可重复粒子的基础上, 对其实验室合成的70种阳离子脂材进行了快速的筛选, 并与对应材料常规方法混合所得的siRNA/lipid复合物进行对比, 体内药效学结果显示, 用微流控筛选出15种脂材可取得较好的药效, 而常规方法只筛选得到2种脂材药效较好。该课题组[59]还利用微流控芯片对103种脂肽递送siRNA进行了筛选, 快速筛选得到其中2种材料在给药剂量0.1 mg·kg-1下取得了很好的药效。
4 微流控在纳米粒构效关系研究中的应用纳米粒与生物膜的相互作用取决于纳米粒的结构及表面理化性质, 如粒径[60, 61]、表面修饰[62-65]、结构和硬度[66]等。微流控通过对流体的体积比例、混合速度、材料混合顺序、混合时间及芯片通道结构等参数的精准控制, 来精确调控纳米粒的结构、形貌、大小及表面性质等, 为纳米粒的构效关系研究提供了良好的制备技术平台, 也为优化筛选不同结构特征的纳米载药系统提供可能性。
Sato等[67]通过微流控制备出稳定可重复、粒径在32~67 nm的一系列脂质纳米粒包载siRNA, 对不同粒径粒子的生物学效应进行对比, 探讨了粒子粒径大小对发挥药效的影响及其环节, 并由此指出提高包封能力和减少血浆的吸附是设计下一代小粒径载药纳米粒需要考虑的问题。除了粒子本身的性质外, Chen等[58]利用微流控筛选一系列阳离子脂材后, 对照不同脂材结构构建出的粒子与其对应药效学结果, 初步探讨了脂材疏水链和亲水含氮片段对药效可能的影响。
除了以上正向的构效关系研究思路, 还有一些研究者, 从研究的目标出发, 根据对构效关系的设想, 通过微流控芯片设计粒子结构来进行构效关系的研究, Sun等[66]以研究纳米粒硬度与生物学效应间关系为出发点, 设计选用了二级聚二甲基硅氧烷芯片(图 5), 一级部分由3个入口和直线混合通道组成, 二级部分由1个中心入口和螺旋混合通道组成, 向芯片内引入PLGA和多柔比星的二甲基甲酰胺/四氟乙烯(体积比13:7) 混合溶液与脂材和考布他汀类的乙醇溶液, 通过改变材料的通入顺序, 构建两种不同结构类型的纳米粒:一种是PLGA纳米粒表面直接覆盖疏水性脂材而形成的纳米粒(PLGA-lipid nanoparticles,P-LNPs); 另一种是PLGA纳米粒表面与亲水性脂膜层中间夹有水层结构的纳米粒(PLGA-water-lipid nanoparticles, P-W-LNPs)。通过对比两种纳米粒的性质, 发现两者在粒径、电位和药物包封率均相近, 但粒子硬度有明显的差异性(杨氏模量分别为P-LNPs: 1.2 ± 0.11 GPa; P-W-LNPs: 0.76 ± 0.07 GPa), 进而在生物学效应上表现为粒子硬度较大的P-LNPs的细胞摄取能力显著高于P-W-LNPs。该作者还结合分子动态模拟对此研究结果进行了验证。

|
Figure 5 Schematic illustration of two-stage microfluidic chip for lipid-polymer nanoparticles construction with different structures by changing material injection location |
从其技术优势和已有的研究进展来看, 微流控在纳米药物输送系统研究领域具有广阔的发展前景: ① 有利于制备结构高度均一、单分散性的纳米粒; ② 有利于快速高效地筛选载体材料, 且有利于在常规方法中将不易组装形成纳米粒的载体材料通过微流控组装工艺得以重新利用; ③ 有利于纳米结构的精准可调控组装, 便于开展纳米粒的构效关系研究; ④ 有利于设计多功能化、复杂结构的纳米药物输送系统。毫无疑问, 微流控具有的独特流体特性和机械可控性等特点, 在制备和组装纳米药物输送系统方面具有粒子结构相对均一、批次间重复性好、单分散性强、结构高度可控性和制备工艺方便快捷等优点。然而, 也要客观地认识到, 任何技术都有自身的局限性或缺陷, 微流控技术因其自身技术特点限制(体积小), 在目前条件下实现大规模的制剂制备仍存在很大困难, 这将限制其在纳米制剂工业化生产中的应用。相信该技术在纳米研究领域所具有的广泛应用前景, 必将会使更多的研究人员在纳米医药领域取得更大突破性的研究成果。
| [1] | Langer R. Drug delivery and targeting[J]. Nature, 1998, 392: 5–10. |
| [2] | Hubbell JA, Chilkoti A. Chemistry. Nanomaterials for drug delivery[J]. Science, 2012, 337: 303–305. DOI:10.1126/science.1219657 |
| [3] | Mura S, Nicolas J, Couvreur P. Stimuli-responsive nanocarriers for drug delivery[J]. Nat Mater, 2013, 12: 991–1003. DOI:10.1038/nmat3776 |
| [4] | Bhise NS, Ribas J, Manoharan V, et al. Organ-on-a-chip platforms for studying drug delivery systems[J]. J Control Release, 2014, 190: 82–93. DOI:10.1016/j.jconrel.2014.05.004 |
| [5] | Chen CJ, Wang JC, Zhao EY, et al. Self-assembly cationic nanoparticles based on cholesterol-grafted bioreducible poly (amidoamine) for siRNA delivery[J]. Biomaterials, 2013, 34: 5303–5316. DOI:10.1016/j.biomaterials.2013.03.056 |
| [6] | Lepeltier E, Bourgaux C, Couvreur P. Nanoprecipitation and the " Ouzo effect" : application to drug delivery devices[J]. Adv Drug Deliv Rev, 2014, 71: 86–97. DOI:10.1016/j.addr.2013.12.009 |
| [7] | Duan J, Mansour HM, Zhang Y, et al. Reversion of multidrug resistance by co-encapsulation of doxorubicin and curcumin in chitosan/poly(butyl cyanoacrylate) nanoparticles[J]. Int J Pharm, 2012, 426: 193–201. DOI:10.1016/j.ijpharm.2012.01.020 |
| [8] | Chen H, Khemtong C, Yang X, et al. Nanonization strategies for poorly water-soluble drugs[J]. Drug Discov Today, 2011, 16: 354–360. DOI:10.1016/j.drudis.2010.02.009 |
| [9] | Valencia PM, Farokhzad OC, Karnik R, et al. Microfluidic technologies for accelerating the clinical translation of nanoparticles[J]. Nat Nanotechnol, 2012, 7: 623–629. DOI:10.1038/nnano.2012.168 |
| [10] | Whitesides GM. The origins and the future of microfluidics[J]. Nature, 2006, 442: 368–373. DOI:10.1038/nature05058 |
| [11] | El-Ali J, Sorger PK, Jensen KF. Cells on chips[J]. Nature, 2006, 442: 403–411. DOI:10.1038/nature05063 |
| [12] | Yager P, Edwards T, Fu E, et al. Microfluidic diagnostic technologies for global public health[J]. Nature, 2006, 442: 412–418. DOI:10.1038/nature05064 |
| [13] | Liu D, Cito S, Zhang Y, et al. A versatile and robust micro fluidic platform toward high throughput synthesis of homoge neous nanoparticles with tunable properties[J]. Adv Mater, 2015, 27: 2298–2304. DOI:10.1002/adma.v27.14 |
| [14] | Rhee M, Valencia PM, Rodriguez MI, et al. Synthesis of size-tunable polymeric nanoparticles enabled by 3D hydrodynamic flow focusing in single-layer microchannels[J]. Adv Mater, 2011, 23: H79–H83. DOI:10.1002/adma.201004333 |
| [15] | Lu M, Yang S, Ho YP, et al. Shape-controlled synthesis of hybrid nanomaterials via three-dimensional hydrodynamic focusing[J]. ACS Nano, 2014, 8: 10026–10034. DOI:10.1021/nn502549v |
| [16] | Li YJ, Huo Y, Li D, et al. Technology, application and development of microfluidics[J]. J Hebei Univ Sci Technol (河北科技大学学报), 2014, 35: 11–19. |
| [17] | Tokeshi M, Minagawa T, Uchiyama K, et al. Continuous-flow chemical processing on a microchip by combining microunit operations and a multiphase flow network[J]. Anal Chem, 2002, 74: 1565–1571. DOI:10.1021/ac011111z |
| [18] | Zhao B, Viernes NO, Moore JS, et al. Control and applica tions of immiscible liquids in microchannels[J]. J Am Chem Soc, 2002, 124: 5284–5285. DOI:10.1021/ja025835j |
| [19] | Hibara A, Nonaka M, Hisamoto H, et al. Stabilization of liquid interface and control of two-phase confluence and separation in glass microchips by utilizing octadecylsilane modification of microchannels[J]. Anal Chem, 2002, 74: 1724–1728. DOI:10.1021/ac011038c |
| [20] | Van der Linden HJ, Jellema LC, Holwerda M, et al. Stabilization of two-phase octanol/water flows inside poly(dimethylsiloxane) microchannels using polymer coatings[J]. Anal Bioanal Chem, 2006, 385: 1376–1383. DOI:10.1007/s00216-006-0526-y |
| [21] | Sun J, Xianyu Y, Li M, et al. A microfluidic origami chip for synthesis of functionalized polymeric nanoparticles[J]. Nanoscale, 2013, 5: 5262–5265. DOI:10.1039/c3nr01289a |
| [22] | Zhao B, Moore JS, Beebe DJ. Surface-directed liquid flow inside microchannels[J]. Science, 2001, 291: 1023–1026. DOI:10.1126/science.291.5506.1023 |
| [23] | Bringer MR, Gerdts CJ, Song H, et al. Microfluidic systems for chemical kinetics that rely on chaotic mixing in droplets[J]. Philos Trans A Math Phys Eng Sci, 2004, 362: 1087–1104. DOI:10.1098/rsta.2003.1364 |
| [24] | Hong C, Choi J, Ahn CH. A novel in-plane passive micro fluidic mixer with modified Tesla structures[J]. Lab Chip, 2004, 4: 109. DOI:10.1039/b305892a |
| [25] | Chu L, Utada AS, Shah RK, et al. Controllable monodisperse multiple emulsions[J]. Angew Chem Int Ed, 2007, 46: 8970–8974. DOI:10.1002/(ISSN)1521-3773 |
| [26] | Koh CG, Kang X, Xie Y, et al. Delivery of polyethylenimine/ DNA complexes assembled in a microfluidics device[J]. Mol Pharm, 2009, 6: 1333–1342. DOI:10.1021/mp900016q |
| [27] | Chen C, Abate AR, Lee D, et al. Microfluidic assembly of magnetic hydrogel particles with uniformly anisotropic structure[J]. Adv Mater, 2009, 21: 3201–3204. DOI:10.1002/adma.v21:31 |
| [28] | Zhao Y, Shum HC, Chen H, et al. Microfluidic generation of multifunctional quantum dot barcode particles[J]. J Am Chem Soc, 2011, 133: 8790–8793. DOI:10.1021/ja200729w |
| [29] | Karnik R, Gu F, Basto P, et al. Microfluidic platform for controlled synthesis of polymeric nanoparticles[J]. Nano Lett, 2008, 8: 2906–2912. DOI:10.1021/nl801736q |
| [30] | Dev S, Iyer KS, Raston CL. Nanosized drug formulations under microfluidic continuous flow[J]. Lab Chip, 2011, 11: 3214. DOI:10.1039/c1lc20666d |
| [31] | Debus H, Beck-Broichsitter M, Kissel T. Optimized prepara tion of pDNA/poly(ethylene imine) polyplexes using a micro fluidic system[J]. Lab Chip, 2012, 12: 2498–2506. DOI:10.1039/c2lc40176b |
| [32] | Li Y, Lee RJ, Huang X, et al. Single-step microfluidic synthesis of transferrin-conjugated lipid nanoparticles for siRNA delivery[J]. Nanomedicine, 2017, 13: 371–381. DOI:10.1016/j.nano.2016.09.014 |
| [33] | Hood RR, Shao C, Omiatek DM, et al. Microfluidic synthesis of PEG-and folate-conjugated liposomes for one-step formation of targeted stealth nanocarriers[J]. Pharm Res, 2013, 30: 1597–1607. DOI:10.1007/s11095-013-0998-3 |
| [34] | Hood RR, DeVoe DL. High-throughput continuous flow production of nanoscale liposomes by microfluidic vertical flow focusing[J]. Small, 2015, 11: 5790–5799. DOI:10.1002/smll.201501345 |
| [35] | Geng Y, Dalhaimer P, Cai S, et al. Shape effects of filaments versus spherical particles in flow and drug delivery[J]. Nat Nanotechnol, 2007, 2: 249–255. DOI:10.1038/nnano.2007.70 |
| [36] | Gaucher G, Dufresne MH, Sant VP, et al. Block copolymer micelles: preparation, characterization and application in drug delivery[J]. J Control Release, 2005, 109: 169–188. DOI:10.1016/j.jconrel.2005.09.034 |
| [37] | Wang CW, Sinton D, Moffitt MG. Flow-directed block copolymer micelle morphologies via microfluidic self-assembly[J]. J Am Chem Soc, 2011, 133: 18853–18864. DOI:10.1021/ja2067252 |
| [38] | Bains A, Cao Y, Moffitt MG. Multiscale control of hierarchical structure in crystalline block copolymer nanoparticles using microfluidics[J]. Macromol Rapid Commun, 2015, 36: 2000–2005. DOI:10.1002/marc.201500359 |
| [39] | Bains A, Wulff JE, Moffitt MG. Microfluidic synthesis of dye-loaded polycaprolactone-block-poly (ethylene oxide) nanopar ticles: insights into flow-directed loading and in vitro release for drug delivery[J]. J Colloid Interface Sci, 2016, 475: 136–148. DOI:10.1016/j.jcis.2016.04.010 |
| [40] | Wang CW, Sinton D, Moffitt MG. Morphological control via chemical and shear forces in block copolymer self-assembly in the lab-on-chip[J]. ACS Nano, 2013, 7: 1424–1436. DOI:10.1021/nn305197m |
| [41] | Tran TT, Nguyen MH, Tan YZ, et al. Millifluidic synthesis of amorphous drug-polysaccharide nanoparticle complex with tunable size intended for supersaturating drug delivery applications[J]. Eur J Pharm Biopharm, 2017, 112: 196–203. DOI:10.1016/j.ejpb.2016.11.030 |
| [42] | Lim JM, Bertrand N, Valencia PM, et al. Parallel micro fluidic synthesis of size-tunable polymeric nanoparticles using 3D flow focusing towards in vivo study[J]. Nanomedicine, 2014, 10: 401–409. DOI:10.1016/j.nano.2013.08.003 |
| [43] | Wang F, Li C, Cheng J, et al. Recent advances on inorganic nanoparticle-based cancer therapeutic agents[J]. Int J Environ Res Public Health, 2016, 13: 1182. DOI:10.3390/ijerph13121182 |
| [44] | Feng Q, Sun J, Jiang X. Microfluidics-mediated assembly of functional nanoparticles for cancer-related pharmaceutical applications[J]. Nanoscale, 2016, 8: 12430–12443. DOI:10.1039/C5NR07964K |
| [45] | Abou-Hassan A, Sandre O, Cabuil V. Microfluidics in inorganic chemistry[J]. Angew Chem Int Ed Engl, 2010, 49: 6268–6286. DOI:10.1002/anie.200904285 |
| [46] | Hassan AA, Sandre O, Cabuila V, et al. Synthesis of iron oxide nanoparticles in a microfluidic device: preliminary results in a coaxial flow millichannel[J]. Chem Commun (Camb), 2008(15): 1783–1785. DOI:10.1039/b719550h |
| [47] | Edel J B, Fortt R, DeMello JC, et al. Microfluidic routes to the controlled production of nanoparticles[J]. Chem Commun (Camb), 2002(10): 1136–1137. DOI:10.1039/b202998g |
| [48] | Wang H, Li X, Uehara M, et al. Continuous synthesis of CdSe-ZnS composite nanoparticles in a microfluidic reactor[J]. Chem Commun (Camb), 2004(1): 48–49. DOI:10.1039/B310644F |
| [49] | Khan SA, Günther A, Schmidt MA, et al. Microfluidic synthesis of colloidal silica[J]. Langmuir, 2004, 20: 8604–8611. DOI:10.1021/la0499012 |
| [50] | Salvador-Morales C, Valencia PM, Thakkar AB, et al. Recent developments in multifunctional hybrid nanoparticles: oppor tunities and challenges in cancer therapy[J]. Front Biosci (Elite Ed), 2012, 4: 529–545. |
| [51] | Gao HL, Jiang XG. The progress of novel drug delivery systems[J]. Acta Pharm Sin (药学学报), 2017, 52: 181–188. |
| [52] | Zhang L, Chan JM, Gu FX, et al. Self-assembled lipid-polymer hybrid nanoparticles: a robust drug delivery platform[J]. ACS Nano, 2008, 2: 1696–1702. DOI:10.1021/nn800275r |
| [53] | Valencia PM, Basto PA, Zhang L, et al. Single-step assembly of homogenous lipid-polymeric and lipid — quantum dot nanoparticles enabled by microfluidic rapid mixing[J]. ACS Nano, 2010, 4: 1671–1679. DOI:10.1021/nn901433u |
| [54] | Bose RJC, Ravikumar R, Karuppagounder V, et al. Lipid-polymer hybrid nanoparticle-mediated therapeutics delivery: advances and challenges[J]. Drug Discov Today, 2017, 22: 1258–1265. DOI:10.1016/j.drudis.2017.05.015 |
| [55] | Zhang L, Feng Q, Wang J, et al. Microfluidic synthesis of rigid nanovesicles for hydrophilic reagents delivery[J]. Angew Chem Int Ed, 2015, 54: 3952–3956. DOI:10.1002/anie.201500096 |
| [56] | Liu D, Zhang H, M kil E, et al. Microfluidic assisted one-step fabrication of porous silicon@acetalated dextran nano composites for precisely controlled combination chemotherapy[J]. Biomaterials, 2015, 39: 249–259. DOI:10.1016/j.biomaterials.2014.10.079 |
| [57] | Kim Y, Fay F, Cormode DP, et al. Single step reconstitution of multifunctional high-density lipoprotein-derived nanomaterials using microfluidics[J]. ACS Nano, 2013, 7: 9975–9983. DOI:10.1021/nn4039063 |
| [58] | Chen D, Love KT, Chen Y, et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation[J]. J Am Chem Soc, 2012, 134: 6948–6951. DOI:10.1021/ja301621z |
| [59] | Dong Y, Love KT, Dorkin JR, et al. Lipopeptide nanoparticles for potent and selective siRNA delivery in rodents and nonhuman primates[J]. Proc Natl Acad Sci U S A, 2014, 111: 3955–3960. DOI:10.1073/pnas.1322937111 |
| [60] | Feng Q, Zhang L, Liu C, et al. Microfluidic based high throughput synthesis of lipid-polymer hybrid nanoparticles with tunable diameters[J]. Biomicrofluidics, 2015, 9: 052604. DOI:10.1063/1.4922957 |
| [61] | Jin H, Heller DA, Sharma R, et al. Size-dependent cellular uptake and expulsion of single-walled carbon nanotubes: single particle tracking and a generic uptake model for nanoparticles[J]. ACS Nano, 2009, 3: 149–158. DOI:10.1021/nn800532m |
| [62] | Nasongkla N, Shuai X, Ai H, et al. cRGD-functionalized polymer micelles for targeted doxorubicin delivery[J]. Angew Chem Int Ed, 2004, 43: 6323–6327. DOI:10.1002/(ISSN)1521-3773 |
| [63] | Mishra S, Webster P, Davis ME. PEGylation significantly affects cellular uptake and intracellular trafficking of non-viral gene delivery particles[J]. Eur J Cell Biol, 2004, 83: 97–111. DOI:10.1078/0171-9335-00363 |
| [64] | Yue ZG, Wei W, Lü PP, et al. Surface charge affects cellular uptake and intracellular trafficking of chitosan-based nanopar ticles[J]. Biomacromolecules, 2011, 12: 2440–2446. DOI:10.1021/bm101482r |
| [65] | Sudimack J, Lee RJ. Targeted drug delivery via the folate receptor[J]. Adv Drug Deliv Rev, 2000, 41: 147–162. DOI:10.1016/S0169-409X(99)00062-9 |
| [66] | Sun J, Zhang L, Wang J, et al. Tunable rigidity of (polymeric core)-(lipid shell) nanoparticles for regulated cellular uptake[J]. Adv Mater, 2015, 27: 1402–1407. DOI:10.1002/adma.201404788 |
| [67] | Sato Y, Note Y, Maeki M, et al. Elucidation of the physico chemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery[J]. J Control Release, 2016, 229: 48–57. DOI:10.1016/j.jconrel.2016.03.019 |
 2017, Vol. 52
2017, Vol. 52


